 , 吴小梅1, 刘苏2, 吴兵1
, 吴小梅1, 刘苏2, 吴兵1

1. 南京大学环境学院, 污染控制与资源化研究国家重点实验室, 南京 210023;
2. 中国药科大学工学院环境科学科研室, 南京 211198
收稿日期: 2020-08-06; 修回日期: 2020-10-06; 录用日期: 2020-10-06
基金项目: 国家自然科学基金项目(No.21577061,21806078);国家重点研发计划项目课题(No.2016YFA0203103)
作者简介: 顾纬卿(1996-), 女, E-mail: gwq960722@sina.com
通讯作者(责任作者): 吴兵, E-mail: bwu@nju.edu.cn
摘要:二硫化钨纳米材料(WS2)因其独特的晶体结构和机械柔韧性,在电子、能源和医药等领域应用前景广阔,但其毒性危害也受到广泛关注,本研究采用人结肠癌Caco-2细胞构建了体外肠道吸收模型,研究了WS2纳米片对肠道细胞层结构和功能的毒性效应.结果表明,1~80 μg·mL-1 WS2未诱导Caco-2细胞内线粒体膜电位的改变,≥50 μg·mL-1 WS2增加了胞内氧化自由基含量,具有低细胞毒性.对于Caco-2细胞单层模型,2和20 μg·mL-1 WS2纳米片均不能改变其渗透性和完整性,未引起氧化应激相关基因表达的变化,但抑制了细胞膜ABC转运蛋白的活性.WS2纳米片与镉、砷和苯并(a)芘等污染物共暴露于Caco-2细胞单层时,细胞膜损伤和细胞单层转运功能未被改变,但增加了镉对Caco-2细胞单层氧化应激相关基因GPx和OXSR1表达水平的影响.研究结果为WS2纳米片的胃肠道毒性评估及健康风险评价提供了数据支撑.
关键词:二硫化钨肠毒性Caco-2细胞联合毒性
Intestinal toxicity of tungsten disulfide nanosheet determined by Caco-2 cell monolayer model
GU Weiqing1
 , WU Xiaomei1, LIU Su2, WU Bing1
, WU Xiaomei1, LIU Su2, WU Bing1

1. State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023;
2. Department of Environmental Science, School of Engineering, China Pharmaceutical University, Nanjing 211198
Received 6 August 2020; received in revised from 6 October 2020; accepted 6 October 2020
Abstract: Tungsten disulfide (WS2) as a two-dimensional nanomaterial has a broad application prospect in the fields of electronics, energy and medicine due to its unique crystal structure and mechanical flexibility. In this paper, human colon cancer Caco-2 cells were used to construct an in vitro intestinal absorption model, and the toxic effects of WS2 on intestinal cell layer structure and function were studied. Results showed that 1~80 μg·mL-1 WS2 did not induce the change of mitochondrial membrane potential in the Caco-2 cells, and ≥ 50 μg·mL-1 WS2 increased the content of intracellular reactive oxygen species, showing low cytotoxicity. For the monolayer of Caco-2 cells, 2 and 20 μg·mL-1 WS2 did not change their permeability, integrity, and expression of genes related to oxidative stress. However, WS2 inhibited the activity of plasma membrane ABC transporter in the Caco-2 cell monolayer. When the WS2 were co-exposed to the Caco-2 cell monolayer with cadmium, arsenic, benzo(a)pyrene, the cell membrane integrity and monolayer transport function in the monolayer did not change, however, the influence of cadmium on the expressions of oxidative stress-related genes GPx and OXSR1 in the cell monolayer increased. Results of this study provide basic data for the evaluation of gastrointestinal toxicity and health risk of WS2.
Keywords: tungsten disulfideintestinal toxicityCaco-2 cellscombined toxicity
1 引言(Introduction)近年来, 具有片状结构的纳米材料, 例如过渡金属二卤化物(TMDs), 凭借其可调节的晶体结构和良好的机械柔韧性而备受关注(Komsa et al., 2012;Xu et al., 2013).二硫化钨(WS2)是最重要的TMDs之一, 在纳米光电子器件、能源转化存储和生物医药等领域都有广泛的应用(Voiry et al., 2013;Manzeli et al., 2017;孔春霞等, 2019).然而随着纳米WS2潜在应用不断被挖掘, 它的人体健康风险也受到越来越多的关注, 因此, 对其进行毒性评价是必要的.
现有文献报道表明, 纳米WS2对哺乳动物没有明显的毒性作用, 具有很高的生物相容性(Redlich et al., 2008;Goldman et al., 2015;Appel et al., 2016).但Yuan等发现WS2纳米片诱导了小鼠巨噬细胞和人肺癌细胞的脂质过氧化(Yuan et al., 2020).除了肺部暴露, 经口暴露也是生物体暴露于纳米材料的重要途径之一.纳米WS2已运用于牙齿正畸的不锈钢丝涂层, 以减小摩擦力, 并且纳米WS2涂层还可用于增加其他医疗设备的润滑性, 如导管或内窥镜, 增加了经口暴露的风险(Redlich et al., 2008).而片状纳米材料可造成肠道内的机械损害, 增加肠细胞凋亡, 因此肠道是重要的靶器官(Ganguly et al., 2018;Yu et al., 2019).研究发现, 将小鼠、斑马鱼、线虫等生物体暴露于片状纳米材料, 可引起肠道菌群失调、屏障功能损伤等不良反应(Jia et al., 2019;刘斯亮, 2019;Liu et al., 2020).但目前关于纳米WS2对胃肠道的毒性研究仍十分匮乏.
环境中的纳米材料通常与重金属、持久性有机污染物等环境污染物共存(Lamon et al., 2019), 大量研究表明, 片状纳米材料可以改变共存污染物的生物利用度, 产生比单种污染物暴露更复杂的毒性效应.例如, 带有镉离子的氧化石墨烯更易附着并进入藻细胞, 氧化石墨烯可显著增强镉离子对铜绿微囊藻的毒性(Tang et al., 2015).二硫化钼和氮化硼等片状纳米材料可显著增加砷诱导人肝癌HepG2细胞中ROS的能力(Liu et al., 2017).但关于WS2与环境污染物联合暴露产生的肠道毒性的研究较少.本研究选取人结肠癌细胞株Caco-2细胞作为受试对象, 建立了Caco-2细胞单层吸收模型系统研究WS2纳米片单一暴露及其与砷(As)、镉(Cd)和苯并(a)芘(B(a)P)等污染物联合暴露对体外肠道吸收模型的毒性效应, 为评估经口暴露的WS2毒性及健康风险提供依据.
2 材料与方法(Materials and methods)2.1 实验材料2.1.1 WS2纳米片WS2纳米片购自南京先丰纳米材料科技有限公司.暴露实验前, 配制1000 mg·L-1 WS2纳米片悬液为母液, 通过超声仪分散15 min后立即稀释至使用浓度, 现配现用.采用透射电子显微镜(TEM, JEM-200CX, 日本)表征WS2纳米片的大小和形貌;采用激光粒度分析仪(DLS, Zetasizer Nano-ZS, 英国)测定WS2纳米片的粒度和分布.
2.1.2 化学试剂三氧化二砷(Nsi Solutions Inc., 美国);氯化镉(Sigma-aldrich公司, 美国);苯并(a)芘(o2si smart solutions公司, 美国); CCK-8(同仁化学研究所, 日本);DCFH-DA(碧云天生物技术有限公司, 上海);Hoechst 33342(翊圣生物科技有限公司, 中国);荧光黄(LY, Sigma-aldrich公司, 美国).线粒体膜电位(JC-1)检测试剂盒购自上海碧云天生物技术有限公司, 乳酸脱氢酶(LDH)试剂盒购自南京建成生物工程研究所.
人结肠癌细胞株Caco-2购自上海生物化学与细胞生物学研究所.Caco-2细胞培养于含100 U·mL-1青霉素、100 μg·mL-1链霉素、20%胎牛血清(Gibco, 美国)的不完全MEM(Minimum Essential Media, 江苏凯基生物技术股份有限公司, 中国)培养基中.
2.2 实验方法2.2.1 WS2纳米片细胞毒性检测采用细胞活性、线粒体膜电位和胞内氧化自由基(ROS)含量为指标分析了WS2纳米片对Caco-2细胞的毒性.Caco-2细胞以1×104个·mL-1的密度种于96孔培养板后置于5% CO2、37 ℃培养箱培养.为了减少胎牛血清对毒性的影响, 暴露期间未在培养基中添加血清.
① 细胞活性检测.采用0、1、10、20、50和80 μg·mL-1的WS2纳米片悬液进行Caco-2细胞暴露实验.暴露24 h后, 弃去培养液并洗涤, 每孔加入100 μL培养基和10 μL CCK-8储备液, 孵育1 h.用多功能酶标仪(Synergy H1, BioTek, 美国)在450 nm处测定其吸光度, 用相对吸光度来表示其细胞存活率.
② 细胞内ROS的检测.采用0、1、10、20、50和80 μg·mL-1的WS2纳米片悬液进行Caco-2细胞暴露实验.暴露24 h后, 加入10 μmol·L-1 DCFH-DA工作液和2.5 μg·mL-1 Hoechst 33342染料, 并在37 ℃条件下孵育20 min.同时设立阳性对照组, 加入50 mg·L-1 Rosup, 孵育20 min.PBS洗涤细胞2次, 使用多功能酶标仪检测(Synergy H1, BioTek, 美国)荧光强度, 各组单位活性氧含量=(DCFH-DA荧光值/Hoechst 33342荧光值).
③ 线粒体膜电位的检测.采用0、1、10、20、50和80 μg·mL-1的WS2纳米片悬液进行Caco-2细胞暴露实验.暴露24 h后, 弃去培养液并洗涤, 每孔加入50 μL不完全MEM培养基和50 μL稀释200倍的JC-1工作液, 37 ℃条件下孵育20 min.用多功能酶标仪(Synergy H1, BioTek, 美国)检测红色/绿色荧光强度的比值, 以衡量WS2纳米片对细胞线粒体膜电位的影响, 比值的升高和降低分别表明线粒体去极化的降低和增加.
2.2.2 WS2纳米片对Caco-2细胞单层的毒性实验将Caco-2细胞以1×104个·mL-1的密度接种于带有聚酯膜的Transwell小室中(膜孔径0.4 μm, 面积1.12 cm2).接种后每2 d换新鲜培养液1次, 1周后每天换培养液, 培养21 d.第21 d用Millicell-ERS电阻仪测定跨上皮细胞电阻(TEER), 确定Caco-2细胞单层完整性.在上室中分别添加不同浓度WS2纳米片悬液对细胞单层进行48 h暴露.WS2纳米片暴露浓度设置为2和20 μg·mL-1, 分别为细胞毒性最高无效应浓度及其十分之一.
① 细胞单层渗透性的检测.采用细胞旁转运标记物荧光黄(LY)检测WS2纳米片暴露后细胞单层的通透性变化, 在上室加入0.1 mL的0.4 mg·mL-1 LY溶液, 在培养箱中孵育2 h, 取下室培养基检测LY的荧光强度(发射波长428 nm、吸收波长536 nm).采用LDH检测Caco-2细胞的膜完整性.取WS2纳米片暴露后Transwell上室培养基, 测定450 nm处的吸光度, 计算LDH释放量.
② 细胞单层基因表达的检测.收集WS2纳米片暴露后的Caco-2细胞, 使用mRNA提取试剂盒(TaKaRa, 日本)提取总RNA, 并利用SuperScript Ⅲ反转录酶(Invitrogen, 美国)将其反转录成cDNA, 使用QuantStudio 12K Flex荧光定量PCR仪(Applied Biosystems, 美国)进行qRT-PCR分析.引物序列如表 1所示, 反应条件如下:95 ℃反应5 min进行预变性;95 ℃反应10 s, 60 ℃反应30 s, 循环反应40次;最后95 ℃反应15 s, 60 ℃反应60 s, 95 ℃反应15 s.以β-actin为内参基因, 采用相对定量法(2-△△CT)计算基因的表达情况.
表 1(Table 1)
| 表 1 本实验使用的引物序列 Table 1 Primer sequences used in this study | |||||||||||||||||||||
表 1 本实验使用的引物序列 Table 1 Primer sequences used in this study
| |||||||||||||||||||||
2.2.3 WS2纳米片与污染物联合暴露对Caco-2细胞单层的毒性实验按2.2.2节所述方法建立Caco-2细胞单层模型, 形成紧密的细胞单层后, 在上室中分别添加不同浓度的WS2纳米片悬液和/或典型环境污染物(As、Cd和B(a)p), 进行48 h的联合暴露.WS2纳米片悬液的暴露浓度设置为2和20 μg·mL-1, As、Cd和B(a)P的暴露浓度分别为37.5、112和100 μg·L-1, 均与生物体内该污染物浓度相符(王汨, 2013;He et al., 2020).
① 污染物浓度检测.对As和Cd, 分别在Transwell的上室和下室中取200 μL和300 μL培养基, 加入质量分数为2%的硝酸将样品定容至1.2 mL并消解.通过0.22 μm滤膜过滤, 使用电感耦合等离子体质谱法(ICP-MS, PerkinElmer, 美国)测量As和Cd的含量.对于B(a)P, 分别在Transwell的上室和下室中取150 μL和250 μL培养基, 用Milli-Q将样品定容至500 μL.使用Waters Alliance e2695高效液相色谱系统(HPLC, Waters, 美国)的荧光检测器检测样品中B(a)P的浓度.色谱条件:Waters PAH C18色谱柱(4.6×250 mm, 5 μm);柱温30 ℃;进样量为30 μL;流动相A为Milli-Q, 流动相B为乙腈, 流速为1.5 mL·min-1;等度洗脱;激发波长为290 nm, 发射波长为410 nm.
② 细胞单层基因表达的检测.按2.2.2节②中所述方法测定联合暴露后细胞单层中基因GPx和OXSR1的转录表达.
③ 细胞单层膜损伤的检测.按2.2.2节①中所述方法测定联合暴露后细胞单层的LDH释放.
2.3 实验数据处理各指标的测定均进行3次生物学重复, 每次实验每组设置6个平行孔.使用GraphPad Prism 6.0数据处理和统计软件对实验数据进行计算和统计学分析, 实验结果表示为平均值±标准偏差.通过单因素ANOVA分析方法进行统计分析, 组间比较用Tukey检验, p < 0.05为显著性差异.
3 结果与讨论(Results and discussion)3.1 WS2纳米片表征采用TEM对WS2纳米片进行外观表征, 结果如图 1a所示, WS2纳米片形貌与片状纳米材料相符, 粒径与制造商提供数据一致(20~500 nm).
图 1(Fig. 1)
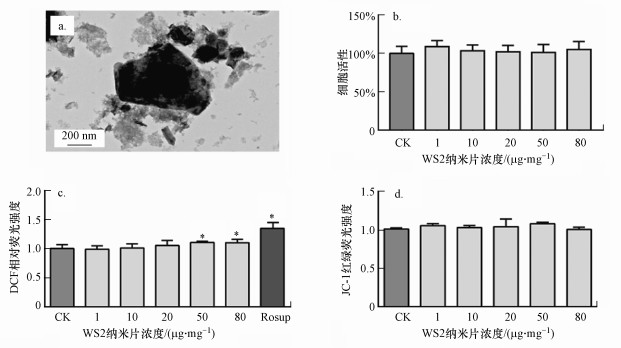 |
| 图 1 WS2纳米片形貌及对Caco-2细胞的毒性效应(a. WS2纳米片的TEM图, b.细胞内ROS水平, c.线粒体膜损伤水平;* 表示与CK组相比有显著差异, p < 0.05) Fig. 1Cytotoxicity of WS2 nanosheets on Caco-2 cell |
3.2 WS2纳米片的Caco-2细胞毒性效应暴露于WS2纳米片24 h后, 根据Caco-2细胞的细胞活力、ROS水平和线粒体膜电位评估了WS2纳米片的细胞毒性.当暴露浓度增加到80 μg·mL-1时, Caco-2细胞的活力仍没有明显改变(图 1b).但是WS2纳米片在≥50 μg·mL-1时显著提高了Caco-2细胞内的ROS水平(图 1c).但对于线粒体膜电位, 在0~80 μg·mL-1的浓度暴露范围内, JC-1的红色/绿色荧光比未发生显著变化, 表明WS2纳米片没有引起Caco-2细胞内线粒体的损伤(图 1d).本研究发现了WS2纳米片具有较高生物相容性, 发现仅在较高浓度时引起细胞内氧化应激.现有文献中也得出了一致的实验结果, WS2纳米材料不能诱导人肾上皮细胞HEK293f的活力降低和高水平的ROS(Appel et al., 2016), 但Teo等发现, 当暴露浓度高达400 μg·mL-1时, WS2纳米片才会对人肺癌上皮细胞A549产生低毒性作用(Teo et al., 2014).综合本研究和文献报道表明, WS2纳米片具有低细胞毒性.
3.3 WS2纳米片对Caco-2细胞单层的毒性构建Caco-2细胞单层模型, TEER值>700 Ω·cm2的细胞单层用于毒性研究.选择WS2最高无效应浓度(NOEC, 20 μg·mL-1)及1/10的NOEC(2 μg·mL-1)为暴露浓度, 暴露48 h后用于毒性检测.
3.3.1 WS2纳米片不影响细胞单层渗透性和完整性LY可以通过细胞连接结构, 其通过量可直接评估Caco-2细胞单层模型的通透性(Ferraretto et al., 2018).WS2纳米片暴露未导致Caco-2细胞单层转运LY的通量增加(p>0.05), 表明Caco-2细胞单层的细胞旁转运途径未受到影响(图 2a).在与WS2纳米片相似的氧化石墨烯暴露中也发现了类似的结果(Domenech et al., 2020).因此, WS2纳米片不影响肠道屏障的功能或结构完整性.据调查发现, 先前的研究并未分析过WS2纳米片暴露后肠道屏障的完整性.
图 2(Fig. 2)
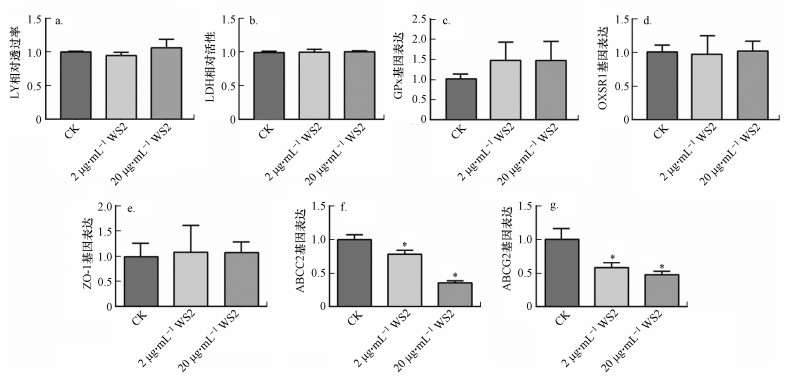 |
| 图 2 WS2纳米片对Caco-2细胞单层的毒性效应(a. LY相对透过率, b.LDH相对活性, c~g. GPx、OXSR1、ZO-1、ABCC2、ABCG2基因表达水平;* 表示与CK组相比有显著差异, p < 0.05) Fig. 2Toxic effects of WS2 nanosheets on Caco-2 cell monolayer |
质膜的完整性在膜功能中起重要作用.LDH是一种可溶性细胞质酶, 当质膜受损时可以释放到细胞外空间, 细胞外LDH可反映细胞膜完整性(Gandamalla et al., 2019).暴露于2和20 μg·mL-1 WS2纳米片后, 与未处理的细胞相比, 未发现明显的LDH释放(图 2b), 表明膜损伤水平较低.
3.3.2 WS2纳米片诱导Caco-2细胞单层基因表达改变从基因表达水平对WS2纳米片的Caco-2细胞单层毒性进行了分析.氧化应激被认为是纳米毒性的主要形式之一(Nel, 2006).本研究也发现了≥50 μg·mL-1的WS2纳米片可增加Caco-2细胞内ROS含量(图 1).对于Caco-2细胞单层, WS2纳米片暴露后的谷胱甘肽过氧化物酶(GPx)和氧化应激反应1(OXSR1)基因表达变化情况被分析, 结果如图 2c和图 2d显示, 48 h的WS2纳米片暴露未改变GPx和OXSR1的表达水平.细胞可通过改变GPx、OXSR1活性以消除氧化应激, 因此, 2和20 μg·mL-1 WS2纳米片并没有刺激细胞的抗氧化系统, 未引起细胞内氧化应激.
肠上皮细胞屏障是宿主防御外源性毒害污染物的重要场所, 是人和动物体内最重要的生物屏障之一(何新颖等, 2008).肠道屏障具有两种物质转运外源物的方式:细胞旁转运途径和跨细胞转运途径(王坤英等, 2012).肠道内细胞旁转运是通过肠道上皮细胞间隙(紧密连接)发生的.本研究分析了WS2纳米片对Caco-2单细胞层闭锁连接蛋白-1(ZO-1)基因的表达情况.结果显示, WS2纳米片对ZO-1的mRNA表达没有明显的影响(图 2e).结合LY通透性结果, 2和20 μg·mL-1WS2纳米片暴露不改变Caco-2细胞单层的旁路转运途径.
细胞膜ABC转运蛋白是内源和外源化合物跨细胞主动转运的重要途径(张久聪等, 2014).多药耐药相关蛋白(ABCC2)和乳腺癌耐药蛋白(ABCG2)属于ABC转运蛋白家族的主要成员(Navarro et al., 2012).本研究发现2和20 μg·mL-1 WS2纳米片降低了ABCC2和ABCG2的mRNA水平, 并显示出浓度依赖效应(图 2f和2g), 表明WS2纳米片在非细胞毒性浓度暴露时, 可抑制ABC转运蛋白的活性.因为细胞膜ABC转运蛋白可识别进入胞内的多种外源化合物, 并以能量依赖方式将其泵出细胞(Chen et al., 2015).本课题组前期的研究及文献报道显示, 与WS2纳米片具有相似性质的二硫化钼和氧化石墨烯可抑制ABC转运蛋白的活性, 导致细胞内其他污染物的积累(Liu et al., 2017;Zhu et al., 2018).A549和RAW264.7细胞暴露于1~10 μg·mL-1 WS2纳米片24 h后, 共存有机污染物对细胞的毒性和细胞内的积累显著增加(Yuan et al., 2020).综合上述结果, 可推测WS2纳米片对Caco-2细胞单层ABC转运蛋白的影响可能会改变与其共存污染物的生物有效性或毒性.
3.4 WS2纳米片与环境污染物联合暴露对Caco-2细胞单层的毒性基于WS2纳米片对Caco-2细胞单层的毒性效应, 进一步分析了WS2纳米片与As、Cd和B(a)P对Caco-2细胞单层转运功能、氧化应激及膜损伤的联合毒性.
3.4.1 WS2纳米片对Caco-2细胞单层转运污染物功能的影响本研究对Caco-2细胞单层模型中污染物由上室向下室的转运情况进行了检测.WS2纳米片分别与As、Cd和B(a)P共暴露48 h后, 收集Caco-2细胞单层模型上、下室的培养基, 检测并确定了目标污染物的跨膜率.如图 3a~3c所示, As、Cd和B(a)P的Caco-2细胞单层通过率分别为31%、2%和27%.2和20 μg·mL-1 WS2纳米片未影响Caco-2细胞单层转运As、Cd或B(a)P的能力.文献报道显示, 细胞旁转运是As、Cd和B(a)P在肠道中的重要运输方式, As持续暴露会破坏细胞旁转运, 导致肠上皮渗透性增加和屏障功能丧失(Chiocchetti et al., 2019).CdCl2暴露后, 肠上皮细胞的屏障功能降低, 但未发现CdCl2对转运蛋白P-gp活性的影响(Boveri et al., 2004).B(a)P对人肠Caco-2细胞中ABCB1和ABCC2的外排活性没有影响, 但会引起血脑屏障模型的TEER值降低(Ho et al., 2019;Guo et al., 2020).基于上述文献报道及本研究3.3节发现的WS2纳米片对Caco-2细胞单层的旁路转运途径的低毒性效应.可以推测, WS2纳米片的毒性作用机制和As、Cd和B(a)P的毒性作用方式及转运通路存在差异, 导致了WS2对细胞单层转运3种污染物的能力没有改变.
图 3(Fig. 3)
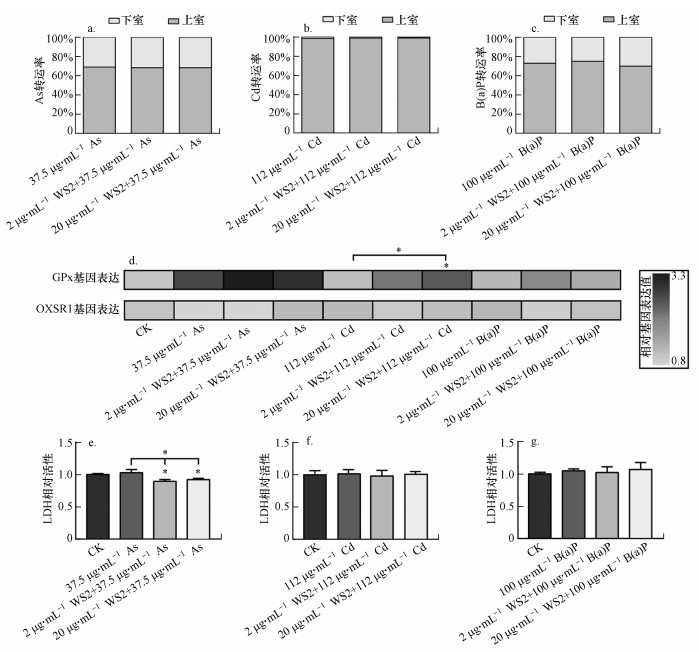 |
| 图 3 WS2纳米片与环境污染物联合暴露对Caco-2细胞单层的毒性效应(a~c. As、Cd和B(a)P从Caco-2细胞单层上室向下室的转运, d.Caco-2细胞单层的GPx和OXSR1基因表达水平, e~g. As、Cd、B(a)P暴露或与WS2纳米片联合暴露的LDH相对活性;* 表示与CK组相比有显著差异, p < 0.05) Fig. 3Toxic effects of combined exposure of WS2 nanosheets and target pollutants on Caco-2 cell monolayer |
3.4.2 联合暴露对Caco-2细胞单层的氧化应激毒性效应采用GPx和OXSR1基因表达量指示WS2纳米片与环境污染物对氧化应激的联合毒性(梅俏等, 2003;Campo-Sabariz et al., 2019).结果如图 3d所示, 37.5 μg·L-1 As和100 μg·L-1 B(a)P单独暴露没有改变GPx和OXSR1的表达水平, WS2纳米片也未影响Caco-2细胞单层对于As和B(a)P的氧化应激响应.但20 μg·mL-1 WS2纳米片和112 μg·L-1 Cd的联合暴露显著增加了Caco-2细胞单层中GPx的mRNA水平(图 3d).上述结果表明, 20 μg·mL-1 WS2纳米片使Caco-2细胞单层对Cd更为敏感, 但对As和B(a)P无类似的效应.产生这一差异的原因可能由于本实验中As和B(a)P的暴露浓度较低, 即使与WS2纳米片共同暴露, 在细胞实验中仍然不易引起氧化应激, 而Cd则在250 μg·L-1浓度下单独暴露即可引起GPx活性变化(Aziz et al., 2014), 与本研究采用的暴露浓度更为接近.
3.4.3 联合暴露对Caco-2细胞单层的膜损伤当细胞内ROS产生和代谢的平衡遭到破坏, 多余的ROS会破坏细胞膜的磷脂.WS2纳米片分别与As、Cd和B(a)P对Caco-2细胞单层进行共暴露后, 各暴露组均未观察到培养液中LDH的明显提高, 表明未诱导细胞膜完整性破坏(图 3e~3g).但WS2纳米片显著降低了As暴露组细胞的LDH漏出率, 这可能是共暴露抑制了LDH的合成或加速了LDH代谢(李建民等, 2011).
4 结论(Conclusions)1) WS2纳米片对于Caco-2细胞具有低毒性作用, 毒性效应体现于提高细胞内ROS水平, 本研究的最低毒性浓度为50 μg·mL-1, 为WS2纳米片的毒性研究提供了依据.
2) 2和20 μg·mL-1WS2纳米片对Caco-2细胞单层模型的渗透性和完整性没有毒性效应, 不会诱导细胞单层的氧化应激, 但抑制了ABC转运蛋白的活性, 进一步证明了WS2纳米片具有较高的生物相容性.
3) WS2纳米片增加了Cd对Caco-2细胞单层ROS相关基因表达水平的影响, 但未改变As和B(a)P对Caco-2细胞单层的毒性结果.WS2纳米片与上述3种污染物的共暴露不会造成明显的细胞单层膜损伤及跨膜转运功能的改变, 因此, 在复杂的实际暴露环境中, WS2纳米片没有明显的化学增敏性, 具有较低的环境健康风险.
参考文献
| Appel J H, Li D O, Podlevsky J D, et al. 2016. Low cytotoxicity and genotoxicity of two-dimensional MoS2 and WS2[J]. ACS Biomaterials Science & Engineering, 2(3): 361-367. |
| Aziz R, Rafiq M T, Yang J, et al. 2014. Impact assessment of cadmium toxicity and its bioavailability in human cell lines (Caco-2 and HL-7702)[J]. BioMed Research International, 2014: 839538. |
| Boveri M, Pazos P, Gennari A, et al. 2004. Comparison of the sensitivity of different toxicological endpoints in Caco-2 cells after cadmium chloride treatment[J]. Archives of Toxicology, 78(4): 201-206. DOI:10.1007/s00204-003-0532-1 |
| Campo-Sabariz J, Moral-Anter D, Brufau M T, et al. 2019. 2-Hydroxy-(4-methylseleno)butanoic acid is used by Intestinal Caco-2 cells as a source of selenium and protects against oxidative stress[J]. The Journal of Nutrition, 149(12): 2191-2198. DOI:10.1093/jn/nxz190 |
| Chen H, Zha J, Yuan L, et al. 2015. Effects of fluoxetine on behavior, antioxidant enzyme systems, and multixenobiotic resistance in the Asian clam Corbicula fluminea[J]. Chemosphere, 119: 856-862. DOI:10.1016/j.chemosphere.2014.08.062 |
| Chiocchetti G M, Velez D, Devesa V. 2019. Inorganic arsenic causes intestinal barrier disruption[J]. Metallomics, 11(8): 1411-1418. DOI:10.1039/C9MT00144A |
| Domenech J, Hernandez A, Demir E, et al. 2020. Interactions of graphene oxide and graphene nanoplatelets with the in vitro Caco-2/HT29 model of intestinal barrier[J]. Scientific Reports, 10(1): 2793. DOI:10.1038/s41598-020-59755-0 |
| Ferraretto A, Bottani M, De Luca P, et al. 2018. Morphofunctional properties of a differentiated Caco2/HT-29 co-culture as an in vitro model of human intestinal epithelium[J]. Bioscience Reports, 38(2): BSR20171497. DOI:10.1042/BSR20171497 |
| Gandamalla D, Lingabathula H, Yellu N. 2019. Nano titanium exposure induces dose- and size-dependent cytotoxicity on human epithelial lung and colon cells[J]. Drug and Chemical Toxicology, 42(1): 24-34. DOI:10.1080/01480545.2018.1452930 |
| Ganguly P, Breen A, Pillai S C. 2018. Toxicity of nanomaterials: exposure, pathways, assessment, and recent advances[J]. ACS Biomaterials Science & Engineering, 4(7): 2237-2275. |
| Goldman E B, Zak A, Tenne R, et al. 2015. Biocompatibility of tungsten disulfide inorganic nanotubes and fullerene-like nanoparticles with salivary gland cells[J]. Tissue Engineering: Part A, 21(5/6): 1013-1023. |
| Guo B, Xu Z, Yan X, et al. 2020. Novel ABCB1 and ABCC transporters are involved in the detoxification of benzo(α)pyrene in thick shell mussel, Mytilus coruscus[J]. Frontiers in Marine Science, 7: 119. DOI:10.3389/fmars.2020.00119 |
| He C, Su T, Liu S, et al. 2020. Heavy metal, arsenic, and selenium concentrations in bird feathers from a region in southern China impacted by intensive mining of non-ferrous metals[J]. Environmental Toxicology and Chemistry, 39(2): 371-380. DOI:10.1002/etc.4622 |
| 何新颖, 唐志鹏, 张亚利. 2008. 肠上皮屏障与炎症性肠病研究进展[J]. 世界华人消化杂志, (29): 3316-3320. DOI:10.3969/j.issn.1009-3079.2008.29.013 |
| Ho D H, Burggren W W. 2019. Blood-brain barrier function, cell viability, and gene expression of tight junction-associated proteins in the mouse are disrupted by crude oil, benzo[a]pyrene, and the dispersant COREXIT[J]. Comparative Biochemistry and Physiology, Part C, 223: 96-105 |
| Jia P P, Sun T, Junaid M, et al. 2019. Chronic exposure to graphene oxide (GO) induced inflammation and differentially disturbed the intestinal microbiota in zebrafish[J]. Environmental Science: Nano, 6(8): 2452-2469. DOI:10.1039/C9EN00364A |
| Komsa H P, Kotakoski J, Kurasch S, et al. 2012. Two-dimensional transition metal dichalcogenides under electron irradiation: defect production and doping[J]. Physical Review Letters, 109(3): 035503. DOI:10.1103/PhysRevLett.109.035503 |
| 孔春霞, 张雪, 戴腾飞, 等. 2019. 二硫化钨的制备、表征及其在全固态绿光脉冲激光器中的应用[J]. 量子光学学报, 25(4): 449-455. |
| Lamon L, Aschberger K, Asturiol D, et al. 2019. Grouping of nanomaterials to read-across hazard endpoints: a review[J]. Nanotoxicology, 13(1): 100-118. DOI:10.1080/17435390.2018.1506060 |
| 李建民, 徐艳明, 陈巧云, 等. 2011. 杜仲抗UVB致HaCaT细胞光老化活性部位的初步筛选[J]. 中医药信息, 28(1): 24-26. DOI:10.3969/j.issn.1002-2406.2011.01.010 |
| Liu P, Shao H, Kong Y, et al. 2020. Effect of graphene oxide exposure on intestinal Wnt signaling in nematode Caenorhabditis elegans[J]. Journal of Environmental Sciences, 88: 200-208. DOI:10.1016/j.jes.2019.09.002 |
| Liu S, Shen Z, Wu B, et al. 2017. Cytotoxicity and efflux pump inhibition induced by molybdenum disulfide and boron nitride nanomaterials with sheetlike structure[J]. Environmental Science & Technology, 51(18): 10834-10842. |
| 刘斯亮. 2019. 氧化石墨烯对肠炎小鼠肠上皮细胞损伤的影响及机制研究[D]. 广州: 南方医科大学 |
| Manzeli S, Ovchinnikov D, Pasquier D, et al. 2017. 2D transition metal dichalcogenides[J]. Nature Reviews Materials, 2(8): 17033. DOI:10.1038/natrevmats.2017.33 |
| 梅俏, 项立, 胡咏梅, 等. 2003. 褪黑素对结肠黏膜上皮细胞氧化应激的影响[J]. 安徽医科大学学报, (3): 191-194. DOI:10.3969/j.issn.1000-1492.2003.03.009 |
| Navarro A, Weissbach S, Faria M, et al. 2012. Abcb and Abcc transporter homologs are expressed and active in larvae and adults of zebra mussel and induced by chemical stress[J]. Aquat Toxicol, 122-123: 144-152. DOI:10.1016/j.aquatox.2012.06.008 |
| Nel A, Xia T, Madler L, et al. 2006. Toxic potential of materials at the nanolevel[J]. Science, 311(5761): 622-627. DOI:10.1126/science.1114397 |
| Redlich M, Katz A, Rapoport L, et al. 2008. Improved orthodontic stainless steel wires coated with inorganic fullerene-like nanoparticles of WS2 impregnated in electroless nickel-phosphorous film[J]. Dental Materials, 24(12): 1640-1646. DOI:10.1016/j.dental.2008.03.030 |
| Tang Y, Tian J, Li S, et al. 2015. Combined effects of graphene oxide and Cd on the photosynthetic capacity and survival of Microcystis aeruginosa[J]. Science of the Total Environment, 532: 154-161. DOI:10.1016/j.scitotenv.2015.05.081 |
| Teo W Z, Chng E L, Sofer Z, et al. 2014. Cytotoxicity of exfoliated transition-metal dichalcogenides (MoS2, WS2, and WSe2) is lower than that of graphene and its analogues[J]. Chemistry, 20(31): 9627-9632. DOI:10.1002/chem.201402680 |
| Voiry D, Yamaguchi H, Li J, et al. 2013. Enhanced catalytic activity in strained chemically exfoliated WS2 nanosheets for hydrogen evolution[J]. Nature Materials, 12(9): 850-855. DOI:10.1038/nmat3700 |
| 王坤英, 贾永芳, 李卫国. 2012. 小肠上皮细胞钙转运机制研究进展[J]. 生物学教学, 37(8): 6-8. DOI:10.3969/j.issn.1004-7549.2012.08.003 |
| 王汨. 2013. 长江上游鱼类体内多环芳烃的含量及饲料菲对中华倒刺鲃生态毒理学影响[D]. 重庆: 西南大学 |
| Xu M, Liang T, Shi M, et al. 2013. Graphene-like two-dimensional materials[J]. Chemical Reviews, 113(5): 3766-3798. DOI:10.1021/cr300263a |
| Yu L, Tian X, Gao D, et al. 2019. Oral administration of hydroxylated-graphene quantum dots induces intestinal injury accompanying the loss of intestinal stem cells and proliferative progenitor cells[J]. Nanotoxicology, 13(10): 1409-1421. DOI:10.1080/17435390.2019.1668068 |
| Yuan P, Zhou Q, Hu X. 2020. WS2 Nanosheets at noncytotoxic concentrations enhance the cytotoxicity of organic pollutants by disturbing the plasma membrane and efflux pumps[J]. Environmental Science & Technology, 54(3): 1698-1709. |
| 张久聪, 王彪猛, 常宗宏, 等. 2014. ABC细胞膜转运蛋白及其介导的细胞多药耐药研究进展[J]. 生物技术通讯, 25(6): 862-866. DOI:10.3969/j.issn.1009-0002.2014.06.027 |
| Zhu J, Xu M, Wang F, et al. 2018. Low-dose exposure to graphene oxide significantly increases the metal toxicity to macrophages by altering their cellular priming state[J]. Nano Research, 11(8): 4111-4122. DOI:10.1007/s12274-018-1996-x |
