 , 王诗慧1, 朱克宇1, 马宁2, 张辉3, 王华1
, 王诗慧1, 朱克宇1, 马宁2, 张辉3, 王华1

1. 大连海洋大学, 水产与生命学院, 大连 116023;
2. 北京市水科学技术研究院, 流域水环境与生态技术北京市重点实验室, 北京 100048;
3. 北京师范大学, 环境学院, 北京 100875
收稿日期: 2020-10-26; 修回日期: 2021-01-08; 录用日期: 2021-01-08
基金项目: 国家重点研发计划(No.2016YFC0401405);辽宁省自然科学基金指导计划(No.2019-ZD-0726)
作者简介: 卢毅(1995-), 男, E-mail: 18340802711@163.com
通讯作者(责任作者): 王华, E-mail: wanghua@dlou.edu.cn
摘要:为评估纳米TiO2在环境水体中的暴露风险,选用大型溞作为模式生物,研究了不同粒径纳米TiO2(20、40、60和100 nm)对大型溞毒性效应的影响,并探究了腐殖酸对不同粒径纳米TiO2毒性效应的调控作用.结果表明,粒径是影响纳米TiO2颗粒毒性效应的重要因素,以大型溞半数致死时间(LT50)为指标,不同粒径纳米TiO2对大型溞的毒性作用强弱顺序依次为:20 nm颗粒> 40 nm颗粒> 60 nm颗粒> 100 nm颗粒(p < 0.05).腐殖酸的存在可以显著降低纳米TiO2颗粒对大型溞的毒性作用,腐殖酸对小尺寸纳米TiO2颗粒的毒性抑制作用更为明显(p < 0.05).大型溞体内ROS水平与抗氧化系统相关酶活分析表明,纳米TiO2导致大型溞体内活性氧自由基(ROS)浓度升高是其产生毒性作用的重要原因,腐殖酸的存在可以显著降低大型溞体内由于纳米TiO2暴露而引起的ROS浓度上升(p < 0.05),进而减轻纳米TiO2对大型溞的毒性作用.此外,腐殖酸可以减小不同粒径纳米TiO2之间的毒性差异.本研究结果可为纳米TiO2在环境水体中的暴露风险评估提供参考依据.
关键词:纳米TiO2大型溞毒性活性氧抗氧化酶
Size-dependent toxicity of TiO2 nanoparticle to Daphnia magna and its regulation by humic acid
LU Yi1
 , WANG Shihui1, ZHU Keyu1, MA Ning2, ZHANG Hui3, WANG Hua1
, WANG Shihui1, ZHU Keyu1, MA Ning2, ZHANG Hui3, WANG Hua1

1. School of Fisheries and Life Science, Dalian Ocean University, Dalian 116023;
2. Beijing Key Laboratory of Water Environmental and Ecological Technology for River Basins, Beijing Water Science and Technology Institute, Beijing 100048;
3. School of Environment, Beijing Normal University, Beijing 100875
Received 26 October 2020; received in revised from 8 January 2021; accepted 8 January 2021
Abstract: To investigate the potential risk of TiO2 nanoparticles (NPs) to ecological system, Daphnia magna was adopted to assess the size-dependent toxicity of TiO2 NPs in the absence and present of humic acids (HA). The acute toxicity results revealed that the size of TiO2 NPs played an important role in determining their toxicity to D. magna. TiO2 NPs with smaller size showed higher toxicity to D. magna than the larger ones (p < 0.05). HA could significantly reduce the toxicity of TiO2 NPs in a size-dependent manner, which means a more remarkable protective role of HA against TiO2 NPs toxicity was observed for smaller sized TiO2 NPs than the larger ones (p < 0.05). Several antioxidant biomarkers results showed that the accumulation of ROS concentration induced by TiO2 NPs was mainly responsible for the toxicity to D. magna. The presence of HA could significantly reduce the increase of ROS level caused by TiO2 NPs exposure, and then led to alleviated toxicity. Furthermore, HA could reduce the toxicity differences between TiO2 NPs with different size. These results highlight the importance of the physicochemical properties of TiO2 NPs in evaluating their environmental risks.
Keywords: TiO2 NPsDaphnia magnatoxicityreactive oxygen speciesantioxidant enzymes
1 引言(Introduction)随着纳米技术的不断发展, 纳米TiO2被广泛用于涂料、化妆品、纺织、医疗等领域(Chen et al., 2007; Musial et al., 2020;甘禹鑫等, 2020).随着全球范围内纳米TiO2产量的逐年增加, 在中国、瑞士和美国等国家的水体中均检测到纳米TiO2的存在(Westerhoff et al., 2011; Gao et al., 2013; Coll et al., 2016).纳米TiO2的广泛应用使其不可避免地进入到环境介质中并对生态环境产生影响(Shandilya et al., 2015; Ettrup et al., 2017), 且已有研究表明纳米TiO2会对生物产生毒性效应(Zhu et al., 2010; Erdem et al., 2015; Sendra et al., 2017; Li et al., 2019).由于纳米TiO2自身种类丰富(形貌、晶相等), 且其排放到环境水体后不可避免地与水体中的腐殖酸、盐离子等发生相互作用, 因此, 多角度评估纳米TiO2的环境行为及毒性效应对全面评估纳米TiO2的环境暴露风险具有重要意义.
一般来说, 纳米TiO2在环境水体中的生态暴露风险与两方面因素有关:一是纳米TiO2自身的理化性质, 如表面电荷、尺寸、晶相结构等;二是纳米TiO2在环境水体中发生的物理化学转化过程(Tong et al., 2013; Maurer-Jones et al., 2013; Espinasse et al., 2018).Kim等(2010)研究发现, 粒径为200 nm的纳米TiO2对大型溞(Daphnia magna Straus)的毒性作用明显强于400 nm和800 nm的纳米TiO2, 并会产生显著的氧化应激反应, 但对于小尺寸纳米TiO2颗粒(< 100 nm)的毒性效应缺乏研究.Brzicova等(2019)对比了14种纳米TiO2对THP-1巨噬细胞的杀伤作用, 结果表明, 粒径和晶面都会不同程度地影响纳米TiO2的毒性作用.此外, 研究表明, 纳米TiO2、纳米ZnO、纳米Ag和纳米炭黑颗粒等均显示出对生物组织或细胞随粒径变化的毒性效应(Ca?as et al., 2011; Brzicova et al., 2019; 张瑞, 2019; 李晴晴, 2020), 不同粒径微塑料对大型溞摄食率也会产生明显的效应差异(苑文珂, 2020).因此, 揭示纳米TiO2理化性质与毒性效应间的相互关系是建立纳米TiO2环境暴露风险模型, 进而预测纳米材料环境暴露风险的关键.
腐殖酸(HA)是自然水体中广泛存在的一种天然有机物(NOM), 可以显著影响纳米材料在水体中的转化归趋行为, 进而影响纳米材料的毒性效应(Fadare et al., 2019; Abdel-Latif et al., 2020).Kansara等(2019)发现腐殖酸和泥土的共同作用可改变纳米TiO2的聚集状态, 并降低纳米TiO2对斑马鱼胚胎的毒性作用.腐殖酸可直接吸附在纳米TiO2表面, 影响其与生物体内大分子(如蛋白质)的相互作用, 进而调控纳米材料在环境中的毒性效应(Nasser et al., 2019; Fadare et al., 2020).尽管目前对腐殖酸与纳米材料相互作用有一定研究, 然而腐殖酸对不同粒径纳米粒子的毒性调控作用差异及机制尚不明确, 无法有效地预测其进入水环境中对水生动物产生的危害.因此, 亟需研究腐殖酸对不同粒径纳米TiO2毒性作用的影响, 进而全面评估纳米TiO2在环境水体中的暴露风险.
基于此, 本文选用大型溞作为模式生物, 在进行24 h或72 h急性毒性试验后, 以大型溞存活率、活性氧水平、抗氧化酶活性和丙二醛含量等作为毒性评价指标, 考察不同粒径纳米TiO2对大型溞的毒性作用, 并探究粒径对纳米TiO2与腐殖酸相互作用的影响及毒性效应的调控作用, 以期评估纳米TiO2在环境水体中的暴露风险.
2 材料与方法(Materials and methods)2.1 材料锐钛矿型纳米TiO2颗粒(粒径20、40、60、100 nm)购自上海阿拉丁生化科技有限公司;腐殖酸标准样品(HA)购自国际腐殖酸协会, 来源于Suwannee河;活性氧(ROS)测定试剂盒、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒均购自南京建成生物科技公司.大型溞来源于英国伯明翰大学, 在实验室稳定培育5 a以上.
2.2 纳米TiO2表征纳米TiO2的形貌结构采用场发射扫描电子显微镜(FE-SEM, SU-8020, JP)进行表征.纳米TiO2溶液的Zeta电位和水合动力学半径利用Malvern Zetasizer Nano ZS动态光散射仪进行测定.纳米TiO2溶液采用M7培养基进行配置, TiO2浓度为0.1 mg·L-1.在纳米TiO2和腐殖酸共存溶液体系中, 腐殖酸浓度为1.0 mg·L-1.
2.3 大型溞毒性暴露实验2.3.1 大型溞培养大型溞在恒温光照培养箱中培养, 培养箱温度维持在23 ℃, 光照/暗态时间为16 h/8 h.大型溞培养基采用Elendt M7培养基(Samel et al., 1999), pH值控制在7.8~8.1, 每1~2 d更换一次培养基.培养过程中, 每日定量喂食淡水小球藻, 每次喂食时, 每30个成年溞定量添加5 mL小球藻母液.小球藻母液配置方法:淡水小球藻在光照下连续曝气72 h后离心(3500 r·min-1, 5 min)去上清, 随后沉淀部分添加纯水稀释至405 nm下吸光度为0.8, 此为淡水小球藻母液, 储存于4 ℃冰箱.
2.3.2 纳米TiO2暴露大型溞毒性试验根据经合组织OECD 202推荐有关大型溞的毒性试验方法(OECD, 2004), 采用24 h内出生的大型溞作为试验生物进行急性毒性暴露试验:首先将不同粒径纳米TiO2混合培养基充分超声分散和机械搅拌配置成TiO2分散溶液, 然后添加不同量腐殖酸配置成含0、0.1、0.5、1.0、1.5 mg·L-1 HA的培养基溶液, 纳米TiO2最终浓度为50 mg·L-1.每个烧杯放置24 h内出生的幼溞10只, 保鲜膜封口后置于恒温光照培养箱(23 ℃, 光暗比16 h/8 h)暴露72 h, 试验过程中均不喂食小球藻, 实验设计3组平行并重复3次.
2.3.3 大型溞细胞内活性氧水平测定与急性毒性试验类似, 分别在不同粒径的纳米TiO2(50 mg·L-1)溶液中暴露大型溞, 在试验进行至0、6、12、24、36、48、72 h时, 取暴露后的大型溞吸干体表水分并称重(每种粒径每个时间点取3组, 每组10只), 使用电动匀浆机制成匀浆介质(大型溞质量∶生理盐水体积=1 mg∶9 mL), 离心(2500 r·min-1, 15 min)后, 利用总蛋白(TP)测定试剂盒(南京建成)测定大型溞蛋白含量;再使用活性氧(ROS)测定试剂盒(南京建成), 将匀浆介质暴露在DACH-DA探针中37 ℃孵育45 min, 使用酶标仪测定匀浆介质的ROS含量, 试验结果以实验组/对照组表示.在纳米TiO2和HA共暴露体系中, TiO2浓度为50 mg·L-1, HA浓度为1.0 mg·L-1, 暴露24 h后, 每组取10只大型溞并重复上述实验操作.
2.3.4 大型溞体内纳米TiO2分布的显微镜观察大型溞在纳米TiO2(50 mg·L-1)溶液中暴露24 h后, 每个暴露组取一只活大型溞, 表面清洗干净后转移至离心管并添加无水乙醇, 随后立刻将大型溞放于载玻片上, 并滴加纯水置于光学显微镜下观察.在纳米TiO2和HA共暴露体系中, HA浓度为1.0 mg·L-1, 暴露24 h后, 重复上述实验步骤进行显微镜观察.
2.3.5 大型溞氧化应激有关指标的测定大型溞在50 mg·L-1 TiO2溶液中暴露24 h(HA浓度分别为0、0.1、0.5、1.0、1.5 mg·L-1)后, 收集10只大型溞并制成匀浆介质, 采用低温离心机(Optima L-100 K, Beckman Coulter, Indianapolis, IL, US)进行离心(2500 r·min-1, 15 min)后利用总蛋白(TP)测定试剂盒(南京建成)测定匀浆介质蛋白含量, 随后按照说明书利用试剂盒分别检测大型溞体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)酶活性和丙二醛(MDA)含量, 以评估大型溞抗氧化酶活性和脂质过氧化水平.每次实验取3组平行样, 并重复实验3次.
2.4 数据分析与处理实验数据使用SPSS 21.0软件进行统计分析, 采用单因素方差分析(ANOVA)对大型溞存活率、半数致死时间、体内ROS含量、SOD、CAT、GSH-Px酶活性和MDA含量变化进行组间差异性分析, 显著性水平为p < 0.05.
3 结果与讨论(Results and discussion)3.1 纳米TiO2结构性质表征不同粒径纳米TiO2扫描电镜(SEM)照片如图 1所示, 所购的纳米TiO2形貌均匀, 粒径分布在20、40、60、100 nm左右.不同粒径纳米TiO2的Zeta电位分别为6.85 mV(20 nm)、7.2 mV(40 nm)、8.65 mV(60 nm)、13.8 mV(100 nm), 说明以上4种不同粒径的纳米TiO2具有相似的结构和理化性质, 可以作为模型体系研究纳米颗粒尺寸对其生物毒性效应的影响.
图 1(Fig. 1)
 |
| 图 1 不同粒径纳米TiO2的SEM照片(a.20 nm, b.40 nm, c.60 nm, d.100 nm) Fig. 1SEM images of TiO2 nanoparticles (a.20 nm, b.40 nm, c.60 nm, d.100 nm) |
为揭示腐殖酸加入后对4种粒径纳米TiO2理化性质的影响, 对腐殖酸加入前后纳米TiO2溶液的Zeta电位和水合粒径进行了测定.如表 1所示, 在M7培养基中(pH=7.9), TiO2颗粒表面带负电荷, 其水合粒径随纳米颗粒的增大呈逐渐增加趋势.与纳米TiO2在纯水溶液中相比, 由于M7培养基中含有大量盐离子和有机质, 导致纳米TiO2颗粒发生一定聚集行为, 实验中测得的水合粒径相对较大.加入腐殖酸后, 腐殖酸吸附在纳米TiO2颗粒表面, 由于腐殖酸含有大量的含氧官能团, 使得纳米TiO2颗粒表面的负电荷强度增加, 同时由于腐殖酸的稳定作用, 使得纳米TiO2胶体的水合粒径在加入腐殖酸后显著降低.这表明腐殖酸改变了纳米TiO2在培养基中的聚集状态, 使纳米TiO2在培养基中更均匀地分散, 增加了大型溞对纳米TiO2-HA的摄食几率.
表 1(Table 1)
| 表 1 不同粒径纳米TiO2吸附腐殖酸后Zeta电位和水合粒径变化情况 Table 1 Zeta potential and hydrodynamic diameter of TiO2 nanoparticles in the present/absence of HA | |||||||||||||||||||||||||||||||||||
表 1 不同粒径纳米TiO2吸附腐殖酸后Zeta电位和水合粒径变化情况 Table 1 Zeta potential and hydrodynamic diameter of TiO2 nanoparticles in the present/absence of HA
| |||||||||||||||||||||||||||||||||||
3.2 不同粒径纳米TiO2暴露对大型溞的毒性作用图 2展示了暴露于不同粒径纳米TiO2(20、40、60、100 nm) 0~72 h后大型溞的存活率曲线.可以看出, 在暴露初期(0~24 h), 各粒径纳米TiO2均不会对大型溞产生明显的毒性作用, 而后随着暴露时间的延长, 纳米TiO2在大型溞体内不断积累, 导致越来越明显的毒性作用.以大型溞半数致死时间(LT50)为指标评估纳米颗粒尺寸对其毒性作用的影响(Céréghino et al., 2020), 发现20、40、60、100 nm的纳米TiO2的半数致死时间(LT50)分别为36.8、40.4、47.7、50.5 h, 这表明粒径越小的纳米TiO2对大型溞的毒性作用越强, 具体表现为20 nm颗粒>40 nm颗粒>60 nm颗粒>100 nm颗粒(p < 0.05).以上结果说明粒径大小是影响纳米TiO2对大型溞毒性作用的重要因素.
图 2(Fig. 2)
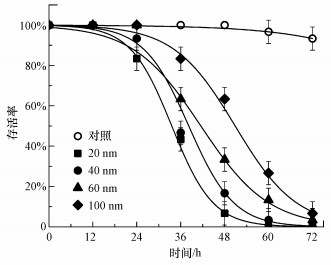 |
| 图 2 不同粒径纳米TiO2(50 mg·L-1)暴露后大型溞存活率随暴露时间的变化(实验数据以平均值±标准偏差表示, n=3, 下同) Fig. 2Percentage survival of D. magna exposed to TiO2 NPs (50 mg·L-1) for 72 h (Data are presented as mean±standard deviation, n=3, the same below) |
氧化应激效应是纳米材料毒性效应的重要发生机制, 大型溞体内的ROS水平可作为评估大型溞体内氧化损伤水平和产生毒性效应的重要指标(Lu et al., 2017; Hou et al., 2019).由图 3可知, 大型溞体内ROS水平随纳米TiO2暴露时间的增长而不断升高, 这是由于暴露初期纳米TiO2不断在大型溞体内生物富集, 进而导致大型溞体内ROS快速积累并产生明显的毒性作用, 在暴露的最后阶段(48~72 h)大型溞出现大量死亡.暴露粒径越小的纳米TiO2其对应大型溞体内ROS水平越高(20 nm颗粒>40 nm颗粒>60 nm颗粒>100 nm颗粒)(p<0.05), 这与暴露于不同粒径纳米TiO2后大型溞的存活率是一致的, 以上说明ROS升高是纳米TiO2对大型溞产生毒性作用的重要原因.
图 3(Fig. 3)
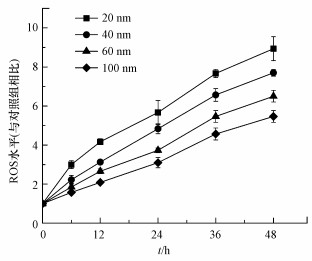 |
| 图 3 暴露于不同粒径纳米TiO2后大型溞体内ROS水平(与对照组相比)随暴露时间的变化 Fig. 3ROS level in D. magna in response to TiO2 NPs during 48 h of exposure |
3.3 腐殖酸对不同粒径纳米TiO2毒性作用的调控在环境水体中, 腐殖酸作为一种天然有机质(NOM)广泛存在.为进一步评估纳米TiO2在环境介质中的暴露风险, 将不同浓度腐殖酸添加到纳米TiO2溶液体系进行共暴露, 考察腐殖酸对不同粒径纳米TiO2毒性效应的影响.图 4为当0、0.1、0.5、1.0、1.5 mg·L-1腐殖酸存在时, 在20、40、60、100 nm纳米TiO2暴露下大型溞的生存率随时间的变化曲线.结果显示, 0.1 mg·L-1腐殖酸对纳米TiO2毒性的影响并不明显(p>0.05);当浓度达到0.5 mg·L-1后, 腐殖酸明显降低了纳米TiO2对大型溞的毒性作用(p<0.05);而当腐殖酸浓度达到1.0和1.5 mg·L-1时, 显著减轻了4种粒径纳米TiO2对大型溞的毒性作用, 但两者之间无显著性差异(p>0.05), 这说明1.0 mg·L-1为腐殖酸调控各粒径TiO2毒性作用的最大效应浓度.以上结果表明, 腐殖酸可以显著降低纳米TiO2对大型溞的毒性作用, 在0~1.0 mg·L-1范围内, 腐殖酸对不同粒径纳米TiO2毒性的抑制程度与腐殖酸浓度呈正相关.这是由于腐殖酸吸附在纳米粒子表面后, 在其表面形成腐殖酸层, 从而阻碍了纳米TiO2直接与生物分子发生相互作用, 实现对纳米颗粒毒性效应的抑制(Nasser et al., 2019).
图 4(Fig. 4)
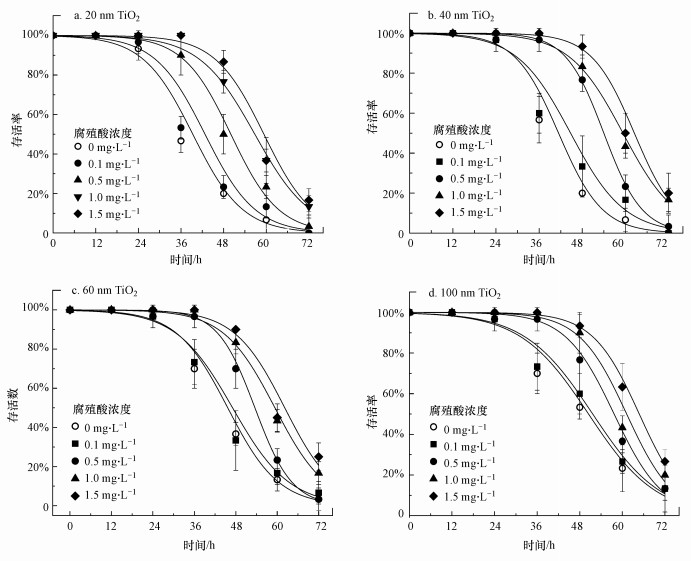 |
| 图 4 不同浓度腐殖酸存在时不同粒径纳米TiO2暴露下大型溞存活率随时间的变化曲线 Fig. 4Percentage survival of D. magna exposed to TiO2 NPs (50 mg·L-1) for 72 h in the presence of HA (0, 0.1, 0.5, 1.0, 1.5 mg·L-1) |
为进一步定量描述腐殖酸对纳米TiO2毒性效应的影响, 对纳米TiO2暴露后大型溞的半数致死时间(LT50)进行分析.如图 5a所示, 当腐殖酸浓度达到0.5 mg·L-1后, 4种粒径纳米TiO2暴露的大型溞半数致死时间与无腐殖酸组相比有显著性差异(p<0.05);当腐殖酸浓度达到1.0 mg·L-1时, 20、40、60、100 nm纳米TiO2暴露的大型溞半数致死时间分别为无腐殖酸暴露组的1.60、1.40、1.24、1.15倍, 说明腐殖酸对粒径越小的纳米TiO2的毒性抑制效果越强(表现为20 nm颗粒>40 nm颗粒>60 nm颗粒>100 nm颗粒)(p<0.05).这可能是由于粒径较小的纳米TiO2具有更大的比表面积, 进而吸附了更多的腐殖酸, 产生了更强的毒性抑制效果;此外, 当腐殖酸浓度达到0.5 mg·L-1后, 20、40、60、100 nm纳米TiO2暴露下的大型溞半数致死时间之间无显著性差异(p>0.05), 说明此时4种粒径纳米TiO2对大型溞的毒性作用处于同一水平, 这表明一定浓度腐殖酸的存在显著降低了不同粒径纳米TiO2对大型溞的毒性效应差异.
图 5(Fig. 5)
 |
| 图 5 不同浓度腐殖酸对不同粒径纳米TiO2暴露下大型溞半数致死时间(LT50)的影响(a)及不同粒径纳米TiO2暴露24 h后大型溞体内ROS水平变化(b)(*表示与对照组相比有显著性差异) Fig. 5The median lethal time (LT50)(a) and ROS level(b) in D. magna in response to TiO2 NPs (50 mg·L-1) in the presence of 0~1.5mg·L-1 HA after 24 h of exposure(b) (*p < 0.05 indicates a significant difference in comparison with the control group) |
3.4 大型溞体内纳米TiO2分布的显微镜观察为进一步明确纳米TiO2在大型溞体内的暴露情况, 采用光学显微镜对不同粒径纳米TiO2(50 mg·L-1)暴露24 h后的大型溞样品进行观察.如图 6所示, 纳米TiO2主要分布在大型溞的肠道、胸肢及体表.相较于20 nm和40 nm暴露组, 60 nm和100 nm暴露组可以较清晰地观察到大型溞胸肢、肠道的轮廓, 说明20、4 nm的纳米TiO2在大型溞胸肢、肠道富集的更多.Tervonen等(2010)认为大型溞肠道的pH值和离子强度是影响纳米粒子生物积累的重要因素, 而Lewinski等(2010)认为这是由于纳米粒子粘在肠道壁上并不断积累导致.由于尺寸较小的纳米TiO2具有更大的比表面积更容易吸附在物体表面(张智等, 2017), 导致大型溞体内粒径较小的纳米TiO2含量更多、分布更均匀, 进而产生更强的毒性作用.
图 6(Fig. 6)
 |
| 图 6 不同粒径纳米TiO2 (50 mg·L-1)暴露24 h后大型溞体内的分布及有腐殖酸(1.0 mg·L-1)存在时纳米TiO2在大型溞体内分布的变化情况 Fig. 6TiO2 NPs distribution in D. magna after exposure with TiO2 NPs (50 mg·L-1) for 24 h in the present/absence of HA (1.0 mg·L-1) |
当腐殖酸存在时, 与单独纳米TiO2暴露体系相比, 可以发现腐殖酸的存在显著减少了纳米TiO2粘附在大型溞胸肢的量.由于纳米TiO2在大型溞体表的粘附量较低, 可以更加清晰地观察到大型溞肠道的轮廓结构.Lin等(2012)认为这是由于纳米TiO2吸附腐殖酸后, 表面负电荷强度增大, 从而增大了静电斥力, 减缓了纳米TiO2在细胞表面的吸附, 导致进入生物体内和粘附在生物体表的TiO2量显著减少.
3.5 腐殖酸对纳米TiO2暴露大型溞体内ROS水平及抗氧化相关酶活的影响目前的研究中一般认为纳米TiO2主要通过诱导生物体内产生过量的ROS从而产生毒性作用(张智等, 2017).当生物体内ROS失衡后, 过多的ROS自由基会导致细胞氧化系统和抗氧化系统失衡, 而SOD、CAT、GSH-Px酶作为生物体内的抗氧化酶均可清除体内的活性氧(张章等, 2016).
为了进一步考察腐殖酸对纳米TiO2诱导大型溞氧化应激效应的影响, 对不同腐殖酸浓度下纳米TiO2暴露24 h后大型溞体内ROS的浓度水平进行了测定(图 5b).结果显示, 4种粒径纳米TiO2诱导大型溞体内ROS水平均随腐殖酸浓度升高而降低, 这说明腐殖酸的存在可显著抑制TiO2诱导大型溞体内的氧化应激效应.当腐殖酸浓度达到1.5 mg·L-1时, 40、60、100 nm TiO2暴露组大型溞体内ROS水平均与未暴露组之间无显著性差异(p>0.05), 20 nm TiO2暴露组大型溞体内ROS水平也显著降低, 这与腐殖酸对大型溞半数致死时间的影响是一致的, 说明大型溞体内ROS水平升高是导致纳米TiO2产生毒性作用的重要原因, 而腐殖酸的存在可以显著提高纳米TiO2的生物相容性.
当不同浓度腐殖酸(0~1.5 mg·L-1)存在时, 对不同粒径纳米TiO2暴露24 h后大型溞体内抗氧化酶活性(SOD、CAT、GSH-Px酶)进行了检测.如图 7a~7c所示, 在纳米TiO2暴露24 h后, 大型溞体内抗氧化相关酶活与对照组相比均有明显上升(p<0.05), 说明大型溞的细胞已经受到了ROS显著影响.图 7 d显示MDA含量也显著上升(p<0.05), 表明大型溞细胞受到脂质过氧化损伤, 20、40、60、100 nm TiO2暴露的大型溞之间抗氧化酶活性和MDA含量也表现出显著差异(p<0.05), 小尺寸的纳米TiO2暴露后大型溞体内抗氧化酶活性和MDA含量明显大于大尺寸纳米TiO2暴露组(p<0.05), 这与前文的实验结果一致, 同时也进一步说明纳米TiO2诱导的氧化应激效应是导致大型溞死亡的重要原因.当腐殖酸存在时, 在0~1.5 mg·L-1浓度范围内, 随着腐殖酸浓度的提升, 大型溞体内抗氧化酶活性逐渐降低, 脂质过氧化指标MDA含量也随之降低, 这表明腐殖酸可以明显降低TiO2暴露后大型溞体内ROS的产生.当腐殖酸浓度达到1.0 mg·L-1时, 20、40、60、100 nm TiO2暴露组之间大型溞体内抗氧化酶(SOD酶、CAT酶和GSH-Px酶)活性及MDA含量均无显著性差异(p>0.05), 说明腐殖酸显著削弱了不同粒径TiO2对大型溞毒性效应的差异, 这与前文得到的结果一致.
图 7(Fig. 7)
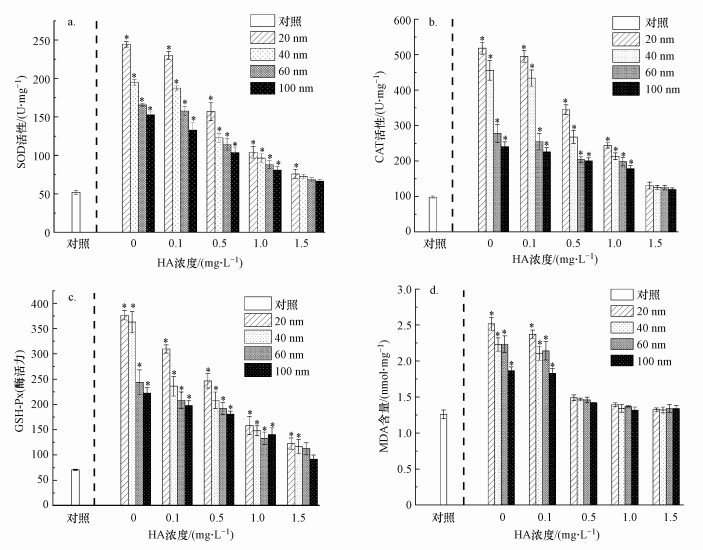 |
| 图 7 腐殖酸存在时不同粒径纳米TiO2(50 mg·L-1)暴露24 h后大型溞体内SOD(a)、CAT(b)、GSH-Px(c)酶活性和MDA含量变化(d)(*表示与对照组相比有显著性差异, p < 0.05) Fig. 7SOD(a), CAT(b), GSH-Px(c) enzyme activity and MDA content(d) in D.magna in response to TiO2 NPs (50 mg·L-1) in the presence of 0~1.5mg·L-1 HA after 24 h of exposure(* indicates a significant difference in comparison with the control group, p < 0.05) |
结合有无腐殖酸共存时ROS水平与氧化应激相关指标的测定结果, 可以发现两者之间呈显著正相关.当大型溞暴露于纳米TiO2时, 由于生物体内产生氧化应激效应, 导致大型溞体内ROS浓度水平随纳米TiO2暴露时间延长而逐渐上升, 此时, 大型溞体内细胞为消除ROS浓度的上升而过度表达SOD、CAT、GSH-Px酶来清除体内产生的大量ROS;同时, 由于体内ROS的过度产生导致大型溞体内脂肪酸被氧化, 产生脂质过氧化产物, MDA水平显著上升, 细胞发生氧化损伤.随着水体中腐殖酸浓度升高, TiO2在大型溞体内诱导的ROS水平降低, 大型溞体内SOD、CAT、MDA酶活性及MDA含量也同时降低.以上说明TiO2诱导大型溞体内发生氧化应激效应生成过量ROS, 进而导致大型溞体内相关生理指标产生变化.而腐殖酸与纳米TiO2的相互作用降低了ROS在大型溞体内的产生及抗氧化酶等指标的变化, 对纳米TiO2暴露下的大型溞产生明显的解毒作用.
4 结论(Conclusions)纳米TiO2对大型溞的毒性效应具有明显的粒径依赖性, 随着纳米TiO2粒径的逐渐减小, 其对应大型溞的半数致死时间逐渐降低, 大型溞体内ROS水平逐渐升高.纳米TiO2胁迫大型溞体内产生氧化应激效应导致大量ROS积累是纳米TiO2产生毒性效应的重要原因.腐殖酸的存在一方面减少了纳米TiO2进入大型溞体内的量, 另一方面纳米TiO2表面的腐殖酸层阻碍了其与大型溞体内生物分子发生直接相互作用, 进而降低了大型溞体内ROS水平及相关抗氧化酶等指标, 呈现明显的解毒效应, 同时腐殖酸减小了不同粒径暴露纳米TiO2对大型溞的毒性效应差异.
参考文献
| Abdel-latif H M R, Dawood M A O, Menanteau-ledouble S, et al. 2020. Environmental transformation of n-TiO2 in the aquatic systems and their ecotoxicity in bivalve mollusks: A systematic review[J]. Ecotoxicology and Environmental Safety, 200: 110776. DOI:10.1016/j.ecoenv.2020.110776 |
| Brzicova T, Sikorova J, Milcova A, et al. 2019. Nano-TiO2 stability in medium and size as important factors of toxicity in macrophage-like cells[J]. Toxicology in Vitro, 54: 178-188. DOI:10.1016/j.tiv.2018.09.019 |
| Ca?as J E, Qi B, Li S, et al. 2011. Acute and reproductive toxicity of nano-sized metal oxides (ZnO and TiO2) to earthworms (Eisenia fetida)[J]. Journal of Environmental Monitoring, 13: 3351-3357. DOI:10.1039/c1em10497g |
| Céréghino R, Fran?oise L, Bonhomme C, et al. 2020. Desiccation resistance traits predict freshwater invertebrate survival and community response to drought scenarios in a neotropical ecosystem[J]. Ecological Indicators: 119. DOI:10.1016/j.ecolind.2020.106839 |
| Chen X, Mao S S. 2007. Titanium dioxide nanomaterials: synthesis, properties, modifications, and applications[J]. Chemical Reviews, 107: 2891-2959. DOI:10.1021/cr0500535 |
| Coll C, Notter D, Gottschalk F, et al. 2016. Probabilistic environmental risk assessment of five nanomaterials (nano-TiO2, nano-Ag, nano-ZnO, CNT, and fullerenes)[J]. Nanotoxicology, 10: 436-444. DOI:10.3109/17435390.2015.1073812 |
| Erdem A, Metzler D, Cha D K, et al. 2015. The short-term toxic effects of TiO2 nanoparticles toward bacteria through viability, cellular respiration, and lipid peroxidation[J]. Environmental Science and Pollution Research International, 22: 17917-17924. DOI:10.1007/s11356-015-5018-1 |
| Espinasse B P, Geitner N K, Schierz A, et al. 2018. Comparative persistence of engineered nanoparticles in a complex aquatic ecosystem[J]. Environmental Science & Technology, 52: 4072-4078. |
| Ettrup K, Kounina A, Hansen S F, et al. 2017. Development of comparative toxicity potentials of TiO2 nanoparticles for use in life cycle assessment[J]. Environmental Science & Technology, 51: 4027-4037. |
| Fadare O O, Wan B, Guo L H, et al. 2019. Humic acid alleviates the toxicity of polystyrene nanoplastic particles to Daphnia magna[J]. Environmental Science-Nano, 6: 1466-1477. DOI:10.1039/C8EN01457D |
| Fadare O O, Wan B, Liu K, et al. 2020. Eco-Corona vs Protein Corona: Effects of humic substances on corona formation and nanoplastic particle toxicity in Daphnia magna[J]. Environmental Science & Technology, 54: 8001-8009. |
| Gao Y, Luo Z, He N, et al. 2013. Metallic nanoparticle production and consumption in China between 2000 and 2010 and associative aquatic environmental risk assessment[J]. Journal of Nanoparticle Research: 15. DOI:10.1007/s11051-013-1681-7 |
| 甘禹鑫, 张帅奇, 王志鸽, 等. 2020. 二氧化钛材料的应用研究进展[J]. 化工技术与开发, 49(9): 46-48+27. DOI:10.3969/j.issn.1671-9905.2020.09.013 |
| Hou J, Wang L, Wang C, et al. 2019. Toxicity and mechanisms of action of titanium dioxide nanoparticles in living organisms[J]. Journal of Environmental Sciences, 75: 40-53. DOI:10.1016/j.jes.2018.06.010 |
| Kansara K, Kumar A, Karakoti A S. 2019. Combination of humic acid and clay reduce the ecotoxic effect of TiO2 NPs: A combined physico-chemical and genetic study using zebrafish embryo[J]. The Science of the total environment, 698: 134133. |
| Kim K T, Klaine S J, Cho J, et al. 2010. Oxidative stress responses of Daphnia magna exposed to TiO2 nanoparticles according to size fraction[J]. Science of the Total Environment, 408: 2268-2272. DOI:10.1016/j.scitotenv.2010.01.041 |
| Lewinski N A, Zhu H, Jo H J, et al. 2010. Quantification of water solubilized CdSe/ZnXquantum dots in Daphnia magna[J]. Environmental Science & Technology, 44: 1841-1846. |
| Li K, Qian J, Wang P, et al. 2019. Toxicity of three crystalline TiO2 nanoparticles in activated sludge: Bacterial cell death modes differentially weaken sludge dewaterability[J]. Environmental Science & Technology, 53: 4542-4555. |
| 李晴晴. 2020. 纳米银对青春期和哺乳期小鼠乳腺的毒性及其机制研究[D]. 新乡: 新乡医学院 |
| Lin D, Ji J, Long Z, et al. 2012. The influence of dissolved and surface-bound humic acid on the toxicity of TiO2 nanoparticles to Chlorella sp[J]. Water Research, 46: 4477-4487. DOI:10.1016/j.watres.2012.05.035 |
| Lu H, Fan W, Dong H, et al. 2017. Dependence of the irradiation conditions and crystalline phases of TiO2 nanoparticles on their toxicity to Daphnia magna[J]. Environmental Science: Nano, 4: 406-414. DOI:10.1039/C6EN00391E |
| Maurer-Jones M A, Gunsolus I L, Murphy C J, et al. 2013. Toxicity of engineered nanoparticles in the environment[J]. Analytical Chemistry, 85: 3036-3049. DOI:10.1021/ac303636s |
| Musial J, Krakowiak R, Mlynarczyk D T, et al. 2020. Titanium dioxide nanoparticles in food and personal care products-What do we know about their safety[J]. Nanomaterials, 10: 23. |
| Nasser F, Constantinou J, Lynch I. 2020. Nanomaterials in the environment acquire an "Eco-Corona" impacting their toxicity to Daphnia Magna-a call for updating toxicity testing policies[J]. Proteomics, 20(9): : e1800412. DOI:10.1002/pmic.201800412 |
| OECD. 2004. Test No. 202: Daphnia sp. Acute Immobilisation Test[S]. Paris: OECD |
| Samel A, Ziegenfuss M, Goulden C E, et al. 1999. Culturing and bioassay testing of Daphnia magna using Elendt M4, Elendt M7, and combo media[J]. Ecotoxicology and Environmental Safety, 43: 103-110. DOI:10.1006/eesa.1999.1777 |
| Sendra M, Moreno-Garrido I, Yeste M P, et al. 2017. Toxicity of TiO2, in nanoparticle or bulk form to freshwater and marine microalgae under visible light and UV-A radiation[J]. Environmental Pollution, 227: 39-48. DOI:10.1016/j.envpol.2017.04.053 |
| Shandilya N, Le Bihan O, Bressot C, et al. 2015. Emission of titanium dioxide nanoparticles from building materials to the environment by wear and weather[J]. Environmental Science & Technology, 49: 2163-2170. |
| Tervonen K, Waissi G, Petersen E J, et al. 2010. Analysis of fullerene-C60 and kinetic measurements for its accumulation and depuration in Daphnia magna[J]. Environmental Toxicology and Chemistry, 29: 1072-1078. |
| Tong T, Shereef A, Wu J, et al. 2013. Effects of material morphology on the phototoxicity of nano-TiO2 to bacteria[J]. Environmental Science & Technology, 47: 12486-12495. |
| Westerhoff P, Song G, Hristovski K, et al. 2011. Occurrence and removal of titanium at full scale wastewater treatment plants: implications for TiO2 nanomaterials[J]. Journal of Environmental Monitoring, 13: 1195-1203. DOI:10.1039/c1em10017c |
| 苑文珂. 2020. 聚苯乙烯微/纳米塑料对重金属的吸附行为及其对两种典型水生生物的生态毒性研究[D]. 北京: 中国科学院大学 |
| Zhu X, Wang J, Zhang X, et al. 2010. Trophic transfer of TiO2 nanoparticles from Daphnia to zebrafish in a simplified freshwater food chain[J]. Chemosphere, 79: 928-933. DOI:10.1016/j.chemosphere.2010.03.022 |
| 张瑞. 2019. 分子、细胞和动物水平上超细炭黑诱发氧化应激和基因毒性的机理[D]. 济南: 山东大学 |
| 张章, 唐天乐, 唐文浩. 2016. 人工纳米材料对斑马鱼生态毒理效应研究进展[J]. 生态毒理学报, 11(5): 14-23. |
| 张智, 杨浩, 郭衡, 等. 2017. 纳米TiO2的健康风险与环境毒性研究进展[J]. 环境科学与管理, 42(3): 52-56. DOI:10.3969/j.issn.1673-1212.2017.03.012 |
