 , 仪慧兰1
, 仪慧兰1

1. 山西大学生命科学学院, 太原 030006;
2. 晋中学院化学化工学院, 晋中 030619
收稿日期: 2018-12-20; 修回日期: 2019-02-21; 录用日期: 2019-02-21
基金项目: 国家自然科学基金(No.31371868);高等学校博士学科点专项科研基金(No.20121401110007);中国博士后科学基金(No.2014M551056)
作者简介: 李利红(1982-), 女, E-mail:lihongli19821129@163.com
通讯作者(责任作者): 仪慧兰(1963—), 女, 博士, 教授, 博士生导师, 主要从事环境生物学与逆境生理学方面的研究.主持和完成国家级研究课题5项, 省部级研究课题20余项, 发表研究论文100余篇, 获国家发明专利授权2项.E-mail:yihl@sxu.edu.cn
摘要: 以拟南芥为材料,利用高通量测序技术并结合生物信息学分析方法,检测二氧化硫(SO2)处理后拟南芥植株的小分子RNA表达谱,筛选SO2胁迫响应microRNAs(miRNAs)分子,研究植物miRNAs对逆境胁迫的应答机制.结果发现,30 mg·m-3 SO2处理72 h后,拟南芥地上组织小分子RNA长度分布发生改变,在对照组和SO2组中均有大量特有的小分子RNA序列,说明SO2胁迫可诱导拟南芥小分子RNA的表达改变.SO2胁迫诱导186个保守miRNA和16个新miRNA分子差异表达,其靶基因主要涉及转录调控、信号转导、代谢、刺激响应等生理过程.差异表达的miR160和miR393可通过生长素信号途径调控植株生长发育,参与植物对SO2的胁迫响应.本研究揭示了植物中参与SO2胁迫应答的miRNA种类及作用机制,进一步阐明了miRNAs在植物抗逆应答过程中的作用.
关键词:拟南芥SO2miRNA高通量测序生物信息学
Analysis of miRNA expression profiles in Arabidopsis under SO2 stress
LI Lihong2
 , YI Huilan1
, YI Huilan1

1. School of Life Science, Shanxi University, Taiyuan 030006;
2. School of Chemistry and Chemical Engineering, Jinzhong College, Jinzhong 030619
Received 20 December 2018; received in revised from 21 February 2019; accepted 21 February 2019
Abstract: MicroRNAs (miRNAs) are a class of small non-coding RNAs that play important regulative roles in response to environmental stress. Sulfur dioxide (SO2) is one of the most common and harmful air pollutants. In this study, we investigated the miRNAs expression profiles to indentify SO2-responsive miRNAs in Arabidopsis thaliana shoots by using deep sequencing. The results showed that the length distribution and the abundance of small RNAs (sRNAs) were changed in Arabidopsis shoots after exposed to 30 mg·m-3 SO2 for 72 h. Meanwhile, there were many specific sRNAs sequences in both the control and SO2-treated Arabidopsis shoots. Our results indicated that SO2 exposure induced the changes in expression levels of sRNAs in Arabidopsis. A total of 186 conserved miRNAs and 16 novel miRNAs are expressed differentially under SO2 stress. Functional analysis showed that the target genes of SO2-responsive miRNAs were involved in transcription regulation, signal transduction, metabolism and stress response. The expression levels of miR160 and miR393 were significantly up-regulated in response to SO2 stress, which would affect plant growth and development through regulating auxin signaling pathway. This study revealed the miRNAs that involved in SO2 stress response and the regulatory mechanisms, and further clarified the role of miRNAs in plant defense responses.
Keywords: ArabidopsisSO2miRNAdeep sequencingbioinformatics
1 引言(Introduction)植物体内存在多种不同类型的小分子RNA(sRNA).MicroRNA(miRNA)是一类在生物体内普遍存在的内源性非编码蛋白质的小分子RNA.借助克隆、深度测序和生物信息学等方法, 人们在拟南芥、水稻、玉米、小麦和苔藓等植物中发现了不同数量和类型的miRNA(Schmitz et al., 2011;黄儒等, 2014).miRNA通过与靶mRNA互补配对结合, 介导目标mRNA转录沉默、降解或翻译抑制, 在转录后水平调节基因的表达, 参与植物器官的形态建成、生长发育、信号转导以及抗逆反应等过程(王海波等, 2013;曾幼玲等, 2016).
最新研究表明, miRNA在植物感受逆境胁迫并做出适应性调整的过程中发挥着重要作用(Megha et al., 2018;宋顺等, 2018).在干旱、盐碱、低温、ABA胁迫处理后, 拟南芥miR393水平显著上升, miR397b和miR402的水平略有升高, miR389a水平下降, 这些miRNA参与胁迫响应基因的表达调控(Sunkar et al., 2004).Zhou等(2012)利用高通量测序技术, 发现镉胁迫诱导油菜中17个miRNAs分子差异表达, 并通过调控其靶基因的表达参与重金属的胁迫应答.另外, 植物miRNA参与营养缺失、机械损伤等胁迫应答过程(Liang et al., 2012;Chien et al., 2017).拟南芥miR395靶向硫酸盐转运体(SULTR2;1)和3个ATP硫酸化酶基因(APS1、APS3和APS4).在缺硫条件下, 拟南芥miR395诱导表达, 其靶基因APS1转录水平降低(Jagadeeswaran et al., 2014).除此之外, 植物在受到细菌、真菌等胁迫时, 体内大量的miRNA及其靶基因表达发生改变(Xia et al., 2018;Islam et al., 2018).
二氧化硫(SO2)是一种常见的全球性大气污染物, 环境中高浓度的SO2影响植物生长发育, 并对植物产生毒害作用(Choi et al., 2014).在长期进化过程中, 植物体内形成了一系列复杂的防御机制来保护自己.我们前期基因表达谱分析结果表明, 30 mg · m-3 SO2胁迫可诱导拟南芥细胞中多个抗逆相关基因转录水平改变(Li et al., 2012).但目前为止, 植物miRNA对SO2的胁迫响应及其对基因表达调控机制尚不清楚.本实验以模式植物拟南芥为材料, 采用Solexa高通量测序技术结合生物信息学方法, 检测对照组和SO2处理组(30 mg · m-3, 72 h)拟南芥植株的小分子RNA表达谱, 筛选出参与SO2胁迫响应的miRNA分子, 研究miRNA在植物逆境生理过程中的重要作用.
2 材料与方法(Materials and methods)2.1 植株培养和SO2胁迫处理拟南芥(Arabidopsis thaliana L.)Columbia生态型(Col-0).播种于泥炭藓、蛭石和珍珠岩按体积比1 : 1 : 1均匀混合的培养介质中, 4 ℃春化2 d后置于培养间, 培养温度22 ℃, 光/暗周期为16 h/8 h, 光照强度≥3000 lx, 相对湿度约70%.
取4周龄的拟南芥植株, 采用体积0.512 m3的密闭箱静态熏气, 温度和光照同上.根据K2S2O5+2HCl→2KCl+H2O+2SO2的原理, 定量产生SO2气体, 并采用甲醛吸收-副玫瑰苯胺分光光度法测定SO2浓度, 保持SO2浓度稳定.设对照组和SO2处理组(30 mg · m-3), 在熏气前一天将植株移入熏气箱中适应箱内环境, 之后连续熏气72 h.
2.2 高通量测序及生物信息学分析30 mg · m-3 SO2熏气72 h后, 取对照和处理组拟南芥植株的地上部分, 利用Trizol法(Invitrogen)提取总RNA, 采用变性聚丙烯酰胺凝胶分离纯化出18~30nt的小RNA片段, 分别在3′端和5′端连上接头序列, 经RT-PCR扩增构建小分子RNA的cDNA文库, 采用Illumina/Solexa测序技术于华大基因公司进行测序.
通过去接头、去低质量、去污染等一系列处理得到干净的序列(clean reads), 统计小RNA的序列种类(用unique表示)及序列数量(用total表示), 并对小RNA序列做长度分布统计;统计两样品间公共序列和特有序列的种类及数量分布情况;将所有sRNA与Genbank和Rfam(10.1)(http://www.sanger.ac.uk/software/Rfam)数据库中的各类RNA进行比对, 注释测序得到的小RNA序列, 没有任何注释信息的sRNA用unann表示;将小RNA序列与miRNA数据库(miRBaserelease:19.0)中拟南芥miRNA序列进行比对, 鉴定样品中的已知miRNA.
选择没有匹配上任何注释信息的小RNA进行新miRNA的预测.利用在线软件MFOLD3.2对目标miRNA位点上游和下游各150 bp范围内的序列进行其前体的二级折叠结构分析, 并用MIREAP软件进行评估, 筛选二级结构严格符合miRNA前体特征的序列作为新miRNA基因.
利用在线软件miRU和WMD3预测差异表达miRNA的靶基因, 并进行GO富集分析和KEGG通路分析.
2.3 数据处理及分析将对照组和SO2组样品归一化到同一个量级, 统计两个样品中已知miRNA和新miRNA的表达水平, 并分别使用log2-ratio、Scatter plot图比较两个样品中miRNA表达量的差异, 筛选在SO2处理组和对照组间显著差异表达的miRNA.
2.4 Real-time PCRTrizol法提取拟南芥地上组织总RNA.Poly(A)加尾和第一链cDNA合成利用miScript plant RT Kit(QIAGEN), miRNA定量检测用miScript SYBR Green PCR Kit(QIAGEN), 以U6 snRNA为内参基因(Chen et al., 2005).每个样品做2个生物重复, 每个反应各设一个空白对照(cDNA模板空白), 所用引物一条为试剂盒提供的通用引物, 另一条为miRNA特异引物, 与待测miRNA序列基本一致, 由宝生物工程(大连)有限公司合成.miRNA相对表达量的计算采用2-ΔΔCT方法(Livak et al., 2001).
3 结果(Results)3.1 SO2胁迫下拟南芥小分子RNA表达谱经高通量测序分析, 在对照组和SO2组拟南芥小分子RNA库中分别获得高质量序列19284355和22053722条.去除接头并滤去低质量数据后, 获得小RNA数量(total sRNAs)分别为19092646和21691110条, 小RNA种类(unique sRNAs)分别为3319074和3310839.将测序所得序列与miRBase、GeneBank和Rfam等数据库比对, 对小RNA序列进行注释, 区分不同的类型, 包括外显子反向序列、外显子序列、内含子反向序列、内含子序列、miRNA、rRNA、重复序列、snRNA、snoRNA、tRNA和未知序列(unannotated reads).对照组和SO2组中不同类型小RNA所占比例没有明显变化(表 1).
表 1(Table 1)
| 表 1 拟南芥小分子RNA的类型和数量 Table 1 The type and number of small RNAs in Arabidopsis shoots | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 拟南芥小分子RNA的类型和数量 Table 1 The type and number of small RNAs in Arabidopsis shoots
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
在对照组和SO2组拟南芥的小分子RNA库中, 共有的小RNA数量占87.44%, 种类占21.06%.两样品中特有的小RNA数量均占6.28%, 对照组特有的小RNA种类占39.55%, SO2处理组特有的小RNA种类占39.39%(图 1).
图 1(Fig. 1)
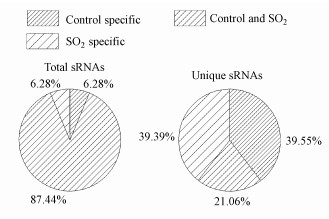 |
| 图 1 对照组和SO2处理组拟南芥的公共和特有小RNA序列 Fig. 1Common and specific small RNAs sequence in the control and SO2-treated Arabidopsis shoots |
小RNA序列长度分布分析发现, 对照组和SO2组拟南芥的小RNA长度主要分布在20~24 nt, 均占到总小RNA序列的89%, 并且21 nt和24 nt的小RNA序列丰度比较高.但是, 在对照组中占比最大的是24 nt小RNA, 其次是21 nt小RNA, 而在SO2组中24 nt小RNA占比较小, 占比最大的是21 nt小RNA.
3.2 SO2胁迫响应的miRNA分子在对照组和SO2组分别检出保守miRNA分子221和217个, 差异表达保守miRNA分子186个.其中, 4个miRNA家族的7个成员差异表达1倍以上, miR394a、miR394b、miR780.2为显著差异表达, miR393a、miR393b、miR780.1和miR160b为极显著差异表达(表 2).
表 2(Table 2)
| 表 2 拟南芥SO2胁迫响应的miRNA分子 Table 2 SO2-responsive miRNAs in Arabidopsis shoots | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 拟南芥SO2胁迫响应的miRNA分子 Table 2 SO2-responsive miRNAs in Arabidopsis shoots
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
利用MIREAP软件, 在对照组和SO2组中分别预测到新miRNA分子18和20个, SO2诱导差异表达新miRNA分子16个.其中, miR48、miR49、miR52、miR53、miR63、miR66和miR67为极显著上调表达, miR14、miR2、miR20、miR43和miR44为极显著下调表达(表 2).
为了确认高通量测序结果, 随机挑选4个(miR160、miR393、miR394、novel-miR66)SO2胁迫响应miRNA分子做定量分析.RT-qPCR结果表明, SO2组miR160、miR393、miR394、novel-miR66分子表达水平提高, 与高通量测序结果一致, 证实高通量测序结果是可靠的.
图 2(Fig. 2)
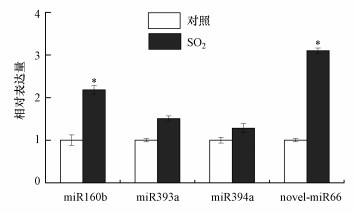 |
| 图 2 拟南芥SO2胁迫响应miRNAs的表达分析 Fig. 2Analysis of miRNAs expression in Arabidopsis shoots under SO2 stress |
3.3 SO2胁迫响应miRNA的靶基因预测利用miRU和WMD3软件, 本研究为7个保守miRNA分子预测到10个靶基因, 5个新miRNA分子预测到8个靶基因(表 3).其中, 拟南芥miR160的靶基因为生长素响应因子(Auxin response factor 10/16/17, ARF10/16/17), miR393的靶基因为生长素受体(Transport inhibitor response 1, TIR1)和F-box家族成员(Auxin signaling F-BOX 2/3, AFB2/3), miR394的靶基因为F-box家族成员(Leaf curling responsiveness, LCR), 它们在植物的生长发育和逆境应答等过程中发挥重要作用.
表 3(Table 3)
| 表 3 拟南芥SO2胁迫响应miRNA的靶基因预测 Table 3 Prediction of target genes of SO2-responsive miRNAs in Arabidopsis shoots | ||||||||||||||||||||||||||||||
表 3 拟南芥SO2胁迫响应miRNA的靶基因预测 Table 3 Prediction of target genes of SO2-responsive miRNAs in Arabidopsis shoots
| ||||||||||||||||||||||||||||||
对已知功能靶基因进行GO富集分析, 发现这些基因主要涉及植物生长发育、转录调控、信号转导、代谢、刺激响应、细胞死亡等生理过程.为了进一步阐明miRNA靶基因的功能, 我们对这些靶基因进行KEGG通路分析, 发现这些靶基因主要参与植物激素信号途径(ko04075)、嘌呤代谢(ko00230)、植物生理节律(Ko04712)、次生代谢物合成途径(ko01110)、植物-病原菌互作途径(ko04626)和核糖体途径(ko03010).
4 讨论(Discussion)SO2是一种有毒的大气污染物.高浓度SO2可影响植物的光合作用、呼吸作用, 引起植物生长发育的重大变化, 还可诱发细胞核固缩、DNA断裂、染色体畸变等, 甚至导致细胞死亡(Yi et al., 2012).研究表明, 植物受到逆境胁迫时, 体内的miRNA分子差异表达, 在转录或转录后水平调控其靶基因的表达, 从而使植株形态和生理上发生改变以适应生存环境(Zhang et al., 2015;Begheldo et al., 2015;杜康兮等, 2018).
本研究中, 利用Solexa高通量测序并结合生物信息学分析, 在对照组和SO2处理组拟南芥地上组织中, 分别获得干净序列19092646和21691110条.通过对文库中小分子RNA的长度分布进行统计, 发现对照组中24 nt的小分子RNA为主要类型, 这与前人所得拟南芥小分子RNA的长度分布结果一致(Xie et al., 2005;Rajagopalan et al., 2006).而在SO2组中, 21 nt的小分子RNA为主要类型, 24 nt的小分子RNA含量次之.同时, 统计对照组和SO2处理组小分子RNA文库中公共及特有序列, 发现在对照组和SO2组中, 均有大量特有的小RNA序列.这些研究结果表明, SO2胁迫后拟南芥地上组织细胞中小分子RNA的表达发生了明显改变.
SO2胁迫诱导多个保守miRNA分子和新miRNA分子差异表达, 这些胁迫响应miRNA的靶基因主要参与植物生长和发育、信号转导、结合、代谢、刺激响应等生理过程, 在植物抗逆调控中发挥重要作用.SO2胁迫后, 拟南芥地上组织中miR160、miR780.1、miR780.2、miR393和miR394显著上调表达.miR394作用于F-box家族成员(LCR), 调控植物激素信号传导、形态建成以及生物钟节律等, 在植物适应低温、盐、干旱、重金属胁迫过程中都起着重要作用(Song et al., 2012;Knauer et al., 2013).miR160和miR393是植物体内参与生长发育调控的miRNA分子.在遭受干旱、盐、UV-B、低温等胁迫时, 植物miR160和miR393表达量提高(Sunkar et al., 2004).拟南芥miR160的靶基因是生长素应答因子ARF10/16/17, miR393的靶基因是生长素受体TIR1(Sunkar et al., 2004).ARF是生长素信号响应途径关键的早期蛋白, TIR1蛋白与Aux/IAA蛋白结合并将其降解, 从而释放ARF转录因子, 激活或抑制下游生长素应答基因的表达.SO2胁迫诱导拟南芥miR160和miR393表达水平显著提高, 在转录后水平对其靶基因进行负调控, 导致细胞中ARF转录因子水平降低(Xue et al., 2018), 从而通过生长素信号途径调节植株的生长发育过程.由此可见, SO2胁迫响应的拟南芥miRNA可以通过调节植物激素信号途径来提高对逆境的适应性.
5 结论(Conclusions)SO2胁迫后, 拟南芥地上组织中多个miRNA分子表达改变, 这些miRNAs靶基因的功能主要涉及生长发育、转录调控、胁迫响应、激素信号转导等, miRNA分子通过调控其靶基因参与植物对SO2的胁迫应答.同时, 多个SO2胁迫响应miRNAs分子参与调节生长素信号途径, 揭示了逆境胁迫影响植物生长发育的分子机制, 进一步明确了miRNAs在植物抗逆调控中的作用.
参考文献
| Begheldo M, Nonis A, Trevisan S, et al. 2015. The dynamic regulation of microRNAs circuits in plant adaptation to abiotic stresses:a survey on molecular, physiological and methodological aspects[J]. Environmental and Experimental Botany, 114: 65–79.DOI:10.1016/j.envexpbot.2014.05.011 |
| Chen C, Ridzon D A, Broomer A J, et al. 2005. Real-time quantification of microRNAs by stem-loop RT-PCR[J]. Nucleic Acids Research, 33(20): e179.DOI:10.1093/nar/gni178 |
| Chien P, Chiang C, Wang Z, et al. 2017. MicroRNA-mediated signaling and regulation of nutrient transport and utilization[J]. Current Opinion in Plant Biology, 39: 73–79.DOI:10.1016/j.pbi.2017.06.007 |
| Choi D, Toda H, Kim Y, et al. 2014. Effect of sulfur dioxide (SO2) on growth and physiological activity in Alnus sieboldiana at Miyakejima Island in Japan[J]. Ecological Research, 29(1): 103–110.DOI:10.1007/s11284-013-1103-4 |
| 杜康兮, 沈文辉, 董爱武. 2018. 表观遗传调控植物响应非生物胁迫的研究进展[J]. 植物学报, 2018, 53(5): 581–593. |
| 黄儒, 苍晶, 于晶, 等. 2014. 冬小麦小RNA高通量测序及生物信息学分析[J]. 植物学报, 2014, 49(1): 8–18. |
| Islam W, Qasim M, Noman A, et al. 2018. Plant microRNAs:Front line players against invading pathogens[J]. Microbial Pathogenesis, 118: 9–17.DOI:10.1016/j.micpath.2018.03.008 |
| Jagadeeswaran G, Li Y F, Sunkar R. 2014. Redox signaling mediates the expression of a sulfate-deprivation-inducible microRNA395 in Arabidopsis[J]. Plant Journal, 77: 85–96.DOI:10.1111/tpj.2013.77.issue-1 |
| Knauer S, Holt A L, Rubio-Somoza I, et al. 2013. A protodermal miR394 signal defines a region of stem cell competence in the Arabidopsis shoot meristem[J]. Development Cell, 24: 125–132.DOI:10.1016/j.devcel.2012.12.009 |
| Li L H, Yi H L. 2012. Differential expression of Arabidopsis defense-related genes in response to sulfur dioxide[J]. Chemosphere, 78: 718–724. |
| Liang G, He H, Yu D. 2012. Identification of nitrogen starvation-responsive microRNAs in Arabidopsis thaliana[J]. PLoS ONE, 7(11): e48951.DOI:10.1371/journal.pone.0048951 |
| Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 25(4): 402–408.DOI:10.1006/meth.2001.1262 |
| Megha S, Basu U, Kav N N V. 2018. Regulation of low temperature stress in plants by microRNAs[J]. Plant Cell and Environment, 41: 1–15.DOI:10.1111/pce.v41.1 |
| Rajagopalan R, Vaucheret H, Trejo J, et al. 2006. A diverse and evolutionarily fluid set of microRNAs in Arabidopsis thaliana[J]. Gene & Development, 20: 3407–3425. |
| Schmitz R J, Zhang X. 2011. High-throughput approaches for plant epigenomic studies[J]. Current Opinion in Plant Biology, 14: 130–136.DOI:10.1016/j.pbi.2011.03.010 |
| Song J B, Huang S Q, Dalmay T, et al. 2012. Regulation of leaf morphology by microRNA394 and its target Leaf Curling Responsiveness[J]. Plant and Cell Physiology, 53: 1283–1294.DOI:10.1093/pcp/pcs080 |
| Sunkar R, Zhu J K. 2004. Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis[J]. The Plant Cell, 16(8): 2001–2019.DOI:10.1105/tpc.104.022830 |
| 宋顺, 黄冬梅, 王安邦, 等. 2018. 作物抗逆相关miRNA的研究进展[J]. 分子植物育种, 2018, 16(7): 2180–2186. |
| 王海波, 王莎莎, 龚明. 2013. 植物miRNA的分子特征及其在逆境中的响应机制[J]. 基因组学与应用生物学, 2013, 32(1): 121–126. |
| Xia Z, Zhao Z, Li M, et al. 2018. Identification of miRNAs and their targets in maize in response to Sugarcane mosaic virus infection[J]. Plant Physiology and Biochemistry, 125: 143–152.DOI:10.1016/j.plaphy.2018.01.031 |
| Xue M Z, Yi H L. 2018. Enhanced Arabidopsis disease resistance against Botrytis cinerea induced by sulfur dioxide[J]. Ecotoxicology and Environmental Safety, 147: 523–529.DOI:10.1016/j.ecoenv.2017.09.011 |
| Yi H, Yin J, Liu X, et al. 2012. Sulfur dioxide induced programmed cell death in Vicia guard cells[J]. Ecotoxicology and Environmental Safety, 78(1): 281–286. |
| Zhang B H. 2015. MicroRNA:a new target for improving plant tolerance to abiotic stress[J]. Journal of Experiment Botany, 66(7): 1749–1761.DOI:10.1093/jxb/erv013 |
| Zhou Z S, Song J B, Yang Z M. 2012. Genome-wide identification of Brassica napus microRNAs and their targets in response to cadmium[J]. Journal of Experiment Botany, 63(12): 4597–4613.DOI:10.1093/jxb/ers136 |
| 曾幼玲, 杨瑞瑞. 2016. 植物miRNA的生物学特性及在环境胁迫中的作用[J]. 中国农业科学, 2016, 49(19): 3671–3682.DOI:10.3864/j.issn.0578-1752.2016.19.001 |
