
 , 王英雪1,2, 郑苗苗1,2, 崔建升1,2
, 王英雪1,2, 郑苗苗1,2, 崔建升1,2
 , 李珊1,2, 黄飞宇1,2
, 李珊1,2, 黄飞宇1,21. 河北科技大学环境科学与工程学院, 河北省污染防治生物技术实验室, 石家庄 050018;
2. 河北省药用分子化学重点实验室, 石家庄 050018
收稿日期: 2018-11-24; 修回日期: 2019-01-23; 录用日期: 2019-01-23
基金项目: 国家自然科学基金(No.201407040);河北省自然科学基金(No.B2015208113);河北省高等学校青年拔尖儿人才项目(No.BJ2019033)
作者简介: 王立新(1984—),女,博士研究生,E-mail: lixinwang2007@126.com
通讯作者(责任作者): 王立新, 副教授, 硕士生导师, 长期从事环境毒理学、环境学及环境化学等的教学和科研工作, 在国内外核心学术期刊上发表论文20余篇, 其中SCI收录15余篇
崔建升, 教授, 硕士生导师, 长期从事环境学、环境监测及环境影响评价等的教学和科研工作, 在国内外核心学术期刊上发表论文50余篇, 其中SCI收录10余篇, cui1603@163.com
摘要: 多污染物引发的联合毒性是环境污染物风险评价中的重要问题之一,然而此类研究相对不足.多溴联苯醚和重金属镉可在多种环境介质中共存,虽对其各自单独暴露所产生的毒性已有相对明确的认识,但对二者联合毒性效应及其分子机制的探索仍十分有限.生物信息学的发展为污染物的健康效应研究提供了一种新的思路.为此,本研究基于比较毒理基因组学数据库(CTD)分析了十溴联苯醚和镉在单独或共同暴露下所影响的基因和相关疾病,推测两种污染物对胎儿红系造血过程产生的潜在影响,并进一步整合外源红系细胞基因表达数据库中的基因芯片确证二者共同影响的基因集合.同时,通过对这些基因集合进行生物学过程和信号通路富集分析,筛选出潜在的靶基因JAK3和AKT2,并在无显著细胞毒性的暴露条件下,通过体外细胞实验验证了十溴联苯醚和镉对这两个靶基因表达的干扰.本研究结果可为预防多溴联苯醚和重金属的联合暴露风险提供一定的科学依据,同时,CTD数据库和外源特定疾病发生发展相关基因表达数据库联合使用,并结合传统毒理学研究手段的评价模式,可为污染物的共同暴露与特定疾病的相关性及分子机理的探索在研究思路和技术手段上提供参考.
关键词:十溴联苯醚镉比较毒理基因组学数据库联合毒性红系造血
Study on the toxicity induced by the combined exposure of decabromobiphenyl ether and cadmium based on toxicogenomics
WANG Lixin1,2

 , WANG Yingxue1,2, ZHENG Miaomiao1,2, CUI Jiansheng1,2
, WANG Yingxue1,2, ZHENG Miaomiao1,2, CUI Jiansheng1,2
 , LI Shan1,2, HUANG Feiyu1,2
, LI Shan1,2, HUANG Feiyu1,2 1. Pollution Prevention Biotechnology Laboratory of Hebei Province, College of Environmental Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018;
2. Hebei Key Laboratory of Molecular Chemistry for Drug, Shijiazhuang 050018
Received 24 November 2018; received in revised from 23 January 2019; accepted 23 January 2019
Abstract: Joint toxicity caused by co-existing pollutants is one of the issues in risk assessment of environmental pollutants. However, most studies still focus on the exposure to a single pollutant. Polybrominated diphenyl ethers (PBDEs) and heavy metal cadmium coexist under various environmental conditions. Although the toxicity caused by the single exposure to PBDEs or cadmium has been clarified, the understanding on their combined toxic effects and the corresponding molecular mechanisms still lack. To date, the rapidly developed bioinformatics provides a new potential approach for investigating the health effects of pollutants; yet such studies are limited. In the current study, we firstly analyzed the genes and diseases affected by the single or joint exposure to Decabrominated diphenyl ether (PBDE-209) and cadmium. In particular, we predicted the possible effects of the exposure to these two pollutants on erythropoiesis process at fetal stage by employing the Comparative Toxicogenomics Database (CTD). Then, the data derived from the ErythroDB, a public database of erythroid gene expression, were integrated to explore erythroid genes affected by the exposure to PBDE-209 and cadmium. Two target genes, JAK3 and AKT2, were screened out through enrichment analysis of biological process and signaling pathway. Finally, the results from in vitro experiments verified that PBDE-209 and cadmium can interfere erythroid differentiation of fetal liver through regulating the expression of JAK3 and AKT2 without inducing significant cytotoxicity. Our results may help prevent the combined exposure risk of PBDEs and heavy metals. Furthermore, our study provides a new pipeline for investigating the joint toxicity of pollutants with the incorporation of CTD database and the specific database of gene expression as well as the traditional toxicological approaches.
Keywords: decabromobiphenyl ethercadmiumthe comparative toxicogenomics databasecombined exposureerythropoiesis process
1 引言(Introduction)多溴联苯醚(Poly Brominated Diphenyl Ethers, 简称PBDEs)是一类性能优异的溴系阻燃剂, 共有209种同系物, 已被广泛应用于电子、化工、建材、纺织、塑料等工业及日用品中(de Wit et al., 2010).由于其结构和性质与多氯联苯相近, 在毒性方面存在相似之处, 因而成为一类具有生态风险性的新型持久性有机污染物(McDonald, 2002).研究表明, PBDEs对哺乳动物、鱼类甚至人体具有多种潜在毒性, 如肝脏毒性、生殖毒性、神经毒性(杜苗苗等, 2012; Linares et al., 2015).重金属镉(Cd)是一种传统的金属污染物, 毒性较大且在人体内代谢较慢, 具有很强的生物蓄积性.Cd的过量摄入会导致肾脏、肝脏、肺部、骨骼、生殖器官的损伤, 并对免疫系统、心血管系统等产生不利影响, 进而引发多种疾病(Satarug et al., 2010, 杜丽娜等, 2013).
Cd是不同环境介质中与PBDEs共存且含量较高的重金属之一, 灰尘(Tang et al., 2016; He et al., 2017)、土壤(Perez-Vazquez et al., 2014; Orta-García et al., 2016)、水体底泥沉积物(Zheng et al., 2015; Dabrowska et al., 2017)中均可同时检测到二者的存在, 甚至在儿童和孕妇的血液、婴儿脐带血及胎盘组织中也可同时检测到Cd和PBDEs(Linderholm et al., 2011; Foster et al., 2012; Kim et al., 2015), 从而对人体健康构成联合暴露的风险.十溴联苯醚(PBDE-209)的急性毒性较低, 使用广泛, 且是一种最后被管控的PBDEs同系物, 即使现在也只是被部分国家管控, 而在其它地区仍然不断地进入环境介质; 此外, 在灰尘等环境介质中, 与Cd共同存在的多溴联苯醚中, PBDE-209含量最高(Tang et al., 2016; He et al., 2017).因此, 本文拟选择PBDE-209作为多溴联苯醚的典型代表, 考察其与Cd共同暴露所产生的毒性效应.饮食和吸烟是人群Cd暴露的主要来源(Satarug et al., 2013), 据估计, 美国居民平均膳食Cd摄入量为0.3 mg · kg-1 · d-1(ATSDR, 2012); 一项针对英国居民的调查显示, PBDE-209的主要暴露方式为灰尘, 每天的摄入量约为1170~17000 pg · kg-1体重(Bramwell et al., 2017).目前, 有关Cd和PBDE-209这两种污染物联合暴露对哺乳动物引发的毒性研究主要是针对二者联合暴露对大鼠血细胞数目(Curcic et al., 2017)和甲状腺激素分泌所产生的干扰(Curcic et al., 2012), 以及通过人来源细胞系所进行的细胞毒性、氧化应激、整体基因毒性等单一性的研究(Curcic et al., 2014; Wang et al., 2018).
生物信息学的快速发展进一步促进了人们对环境污染物健康风险的评估, 尤其是涉及基因、蛋白质、细胞、动物多层次的系统性研究.毒理基因组学主要在基因组水平上研究机体对环境因子的应答, 了解基因和环境交互作用在疾病发生中的作用, 预测污染物与疾病发生发展的关联(李宏等, 2010).但污染物种类繁多, 涉及的作用类型多种多样, 给研究人员对数据的汇总整理带来了一定的挑战.此外, 目前大多数的毒理基因组学数据库只是进行海量数据统计, 并未解决如何有效利用数据问题, 这主要是源于研究者采用的研究方法各异, 造成对数据的处理不同(Waters et al., 2008; Williams-Devane et al., 2009).这不仅降低了数据的可比性, 也无法建立一个统一的可供利用的数据库.相比而言, 比较毒理基因组学数据库(The Comparative Toxicogenomics Database, 简称CTD, 网址:http://html.rhhz.net/hjkxxb/html/http//ctdbase.org)是当前环境毒理学研究领域比较全面和权威的数据库之一, 在数据处理方面较它同类数据库有着更标准的处理方法, 不仅收集了化合物-基因、基因-疾病、疾病-化合物之间相互关联的数据, 还建立了化合物-基因-疾病的网络检索和预测系统(Davis et al., 2018).利用数据库内的数据可预测多种污染物共同暴露下影响的基因及相关联的疾病, 使人们能够清楚地了解在环境应激状态下发生在生物系统中的基因相互作用模式(Waters et al., 2004).比如, 通过CTD数据库的应用, 研究人员发现杀虫剂、重金属、双酚A和邻苯二甲酸盐影响的基因中, 部分是抑郁症易感基因(Carter et al., 2016); 美国的一项针对水体中混合污染物对鱼类和无脊椎动物潜在健康风险的评估中, 利用CTD数据预测出1000~2900个潜在的靶基因(Bradley et al., 2019).
目前, 利用生物信息学手段进行污染物联合暴露对基因影响及与疾病的关联性探索研究仍然缺乏.因此, 本文以PBDE-209和Cd为研究对象, 先利用CTD数据库整理出两种污染物单独或共同暴露下受影响的基因和相关疾病, 通过对现有相关疾病的分析推断两种污染物可能会影响造血过程, 再整合外源红系细胞基因表达数据库中的数据进一步确证共同影响的基因, 并对这些靶基因进行生物学效应和信号通路分析, 最后选取其中几个靶基因, 在PBDE-209和Cd联合暴露人红白血病细胞系HEL后, 定量分析靶基因在mRNA水平的表达情况, 以探索二者单独或共同暴露下对相关靶基因的调节.
2 材料与方法(Materials and methods)2.1 仪器与试剂主要仪器:二氧化碳培养箱(Thermo, 美国)、多功能酶标仪(SPARK, 德国)、高速低温离心机(GeneSpeed, 韩国)、生物超净台(苏州安泰空气技术有限公司)、普通PCR扩增仪(Applied biosystems, 美国)、Nanodrop 2000(Thermo, 美国)、荧光定量PCR仪(MyGO Pro, 英国), 其它仪器均为实验室常规仪器.
主要试剂:PBDE-209(北京百灵威科技有限工司)、CdCl2(分析纯, 天津市光复科技发展有限公司)、Alamar Blue(AB)试剂(Sigma, 美国)、Trizol(Ambion, 美国)、荧光定量PCR试剂盒(TaKaRa, 日本).
2.2 实验材料人红白血病细胞系HEL购于北京协和细胞库, 培养于含10%胎牛血清(PAN, 德国)和1%双抗(BI, 美国)的1640培养基(Gibco, 美国)中, 培养环境为37 ℃和5% CO2.
2.3 实验方法2.3.1 数据库基因和疾病信息分析利用CTD数据库(截止到2018年4月的数据)筛选出两者单独或共同暴露下受影响的基因或疾病的数目和种类.ErythonDB数据库(网址:https://www.cbil.upenn.edu/ErythronDB/)是专门针对三大红系造血时期(卵黄囊造血、胎儿肝脏造血和成体骨髓造血)中各分化阶段基因表达图谱的数据库(Kingsley et al., 2013), 在红系造血领域得到了广泛应用(Capellera-Garcia et al., 2016; Gao et al., 2016).将ErythronDB数据库中获得的基因芯片数据导入CTD数据库进行比对, 获取PBDE-209-Cd-红细胞发育基因芯片共同覆盖的基因集合.Reactome数据库(网址:https://reactome.org/)得出以上基因集合所对应的显著相关的信号通路, 并筛选出其中出现概率最大的潜在靶基因.Reactome数据库与KEGG、Biocarta是生物信息学中最常用的三大数据库, 通过汇集NCBI、Ensembl、UniProt、UCSC等权威数据库的体内信号通路构建而成(Fabregat et al., 2018).
2.3.2 污染物暴露收集HEL细胞, 计数, 调整细胞浓度为60000个· mL-1, 均匀铺于96孔板, 每个浓度设4个平行, 进行污染物暴露.
PBDE-209储液浓度为20 mmol · L-1, 溶剂为DMSO; CdCl2储液浓度为60 mmol · L-1, 溶剂为去离子水.细胞暴露时, 将储液用培养基逐级稀释成工作液.单独暴露时, CdCl2和PBDE-209浓度均选取0.2、0.5、1、2、5、10、20、50、100 μmol · L-1; 联合暴露时, CdCl2和PBDE-209各选取1、10、20 μmol · L-1 3个浓度作对照并进行两两组合(3×3实验设计方案).实验组均使用溶剂对照, 即0.1%DMSO.
2.3.3 细胞活性检测采用AB法检测PBDE-209和CdCl2暴露48 h后的细胞活性情况, 具体操作步骤同文献(崔建升等, 2016).
2.3.4 PCR法检测HEL细胞暴露PBDE-209和CdCl2 8 h后采用Trizol法提取RNA, 提取过程均按照Ambion公司的操作手册并在超净台内完成.
cDNA合成:提取的总RNA中的mRNA通过OligdT法反转录为cDNA, 反转录的实验方法参考TaKaRa公司试剂盒内提供的说明书.
PCR扩增:反转录结束后, 以cDNA为模板, 加入SYBR定量PCR试剂及相应引物(表 1)进行扩增和定量分析.
表 1(Table 1)
| 表 1 各基因的引物序列及长度 Table 1 Primers sequence and length of each gene | |||||||||||||||
表 1 各基因的引物序列及长度 Table 1 Primers sequence and length of each gene
| |||||||||||||||
扩增过程根据TaKaRa公司试剂盒内提供的说明书进行, 加入试剂混合液, 设置程序并放于荧光定量PCR仪中反应, 最后得出数据.各基因在mRNA水平的表达水平通过Delta-delta Ct法计算得到.
2.4 数据处理数据的统计分析通过Student t检验进行, p < 0.05被认定为具有统计学意义, 实验数据由均值±标准误差(SE)表示.
3 结果与讨论(Results and discussion)3.1 PBDE-209和Cd暴露所影响的基因及疾病3.1.1 PBDE-209与Cd单独暴露所影响的基因数量通过对CTD数据库的数据进行筛选后发现, PBDE-209暴露所直接影响的基因共1908个, 相比之下, Cd因其存在形态众多, 暴露所影响的基因更为复杂(表 2).
表 2(Table 2)
| 表 2 PBDE-209与Cd单独暴露下所影响的基因数量 Table 2 The number of genes influenced by the exposure of PBDE-209 and cadmium | ||||||||||||||||||||
表 2 PBDE-209与Cd单独暴露下所影响的基因数量 Table 2 The number of genes influenced by the exposure of PBDE-209 and cadmium
| ||||||||||||||||||||
CTD数据库现有数据显示, 可对基因产生作用的镉共20种, 包括无机镉和有机镉.由于无机镉是目前镉污染的主要形态且为大多数毒理学研究重点, 因此, 本文的数据分析也限定在无机镉, 具体包括以下8种镉化合物:CdCl2、CdSO4、Cd(CH3CO2)2、CdS、CdTe、CdSe、Cd(NO3)2和CdO.通过筛选, 得出8种镉化合物分别对5870、193、170、56、45、34、4、2个基因的表达有直接影响, 其中, 与CdCl2关联的基因数量最多.因此, 选取CdCl2这一无机镉形态为代表进行后续研究.
3.1.2 PBDE-209与CdCl2单独暴露下受影响基因的调控类型分析通过CTD数据库分析发现, PBDE-209暴露下受直接影响的基因调控类型主要是mRNA表达和蛋白质翻译及蛋白质活性调节, 尤以mRNA表达调控为主(表 3), 例如, PBDE-209既可以诱导Bax基因在mRNA水平的表达(Du et al., 2016), 又可以增强其在蛋白质水平的表达(Sarkar et al., 2017).相比之下, CdCl2暴露对基因的调控方式增加了对启动子甲基化的影响, 如母体在镉暴露下, 母体和胎儿基因组的甲基化水平均可发生显著改变(Dharmadasa et al., 2017).无论是在数量还是调控方式上, CdCl2对基因的影响都远大于PBDE-209, 这可能是由于重金属Cd作为一种备受关注的传统重金属污染物, 其毒理效应及机制研究相对PBDE-209来说更为完善和深入.
表 3(Table 3)
| 表 3 PBDE-209与CdCl2暴露对基因表达的调控类型分析 Table 3 The analysis of regulatory types of gene expression by PBDE-209 and CdCl2 exposure | |||||||||||||||||
表 3 PBDE-209与CdCl2暴露对基因表达的调控类型分析 Table 3 The analysis of regulatory types of gene expression by PBDE-209 and CdCl2 exposure
| |||||||||||||||||
3.1.3 PBDE-209与CdCl2共同影响的基因、所调控的生物过程及可能影响的疾病类型在对PBDE-209和CdCl2单独暴露所影响的基因数量及调控类型进行分析的基础上, 本文进一步考察了两种污染物暴露所影响基因之间的关系.从图 1可以看出, PBDE-209与CdCl2两种污染物暴露所影响的基因中, 有547个基因受到二者的共同影响, 预示着PBDE-209和CdCl2暴露可通过调节相同基因介导类似或相同的生物学效应.
图 1(Fig. 1)
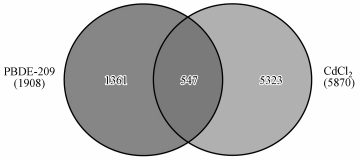 |
| 图 1 PBDE-209与CdCl2暴露所影响的基因维恩图 Fig. 1Venn diagram of genes affected by the exposure of PBDE-209 and CdCl2 |
因此, 本文接下来对这547个基因进行信号通路和胞内生物过程的富集分析.结果显示, 这些基因主要涉及调控炎症反应、细胞周期和细胞凋亡等相关事件的信号通路(图 2a).干扰细胞周期调控过程, 进而影响细胞的增殖是污染物暴露下出现致癌、组织器官分化和发育障碍的常见机制; 细胞凋亡是细胞无法通过自身的调整及对抗机制以应对污染物所造成的DNA损伤等毒性作用时出现的最终结果(Evan et al., 2001).这547个基因涉及的细胞生物学过程主要包括对有氧物质、激素调节、化学有毒物质的响应, 以及细胞周期和系统发育相关的胞内过程(图 2b).
图 2(Fig. 2)
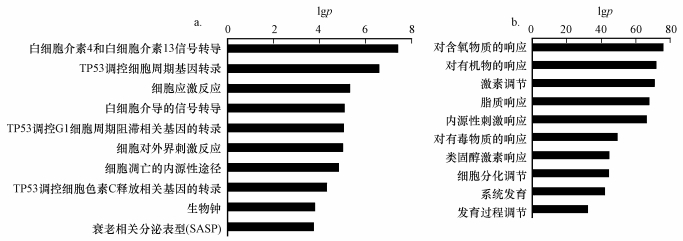 |
| 图 2 PBDE-209和CdCl2共同调节基因所涉及的前10个最显著的信号通路(a)和胞内生物过程的GO分析(b) (横坐标为p值的对数负值(以10为底)) Fig. 2The top 10 signaling(a) and the GO analysis on the biological (b) pathways regulated by the overlapped genes between PBDE-209 and CdCl2 exposure |
环境污染物会使生物体各种生理功能和代谢出现紊乱, 当超过机体的自我调节能力时可能引发疾病.通过对CTD数据库现有数据分析显示, 共有6种疾病或症状与PBDE-209和CdCl2暴露相关, 分别是肝损伤(Zhang et al., 2013, Xu et al., 2017)、肝肿大(El-Demerdash et al., 2004; Sakamoto et al., 2013)、肢端肥大症性心肌病(Ronco et al., 2011, St?hr et al., 2013)、胎儿生长迟缓(Chi et al., 2011; Kippler et al., 2012)、精子减少症(Miyaso et al., 2012; Ren et al., 2012)和睾丸炎(Miyaso et al., 2012; Ogawa et al., 2013).其中, 肝脏作为首要解毒器官, 其肿大和损伤往往是机体炎症反应(图 2a)相关过程失调的结果(Jaeschke, 2011); 而胎儿生长发育迟缓及生殖系统问题除了与细胞周期密切相关外, 还与激素调节、系统发育密切关联(图 2).
3.1.4 PBDE-209和CdCl2暴露对红系造血细胞的潜在影响当前镉暴露对胎儿的致畸作用已在动物模型中得到了不少研究的证实, 且在人体中也观察到镉暴露影响胚胎至胎儿的整个发育过程, 并最终影响胎儿大小(Juan Sebastián Calle et al., 2015); 也有研究表明, 母体中的PBDEs在怀孕前3个月即可通过胎盘进入胎儿(Zhao et al., 2013); 一项来自美国的调查显示, 来自母体的PBDEs可在胎儿肝脏中累积直至出生后(Schecter et al., 2007).哺乳动物的造血过程可依造血部位和发育过程的不同而大致分成3个时期:卵黄囊造血、胎儿肝脏造血和成体骨髓造血时期, 各个时期又可具体分成若干阶段且分别受到不同红系发育相关基因的调控, 而这些基因的表达随着发育阶段呈现各自的变化规律(Palis, 2014).胎儿肝脏是胎儿发育前期的主要造血器官, 在CTD数据库中检索到的上述6种与PBDE-209和CdCl2暴露相关的疾病或症状中, 胎儿生长发育迟缓与肝损伤均可影响胎儿肝脏的造血能力, 如红系造血细胞的分化和成熟过程受阻(Potocnik et al., 2000).为了探讨两种污染物暴露对胎儿肝脏造血时期红细胞发育调控基因的潜在影响, 本文先从ErythronDB红系发育基因芯片数据库中寻找上述3个造血时期在正常情况下, 各自相对其它两个时期差异表达的基因; 之后, 将这些基因导入CTD数据库, 与PBDE-209和CdCl2暴露共同影响的基因进行比较, 从而探讨PBDE-209和CdCl2暴露对红细胞发育过程的潜在影响.
由图 3和表 4可见, 在各造血时期, PBDE-209和CdCl2暴露对众多调控红系细胞发育的基因均可产生干扰.本文接下来针对胎儿肝脏造血时期, 两种污染物暴露所影响的红系发育相关基因进行信号通路的富集分析.结果显示(图 4), 在显著相关的信号通路中, 大部分涉及细胞周期的调节过程.在红系细胞发育过程中, 细胞周期的调节控制着细胞在增殖和分化两个方向的选择, 直接影响细胞的发育过程(Plett et al., 2004).
图 3(Fig. 3)
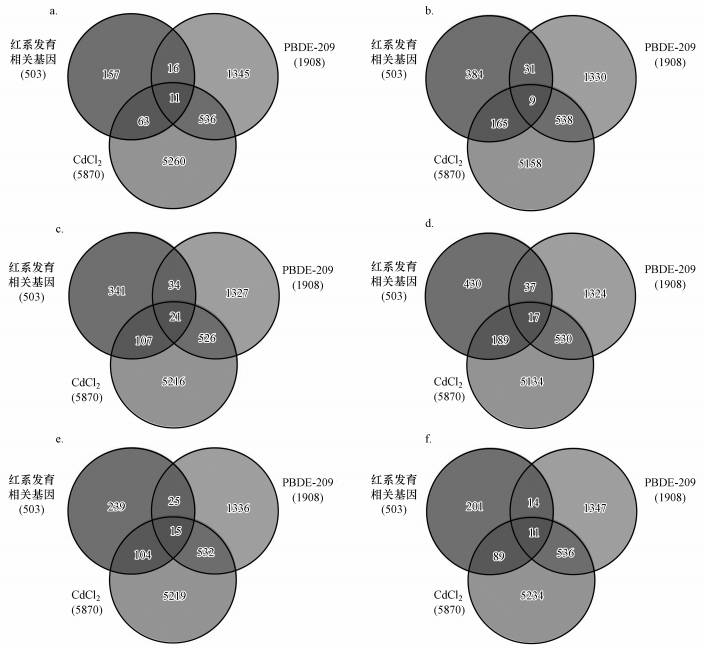 |
| 图 3 PBDE-209和CdCl2暴露对各造血时期红系发育相关基因的影响分析 (a和b.卵黄囊造血时期, c和d.胎儿肝脏造血时期, e和f.成体骨髓造血时期, 其中, a、c、e为红系发育高表达基因的维恩图, b、d、f为红系发育低表达基因的维恩图) Fig. 3Venn diagram of erythropoiesis-related genes and genes regulated by PBDE-209 and CdCl2 exposure |
表 4(Table 4)
| 表 4 红系发育过程中受PBDE-209和CdCl2暴露共同影响的基因 Table 4 Erythropoiesis-related genes regulated by the exposure of PBDE-209 or CdCl2 | ||||||||||||||||||
表 4 红系发育过程中受PBDE-209和CdCl2暴露共同影响的基因 Table 4 Erythropoiesis-related genes regulated by the exposure of PBDE-209 or CdCl2
| ||||||||||||||||||
在表 4和图 4a的基础上筛选出AKT2、JAK3这两个参与调控图 4a中所有上调信号通路的基因作为潜在的靶基因, 通过体外细胞实验进行验证.
图 4(Fig. 4)
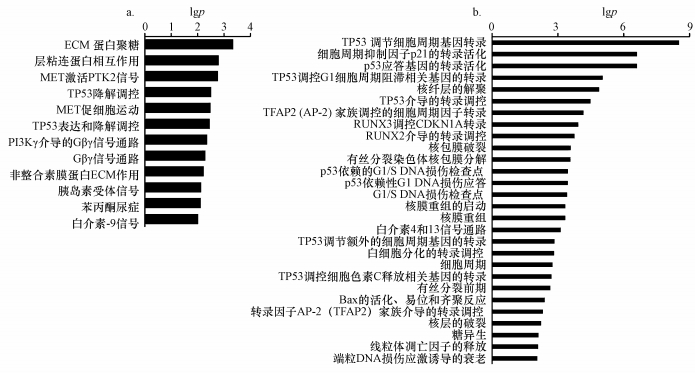 |
| 图 4 胎儿造血时期PBDE-209和CdCl2暴露所影响的高表达(a)与低表达(b)基因的信号通路富集分析 Fig. 4The PBDE-209 and CdCl2 exposure affected signaling pathways which are upregulated(a) and downregulated(b) during the erythropoiesis in the fetal liver |
3.2 PBDE-209和CdCl2联合暴露对红系造血细胞相关靶基因的验证3.2.1 PBDE-209与CdCl2联合暴露剂量的筛选与确定选用更能反映胎儿造血时期红系发育过程的人红白血病HEL细胞作模型, 首先筛选出PBDE-209和CdCl2在单独暴露与联合暴露下对细胞无明显细胞毒性的暴露浓度.
通过AB法对细胞活性的检测发现, PBDE-209单独暴露48 h后, 在浓度为0.2~100 μmol · L-1时, 与对照组相比, 相对荧光强度上下浮动范围小于20%, 均无显著性差异(图 5a).这表明在所考察的浓度范围内, PBDE-209未对细胞活性产生显著影响.
图 5(Fig. 5)
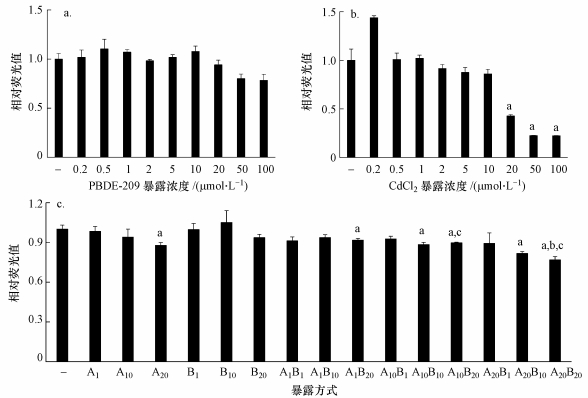 |
| 图 5 不同浓度的PBDE-209 (a)和CdCl2 (b)对HEL细胞单独暴露或复合暴露(c)时的毒性效应 (柱状图中柱子上方各小写字母含义如下:a.与溶剂对照组存在显著差异, p < 0.05;b.与Cd单独暴露组存在显著差异, p < 0.05;c.与PBDE-209单独暴露组存在显著差异, p < 0.05;“-”表示未处理组; 在子图c的横坐标中, A表示CdCl2, B表示PBDE-209, 下标数字表示对应的处理浓度(μmol · L-1)) Fig. 5The toxic effects on the viability of HEL cells upon exposure of different concentration of PBDE-209 or CdCl2 or upon the combined exposure |
如图 5b所示, 与对照组相比, 当CdCl2暴露浓度为0.2 μmol · L-1时, 相对荧光强度显著增加, 预示着在低浓度下细胞出现应激行为; 当浓度为0.5~10 μmol · L-1时, 相对荧光强度降低范围最大不超过15%, 与对照组相比无显著性差异.而暴露浓度增加到20 μmol · L-1以上时, 相对荧光强度显著下降58%~78%(p < 0.05), 细胞活性受到显著抑制.
分别选取1 μmol · L-1 CdCl2(不影响细胞活性)、10 μmol · L-1 CdCl2(对细胞活性稍有降低)和20 μmol · L-1 CdCl2(对细胞活性有显著性降低), 与相同浓度的PBDE-209(1、10和20 μmol · L-1)两两组合, 采用3×3的实验设计方案进行复合暴露实验, 结果如图 5c所示.由图可知, 10、20 μmol · L-1 CdCl2与10、20 μmol · L-1 PBDE-209两两组合时, 与对照组相比, 相对荧光强度均出现显著性下降(p < 0.05);而1 μmol · L-1 CdCl2除与20 μmol · L-1 PBDE-209组合会使细胞活性显著下降外, 与其它浓度PBDE-209组合时, 对细胞活性均无显著性影响.因此, 本文选取1 μmol · L-1 CdCl2+1 μmol · L-1PBDE-209组合, 暴露8 h后进行后续靶基因mRNA表达水平的验证实验.
3.2.2 PBDE-209和CdCl2联合暴露对红系造血细胞相关靶基因的验证JAK3基因所编码的蛋白质是一种酪氨酸激酶, 参与细胞因子受体介导的细胞内信号转导(Francesca et al., 2018).AKT2基因对细胞的增殖周期起到一定调节作用, 影响着细胞的增殖和转移(Chen et al., 2010).在胎儿肝脏造血时期, 红系发育过程可具体分成原红细胞(ProE)、嗜碱性红细胞(Baso)、嗜多色红细胞(PolyE)和网织红细胞(Retic)4个阶段.ErythroDB数据显示, JAK3和AKT2在从PolyE阶段向Retic阶段分化过程中均出现了显著的上调(图 6a、6b), 提示着这两个基因为红系发育后期所必需.
图 6(Fig. 6)
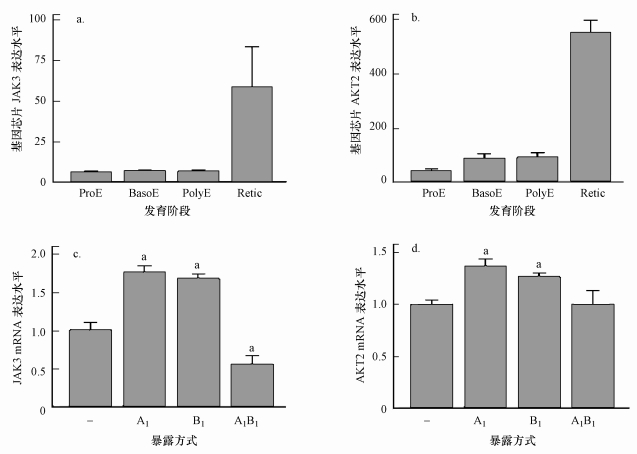 |
| 图 6 JAK3 (a)、AKT2 (b)在红系发育过程中表达水平的变化及CdCl2、PBDE-209单独或复合暴露对其表达水平的影响(c、d) (在子图c和d中, A表示CdCl2, B表示PBDE-209, 下标数字表示对应的处理浓度(μmol · L-1); “-”表示未处理组) Fig. 6The changed expression of JAK3(a) and AKT2(b) during the erythroid differentiation and upon the exposure to PBDE-209 or CdCl2 or upon the combined exposure(c, d) |
依据上述毒性实验结果, 选取对细胞活性无显著影响的暴露浓度考察PBDE-209和CdCl2对HEL细胞中JAK3和AKT2表达的影响.如图 6c所示, 与对照组相比, JAK3基因在单独暴露CdCl2和PBDE-209后其mRNA表达水平分别显著升高75%和67%(p < 0.05), 而共同暴露却显著下降45%(p < 0.05).Tsangaris等(2002)采用低等生物T淋巴细胞系CCRF-CEM发现, CdCl2暴露会上调JAK3的表达水平, 这与本研究CdCl2单独暴露得到的结果一致; 而PBDE-209单独暴露及二者共同暴露对JAK3基因表达的影响目前尚无报道.如图 6d所示, AKT2基因在单独暴露于CdCl2和PBDE-209的情况下, 其mRNA表达水平相比对照组分别显著升高36%和26%(p < 0.05), 但二者共同暴露下并无显著变化.
在红系发育的各个阶段, 基因的表达调控受到严格的控制, 上调或下调均可能会影响红系细胞的分化进程(Passegué et al., 2005).因此, CdCl2和PBDE-209单独暴露对JAK3、AKT2基因表达的促进作用, 可能会促使更多的PolyE阶段的红系细胞提前分化到Retic阶段, 最终影响成熟红细胞的功能.然而, 二者共同暴露下, 相比对照组, JAK3、AKT2基因的表达与单独暴露时所观察到的结果不一致甚至出现相反的趋势, 即并未促进甚至抑制基因的表达, 表明共同暴露可能会抑制PolyE阶段的红系细胞向Retic阶段的分化, 进而引发贫血等症状; 同时预示着CdCl2和PBDE-209共同暴露对细胞相关基因在转录水平的表达上可能呈现拮抗作用, 这与Pb与PBDE-209共同暴露斑马鱼幼体所得的高通量转录组测序结果一致(Chen et al., 2016), 污染物复合暴露作用类型的确定还受到污染物暴露浓度、考察的指标和评价模型等因素的影响, 如CdCl2和PBDE-209在人结肠癌细胞系SW480中对ROS的诱导呈现相加作用, 而对细胞活性的抑制却是协同作用(Curcic et al., 2014).不同因素可能得出不一致的作用类型, 复合作用类型的研究仍是多污染物共同暴露面临的挑战(Curcic et al., 2017).
4 结论(Conclusions)1) 通过CTD数据库分析发现, PBDE-209和CdCl2主要通过影响mRNA水平的表达来调控特定基因进而影响相关生物学过程; 对二者共同影响的基因进行相关疾病分析后发现, 二者可能会引发人体造血障碍问题.
2) 外源红系细胞基因表达数据库与CTD数据库的对比证实PBDE-209和CdCl2单独暴露下可对红系发育相关基因产生干扰, 且共同影响的基因所调控的主要生物学过程是细胞周期.
3) 体外细胞实验结果证实, PBDE-209和CdCl2单独或共同暴露会干扰红系发育过程特定靶基因在mRNA水平的表达.
4) CTD数据库和外源特定疾病发生发展相关基因表达数据库的联合使用并结合传统毒理学研究手段的方式, 可为探索污染物尤其是污染物的共同暴露与特定疾病的相关性研究提供一种新的研究思路和手段.
参考文献
| Agen cy for Toxic Substances and Disease Registry (ATSDR).2012.Toxicological profile for Cadmium[R].Atlanta, GA: U.S.Department of Health and Human Services, Public Health Service |
| Bradley P M, Journey C A, Berninger J P, et al. 2019. Mixed-chemical exposure and predicted effects potential in wadeable southeastern USA streams[J]. Science of The Total Environment, 655: 70–83.DOI:10.1016/j.scitotenv.2018.11.186 |
| Bramwell L, Harrad S, Abou-Elwafa Abdallah M, et al. 2017. Predictors of human PBDE body burdens for a UK cohort[J]. Chemosphere, 189: 186–197.DOI:10.1016/j.chemosphere.2017.08.062 |
| Capellera-Garcia S, Pulecio J, Dhulipala K, et al. 2016. Defining the minimal factors required for erythropoiesis through direct lineage conversion[J]. Cell Reports, 15(11): 2550–2562.DOI:10.1016/j.celrep.2016.05.027 |
| Carter C J, Blizard R A. 2016. Autism genes are selectively targeted by environmental pollutants including pesticides, heavy metals, bisphenol A, phthalates and many others in food, cosmetics or household products[J]. Neurochemistry International, 101: 83–109.DOI:10.1016/j.neuint.2016.10.011 |
| Chen J, Tang H, Hay N, et al. 2010. Akt isoforms differentially regulate neutrophil functions[J]. Blood, 115(21): 4237–4246.DOI:10.1182/blood-2009-11-255323 |
| Chen L, Zhu B, Guo Y, et al. 2016. High-throughput transcriptome sequencing reveals the combined effects of key e-waste contaminants, decabromodiphenyl ether (BDE-209) and lead, in zebrafish larvae[J]. Environmental Pollution, 214: 324–333.DOI:10.1016/j.envpol.2016.04.040 |
| Chi Y, Xia H, Su M, et al. 2011. Metabonomic phenotyping reveals an embryotoxicity of deca-brominated diphenyl ether in mice[J]. Chemical Research in Toxicology, 24(11): 1976–1983.DOI:10.1021/tx200300v |
| Curcic M, Buha A, Stankovic S, et al. 2017. Interactions between cadmium and decabrominated diphenyl ether on blood cells count in rats-Multiple factorial regression analysis[J]. Toxicology, 376: 120–125.DOI:10.1016/j.tox.2016.05.011 |
| Curcic M, Durgo K, NKopjar N, et al. 2014. Cadmium and decabrominated diphenyl ether mixture:In vitro evaluation of cytotoxic, prooxidative and genotoxic effects[J]. Environmental Toxicology and Pharmacology, 38(2): 663–671.DOI:10.1016/j.etap.2014.07.021 |
| Curcic M, Jankovic S, Jacevic V, et al. 2012. Combined effects of cadmium and decabrominated diphenyl ether on thyroid hormones in rats[J]. Arh Hig Rada Toksikol, 63(3): 255–262.DOI:10.2478/10004-1254-63-2012-2179 |
| 崔建升, 高瑜, 王立新, 等. 2016. PCB77和Cd共同暴露诱导的线粒体损伤及其介导的联合毒性效应[J]. 环境化学, 2016, 35(3): 590–596. |
| 杜丽娜, 余若祯, 王海燕, 等. 2013. 重金属镉污染及其毒性研究进展[J]. 环境与健康杂志, 2013, 30(2): 167–174. |
| 杜苗苗, 张娴, 颜昌宙. 2012. 溴系阻燃剂的毒理学研究进展[J]. 生态毒理学报, 2012, 7(6): 575–584. |
| Dabrowska H, Kopko O, Lehtonen K K, et al. 2017. An integrated assessment of pollution and biological effects in flounder, mussels and sediment in the southern Baltic Sea coastal area[J]. Environmental Science and Pollution Research, 24(4): 3626–3639.DOI:10.1007/s11356-016-8117-8 |
| Davis A P, Grondin C J, Johnson R J, et al. 2018. The comparative toxicogenomics database:update 2019[J]. Nucleic Acids Research, 47(D1): 948–954. |
| de Wit C A, Herzke D, Vorkamp K. 2010. Brominated flame retardants in the Arctic environment-trends and new candidates[J]. Science of the Total Environment, 408(15): 2885–2918.DOI:10.1016/j.scitotenv.2009.08.037 |
| Dharmadasa P, Kim N, Thunders M. 2017. Maternal cadmium exposure and impact on foetal gene expression through methylation changes[J]. Food and Chemical Toxicology, 109: 714–720.DOI:10.1016/j.fct.2017.09.002 |
| Du L, Sun W, Zhang H, et al. 2016. BDE-209 inhibits pluripotent genes expression and induces apoptosis in human embryonic stem cells[J]. Journal of Applied Toxicology, 36(5): 659–668.DOI:10.1002/jat.3195 |
| El-Demerdash F M, Yousef M I, Kedwany F S, et al. 2004. Cadmium-induced changes in lipid peroxidation, blood hematology, biochemical parameters and semen quality of male rats:protective role of vitamin E and β-carotene[J]. Food and Chemical Toxicology, 42(10): 1563–1571.DOI:10.1016/j.fct.2004.05.001 |
| Evan G I, Vousden K H. 2001. Proliferation, cell cycle and apoptosis in cancer[J]. Nature, 411: 342.DOI:10.1038/35077213 |
| Fabregat A, Jupe S, Matthews L, et al. 2018. The reactome pathway knowledgebase[J]. Nucleic Acids Research, 46(D1): D649–D655.DOI:10.1093/nar/gkx1132 |
| Foster W G, Cheung A P, Davis K, et al. 2012. Circulating metals and persistent organic pollutant concentrations in Canadian and non-Canadian born primiparous women from five Canadian centres:Results of a pilot biomonitoring study[J]. Science of The Total Environment, 435-436: 326–336.DOI:10.1016/j.scitotenv.2012.06.070 |
| Francesca M, Chiara G, Ilaria G, et al. 2018. An update on JAK inhibitors[J]. Current Medicinal Chemistry, 25: 1–27.DOI:10.2174/092986732501180122140757 |
| Gao X, Wu T, K D, et al. 2016. GATA Factor-G-Protein-Coupled receptor circuit suppresses hematopoiesis[J]. Stem Cell Reports, 6(3): 368–382.DOI:10.1016/j.stemcr.2016.01.008 |
| He C T, Zheng X B, Yan X, et al. 2017. Organic contaminants and heavy metals in indoor dust from e-waste recycling, rural, and urban areas in South China:Spatial characteristics and implications for human exposure[J]. Ecotoxicology and Environmental Safety, 140: 109–115.DOI:10.1016/j.ecoenv.2017.02.041 |
| Jaeschke H. 2011. Reactive oxygen and mechanisms of inflammatory liver injury:Present concepts[J]. Journal of Gastroenterology and Hepatology, 26(s1): 173–179. |
| Juan Sebastián Calle T, Pachajoa H, Charry J D, et al. 2015. Teratogenic effect of cadmium:From the developing embryo to the fetus[J]. Revista Colombiana de Salud Ocupacional, 5(2): 21–26. |
| Kim J T, Son M H, Lee D H, et al. 2015. Partitioning behavior of heavy metals and persistent organic pollutants among feto-maternal bloods and tissues[J]. Environmental Science & Technology, 49(12): 7411–7422. |
| Kingsley P D, Greenfest-Allen E, Frame J M, et al. 2013. Ontogeny of erythroid gene expression[J]. Blood, 121(6): e5–e13.DOI:10.1182/blood-2012-04-422394 |
| Kippler M, Tofail F, Gardner R, et al. 2012. Maternal cadmium exposure during pregnancy and size at birth:A prospective cohort study[J]. Environmental Health Perspectives, 120(2): 284–289.DOI:10.1289/ehp.1103711 |
| 李宏, 王崇均. 2010. 生物信息学在毒理基因组学研究中的应用[J]. 生物信息学, 2010, 8(4): 330–333.DOI:10.3969/j.issn.1672-5565.2010.04.011 |
| Linares V, Bellés M, Domingo J L. 2015. Human exposure to PBDE and critical evaluation of health hazards[J]. Archives of Toxicology, 89(3): 335–356.DOI:10.1007/s00204-015-1457-1 |
| Linderholm L, Jakobsson K, Lundh T, et al. 2011. Environmental exposure to POPs and heavy metals in urban children from Dhaka, Bangladesh[J]. Journal of Environmental Monitoring, 13(10): 2728–2734.DOI:10.1039/c1em10480b |
| McDonald T A. 2002. A perspective on the potential health risks of PBDEs[J]. Chemosphere, 46(5): 745–755.DOI:10.1016/S0045-6535(01)00239-9 |
| Miyaso H, Nakamura N, Matsuno Y, et al. 2012. Postnatal exposure to low-dose decabromodiphenyl ether adversely affects mouse testes by increasing thyrosine phosphorylation level of cortactin[J]. The Journal of Toxicological Sciences, 37(5): 987–999.DOI:10.2131/jts.37.987 |
| Ogawa Y, Itoh M, Hirai S, et al. 2013. Cadmium exposure increases susceptibility to testicular autoimmunity in mice[J]. Journal of Applied Toxicology, 33(7): 652–660.DOI:10.1002/jat.v33.7 |
| Orta-García S T, Ochoa-Martinez A C, Carrizalez-Yá?ez L, et al. 2016. Persistent organic pollutants and heavy metal concentrations in soil from the Metropolitan Area of Monterrey, Nuevo Leon, Mexico[J]. Archives of Environmental Contamination and Toxicology, 70(3): 452–463.DOI:10.1007/s00244-015-0239-3 |
| Palis J. 2014. Primitive and definitive erythropoiesis in mammals[J]. Frontiers in Physiology, 5(3): 1–9. |
| Passegué E, Wagers A J, Giuriato S, et al. 2005. Global analysis of proliferation and cell cycle gene expression in the regulation of hematopoietic stem and progenitor cell fates[J]. The Journal of Experimental Medicine, 202(11): 1599–1611.DOI:10.1084/jem.20050967 |
| Perez-Vazquez F J, Flores-Ramirez R, Ochoa-Martinez A C, et al. 2014. Concentrations of persistent organic pollutants (POPs) and heavy metals in soil from San Luis Potosí, México[J]. Environmental Monitoring and Assessment, 187(1): 4119. |
| Plett P A, Abonour R, Frankovitz S M, et al. 2004. Impact of modeled microgravity on migration, differentiation, and cell cycle control of primitive human hematopoietic progenitor cells[J]. Experimental Hematology, 32(8): 773–781.DOI:10.1016/j.exphem.2004.03.014 |
| Potocnik A J, Brakebusch C, F?ssler R. 2000. Fetal and adult hematopoietic stem cells require β1 integrin function for colonizing fetal liver, spleen, and bone marrow[J]. Immunity, 12(6): 653–663.DOI:10.1016/S1074-7613(00)80216-2 |
| Ren X M, Wang G G, Xu D Q, et al. 2012. The protection of selenium on cadmium-induced inhibition of spermatogenesis via activating testosterone synthesis in mice[J]. Food and Chemical Toxicology, 50(10): 3521–3529.DOI:10.1016/j.fct.2012.07.021 |
| Ronco A M, Montenegro M, Castillo P, et al. 2011. Maternal exposure to cadmium during gestation perturbs the vascular system of the adult rat offspring[J]. Toxicology and Applied Pharmacology, 251(2): 137–145.DOI:10.1016/j.taap.2011.01.001 |
| Sakamoto Y, Inoue K, Takahashi M, et al. 2013. Different pathways of constitutive androstane receptor-mediated liver hypertrophy and hepatocarcinogenesis in mice treated with piperonyl butoxide or decabromodiphenyl ether[J]. Toxicologic Pathology, 41(8): 1078–1092.DOI:10.1177/0192623313482055 |
| Sarkar D, Singh S K. 2017. Maternal exposure to polybrominated diphenyl ether (BDE-209) during lactation affects germ cell survival with altered testicular glucose homeostasis and oxidative status through down-regulation of Cx43 and p27Kip1 in prepubertal mice offspring[J]. Toxicology, 386: 103–119.DOI:10.1016/j.tox.2017.05.016 |
| Satarug S, Garrett S H, Sens M A, et al. 2010. Cadmium, environmental exposure, and health outcomes[J]. Environmental Health Perspectives, 118(2): 182–190.DOI:10.1289/ehp.0901234 |
| Satarug S, Swaddiwudhipong, Ruangyuttikarn, et al. 2013. Modeling cadmium exposures in low-and high-exposure areas in Thailand[J]. Environmental Health Perspectives, 121(5): 531–536.DOI:10.1289/ehp.1104769 |
| Schecter A, Johnson-Welch S, Tung K C, et al. 2007. Polybrominated diphenyl ether (PBDE) levels in livers of U.S.human fetuses and newborns[J]. J Toxicol Environ Health A, 70(1): 1–6. |
| St?hr A, Friedrich F W, Flenner F, et al. 2013. Contractile abnormalities and altered drug response in engineered heart tissue from Mybpc3-targeted knock-in mice[J]. Journal of Molecular and Cellular Cardiology, 63: 189–198.DOI:10.1016/j.yjmcc.2013.07.011 |
| Tang Z, Huang Q, Yang Y, et al. 2016. Polybrominated diphenyl ethers (PBDEs) and heavy metals in road dusts from a plastic waste recycling area in north China:implications for human health[J]. Environmental Science and Pollution Research, 23(1): 625–637.DOI:10.1007/s11356-015-5296-7 |
| Tsangaris G T, Botsonis A, Politis I, et al. 2002. Evaluation of cadmium-induced transcriptome alterations by three color cDNA labeling microarray analysis on a T-cell line[J]. Toxicology, 178(2): 135–160.DOI:10.1016/S0300-483X(02)00236-6 |
| Wang L, Zheng M, Gao Y, et al. 2018. In vitro study on the joint hepatoxicity upon combined exposure of cadmium and BDE-209[J]. Environmental Toxicology and Pharmacology, 57: 62–69.DOI:10.1016/j.etap.2017.11.015 |
| Waters M, Jackson M. 2008. Databases applicable to quantitative hazard/risk assessment-Towards a predictive systems toxicology[J]. Toxicology and Applied Pharmacology, 233(1): 34–44.DOI:10.1016/j.taap.2007.12.036 |
| Waters M D, Fostel J M. 2004. Toxicogenomics and systems toxicology:aims and prospects[J]. Nature Reviews Genetics, 5: 936.DOI:10.1038/nrg1493 |
| Williams-Devane C R, Wolf M A, Richard A M. 2009. Toward a public toxicogenomics capability for supporting predictive toxicology:survey of current resources and chemical indexing of experiments in GEO and arrayexpress[J]. Toxicological Sciences, 109(2): 358–371.DOI:10.1093/toxsci/kfp061 |
| Xu M Y, Wang P, Sun Y J, et al. 2017. Metabolomic analysis for combined hepatotoxicity of chlorpyrifos and cadmium in rats[J]. Toxicology, 384: 50–58.DOI:10.1016/j.tox.2017.04.008 |
| Zhang Z, Sun Z Z, Xiao X, et al. 2013. Mechanism of BDE209-induced impaired glucose homeostasis based on gene microarray analysis of adult rat liver[J]. Archives of Toxicology, 87(8): 1557–1567.DOI:10.1007/s00204-013-1059-8 |
| Zhao Y, Ruan X, Li Y, et al. 2013. Polybrominated diphenyl ethers (PBDEs) in aborted human fetuses and placental transfer during the first trimester of pregnancy[J]. Environmental Science & Technology, 47(11): 5939–5946. |
| Zheng H, Hu G, Xu Z, et al. 2015. Characterization and distribution of heavy metals, polybrominated diphenyl ethers and perfluoroalkyl substances in surface sediment from the Dayan River, South China[J]. Bulletin of Environmental Contamination and Toxicology, 94(4): 503–510.DOI:10.1007/s00128-015-1479-7 |
