 , 李华2, 马学文1
, 李华2, 马学文1
 , 梁文婷1, 李建华3
, 梁文婷1, 李建华3
 , 郜雅静3
, 郜雅静31. 山西大学环境科学研究所, 太原 030006;
2. 山西大学环境与资源学院, 太原 030006;
3. 山西省农业科学院农业环境与资源研究所, 太原 030031
收稿日期: 2018-11-22; 修回日期: 2019-02-15; 录用日期: 2019-02-15
基金项目: 国家重点研发计划(No.2017YFD0801300);国家重点联合基金项目(No.U1710255);山西省重点研发项目(No.201603D421044)
作者简介: 段靖禹(1995-), 男, E-mail:152376909@qq.com
通讯作者(责任作者): 马学文, E-mail:maxuewen@sxu.edu.cn
李建华, E-mail:13453144587@163.com
摘要: 采用随机区组设计,分别对添加不同量的青霉菌和生物炭的砷污染土壤进行培养,通过测定土壤中的As3+、As5+及总砷含量,探究了青霉菌与生物碳复合修复对砷污染土壤中有效砷的钝化率及土壤中砷的价态转化的影响,同时对土壤中的微生物数量进行区系分析,建立了微生物数量与有效砷含量之间的关系.结果显示,随着青霉菌接菌量与生物炭施用量的增加,土壤中总砷含量不会发生变化,有效砷含量从17.74 mg·kg-1下降到12.69 mg·kg-1,有效砷的钝化率可达到27.6%左右.而两种价态的砷(As5+、As3+)之间没有发生转化,约27%的As5+会被青霉菌与生物炭固定,但As3+在土壤中的含量基本保持不变.在有效砷含量下降的同时,土壤中放线菌的含量基本不变,但土壤中细菌的总量有所上升.结果表明,青霉菌与生物碳复合修复可以降低有效砷的含量,并使砷污染土壤中的微生物环境有所改善,对砷污染土壤显示出较好的修复性能.
关键词:青霉菌生物炭砷污染微生物土壤修复
Study on the remediation of arsenic pollution in soil by the combination of penicillium and biochar
DUAN Jingyu1
 , LI Hua2, MA Xuewen1
, LI Hua2, MA Xuewen1
 , LIANG Wenting1, LI Jianhua3
, LIANG Wenting1, LI Jianhua3
 , GAO Yajing3
, GAO Yajing3 1. Institute of Environmental Sciences, Shanxi University, Taiyuan 030006;
2. College of Resources and Environment, Shanxi University, Taiyuan 030006;
3. Institute of Agricultural Environment and Resources, Shanxi Academy of Agricultural Sciences, Taiyuan 030031
Received 22 November 2018; received in revised from 15 February 2019; accepted 15 February 2019
Abstract: In this paper, a randomized block design was used to cultivate with different amounts of penicillium and biochar for the remediation of arsenic-contaminated soil. By measuring the concentrations of As3+, As5+ and total arsenic in the soil, the effects of the penicillium and biochar on the passivation rate of arsenic and the conversion of the valence state of arsenic in the arsenic-contaminated soil were investigated. Meanwhile, the relationship between the amount of microorganisms and the effective arsenic content was established through the analysis of the number of microflora in the soil. The experimental results show that the total arsenic content in soil did not change with the increase of the applied amount of penicillium and biochar. The effective arsenic content decreased from 17.74 to 12.69 mg·kg-1, and the passivation rate of effective arsenic reached up to 27.6%. However, there was no conversion between the two valence of arsenic (As5+, As3+), and about 27% of As5+ was fixed by penicillium and biochar, but the content of As3+ in soil remained unchanged basically. While the effective arsenic content decreased, the content of actinomycetes in soil remained basically the same, but the total amount of bacteria in soil increased. The results show that the combined remediation of penicillium and biochar could reduce the content of effective arsenic, improve the microbial environment in the arsenic-contaminated soil, and show good remediation performance to the arsenic-contaminated soil.
Keywords: penicilliumbiochararsenic pollutionmicroorganismsoil remediation
1 引言(Introduction)砷(As)在自然环境中的分布较为广泛, 含砷矿物的开采及含砷农药的过量使用都会导致土壤中砷的含量不断上升.全国土壤污染状况调查(2005—2013)结果表明, 我国土壤总的点位超标率为16.1%, 其中, 砷点位超标率达到2.7%, 在八大重金属中仅次于Cd(7.0%)、Ni(4.8%).砷污染在我国不仅范围广、程度深, 而且危害严重, 其污染治理已经成为环境治理的当务之急, 相关治理技术也已成为环境科学领域关注的焦点问题之一.我国砷污染土壤面积大, 使用传统的修复方法存在难度大、成本高等一系列问题.目前, 国内外对砷污染土壤的修复主要有三大方法:物理修复法、化学修复法、生物修复法.
物理修复法见效快, 但工程量大、耗时费力、经济效益低, 不建议采用.化学修复法是目前研究最深入, 同样也是应用最广泛的方法, 具有能耗低、投资少、工艺简单等优点, 在高浓度砷污染土壤修复中能起到绝佳的作用, 但化学淋洗剂的使用不当会对土壤环境造成更深层次的污染.例如, 化学钝化剂的添加会改变土壤自身的结构, 但有关其稳定性的长期与否目前还没有准确的研究.微生物修复是一种环境友好的治理技术, 具有较好的发展前景, 且许多真菌已被分离并发现具有生物累积与挥发能力, 如黄青霉、产紫青霉均表现出对砷的累积性, 青霉菌对砷具有生物挥发与生物累积的双重作用, 但有关真菌与其他方法结合修复砷污染土壤的研究不是很多.
生物炭作为一种新型环境材料, 不仅能够吸附重金属污染物, 而且能够提高土壤肥力, 改善土壤生境, 为微生物的生长繁殖提供营养物质和栖息场所.微生物与生物炭协同固定土壤重金属, 可以实现对土壤重金属的原位修复, 并为农业生产废弃物的二次利用及生物强化技术修复土壤重金属复合污染提供一条新的途径.
生物刺激是在污染土壤中加入营养物质和碳源, 以满足微生物降解需要, 并提高微生物代谢活性的一种手段.基于此, 本文从青霉菌的生物刺激方面入手, 在青霉菌的处理过程中加入生物炭, 设计随机区组实验, 通过调整砷污染土壤中青霉菌的接菌量与生物炭的施用量, 对不同处理中砷的有效态含量、As3+、As5+含量进行相应的测定, 来评价生物炭与青霉菌复合修复砷污染土壤这一方法的有效性, 以期为砷污染土壤修复提供参考.
2 材料和方法(Materials and methods)本研究在砷含量为20 mg·kg-1的砷污染土壤中添加不同量的青霉菌和生物炭进行培养试验, 分别在第15、30、45 d时测定土壤中的As3+、As5+、总砷含量, 探究青霉菌与生物碳复合修复对砷污染土壤中有效砷的钝化率, 以及对土壤中砷的价态转化的影响.
2.1 供试菌株及培养基实验用菌是购买于中国科学院菌种保藏中心的青霉属(Penicillium sp.), 编号bio-65577, 将冻干粉状的菌种从安瓿瓶中经无菌操作取出, 用0.5 mL的液体培养基溶解后转移至盛有4~5 mL液体培养基的试管内摇匀, 取100 μL转接到固体培养基上, 28 ℃条件下培养.
培养基为马铃薯培养基(PDA):马铃薯提取液1.0 L, 葡萄糖20.0 g, 琼脂15.0 g, pH=6.0.马铃薯提取液:取马铃薯200 g, 切成小块, 加水1.0 L, 煮沸30 min, 用纱布滤去马铃薯块, 将滤液补足到1.0 L.
2.2 供试土壤土样采自山西省古交市矿区, 供试土壤的基本理化性质为:pH=8.13, 全氮0.35 g·kg-1, 有机质1.256 g·kg-1, 全磷585.52 mg·kg-1, 全钾14.70 g·kg-1, 碱解氮14.92 mg·kg-1, 有效磷4.64 mg·kg-1, 速效钾89.1 mg·kg-1, EC 100.3 μS·cm-1, 总砷含量10.67 mg·kg-1.添加外源砷Na3AsO4·12H2O之后, 进行为期90 d的老化, 待土壤总砷含量基本不变时进行实验, 最终获得的供试土样中总砷含量为20 mg·kg-1, 有效砷含量为17.74 mg·kg-1.
2.3 实验设计实验设一个砷污染剂量(A2), 3个菌剂接种量分别为T1(0)、T2(10%)、T3(20%), 3个生物炭添加量分别为B1(0)、B2(2%)、B3(4%), 具体设计见表 1.从培养好的固体PDA培养基上挑取菌体接种到液体PDA培养基内, 在恒温摇床内(28 ℃、160 r·min-1)培养3 d, 待菌体长成直径为3 mm的球状体后, 充分摇匀, 之后将带有菌体的液体培养基按实验设计依次接种到土壤中, 每盆中的土壤为300 g, 菌种接菌量和生物炭添加量均为质量分数, 每个处理设3个重复.接种时应注意菌与土壤充分混匀, 接种好的样品置于塑料盆中于28 ℃下培养, 并保持田间持水量的60%, 分别于培养15、30、45 d时进行取样, 测定土壤样品中的As3+、As5+及总砷含量, 并且对第45 d的土壤样品进行微生物区系分析.
表 1(Table 1)
| 表 1 菌剂接种量和生物炭添加量对应表 Table 1 The amount of bacteria inoculation and biochar addition | ||||||||||||||||
表 1 菌剂接种量和生物炭添加量对应表 Table 1 The amount of bacteria inoculation and biochar addition
| ||||||||||||||||
2.4 测定项目及方法2.4.1 土壤中总砷的测定土壤中总砷的测定采用氢原子发生原子吸收光谱法.
2.4.2 青霉菌作用下土壤的酸碱性对培养至45 d的土壤样品进行pH的测定, 各处理中称取10.0 g土壤, 风干过30目筛后置于50 mL高型烧杯中, 再加入25 mL去离子水, 用玻璃棒搅拌1 min, 使土粒充分分散, 放置30 min后进行测定.
2.4.3 土壤中As3+、As5+的测定价态砷的测定采用高效液相色谱-原子荧光光谱法.土壤有效砷的提取:每组土壤准确称取0.4000 g土样, 放入50 mL离心管中, 加入20 mL浸取剂(1 mol·L-1 H3PO4与0.1 mol·L-1抗坏血酸的混合液), 摇匀并在回旋式振荡器上以180 r ·min-1振荡浸提一定时间, 之后放入100 ℃的恒温水浴锅内水浴3 h, 水浴完成后将离心管放入离心机中, 以4000 r ·min-1的转速离心5 min, 过滤得到试液, 待测定.
氢化物发生条件:载液为5%HCl, 流速为60 mL·min-1; 还原剂为2% KBH4溶液, 含0.5%NaOH, 流速为60 mL ·min-1; 载气、屏蔽气均为氩气, 载气流速为300 mL·min-1, 屏蔽气流速为900 mL·min-1.
液相色谱流动相:准确称取0.8954 g磷酸氢二钠、3.026 g磷酸二氢钾放入500 mL烧杯中, 用约300 mL高纯水溶解, 之后定容至500 mL, 摇匀; 然后用0.45 μm滤膜过滤, 再经脱气后使用.
将配制好的As3+、As5+混合标准溶液根据浓度值的高低进行排放, 用进样针手动依次进样, 一次进样100 μL, 做出标准曲线后, 进而测定土壤样品中砷的不同价态; 样品中不同形态的砷在流动相的载流下通过色谱柱, As3+、As5+会在不同的时间洗脱, 依次与盐酸(5%)溶液混合后加入碱性硼氢化钾(2%)溶液, 形成砷化氢气体, 由高纯氩气直接导入石英管原子化器中, 在氩氢火焰中原子化.基态原子受特种空心阴极灯光源的激发, 产生原子荧光, 通过检测原子荧光的相对强度, 利用荧光强度与溶液中不同价态砷含量成正比的关系, 计算出样品中相应不同价态砷的含量.
2.4.4 微生物区系分析采用系列稀释平板培养计数法(Colony Forming Unit/CFU)对9种供试土壤样品中可培养微生物种类进行活菌数量测定.细菌、真菌和放线菌分别采用牛肉膏蛋白胨琼脂培养基、马丁孟加拉红培养基和改良高氏1号培养基进行选择性培养.实验设定3个平行, 设定真菌和放线菌的稀释度分别为10-4~10-6、10-1~10-5和10-3~10-5, 涂布量为100 μL, 在28 ℃的恒温培养箱中培养, 在培养第4 d时, 对细菌和真菌计数, 在培养第7 d时对放线菌进行计数.
2.5 数据处理本文采用Microsoft Excel2003进行数据图表处理, 运用SPSS(Statistical Product and Service Solutions20.0)进行多重差异显著性分析.
3 结果与讨论(Results and discussion)3.1 青霉菌的产酸性由图 1可知, 在不同生物炭施用量下, 随着青霉菌接菌量的增加, 土壤的pH均呈现出下降的趋势, 即土壤的酸性会逐渐增强, 可见青霉菌在生长过程中会分泌酸性物质, 增强环境的酸性.
图 1(Fig. 1)
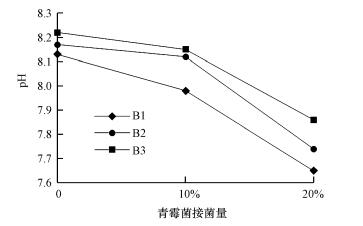 |
| 图 1 青霉菌的产酸性 Fig. 1The pH of Penicillium growth medium |
3.2 青霉菌对土壤中有效砷含量的影响青霉菌在砷含量为20 mg·kg-1环境下对有效砷的钝化率如图 2所示.在相同培养时间内(45 d), 不接种菌的CK组中有效砷含量为17.09 mg·kg-1, 钝化率为7.0%;当接菌量提升为10%时, 土壤中的有效砷含量下降到14.61 mg·kg-1, 钝化率为20.4%;继续提高接菌量至20%, 有效砷含量下降为13.02 mg·kg-1, 钝化率达到29.1%(p < 0.05).可见随着接菌量的增加, 土壤中的有效砷含量显著降低, 钝化率显著上升.这是由于在接菌量升高时, 土壤中的青霉菌数量增多, 与土壤中的土著菌相比具有竞争优势, 同时与砷结合的靶器官及各种与砷结合的官能团增多, 对土壤中的砷吸附效果增强, 因而土壤中有效砷的钝化效果会显著上升.
图 2(Fig. 2)
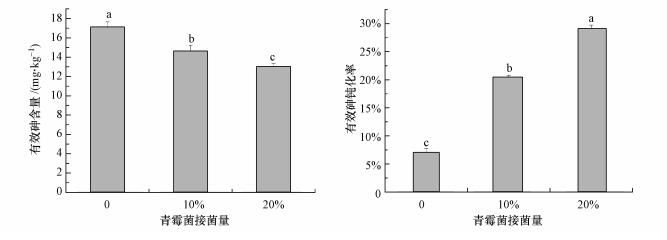 |
| 图 2 青霉菌对土壤有效砷含量的影响 (图中不同小写字母表示各处理之间在0.05水平存在显著性差异(n=3);下同) Fig. 2Effect of Penicillium inoculation size on the content of effective arsenic in soil |
接菌量从0增加到10%时, 土壤中有效砷含量下降了2.48 mg·kg-1, 接菌量从10%增加到20%时, 土壤中有效砷含量下降了1.59 mg·kg-1.可见随着接菌量的增加, 有效砷含量的下降幅度会越来越小, 最终会到达一个稳定值.
3.3 青霉菌与生物碳复合修复对土壤中有效砷含量的影响通过SPSS20.0对数据进行分析, 发现接菌量与生物炭施加量之间具有显著的交互作用(p < 0.05).对比各自的单独处理, 二者的复合处理具有显著的提升效果, 其中, 各处理对土壤中有效砷含量及钝化率的影响见表 2.从表中可以看出, A2T3B3处理对土壤中有效砷的钝化效果最好, 高于其他8种处理, 钝化率最高可达31.1%;其次是A2T3B2、A2T3B1处理, 但它们之间差异不显著, 可见生物炭在高接菌量(20%)环境下对有效砷的钝化效果并不明显.CK、A2T1B2、A2T1B3这3组处理土壤中有效砷的钝化率差异显著, 说明生物炭在低接菌量(10%)环境下对有效砷的钝化有明显的促进作用.在高生物碳添加量(4%)条件下, A2T1B3、A2T2B3与A2T3B3这3组处理间差异显著, 在低生物碳添加量(2%)条件下, A2T1B2、A2T2B2、A2T3B2这3组处理之间差异显著.说明生物炭施加量相同时, 只要接菌量不同, 处理结果就会产生显著差异, 因此, 在整个土壤中有效砷的钝化过程中, 接菌量占主要地位.
表 2(Table 2)
| 表 2 青霉菌与生物碳复合修复对砷污染土壤中有效砷含量的影响 Table 2 Effect of combined remediation of Penicillium and bio-carbon on the effective arsenic content in arsenic comtanimated soil | |||||||||||||||||||||||||||||||||
表 2 青霉菌与生物碳复合修复对砷污染土壤中有效砷含量的影响 Table 2 Effect of combined remediation of Penicillium and bio-carbon on the effective arsenic content in arsenic comtanimated soil
| |||||||||||||||||||||||||||||||||
饶霜等(2016)、姚玲丹等(2015)研究表明, 生物炭虽然在土壤中不会被微生物直接利用, 但生物炭加入到土壤后会作为碳库长时间的储存, 丰富土壤中的碳源种类, 能够改善土壤中微生物群落多样性, 增加土壤的养分含量, 增强微生物的代谢能力.生物炭表面含有丰富的含氧官能团, 具有较强的阳离子交换能力, 因此, 它可以与土壤中的铁、锰结合, 形成铁锰氧化物, 进而对环境中的砷产生吸附作用.虽然生物炭会降低土壤酸度, 导致土壤pH升高, 进而使土壤中的砷发生解吸附, 但青霉菌的产酸性会中和掉一部分, 使得整体的吸附作用大于解析作用, 达到改善土壤砷污染的效果.
CK组中有效砷的含量为17.74 mg·kg-1, 随着接菌量与生物炭添加量的增加, 有效砷含量依次减少了0.81、1.24、0.75、0.89、0.60、0.45、0.12、0.16 mg·kg-1, 整体来看, 有效砷钝化量越来越少, 青霉菌与生物炭的复合作用会使得钝化率最终达到27.6%左右(31.1%~3.5%).对于此结果本文将在微生物区系分析中进一步解释.
3.4 微生物区系分析土壤微生物包括细菌、真菌、放线菌、古菌、病毒、原生动物及显微藻类.土壤微生物生命活动过程中还会形成各种产物, 如CO2、H2、H2S、热量、各种有机酸、醇、抗生素、维生素、激素等.这些物质可以改变土壤的氧化还原条件, 影响土壤养分供应特征, 从而使得周围环境发生变化, 因此, 本文对不同处理下的土壤进行微生物区系分析, 以便探究微生物数量(均以干土计)与土壤中有效砷含量之间的关系.
未受过污染的土壤中, 细菌、放线菌、真菌分别以1012、1010、108的数量级来计数, 表 3中数据显示, 细菌、放线菌、真菌的数量级分别仅为106、106、102~107, 可见砷对于土壤中绝大部分的微生物有灭活作用.
表 3(Table 3)
| 表 3 三大类土壤微生物数量及土壤中有效砷含量 Table 3 The number of three major types soil microbes and the effective arsenic content in soil | |||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 三大类土壤微生物数量及土壤中有效砷含量 Table 3 The number of three major types soil microbes and the effective arsenic content in soil
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
随着青霉菌接菌量的增加, 土壤中真菌数量由1.4×102个·g-1干土, 增长为1.9×107个·g-1干土, 土壤中的有效砷含量显著下降, 从17.74 mg·kg-1下降为12.49 mg·kg-1.相关性分析结果如表 4所示, 由表中数据可知, 细菌、放线菌数量与土壤有效砷含量之间没有显著相关性, 而青霉菌数量与土壤中有效砷含量之间呈显著负相关(p < 0.01), 可见青霉菌数量越大, 土壤中的有效砷含量越低.
表 4(Table 4)
| 表 4 相关性分析结果 Table 4 Correlation analysis results | ||||||||||||||||||||||||||||||
表 4 相关性分析结果 Table 4 Correlation analysis results
| ||||||||||||||||||||||||||||||
在前3组处理中没有接种青霉菌, 各处理之间的细菌、真菌、放线菌数量相近, 有效砷含量的下降则是因为生物炭施加量的上升而发生变化.对比A2T1B3、A2T2B3与A2T3B3三组处理, 接菌量分别为0、10%、20%, A2T2B3处理的真菌数量是A2T1B3处理的7000倍, 而A2T3B3处理的真菌数量是A2T2B3处理的26倍.可见, 青霉菌在砷污染土壤中的数量有一个饱和度, 并不是接菌量越大, 土壤中青霉菌的数量就越多.这也映证了在青霉菌与生物炭的共同作用下, 土壤中有效砷的最大钝化率在27.6%左右.
在有效砷含量下降的同时土壤中的细菌数量上升了1个数量级, 由106上升到107, 可见有效砷含量下降会导致对土壤中细菌活动的抑制作用减弱.而放线菌的数量变化波动不大, 可见放线菌数量对于有效砷含量变化没有直接反映.
3.5 培养时间对土壤中有效砷含量的影响由图 3可知, 各处理组均表现为随着处理时间的延长, 土壤有效砷含量逐渐降低, 但各处理组土壤的有效砷含量均无显著性差异(p>0.05).这可能是因为青霉菌对土壤中的砷表现出了高亲和力, 接触初期快速吸附于自身体内, 之后达到平衡.这与王婷等(2013)的研究相似, 微生物在与重金属的接触初期, 吸附会以较快的速度进行, 金属离子与菌体的细胞壁结合, 在后续的时间里吸附过程相对平缓.
图 3(Fig. 3)
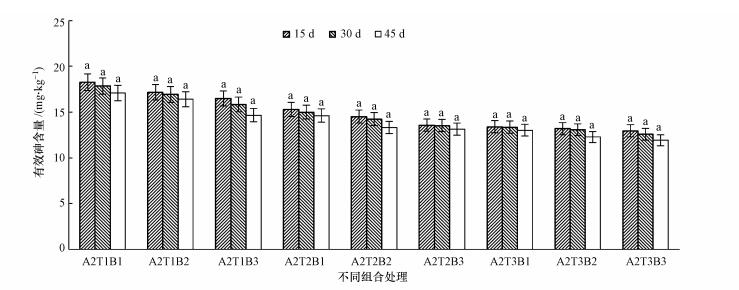 |
| 图 3 砷污染(20 mg·kg-1)土壤中不同处理与处理时长对有效砷含量的影响 (图中相同小写字母a表明在95%置信水平区间内, 各处理随着时间的变化, 有效砷含量没有显著性差异) Fig. 3Effect of different treatment and treatment duration on effective arsenic content in the concentration of 20 mg·kg-1 Arsenic contaminated soil |
3.6 青霉菌与生物碳复合修复对土壤中不同价态砷的影响砷在土壤中的存在形式分为有机砷与无机砷两类, 有机砷的生物毒性较无机砷而言很低, 而无机砷又存在两种主要的价态(As3+、As5+), 其中, As3+相较As5+有着更高的活性和毒性, 也更不容易被金属化合物所固定.通过改变砷的价态, 可将高活性、高毒性的As3+转化为易于固化及低毒性的As5+, 可以达到改善或者修复砷污染土壤的目的.因此, 对于污染土壤中砷的价态分析尤为重要.
本研究表明, 土壤中的总砷含量基本保持不变, 说明青霉菌在处理砷污染土壤时并没有将砷甲基化, 也没有产生生物挥发作用.由图 4可知, As3+含量几乎没有发生变化, 而As5+含量随着处理不同而有所差异, 由CK组(A2T1B1)的86%降低到A2T3B3处理的59%, 固定态砷为总砷与As5+和As3+的差值, 可见有27%的As5+被青霉菌与生物炭固定.说明青霉菌与生物炭对As3+的影响并不显著(p>0.05), 对As5+的固定有显著效果(p < 0.05), 并且菌株接菌浓度越高, 对于As5+的固定效果越好.这可能是因为青霉菌的细胞体上有磷的专用载体, As与磷是同族元素, 具有相似性, As5+可以通过这个载体进入青霉菌体内, 或者是因为青霉菌在高砷环境中, 体内的谷胱甘肽等化合物浓度增加, 从而增加了对环境砷的吸附.
图 4(Fig. 4)
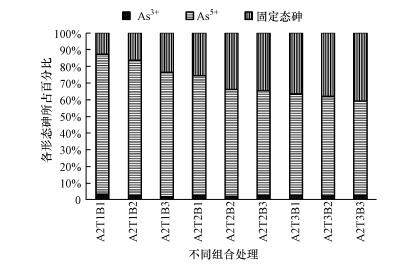 |
| 图 4 不同处理下砷的价态转化 Fig. 4Valence state conversion of arsenic under different treatments |
4 结论(Conclusions)1) 青霉菌与生物炭复合作用下, 土壤中有效砷的钝化率随着青霉菌接菌量与生物炭施用量的增加而增加, 且效果显著.随着接菌量的增加, 生物炭对有效砷钝化效果的影响会逐渐减弱, 当接菌量上升至一定程度时, 对有效砷的钝化效果不会继续提高, 钝化率可以达到27.6%左右.
2) 青霉菌与生物炭复合加入土壤中, 两种无机价态砷(As5+、As3+)之间没有相应的转化, As3+在土壤中的含量基本保持不变, 复合处理下, 会有27%的As5+会被青霉菌与生物炭固定.
参考文献
| 鲍士旦. 2000. 土壤农化分析(第3版)[M]. 北京: 中国农业出版社. |
| 崔健.2013.高效液相色谱-原子荧光光谱仪若干关键技术的研究及其在砷形态分析中的应用[D].天津: 天津大学http://cdmd.cnki.com.cn/Article/CDMD-10055-1014171743.htm |
| 邓西海, 王擎运, 蒋其鳌.2013.液相色谱与原子荧光联用分析土壤中不同形态的砷[C].江苏省无机光谱分析学术研讨会.南京: 110-113 |
| 戴树桂. 2006. 环境化学(第2版)[M]. 北京: 高等教育出版社. |
| 高松, 谢丽. 2009. 中国土壤砷污染现状及修复治理技术研究进展[J]. 安徽农业科学, 2009, 37(14): 6587–6589.DOI:10.3969/j.issn.0517-6611.2009.14.104 |
| 顾海东, 陈邵鹏, 秦宏兵. 2012. 高效液相色谱-原子荧光光谱联用分析土壤中形态砷[J]. 环境监测管理与技术, 2012, 24(1): 38–42.DOI:10.3969/j.issn.1006-2009.2012.01.010 |
| 和秋红, 曾希柏. 2008. 土壤中砷的形态转化及其分析方法[J]. 应用生态学报, 2008, 19(12): 2763–2768. |
| 纪冬丽, 孟凡生, 薛浩, 等. 2016. 国内外土壤砷污染及其修复技术现状与展望[J]. 环境工程技术学报, 2016, 6(1): 90–99.DOI:10.3969/j.issn.1674-991X.2016.01.014 |
| 鲁秀国, 过依婷, 奉向东. 2018. 生物炭对土壤中重金属作用及影响研究进展[J]. 应用化工, 2018, 47(4): 775–779.DOI:10.3969/j.issn.1671-3206.2018.04.035 |
| 潘蓉, 曹理想, 张仁铎. 2010. 青霉菌和镰刀菌对重金属Cd2+、Cu2+、Zn2+和Pb2+的吸附特性[J]. 环境科学学报, 2010, 30(3): 477–484. |
| 秦玉燕, 王运儒, 时鹏涛, 等. 2017. 土壤中砷形态分析研究进展[J]. 分析科学学报, 2017, 33(4): 573–581. |
| 任春强, 张云, 杨明. 2014. 土壤砷污染修复技术研究进展[J]. 环境保护与循环经济, 2014, 34(6): 30–33.DOI:10.3969/j.issn.1674-1021.2014.06.008 |
| 饶霜, 卢阳, 黄飞, 等. 2016. 生物炭对土壤微生物的影响研究进展[J]. 生态与农村环境学报, 2016, 32(1): 53–59. |
| 孙璐, 丛海扬, 姚一夫. 2012. 土壤砷污染的微生物修复技术研究进展[J]. 污染防治技术, 2012, 25(4): 9–14. |
| 苏世鸣, 曾希柏, 白玲玉, 等. 2010. 微生物对砷的作用机理及利用真菌修复砷污染土壤的可行性[J]. 应用生态学报, 2010, 21(12): 3266–3272. |
| Su S, Zeng X, Bai L, et al. 2010. Bioaccumulation and biovolatilisation of pentavalent arsenic by penicillin janthinellum, fusarium oxysporum, and trichoderma asperellum, under laboratory conditions[J]. Current Microbiology, 61(4): 261–266.DOI:10.1007/s00284-010-9605-6 |
| Visoottiviseth P, Panviroj N. 2001. Selection of fungi capable of removing toxic arsenic compounds from liquid medium[J]. Sci Asia, 27: 83–92.DOI:10.2306/scienceasia1513-1874.2001.27.083 |
| 王天亮.2017.氢化物发生-原子荧光法测定土壤样品中砷、汞的研究及应用[D].长春: 吉林大学http://cdmd.cnki.com.cn/Article/CDMD-10183-1018005250.htm |
| 王婷.2013.高效诱变菌与生物炭复合修复重金属污染土壤的研究[D].天津: 南开大学http://cdmd.cnki.com.cn/Article/CDMD-10055-1014171743.htm |
| 邢英, 张永航, 韦万丽, 等. 2015. 生物炭钝化修复镉、铅、铜和砷污染土壤的研究进展[J]. 贵州农业科学, 2015, 43(7): 193–197.DOI:10.3969/j.issn.1001-3601.2015.07.049 |
| 许妍哲, 方战强. 2015. 生物炭修复土壤重金属的研究进展[J]. 环境工程, 2015, 33(2): 156–159. |
| 姚玲丹, 程广焕, 王丽晓, 等. 2015. 施用生物炭对土壤微生物的影响[J]. 环境化学, 2015, 34(4): 697–704. |
| Yang Z, Wu Z, Liao Y, et al. 2017. Combination of microbial oxidation and biogenic schwertmannite immobilization: A potential remediation for highly arsenic-contaminated soil[J]. Chemosphere, 181: 1–8.DOI:10.1016/j.chemosphere.2017.04.041 |
| 张静, 刘晓端, 江林. 2008. 土壤中不同形态砷的分析方法[J]. 岩矿测试, 2008, 27(3): 179–183.DOI:10.3969/j.issn.0254-5357.2008.03.005 |
| 郑坤, 耿丽平, 赵全利, 等. 2015. 硅酸盐菌剂对污染土壤中砷、硅活性的影响效应研究[J]. 水土保持学报, 2015, 29(5): 146–151. |
