 , 李思敏1, 张文强2
, 李思敏1, 张文强2
 , 单保庆2
, 单保庆21. 河北工程大学, 能源与环境工程学院, 邯郸 056038;
2. 中国科学院生态环境研究中心环境水质学国家重点实验室, 北京 100085
收稿日期: 2018-10-21; 修回日期: 2019-01-17; 录用日期: 2019-01-17
基金项目: 国家自然科学基金青年基金(No.21507146);中国科学院青年创新促进会(张文强,2018058);国家自然科学基金-广东省联合基金重点项目(No.15011235)
作者简介: 丰茹江(1992-), 男, E-mail:fengrujiang8023@163.com
通讯作者(责任作者): 张文强, E-mail:wqzhang@rcees.ac.cn
摘要: 利用液相31P核磁共振分析方法,研究了我国不同地理区域湖泊表层沉积物中生物质磷(Biogenic-P)的形态特征.结果表明,不同地理区域湖泊表层沉积物磷含量差异较大,湖泊沉积物中的总磷在184.37~1089.41 mg·kg-1之间,青藏高原的青海湖总磷含量最高,达到1089.41 mg·kg-1.使用31P-NMR技术在湖泊沉积物中共检测到4类磷化合物,其中生物质磷检测到3类磷化合物,分别为:磷酸单酯(Mono-P)、DNA磷(DNA-P)、焦磷酸盐(Pyro-P),其中以磷酸单酯为主,含量在5.57~399.18 mg·kg-1之间.随着我国外源性磷的有效控制,内源性磷成为了磷主要的来源,在磷的内源负荷中,生物质磷矿化释放的磷将会影响水体整体生产力,本研究基于液相31P核磁共振技术,对我国不同区域湖泊沉积物中磷形态的分布有了一些新的认识,可为深入认识磷在不同区域湖泊中转化提供支持,有助于深入研究不同区域湖泊磷生物地球化学循环过程,同时为认识我国不同区域湖泊沉积物中磷形态特征提供数据支持.
关键词:生物质磷沉积物湖泊31P核磁共振
Morphological characteristics of Biomass phosphorus (Biogenic-P) in lake sediments in different geographic regions based on liquid 31P nuclear magnetic resonance spectroscopy
FENG Rujiang1,2
 , LI Simin1, ZHANG Wenqiang2
, LI Simin1, ZHANG Wenqiang2
 , SHAN Baoqing2
, SHAN Baoqing2 1. College of Energy and Environmental Engineering, Hebei University of Engineering, Handan 056038;
2. State Key Laboratory of Environmental Aquatic Chemistry, Research Center of Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
Received 21 October 2018; received in revised from 17 January 2019; accepted 17 January 2019
Abstract: The morphological characteristics of biogenic phosphorus (Biogenic-P) in surface sediments of lakes in different geographical regions of China were studied by liquid 31P-NMR. The results show that the contents of phosphorus in lake sediments varied greatly in different geographical regions. The total phosphorus in lake sediments ranged from 184.37~1089.41 mg·kg-1.The total phosphorus content of Qinghai Lake Tibetan Plateau is the highest, reaching 1089.41 mg·kg-1. Four kinds of phosphorus compounds were detected in lake sediments by 31P-NMR. Among them, three kinds of phosphorus compounds were detected in biomass phosphorus, namely, Mono-P, DNA-P and Pyro-P. The content of phosphorus monoester was mainly 5.57~399.18 mg·kg-1.With the effective control of exogenous phosphorus, endogenous phosphorus has become the main source of phosphorus in the water column. In the endogenous load of phosphorus, the phosphorus released by the mineralization of biomass phosphorus will affect the overall productivity of water. Based on Liquid 31P NMR technology, we have some new understandings of the distribution of phosphorus forms in lake sediments in different regions of China, which can provide insights in understanding the transformation of phosphorus in lakes, and help to further study the phosphorus bio-earth of lakes. Meanwhile, it helps to understand the phosphorus biogeochemical cycle in lakes and to provide data support for understanding the phosphorus morphological characteristics in lake sediments.
Keywords: biogenic phosphoruslakesediment31P-NMR
1 引言(Introduction)磷(P)是所有生命的必需元素, 是所有生物的结构和功能组成部分.磷作为植物体能量转化(ATP)、细胞结构(磷脂)、新陈代谢和信号传导的中心物质, 是生物所必须的一种营养盐元素, 在维持生态系统平衡中起着重要的作用(Paytan et al., 2007).湖泊沉积物是湖泊营养物质的重要蓄积库, 是湖泊流域磷循环的重要归属, 也是湖泊内源性磷的来源, 而湖泊沉积物中的磷形态较复杂, 其中生物质磷(biogenic phosphorus)是沉积物磷中的一类重要磷化合物, 是指除去正磷酸盐以外的所有磷化合物, 该类磷化合物与生物新陈代谢密切相关, 一般包含有机磷化合物、焦磷酸盐和多磷酸盐(Ahlgren et al., 2005).生物质磷主要通过腐殖质、浮游植物和细菌的新陈代谢进行累积, 形成最初的磷储蓄库, 并且参与磷的循环.
水体中磷的来源分为外源磷和内源磷, 当外源性磷的来源得到有效控制时, 内源性磷的来源就成为湖泊水体中磷的主要来源.随着研究的深入, 人们发现在磷的内源负荷中, 生物质磷矿化释放的磷将会影响水体整体生产力(Ahlgren et al., 2006).然而, 在水生生态系统中不同生物质磷化合物的矿化速率各不相同(Ding et al., 2013), 并且每种磷化合物对水体初级生产力的贡献是不同的.例如, 已有研究显示核苷酸磷化合物在所检测到的9种溶解的有机磷化合物中具有最高的藻细胞生长营养价值, 而磷酸三乙酯不能维持生长所需磷的唯一来源(Wang et al., 2011).传统的化学浸提法依靠磷在酸碱溶液里的溶解性不同而进行分析, 将其分成活性Po, 中活性Po和非活性Po.分级方法可以提供不同活性Po的总量, 但无法精确定量分析Po化合物(Bowman, 1989;Kovar and Pierzynski, 2009).核磁共振(NMR)技术是现代科学中用途广泛的分析手段, 它可以快速准确地分析土壤、动植物组织、沉积物等环境样品(Simpson et al., 2012).液相31P核磁共振(31P-NMR)能够根据振动频率的不同分析磷化合物形态(Cardoza et al., 2004; Reitzel et al., 2006).通过液相31P-NMR分析, 膦酸酯、正磷酸盐、磷酸单酯、磷酸二酯(磷酯和DNA磷)、焦磷酸盐和多磷酸盐等被成功检测(Cade-Menu et al., 2005).因此, 液相31P-NMR不仅可以提供海洋、湖泊沉积物中磷的组成和形态特征信息, 也可以提供磷的生物地球化学循环过程信息.
湖泊是陆地表层系统各要素相互作用的节点, 是地球上重要的淡水资源库、洪水调蓄库和物种基因库, 与人类生产与生活息息相关, 在维系流域生态平衡、满足生产生活用水、减轻洪涝灾害和提供丰富水产品等方面发挥着不可替代的作用.但近年来人类生产生活对湖泊造成了很大的干扰, 当外源性磷得到有效的控制时, 内源性磷就成为上覆水磷主要的“源”.
湖泊沉积物磷蓄积特征与流域土地利用方式和湖泊形态特征密切相关.中国幅员辽阔, 湖泊数量多、类型全、分布广、变化复杂, 中国湖泊广泛分布于长江中下游平原、青藏高原、云贵高原、蒙新高原与山地等五大湖区.而我国地貌以山地和高原为主体, 形成巨大的地形阶梯, 这种地貌特征及其诱导的东亚季风和南亚季风气候, 决定了我国湖泊在空间分布上, 显示出具有区域特色的成层格局.K?iv等(2011)对全球54个湖泊(水库)统计表明, 磷易于在湖水深度较大、水力停留时间较长的湖泊滞留.在城市湖泊, 沉积物磷主要以可还原态磷(BD-P)形式存在, 对湖泊内负荷的贡献较大, 而在以农业为主的流域内钙结合态磷(HCl-P)是湖泊沉积物中磷的主要组成部分(Dittrich et al., 2013).沉积物磷形态的迁移转化与湖泊营养状态关系密切, 沉积物磷形态特征可以反映湖泊污染程度(Huo et al., 2011).此外, 有机质的活性差异及矿化分解引发的环境条件(如pH值、Eh等)改变也会间接或直接地影响磷循环过程(Salas et al., 2003).
目前, 对不同区域湖库磷形态特征研究较多, 但运用31P核磁共振分析不同区域湖泊沉积物中生物质磷形态特征和循环转化过程的研究较少.因此, 本研究以云贵高原、长江中下游、蒙新高原以及青藏高原中典型湖泊沉积物为研究对象, 运用液相31P核磁共振分析方法, 研究不同湖区湖泊沉积物中生物质磷的形态特征及其与湖泊基本理化性质之间的关系, 以期为深入认识生物质磷在不同湖区不同环境中持留特征及其湖泊基本理化性质之间的关系.
2 材料与方法(Materials and methods)2.1 研究区域概况及样品采集我国湖泊众多, 据《中国湖泊志》记载, 全国共有面积大于1.0 km2的湖泊2759个, 总面积91019.6 km2(王苏民, 1998), 这些湖泊主要分布于五大湖区:青藏高原、蒙新高原、云贵高原、东北平原和长江中下游平原湖群.本研究区域分别位于青藏高原、蒙新高原、云贵高原、长江中下游平原湖群.在这4个区域共选择7个不同流域特征、生态结构、污染程度的湖泊.其中, 长江中下游湖区选择巢湖、潘阳湖;云贵高原湖区选择泸沽湖、洱海、滇池;青藏高原湖区选择青海湖;蒙新高原湖区选择草型湖泊呼伦湖.
表 1(Table 1)
| 表 1 研究湖泊的环境特征 Table 1 Geographic and limnological features of the studied lakes | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 研究湖泊的环境特征 Table 1 Geographic and limnological features of the studied lakes
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
本次样品采集自各个湖群的典型湖泊, 分别为云贵高原的滇池、洱海、泸沽湖, 长江中下游的巢湖、潘阳湖, 青藏高原的青海湖和蒙新高原的呼伦湖.采样点如图 1所示.表层沉积物样品利用自重力沉积物采集器(奥地利UWITEC)采集沉积物表层约5 cm沉积物样品, 为了取得代表性的样品, 样点布设时, 根据目标湖泊实际情况每个样点同时设置3~5个子样点, 每个样品间隔不小于500 m.样品采集后采用隔氧保存法装入可密封的聚乙烯塑料袋中并于冷藏箱低于4 ℃密封保存.运回实验室后, 将沉积物样品冷冻, 并使用LGJ10冷冻干燥机干燥48 h, 研磨过100目筛后, 四分法取沉积物样品密封低温保存待用.
图 1(Fig. 1)
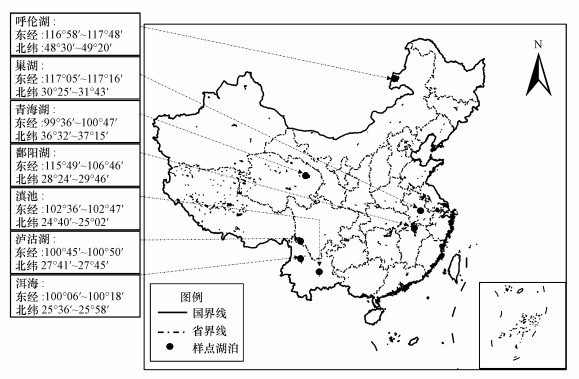 |
| 图 1 不同地理区域湖泊采样点示意图 Fig. 1Schematic diagram of lake sampling points in different geographical regions |
2.2 沉积物理化性质分析样品分析指标包括pH、有机质(OM)、总磷(TP)、总碳(TC)、总氮(TN)和有机磷(Po).具体分析方法如下:pH测定:去CO2水与过20目筛沉积物以2.5 mL /1 mg的水土比混合后, 利用pH计测定(Bai et al., 2009);TP和Po测定:称取沉积物样品两份, 每份0.5 g, 一份样品置于马弗炉中550 ℃灰化2 h, 样品放置常温后用1 mol · L-1 HCl提取16 h, 另一份直接用1 mol · L-1 HCl提取16 h, 提取液采用钼酸盐比色法分别测定TP和Pi, 沉积物Po为TP和Pi的差值(Aspila et al., 1976);沉积物有机质(OM)含量测定:将去除水分的沉积物样品置于马弗炉中550 ℃处理4 h, 灼烧前后的质量差值即为OM(Jensen et al., 1992);TC与TN的测定:称取20~30 mg过100目筛沉积物样品, 利用元素分析仪(型号:Vario EL III厂商:德国elementair)分析其中的TC与TN.
2.3 沉积物Po提取与液相31P-NMR分析本研究中选择沉积物与提取液的比例为1 g/10 mL, 提取时间为16 h, 提取剂选择0.25 mol · L-1 NaOH和50 mmol · L-1EDTA的混合溶液.具体操作步骤为:称取3 g沉积物放入离心管中, 加入30 mL 0.25 mol · L-1NaOH和50 mmol · L-1EDTA的混合溶液, 在室温下提取16 h(Turner et al., 2003b);冷冻离心40 min, 取适量提取液稀释来分析IP和TP, 分析方法采用钼锑抗分光光度法.提取液中的OP由TP与IP的差值得出(Aspila et al., 1976).剩余上清液用冷冻干燥机冷干至粉末状, 用于31P-NMR分析.研究表明, 冻干的提取液不会改变磷的组成(Hupfer et al., 1995; Hupfer et al., 2004).
称取冷冻干燥粉末300 mg用于北京大学核磁共振中心的31P-NMR分析.取300 mg冷冻干燥粉末于2 mL离心管中, 加入0.1 mL 10 mol · L-1 NaOH和0.6 mL D2O的混合溶液重新溶解, 室温下超声振荡30 min后静止平衡5 min, 之后14000 r · min-1条件下高速离心15 min, 将离心获得的上清液转移至核磁共振管中上机检测, 获得图谱.核磁共振仪选用瑞士BRUKER公司的BRUKERAV400, 采用BRUKER标准腔5 mm的BBO探头, 31P谱的脉冲P1=12.00 usec, 脉冲功率PL1=4.15 dB, 31P的共振频率为129.534 Hz, 循环延迟dl=3.6 s, 扫描20000次左右, 测定温度为20 ℃(白秀玲等, 2011;张文强等, 2013;Cade-Menun and Liu, 2014).对图谱进行解析, 所有31P化学位移均参照85%的正磷酸盐, 根据参照文献中主要磷形态峰值的位移确定其组成, 分别为:正磷酸盐(Ortho-P:6~7 ppm)、磷酸单酯(Mono-P:4~6 ppm)、磷脂(Lipid-P:1~3 ppm)、DNA磷(DNA-P:0 ppm)、膦酸盐(Phon-P:18~20 ppm)、焦磷酸盐(Pyro-P:-3.5 ppm~-4.5 ppm)及多聚磷酸盐(poly-P:-17~-19 ppm)(Cade-Menun., 2005;Turner et al., 2005).本研究采用NTUS(2010版本;Acorn NMR, Livermore, CA, USA)核磁共振数据处理软件进行数据处理, 最后对沉积物有机磷不同组分图谱进行积分, 根据不同组分所占比例及TP含量, 计算沉积物中不同组分有机磷的含量.
3 结果与讨论(Results and discussion)3.1 沉积物理化特征湖泊表层沉积物样品基本理化性质见表 2, 对于这7个湖泊表层沉积物来说, 总磷、有机质等基本理化指标在不同湖泊中变化较大.湖泊表层沉积物中TP含量差异反映了湖泊营养盐蓄积特征.不同区域湖泊沉积物中TP含量在184.37~1089.41 mg · kg-1之间, 其中最高值出现在青海湖表层沉积物中, TP含量高达1089.41 mg · kg-1, 泸沽湖沉积物中TP含量最低, 仅有184.37 mg · kg-1;湖泊表层沉积物偏酸性与偏碱性, 其pH值范围在6.55~8.53之间.沉积物的pH偏高偏低主要是受地理环境和气候条件及水化学特性共同作用的结果;闫露霞等(2018)在青藏高原湖泊水质变化及现状评价中写到pH值偏高由于受青藏高原构造湖地理环境和气候条件及水化学特性共同作用的结果:青藏高原构造湖大部分为封闭性内陆湖泊, 出水途径只有湖面蒸发, 青藏高原地区属于干旱半干旱气候, 降水量小, 湖泊蒸发量大, 浓缩作用使湖泊水体pH值偏高.K?iv等(2011)研究发现大型湖泊(水域面积>25 km2)水力停留时间长、相对水深较大时易于磷的蓄积, 这可能是导致4个湖区沉积物TP含量差异的重要原因.pH值是影响磷释放的重要因素, 在酸性和碱性条件下, 均有助于沉积物的磷释放;碱性条件下, 促进NaOH-P的释放, 酸性条件下, 促进HCl-P的释放(金相灿等, 2004).Huang等研究了我国东部浅水湖泊沉积物中铁结合态磷(Fe-P)与钙结合态磷(Ca-P)不同比值在不同pH值的情况下表现出不同的磷释放模式, 铁结合态磷与钙结合态磷的比值小于0.5时, 沉积物在酸性条件下释放出更多的磷, 而较高比值的铁结合态磷与钙结合态磷沉积物在碱性条件下释放出更多的磷(Huang et al., 2005).
表 2(Table 2)
| 表 2 湖泊沉积物理化性质 Table 2 Physiochemical properties of lake | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 湖泊沉积物理化性质 Table 2 Physiochemical properties of lake
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
湖泊表层沉积物有机质含量范围在45.19~122.73 g · kg-1之间.沉积物有机质由于来源及分解机制不同使其组成存在差异, 从而对沉积物磷的释放-吸附行为影响不同(赵海超等, 2014).李军等在太湖五里湖研究中发现, 沉积物在早期成岩作用过程中, 湖泊内源自生有机质发生降解时优先释放有机磷(李军等, 2004).
所研究湖泊表层沉积物中TN含量在0.10%~0.48%;TC的含量在0.88%~6.13%, TS的含量在0.03%~0.29%;其中, 呼伦湖的TC、TN的含量相对较高.C/N、C/P原子比值常用来辨识湖泊沉积物中有机质的来源及其降解程度(Meyers, 1994).一般海洋浮游生物中C/N比值为6.6, C/P比值为106.陆地植物中N和P相对贫瘠, 软组织植物的C/N和C/P分别在10~100和300~1300之间, 木质植物的C/N比值在100~1000之间, C/P比值高于1300.湖泊生物微粒中C : N : P在100 : 12 : 1左右(Ruttenberg et al., 1997).本研究中不同区域湖泊沉积物的C/N比值介于6.0~18.6之间, C/P比值介于35.5~306.5之间, 说明沉积物有机质主要以湖泊内源自生为主.相比而言, 巢湖和滇池的C/N比值小于10, 且C/P相对也较小, 表明巢湖和滇池表层沉积物主要为内源性的, 原因为外源磷的大量输入导致巢湖和滇池水质变差, 容易爆发藻华, 而大量藻类死亡腐解成为表层沉积物有机质的主要来源;当外源性磷得到有效的控制, 水生植物残体经过化学和物理的变化被分解, 从分解的植物残骸中释放的磷将支持水生植物(例如藻类)的代谢, 并增加发生富营养化的风险(Zhang et al., 2017)
3.2 基于核磁共振技术分析的沉积物中生物质磷含量所研究湖泊表层沉积物中共检测到4类磷化合物, 其中3类是生物质磷化合物, 分别为磷酸单酯(Mono-P)、DNA磷(DNA-P)、焦磷酸盐(Pyro-P).在咸水湖的青海湖表层沉积物中未检测到DNA磷, 在所有淡水湖样点湖泊表层沉积物中均检测到DNA磷, 且在所有样点湖泊沉积物中未检测到磷酯(图 2).
图 2(Fig. 2)
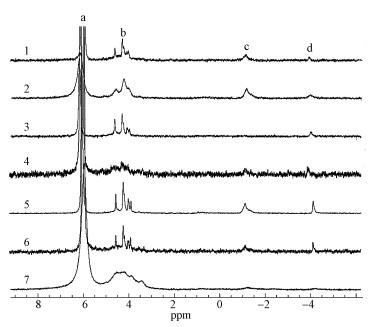 |
| 图 2 表层沉积物液相31P-NMR图谱 (a.正磷酸盐, b.磷酸单酯, c.DNA, d.焦磷酸盐;1.巢湖, 2.洱海, 3.青海湖, 4.潘阳湖, 5.呼伦湖, 6.滇池, 7.泸沽湖) Fig. 231P-NMR spectra of NaON-EDTA extracts of the surface sediments in Lake (a.orthophosphate, b. orthophosphate monoesters, c.DNA, d.pyrophosphate) |
从表 3可以看出所研究湖泊表层沉积物中生物质磷含量在7.09~433.50 mg · kg-1之间, 占TP含量的3.85%~43.28%.磷酸单酯是生物质磷的主要存在形态, 含量在5.57~399.18 mg · kg-1之间, 占TP含量的2.61%~36.64%.在磷酸二酯中仅检查出DNA-P, 其占TP含量的0~8.99%, 在咸水湖的青海湖沉积物中并未检测出DNA-P.焦磷酸盐是无机磷的一种形式, 在所有的湖泊中均检测到了这类磷, 但焦磷酸盐的浓度很低, 其最高含量为34.32 mg · kg-1, 仅占TP含量的4.08%, 最低含量为0.55 mg · kg-1, 占TP的0.25%.
表 3(Table 3)
| 表 3 通过液相31P-NMR检测的NaOH-EDTA提取液中磷化合物的含量 Table 3 Concentrations of P compounds in NaOH-EDTA extracts of the sediments determined by solution 31P-NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 通过液相31P-NMR检测的NaOH-EDTA提取液中磷化合物的含量 Table 3 Concentrations of P compounds in NaOH-EDTA extracts of the sediments determined by solution 31P-NMR
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
磷酸单酯是生物质磷的主要组成部分, 磷酸单酯包括了一大类有机磷化合物, 主要有肌醇磷酸、磷酸糖类等, 在环境中可以和多价离子产生沉淀, 稳定性较高(Ishii et al., 2010), 通常被认为在沉积物中是不易转化和被利用的一种磷形态(Turner et al., 2002; Bai et al., 2009).然而, 近期研究表明, 在厌氧条件下磷酸单酯可能是磷酸盐的来源(Golterman et al., 1998).中国东部的湖泊在夏季常常会出现藻华, 藻华爆发会耗尽水中的溶解氧, 导致沉积物-水界面呈现缺氧状态, 因此, 湖泊表层沉积物中的磷酸单酯在缺氧的状态下将会被矿化, 其将成为藻华所需磷酸盐的主要来源.
磷酸二酯包含DNA、RNA等具有遗传功能的大分子, 以及磷脂等细胞壁成分(Spohn et al., 2013).这类生物质磷不稳定, 易被微生物利用, 稳定性低于磷酸单酯, 其主要来源于细菌等的分解和水生植物的腐解, 同时还可以指示微生物的丰富度(Watts et al., 2002; Ahlgren et al., 2006).Dell′Anno和Danovaro对深海沉积物的研究表明, 深海表层沉积物(10 cm)储存了超过4.5亿吨的细胞外DNA(Extracellular DNA), 这些DNA提供了深海1/5的Po, 为几乎一半的深海原生动物提供了生命所需的Po(Dell′Anno et al., 2005).因此, 胞外DNA对于深海生态系统是至关重要的.Paraskova等研究了两个湖泊Lake Erken和Lake ?nnsj?n沉积物中DNA-P和PL-P的转化速率, 研究表明对两个湖泊而言, 随着沉积柱深度的增加, 磷含量的降低速率快于DNA-P和PL-P的转化速率, 预示着DNA-P是湖泊沉积物磷的主要内源(Paraskova et al., 2014).Watts等(2002)对磷脂进行研究, 发现沉积物中磷脂与微生物群落的变化是一致的, 与水体溶解态磷的变化趋势则相反, 这表明磷脂可以作为短期水体生态系统健康的指示物(Watts et al., 2002).而在此次湖泊表层沉积物中并未检测到磷脂, 这与二酯极易分解有关, 采样过程和样品保存过程可能导致二酯含量的减少也有关系;因此, 这也将是以后对核磁方法优化的一个方面.
焦磷酸盐来源于酯类或者在碱性提取过程中水解的聚磷酸盐(Hupfer et al., 1995).聚磷酸盐和焦磷酸盐被认为是磷化合物中最不稳定的磷, 在磷循环过程中起到重要的作用(Ahlgren et al., 2005).
3.3 生物质磷形态及其与湖泊基本理化性质的关系湖泊富营养化是我国最重要的环境问题之一, 而沉积物理化性质与磷及其形态关系的研究是揭示湖泊富营养化机理的重要一环, 其中关于沉积物的理化性质、磷形态、理化性质与磷形态之间相关性的研究是进一步揭示沉积物-水界面磷行为机理和为我国富营养化湖泊的治理提供指导和理论依据的重要方面.
对所研究湖泊表层沉积物生物质磷形态及其与湖泊理化性质进行相关性分析, 得出相关系数矩阵结果(表 4), 显示不同生物质磷形态及其与湖泊理化性质呈现出显著的相关关系.TP与Biogenic-P相关性显著, 达到0.925, 且Biogenic-P占TP的百分含量最高达到43%, Biogenic-P有可能成为磷主要来源的一类磷形态, 说明当外源性磷得到有效控制时, 内源性磷成为湖泊水体中磷的主要来源.随着研究的深入, 人们发现在磷的内源负荷中, 生物质磷矿化释放的磷将会影响水体整体生产力(Ahlgren et al., 2006).而除咸水湖青海湖外, 不同地理区域淡水湖泊沉积物生物质磷与沉积物理化性质TC表现出显著的相关关系(图 3), 但咸水湖是否有这个性质还需进一步进行验证.
图 3(Fig. 3)
 |
| 图 3 生物质磷与TC相关性 (除青海湖) Fig. 3Biomass phosphorus and TC correlation (except Qinghai Lake) |
表 4(Table 4)
| 表 4 不同形态磷含量间的相关性 Table 4 Pearson correlation coefficients between various phosphorus fractions in the sediments | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 不同形态磷含量间的相关性 Table 4 Pearson correlation coefficients between various phosphorus fractions in the sediments
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
C/N与Biogenic-P表现出显著的相关性, C/N比值常用来辨识湖泊沉积物中有机质的来源及其降解程度, 这说明有机质是Biogenic-P的重要载体, 且Biogenic-P和磷的生物地球化学循环有着密切的联系.Biogenic-P与Fe、Al及Ca表现出负相关关系, 及其形态与Fe、Al及Ca同样也表现出负相关关系.这与生物质磷的水解反应有关.水解反应包括无催化剂参与的水解反应、同价态金属作为催化剂的水解反应和异价态金属作为催化剂的水解反应.在同价金属催化方面, Smolen和Stone(1997)研究表明Co2+、Ni2+、Cu2+、Zn2+和Pb2+对于硫代硫酸盐(thionate)和氧嗪酸钾有机磷农药(oxonate organophosphorus pesticides)在不同pH值条件下的降解起到促进作用, 反应速度最大增速超过104(Smolen et al., 1997).针铁矿(FeOOH)和其他Fe3+的氧化物、锰氧化物也可以促进Po化合物的降解.pH与各生物质磷形态都表现出相关关系, 与Pyro-P相关性显著, 达到0.709, 其次是Mono-P, 说明湖泊沉积物的pH值是影响生物质磷的吸附-释放的重要的因素.
正磷酸盐(Ortho-P)被认为是可溶解性总磷中最易被生物利用的磷形态, 常用来作为研究湖泊富营养化状态的参数.而由表 4可以看出正磷酸盐(Ortho-P)与磷酸单酯(Mono-P)、焦磷酸盐(Pyro-P)相关性显著, 达到0.798、0.795, 表明正磷酸盐的来源较广, 同样也与上述相一致, 磷酸单酯在一定条件下可以转化为正磷酸盐, 可能是正磷酸盐的来源;而焦磷酸盐是一类极不稳定的磷化合物, 在磷循环中起到重要的作用.
4 结论(Conclusions)1) 湖泊表层沉积物中生物质磷包括磷酸单酯(Mono-P, 2.61%~36.64%)、DNA磷(DNA-P, 0%~8.99%)和焦磷酸盐(Pyro-P, 0.25%~4.08%), 其中, 磷酸单酯是生物质磷的主要成分.
2) 利用31P核磁共振技术, 青海湖表层沉积物中并未检测到DNA磷, 且磷酸单酯含量较高, 达到399.18 mg · kg-1, 而在长江中下游湖泊检测到的磷酸单酯含量较低, 最低值仅有5.57 mg · kg-1.洱海表层沉积物中的DNA磷含量较高.而在此次湖泊表层沉积物中都未检测到磷脂, 这与二酯极易分解, 采样过程和样品保存过程可能导致二酯含量的减少也有关系;因此, 这也将是以后对核磁共振检测方法优化的一个方面.
3) TP与Biogenic-P相关性显著, 达到0.925, 说明Biogenic-P有可能成为磷主要来源的一类磷形态.随着研究的深入, 人们发现当外源性磷得到有效控制时, 内源性磷成为湖泊水体中磷的主要来源, 而在磷的内源负荷中, 生物质磷矿化释放的磷将会影响水体总磷含量, 因此, 对水体整体生产力将会受到影响.
4) C/N与Biogenic-P表现出显著的正相关关系;Biogenic-P与Fe、Al及Ca表现出负相关关系, 及其形态与Fe、Al及Ca同样也表现出负相关关系.pH与各生物质磷形态都表现出相关关系, 与Pyro-P相关性显著, 达到0.709, 其次是Mono-P, 说明湖泊沉积物的pH值是影响生物质磷的吸附-释放的重要的因素.Ortho-P和Mono-P、Pyro-P相关性显著, 达到0.798、0.795, 而与其他变量相关性都不显著, 表明湖泊磷来源广泛.不同地理区域淡水湖泊沉积物的生物质磷与TC表现出显著的相关性, 但咸水湖无此相关性, 这有待进一步验证.
参考文献
| Ahlgren J, Reitzel K, Tranvik L, et al. 2006. Degradation of organic phosphorus compounds in anoxic Baltic Sea sediments:A 31P nuclear magnetic resonance study[J]. Limnology & Oceanography, 51(5): 2341–2348. |
| Aspila K I, Agemian H, Chau A S Y. 1976. A semi-automated method for the determination of inorganic, organic and total phosphate in sediments[J]. Analyst, 101(1200): 187–197.DOI:10.1039/an9760100187 |
| Bowman R A. 1989. A sequential extraction procedure with concentrated sulfuric acid and dilute base for soil organic phosphorus[J]. Soil Science Society of America Journal, 53(2): 362–366.DOI:10.2136/sssaj1989.03615995005300020008x |
| 白秀玲, 周云凯, 李斌, 等. 2011. 基于液相31P核磁共振分析的沉积物样品制备方法研究[J]. 环境科学, 2011, 32(7): 1980–1985. |
| Bai X, Ding S, Fan C, et al. 2009. Organic phosphorus species in surface sediments of a large, shallow, eutrophic lake, Lake Taihu, China[J]. Environmental Pollution, 157(8/9): 2507–2513. |
| Cade-Menun B, Liu C W. 2014. Solution phosphorus-31 nuclear magnetic resonance spectroscopy of soils from 2005 to 2013:A review of sample preparation and experimental parameters[J]. Soil Science Society of America Journal, 78(1): 19–37.DOI:10.2136/sssaj2013.05.0187dgs |
| Cade-Menun B J, Navaratnam J A, Walbridge M R. 2006. Characterizing dissolved and particulate phosphorus in water with 31P nuclear magnetic resonance spectroscopy[J]. Environmental Science & Technology, 40(24): 7874–7880. |
| Cardoza L A, Korir A K, Otto W H, et al. 2004. Applications of NMR spectroscopy in environmental science[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 45(3/4): 209–238. |
| Cade-Menun B J, Benitez-Nelson C R, Pellechia P, et al. 2005. Refining 31P nuclear magnetic resonance spectroscopy for marine particulate samples:Storage conditions and extraction recovery[J]. Marine Chemistry, 97(3/4): 293–306. |
| Cade-Menun B J. 2005. Characterizing phosphorus in environmental and agricultural samples by 31P nuclear magnetic resonance spectroscopy[J]. Talanta, 66(2): 359–371.DOI:10.1016/j.talanta.2004.12.024 |
| Ding S, Xu D, Bai X, et al. 2013. Speciation of organic phosphorus in a sediment profile of Lake Taihu Ⅱ. Molecular species and their depth attenuation[J]. Journal of Environmental Sciences, 25(5): 925–932.DOI:10.1016/S1001-0742(12)60137-5 |
| Dittrich M, Chesnyuk A, Gudimov A, et al. 2013. Phosphorus retention in a mesotrophic lake under transient loading conditions:insights from a sediment phosphorus binding form study[J]. Water Research, 47(3): 1433–1447.DOI:10.1016/j.watres.2012.12.006 |
| Dell'Anno A, Danovaro R. 2005. Extracellular DNA plays a key role in deep-sea ecosystem functioning[J]. Science, 309(5744): 2179–2179.DOI:10.1126/science.1117475 |
| Huo S, Zan F, Xi B, et al. 2011. Phosphorus fractionation in different trophic sediments of lakes from different regions, China[J]. Journal of Environmental Monitoring, 13(4): 1088–1095.DOI:10.1039/c0em00696c |
| Huang Q, Wang Z, Wang C, et al. 2005. Phosphorus release in response to pH variation in the lake sedimentswith different ratios of iron-bound P to calcium-bound P[J]. Chemical Speciation & Bioavailability, 17(2): 55–61. |
| Ishii Y, Harigae S, Tanimoto S, et al. 2010. Spatial variation of phosphorus fractions in bottom sediments and the potential contributions to eutrophication in shallow lakes[J]. Limnology, 11(1): 5–16.DOI:10.1007/s10201-009-0279-3 |
| Jensen H S, Kristensen P, Jeppesen E, et al. 1992. Iron: phosphorus ratio in surface sediment as an indicator of phosphate release from aerobic sediments in shallow lakes[M]//Sediment/Water Interactions. Springer, Dordrecht, 731-743 |
| Kovar J L, Pierzynski G M. 2009. Methods of phosphorus analysis for soils, sediments, residuals, and waters second edition[J]. Southern cooperative series bulletin: 408. |
| 金相灿, 王圣瑞, 庞燕. 2004. 太湖沉积物磷形态及pH值对磷释放的影响[J]. 中国环境科学, 2004, 24(6): 707–711.DOI:10.3321/j.issn:1000-6923.2004.06.016 |
| K?iv T, N?ges T, Laas A. 2011. Phosphorus retention as a function of external loading, hydraulic turnover time, area and relative depth in 54 lakes and reservoirs[J]. Hydrobiologia, 660(1): 105–115.DOI:10.1007/s10750-010-0411-8 |
| Kleeberg A, Herzog C, Hupfer M. 2013. Redox sensitivity of iron in phosphorus binding does not impede lake restoration[J]. Water Research, 47(3): 1491–1502.DOI:10.1016/j.watres.2012.12.014 |
| 李军, 刘丛强, 王仕禄, 等. 2004. 太湖五里湖表层沉积物中不同形态磷的分布特征[J]. 矿物学报, 2004, 24(4): 405–410.DOI:10.3321/j.issn:1000-4734.2004.04.015 |
| Liu J, Wang H, Yang H, et al. 2009. Detection of phosphorus species in sediments of artificial landscape lakes in China by fractionation and phosphorus-31 nuclear magnetic resonance spectroscopy[J]. Environmental Pollution, 157(1): 49–56. |
| Meyers P A. 1994. Preservation of elemental and isotopic source identification of sedimentary organic matter[J]. Chemical Geology, 114(3/4): 289–302. |
| Nyenje P M, Foppen J W, Uhlenbrook S, et al. 2010. Eutrophication and nutrient release in urban areas of sub-Saharan Africa-A review[J]. Science of the Total Environment, 408(3): 447–455.DOI:10.1016/j.scitotenv.2009.10.020 |
| Paytan A, McLaughlin K. 2007. The oceanic phosphorus cycle[J]. Chemical Reviews, 107(2): 563–576. |
| Paraskova J V, Sj?berg P J R, Rydin E. 2014. Turnover of DNA-P and phospholipid-P in lake sediments[J]. Biogeochemistry, 119(1/3): 361–370. |
| 钱轶超, 陈英旭, 楼莉萍, 等. 2010. 核磁共振技术在沉积物磷素组分及迁移转化规律研究中的应用[J]. 应用生态学报, 2010, 21(7): 1892–1898. |
| Reitzel K, Ahlgren J, DeBrabandere H, et al. 2007. Degradation rates of organic phosphorus in lake sediment[J]. Biogeochemistry, 82(1): 15–28.DOI:10.1007/s10533-006-9049-z |
| Ruttenberg K C, Goni M A. 1997. Phosphorus distribution, C:N:P ratios, and δ13Coc in arctic, temperate, and tropical coastal sediments:tools for characterizing bulk sedimentary organic matter[J]. Marine Geology, 139(1/4): 123–145. |
| Shinohara R, Imai A, Kawasaki N, et al. 2012. Biogenic phosphorus compounds in sediment and suspended particles in a shallow eutrophic lake: a 31P-nuclear magnetic resonance (31P NMR) study[J]. Environmental Science & Technology, 46(19): 10572–10578. |
| Simpson A J, Simpson M J, Soong R. 2012. Nuclear magnetic resonance spectroscopy and its key role in environmental research[J]. Environmental Science & Technology, 46(21): 11488–11496. |
| Salas A M, Elliott E T, Westfall D G, et al. 2003. The role of particulate organic matter in phosphorus cycling[J]. Soil Science Society of America Journal, 67(1): 181–189.DOI:10.2136/sssaj2003.0181 |
| Smolen J M, Stone A T. 1997. Divalent metal ion-catalyzed hydrolysis of phosphorothionate ester pesticides and their corresponding oxonates[J]. Environmental Science & Technology, 31(6): 1664–1673. |
| Turner B L, Mahieu N, Condron L M. 2003. Phosphorus-31 nuclear magnetic resonance spectral assignments of phosphorus compounds in soil NaOH-EDTA extracts[J]. Soil Science Society of America Journal, 67(2): 497–510.DOI:10.2136/sssaj2003.4970 |
| Turner B L, Cade-Menun B J, Condron L M, et al. 2005. Extraction of soil organic phosphorus[J]. Talanta, 66(2): 294–306.DOI:10.1016/j.talanta.2004.11.012 |
| Wang Z, Liang Y, Kang W. 2011. Utilization of dissolved organic phosphorus by different groups of phytoplankton taxa[J]. Harmful Algae, 12: 113–118.DOI:10.1016/j.hal.2011.09.005 |
| Watts E E, Dean P A W, Martin R R. 2002. 31P nuclear magnetic resonance study of sediment microbial phospholipids[J]. Canadian Journal of Analytical Sciences and Spectroscopy, 47(5): 127–133. |
| Worsfold P J, Gimbert L J, Mankasingh U, et al. 2005. Sampling, sample treatment and quality assurance issues for the determination of phosphorus species in natural waters and soils[J]. Talanta, 66(2): 273–293.DOI:10.1016/j.talanta.2004.09.006 |
| 杨修, 孙芳, 任娜. 2003. 环青海湖地区生态环境问题及其治理对策[J]. 地域研究与开发, 2003, 22(2): 39–42.DOI:10.3969/j.issn.1003-2363.2003.02.010 |
| 闫露霞, 孙美平, 姚晓军, 等. 2018. 青藏高原湖泊水质变化及现状评价[J]. 环境科学学报, 2018, 38(3): 900–910. |
| 张文强, 单保庆. 2013. 基于液相31P核磁共振(NMR)技术的巢湖沉积物中有机磷形态研究[J]. 环境科学学报, 2013, 33(7): 1967–1973. |
| 赵海超, 王圣瑞, 张莉, 等. 2014. 有机质含量及其组分对洱海沉积物磷吸附-释放影响[J]. 环境科学学报, 2014, 34(9): 2346–2354. |
| Zhang W, Zhu X, Jin X, et al. 2017. Evidence for organic phosphorus activation and transformation at the sediment-water interface during plant debris decomposition[J]. Science of the Total Environment, 583: 458–465.DOI:10.1016/j.scitotenv.2017.01.103 |
| Zhang R, Wu F, He Z, et al. 2009. Phosphorus composition in sediments from seven different trophic lakes, China:A phosphorus-31 NMR study[J]. Journal of Environmental Quality, 38(1): 353–359. |
| Zhang T, Wang X, Jin X. 2007. Variations of alkaline phosphatase activity and P fractions in sediments of a shallow Chinese eutrophic lake (Lake Taihu)[J]. Environmental Pollution, 150(2): 288–294.DOI:10.1016/j.envpol.2007.01.007 |
