 , 梁冯2, 程龙1, 刘俏1, 胡元灏1, 吴喆1
, 梁冯2, 程龙1, 刘俏1, 胡元灏1, 吴喆1
 , 晏彪1
, 晏彪1

1. 湖北科技学院基础医学研究中心, 咸宁 437100;
2. 湖北中医药大学医学检验学院, 武汉 430065
收稿日期: 2017-10-08; 修回日期: 2017-12-28; 录用日期: 2017-12-30
基金项目: 湖北省卫生计生委面上项目(No.WJ2017M166);湖北科技学院校级资助项目(No.2016-18X026)
作者简介: 陈业文(1964-), 女, E-mail:1191675866@qq.com
通讯作者(责任作者): 吴喆(1982-), 女, 硕士, 讲师, 主要研究方向:神经生物学.E-mail:wuzhecell@hbust.edu.cn
晏彪(1988-), 男, 硕士, 助教, 主要研究方向:环境医学和分子毒理学.E-mail:e21yanbiao@sina.cn
摘要: 人类神经系统成熟的海马神经元细胞不能进行复制与自我修复,导致了神经系统易受到环境污染物损伤的风险.邻苯二甲酸二异壬酯(Diisonyl phthalate,DINP)是一种增塑剂替代产品,类雌激素作用较弱,正受到欧盟的推广使用.虽然目前已有一些研究表明了DINP的毒性,但有关其神经毒性的体内研究国内还较少.因此,本研究探讨了DINP单独暴露及与褪黑素联合作用对小鼠脑组织的影响.行为学分析显示,经灌胃200 mg·kg-1·d-1的DINP会导致小鼠行为学出现明显变化;脑组织病理学观察、免疫组化分析(半胱氨酸蛋白酶3(Caspase-3)、胶质纤维酸性蛋白(GFAP))、氧化应激水平检测(活性氧簇(ROS)、还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)活性、8-羟基脱氧鸟苷(8-OH-dG)、DNA-蛋白质交联(DPC))、炎症水平检测(肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β))结果显示,小鼠脑组织海马区出现了病理学损伤,氧化应激和炎症水平上升(p < 0.01).DINP处理后予以50 mg·kg-1·d-1的褪黑素可以降低氧化应激水平,对小鼠脑组织海马区起到保护作用.以上数据表明,实验剂量(200 mg·kg-1·d-1)DINP处理后可以导致小鼠脑组织损伤,同时予以褪黑素可以在一定程度上缓解这种损伤.
关键词:DINP褪黑素小鼠脑组织氧化应激免疫组化
Effects of diisolonyl phthalate alone and combined with melatonin on brain injury in mice
CHEN Yewen1
 , LIANG Feng2, CHENG Long1, LIU Qiao1, HU Yuanhao1, WU Zhe1
, LIANG Feng2, CHENG Long1, LIU Qiao1, HU Yuanhao1, WU Zhe1
 , YAN Biao1
, YAN Biao1

1. Research Center of Basic Medical Sciences, Hubei University of Science and Technology, Xianning 437100;
2. School of Laboratory Medicine, Hubei University of Chinese Medicine, Wuhan 430065
Received 8 October 2017; received in revised from 28 December 2017; accepted 30 December 2017
Supported by the Funds of Health and Family Planning Commission of Hubei Province (No.WJ2017M166) and the Scientific Research Foundation for Hubei University of Science and Technology (No.2016-18X026)
Biography: CHEN Yewen(1964-), female, E-mail:1191675866@qq.com
*Corresponding author: WU Zhe, E-mail:wuzhecell@hbust.edu.cn
YAN Biao, E-mail:e21yanbiao@sina.cn
Abstract: Mature hippocampal neurons in the human nervous system are uncapable of regeneration and repairment, while the nervous system is susceptible to environmental contaminants. Diisonyl phthalate (DINP) is a plasticizer substitute that is being promoted by the European Union for its weak estrogen-like effects. Meanwhile DINP was shown that had neurotoxicity in a few domestic researches. The purpose of this study is to investigate the effects of DINP with or without melatonin on brain injury in mice. Behavioral analysis showed that 200 mg·kg-1·d-1 DINP by oral administration significant changed the behaviour of mice. Histopathological observation, immunohistochemically analysis (Caspase-3, GFAP), detection of oxidative stress levels (ROS, GSH, SOD, 8-OH-dG, DPC), and the levels of inflammatory (TNF-α, IL-1β) showed that the hippocampus of brain tissue of the mice appeared pathological damage, oxidative stress and inflammation levels increased (p < 0.01). The combination of 50 mg·kg-1·d-1 melatonin could reduce oxidative stress induced by DINP and protect the hippocampus of brain tissue in mice. These data suggest that exposure to high doses of DINP (200 mg·kg-1·d-1) cause brain damage in mice, but melatonin protects the brain from this damage induced by DINP.
Key words: DINPmelatoninmouse brain tissueoxidative stressimmunohistochemistry
1 引言(Introduction)邻苯二甲酸酯(Phthalate, PAEs)通称为增塑剂, 工业上常用于聚氯乙烯(PVC)的生产中(Ma et al., 2014), 这类物质使用范围很广, 甚至在食品加工和医药领域都有应用(Schnerb, 2015).由于塑化剂与聚氯乙烯之间的结合不是化学键, 所以较易在聚氯乙烯的使用过程中释放出来(Yan et al., 2016).大量研究已经表明, 邻苯二甲酸二辛酯(DEHP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸丁卞酯(BzBP)可以影响雄性啮齿动物生殖系统的发育, 通过抗雄性激素作用减少胎儿睾丸睾酮的产生(Howdeshell et al., 2008).此外, 塑化剂的一些非生殖系统毒性也逐渐被认识, 如肝肾毒性, 引起肝肿瘤, 导致排卵停止, 影响胎儿生长等(Kovacic, 2010;Ma et al., 2014).由于具有一些潜在毒性, 国外相继出台了相关的法律法规限制DEHP、DBP、BzBP在产品中的应用, 这些规定导致DEHP、DBP、BzBP逐渐被一些低毒性的塑化剂替代, 特别是被邻苯二甲酸二异壬酯(DINP)所替代(Chiellini et al., 2013).
与其他塑化剂类似, DINP仍能从聚氯乙烯中溢出, 因此, 人们可以经口、皮肤、吸入等多种途径暴露于DINP(Ma et al., 2014).职业暴露主要通过吸入和皮肤接触, 而消费者最终暴露主要通过口和皮肤接触(Schettler, 2006).更为重要的是, 儿童可能通过含有DINP的玩具或其他物品暴露于高浓度的DINP中(Babich et al., 2004).一些研究指出, 在人体尿液和食品中可检测到DINP及其代谢物(Koch et al., 2007;Fouad et al., 2013).虽然DINP被认为属于“低毒”, 但人类神经系统成熟的海马神经元细胞不能进行复制与自我修复, 仍存在神经系统受到DINP暴露的风险.
欧洲化学品管理局(European Chemicals Agency, ECHA)在其CLH报告中引用了Hellwig (1997)等的研究结果, 大鼠的DINP未观察到有害作用水平(NOAEL)是200 mg·kg-1·d-1(ECHA, 2016), 因而, 本研究主要探究200 mg·kg-1·d-1 DINP经灌胃后对小鼠脑组织的损伤作用, 以及褪黑素是否可以缓解该浓度下DINP暴露产生的神经毒性作用.实验小鼠以200 mg·kg-1 DINP处理14 d后, 采用Morris水迷宫实验(MWM)检测小鼠的行为学变化, 通过组织病理学观察和免疫组化(Caspase-3、GFAP)检测小鼠脑组织损伤情况, 并采用上游分子事件(ROS、GSH、SOD、8-OH-dG、DPC、TNF-ɑ、IL-1β)探究DINP神经损伤的分子机制及与褪黑素(Melatonin, Mel)联合处理后的影响.
2 材料与方法(Materials and methods)2.1 实验动物昆明小鼠购自湖北省实验动物中心, 自由饮水和进食, 标准环境(12 h光照-12 h黑暗循环, 湿度50%~70%, 温度为20~25 ℃)饲养2周后取材实验.
2.2 主要仪器与试剂仪器:FLX800荧光梅标仪、Power wave XS酶标仪(美国Bio-Tek)、DM4000B显微镜(德国Leica)、实验动物神经行为仪(武汉Yi-Hong, 分析软件:ANY-MazeTM, Stoeling Co. USA).
试剂:DINP, 2′, 7′-二氯荧光黄双乙酸盐(DCFH-DA)、5, 5′-二硫代双(2-硝基苯甲酸)(DTNB)、褪黑素(Mel)均购自Sigma-Aldrich, 其他化学试剂均为国产分析纯.小鼠SOD活性试剂盒购自南京建成生物工程研究所, 小鼠TNF-α和IL-1β酶联免疫吸附检测试剂盒购自美国eBioscience, 兔抗Caspase-3抗体、兔抗GFAP抗体、养抗兔IgG抗体、兔IgG过氧化物酶标记的生物素复合物(SABC-POD)及二氨基联苯胺(DAB)购自武汉Boster Bio-engineering.
2.3 实验分组及流程实验模拟人体暴露途径, 实验动物经DINP灌胃处理.28只小鼠被随机分为4组, 每组7只:①溶剂对照组(0.9%NaCl/Tween 80, 1 : 1);②200 mg·kg-1·d-1 DINP (DINP/Tween 80, 1 : 1);③50 mg·kg-1·d-1 Mel(Mel浓度为5 mg·mL-1);④200 mg·kg-1·d-1 DINP+ 50 mg·kg-1·d-1 Mel, 灌胃体积为10 mL·kg-1体重.Mel溶解于3%的乙醇中, 随后在生理盐水中稀释, 最终的灌胃浓度为50 mg·kg-1·d-1;DINP在Tween-80中溶解, Dimitrov等(2011)已在体内实验证明Tween-80是惰性的, 随后稀释到灌胃浓度.DINP+Mel联合暴露组的处理方式是先给予DINP灌胃处理, 3 h后再给予Mel灌胃处理, 其他组正常灌胃处理.DINP处理染毒周期共14 d(每天上午7:00-8:30), 小鼠于第6~12 d进行水迷宫定向航行实验, 第13 d为遗忘期, 第14 d进行空间探索实验.
2.4 Morris水迷宫实验(MWM)Morris水迷宫实验选用通用小鼠型, 圆桶形水箱直径为100 cm, 水深20 cm, 水温控制在(23±1) ℃.水池按照东西南北4个等距点分为4个象限(SE、EN、NW、WS), 不同象限的水池壁上有不同的图形, 有助于小鼠识别位置形成空间记忆, 逃逸平台位于SE象限的正中央, 距离水面0.5 cm.小鼠的游泳轨迹、游泳速度、方向等实验数据由水池正上方的摄像机记录, 影像数据记录传入计算机, 通过AnyMaze软件分析.
Morris水迷宫由定向航行实验和空间探索实验2个部分组成, 定向航行实验主要用来测试小鼠的学习能力, 检测指标为小鼠在水池中找到逃逸平台所花费的时间, 即逃逸潜伏期, 通过对比不同处理组小鼠的逃逸潜伏期来判断不同组小鼠的学习能力强弱.每只小鼠依次从EN、NW、WS象限入水, 每天训练3次, 每次训练持续时间为60 s.小鼠在60 s之内发现逃逸平台, 并登上逃逸平台则训练结束, 所花费的时间即为逃逸潜伏期;如果在60 s之内小鼠并未发现逃逸平台, 则逃逸潜伏期记录为60 s, 然后人工引导小鼠至逃逸平台, 待小鼠登上逃逸平台后, 计时开始, 持续30 s, 促使小鼠空间记忆的形成, 此种训练持续7 d.空间探索实验主要测试小鼠的记忆能力, 通过7 d的定向航行实验, 小鼠对逃逸平台位置形成了一定的空间记忆, 第13 d为遗忘期, 并不进行实验, 然后第14 d进行空间探索实验, 此时撤除逃逸平台, 按此前方式让小鼠入水, 每次训练实验仍为60 s, 通过对比不同组小鼠在逃逸平台所在象限(即SE象限)滞留时间, 进入SE象限次数, 以及游泳轨迹来评估不同组小鼠的记忆情况.
2.5 脑组织病理学观察按照文献所述方法(Sass et al., 1994)制作小鼠脑海马区石蜡切片并进行H&E和Nissl染色, 随后在显微镜下进行切片观察.
2.6 免疫组化制作3.8 mm小鼠冠状脑前囱切片(每只小鼠取3个区域), 切片先后置于3% H2O2溶液中以灭活内源性酶, 置于枸橼酸盐缓冲液(0.01 mol·L-1, pH=6.0)以热修复抗原, 置于0.2% Triton X-100中10 min以透性化细胞, 用10%山羊血清室温封闭20 min以上.然后滴加兔抗小鼠Caspase-3抗体(1 : 200稀释)或兔抗小鼠GFAP抗体(1 : 200稀释), 4 ℃孵育过夜.再按顺序滴加山羊抗兔IgG(1 : 200)和链霉亲和素-生物素-过氧化物酶复合物(SABC), 室温静置1 h后, 将二氨基联苯胺(DAB)加于切片上, 显微镜下控制反应时间, 蒸馏水终止显色.Caspase-3和GFAP蛋白在镜下显示褐色, 在DM4000B显微镜(德国Leica)下观察染色切片, 使用计算机摄像系统采集图像, 应用Image Pro Plus 6.0(美国Media Cyernetics)图像分析软件, 随机选取5个视野, 测定切片的平均灰度值(以非染色区域为对照).由两名病理专业技术人员(与本研究无关)对切片进行双盲观察.
2.7 指标测定2.7.1 氧化损伤指标测定将收集的小鼠脑组织置于冰上, 电子天平称重记录, 按10 mL·g-1添加PBS(pH=7.4), 使用玻璃匀浆器配制成脑组织匀浆;然后将脑组织匀浆在4 ℃、9391 g的条件下离心10 min, 收集上清置于-70 ℃环境冷冻保存, 上清液中蛋白含量选用Lowry法进行测定.
ROS相对荧光检测:ROS含量选用DCFH-DA法检测, 将匀浆上清液使用PBS(pH=7.4)稀释10倍, 取10 μL加入96孔酶标板中;然后加入10 μmol·L-1的DCFH-DA, 每孔100 μL, 37 ℃黑暗环境中恒温反应30 min;利用荧光酶标仪在485 nm激发光、525 nm发射光的条件下测定荧光强度.
GSH含量检测:GSH含量采用DTNB法进行测定, 将处理后的匀浆上清加入酶标板, 每孔50 μL;然后加入150 μL 60 μg·mL-1的DTNB, 室温黑暗环境反应5 min;在412 nm波长处测定吸光值, 同时采用GSH标准品制作标准曲线, 使用标准曲线计算GSH的含量.
SOD活性分析:SOD活性使用成品试剂盒检测, 通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基(O2-), 后者氧化羟胺形成亚硝酸盐, 在显色剂的作用下呈紫红色, 用可见光分光光度计测其吸光度.
8-OH-dG水平检测:取匀浆上清测定其中8-OH-dG的含量, 按照成品ELISA试剂盒步骤完成测定内容, 试剂盒的灵敏度为0.5 ng·mL-1.
DPC系数测定:KCl-SDS法被用来进行DPC交联水平的分析(Liu et al., 2006), 具体步骤参照文献描述进行.
2.7.2 炎症因子TNF-ɑ和IL-1β表达量检测取匀浆上清测定其中TNF-α和IL-1β的含量, 按照成品ELISA试剂盒步骤完成, 试剂盒的灵敏度分别为8、80 pg·mL-1.
2.8 统计分析实验数据采用Mean±SEM表示, 数据统计分析使用Origin 8.0软件, 多组间均数比较采用two-way ANOVA, 然后使用最小显著性差异法(LSD)检验分析各组均数两两之间的差异, p < 0.05或p < 0.01表示差异具有统计学意义.
3 结果(Results)3.1 DINP单独暴露与Mel联合处理后的行为学结果MWM是一种常被用来检测动物认知能力的行为学实验.如图 1所示, 经过7 d的寻找逃逸平台训练, 第14 d各组的平均逃逸时间均出现了差异;与溶剂对照组相比, 200 mg·kg-1·d-1处理组的平均逃逸时间呈下降趋势(p<0.05)(图 1a), 说明200 mg·kg-1·d-1处理组小鼠学习较慢.第14 d, 记录各组小鼠在目标象限中停留的时间并做对比, 结果显示, 200 mg·kg-1·d-1处理组小鼠在目标象限停留的时间下降(图 1b), 而进入目标象限的次数也下降(图 1c).
图 1(Fig. 1)
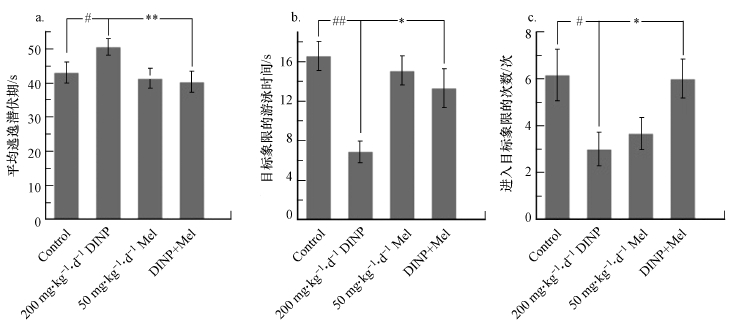 |
| 图 1 DINP单独暴露与Mel联合处理后小鼠的行为学变化 (a. 7 d训练期间的平均逃逸潜伏期;b.第14 d在目标象限的游泳时间;c.第14 d进入目标象限的次数;#p < 0.05, ## p < 0.01, 200 mg·kg-1·d-1 DINP处理组与对照组相比;*p < 0.05, * *p < 0.01, 200 mg·kg-1·d-1 DINP处理组与DINP+Mel组相比) Fig. 1Behavioral effects of DINP alone and combined with Mel on mice after administration |
给予Mel的DINP处理组小鼠的水迷宫实验结果显示, 该组小鼠花费较少的时间就可以找到逃逸平台(图 1a、1b).同时, 该组小鼠7 d的平均逃逸时间较200 mg·kg-1·d-1 DINP处理组减少, 且差异具有统计学意义(p < 0.01)(图 1a), 寻找目标象限更容易(p < 0.05)(图 1b), 有更多的时间处在目标象限中(p < 0.05)(图 1c).
3.2 DINP单独暴露与Mel联合处理后组织病理学观察结果MWM实验结束后, 收集小鼠脑组织进行组织病理学的检测.H&E染色结果显示(图 2a), 溶剂对照组海马CA1区的锥体细胞排列整齐, 细胞边缘清晰, 细胞呈多角形.200 mg·kg-1·d-1 DINP处理组脑组织出现了组织病理学的改变, 细胞排列疏松, 肿胀变形, 顶状树突变短或消失.Nissl染色结果显示(图 2b), 200 mg·kg-1·d-1 DINP处理组与溶剂对照组相比, 细胞内Nissl小体数目下降, 出现了大量Nissl小体缺失的现象.
图 2(Fig. 2)
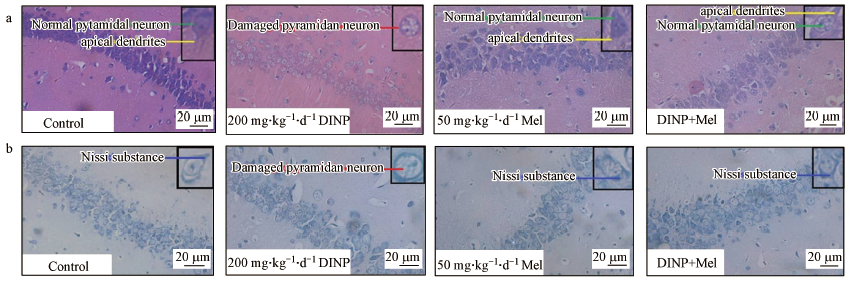 |
| 图 2 DINP单独暴露与Mel联合处理后小鼠脑组织病理变化的切片图 (a. H & E染色, 正常的锥体神经元(绿色线)、受损的锥体神经元(红色线)、树突(黄色)线);b.尼氏染色, 尼氏体(蓝线)) Fig. 2Histopathological changes of brain tissue in mice after administration of DINP alone and combined with Mel |
组织病理学观察结果发现, DINP+Mel组小鼠脑海马细胞仍有损伤, 但损伤细胞的数量明显小于200 mg·kg-1·d-1 DINP处理组.DINP+Mel组细胞结构完整, 染色均匀(图 2a), Nissl染色结果显示, Nissl小体缺失的现象在给予Mel处理后有所缓解(图 2b).
3.3 DINP单独暴露与Mel联合处理后的免疫组化分析结果Caspase-3和GFAP在海马CA1区和大脑皮层区域均有表达, 免疫组化被用来检测Caspase-3和GFAP在小鼠脑组织中的表达量, 免疫组化结果用平均光密度表征.与溶剂对照组相比, DINP处理后脑组织中的Caspase-3和GFAP表达出现了上调(图 3), 结果显示, 200 mg·kg-1·d-1 DINP处理组小鼠脑组织中Caspase-3和GFAP的表达量出现了显著性的上调(p < 0.01)(表 1).免疫组化分析结果显示, 给予Mel后, 与200 mg·kg-1·d-1 DINP处理组相比, DINP+Mel处理组小鼠脑组织中Caspase-3和GFAP的表达量出现了下调(图 3), 并具有统计学意义(p < 0.01, p < 0.05)(表 1).
图 3(Fig. 3)
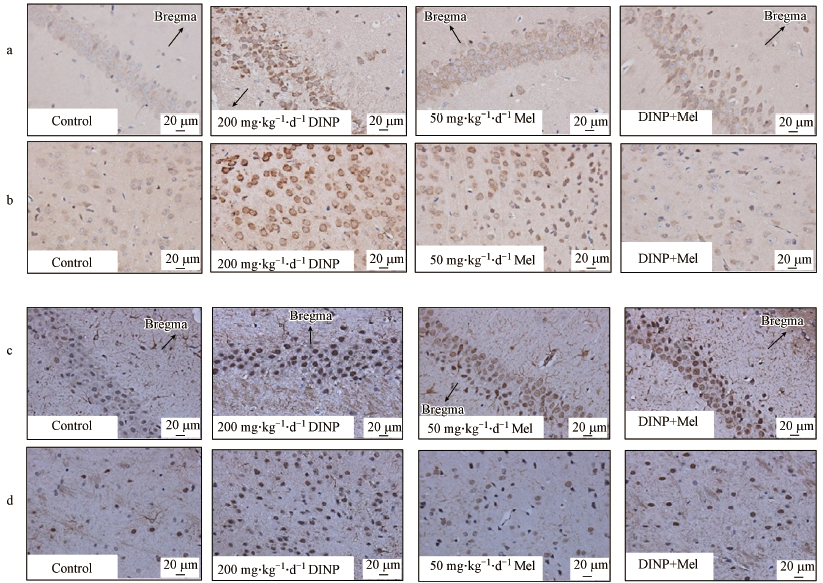 |
| 图 3 DINP单独暴露与Mel联合处理后小鼠脑组织中Caspase-3和GFAP的表达量情况 (该冠状切片按3.8 mm切片;a.海马椎体细胞Caspase-3在CA1区的表达;b.海马星形胶质细胞Caspase-3在大脑皮层的表达;c.海马椎体细胞GFAP在CA1区的表达;d.海马星形胶质细胞GFAP在脑中央区的表达;Caspase-3和GFAP表达水平按平均光密度来分析) Fig. 3Expression of caspase-3 and GFAP in brain of mice after administration of DINP alone and combined with Mel |
表 1(Table 1)
| 表 1 脑组织Caspase-3和GFAP的表达量 Table 1 Expression of caspase-3 and GFAP in brain tissue | |||||||||||||||||||||||||||||||||||||||||
表 1 脑组织Caspase-3和GFAP的表达量 Table 1 Expression of caspase-3 and GFAP in brain tissue
| |||||||||||||||||||||||||||||||||||||||||
3.4 DINP单独暴露与Mel联合处理后的氧化应激水平结果DINP处理后, 200 mg·kg-1·d-1 DINP处理组小鼠脑组织中ROS含量上升(图 4a), GSH含量(以Prot计)和SOD活性(以Prot计)下降(图 4b、4c).小鼠脑组织中8-OH-dG和DPC含量被用来衡量氧化应激导致的DNA损伤, 如图 4d和4e显示, 200 mg·kg-1·d-1 DINP处理组小鼠脑组织中8-OH-dG和DPC出现了显著性升高(p < 0.05, p < 0.01).
图 4(Fig. 4)
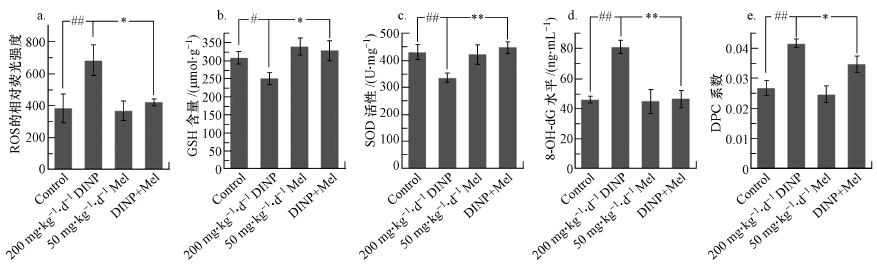 |
| 图 4 DINP单独暴露与Mel联合处理后小鼠脑组织氧化应激水平的情况(n=7) (a.ROS的相对荧光强度;b.GSH含量;c.SOD活性;d.8-OH-dG水平;e.DPC系数;#p < 0.05, ## p < 0.01, 200 mg·kg-1·d-1 DINP处理组与对照组相比;*p < 0.05, **p < 0.01, 200 mg·kg-1·d-1 DINP处理组与DINP+Mel组相比) Fig. 4The level of oxidative stress in the brain tissue of mice after administration of DINP alone and combined with Mel (n=7) |
DINP+Mel组小鼠脑组织中ROS含量与200 mg·kg-1·d-1 DINP处理组相比, 出现了显著性的下降(p < 0.05)(图 4a).GSH含量和SOD的活性水平出现了显著性的上升(p < 0.05, p < 0.01)(图 4b、4c).DNA损伤结果显示, 8-OH-dG和DPC在DINP+Mel组小鼠脑组织中含量也显著性的下降(p < 0.05, p < 0.01)(图 4d、图 4e).
3.5 DINP单独暴露与Mel联合处理后的炎症水平结果TNF-ɑ和IL-1β是炎症反应重要的2种炎症因子, 其表达量检测可反映脑组织受损程度.从图 5可知, 200 mg·kg-1·d-1 DINP处理组小鼠脑组织中TNF-ɑ和IL-1β的表达量最高.给予Mel后, 与200 mg·kg-1·d-1 DINP处理组相比, DINP+Mel组小鼠脑组织中TNF-ɑ和IL-1β的表达量出现了显著性下降(p < 0.05, p < 0.01)(图 5).
图 5(Fig. 5)
 |
| 图 5 DINP单独暴露与Mel联合处理后小鼠脑组织炎症水平的情况(n=7) (a.TNF-α含量;b. IL-1β含量;## p < 0.01, 200 mg·kg-1·d-1 DINP处理组与对照组相比;*p < 0.05, **p < 0.01, 200 mg·kg-1·d-1 DINP处理组与DINP+Mel组相比) Fig. 5The levels of inflammation in the brain tissue of mice after administration of DINP alone and combined with Mel (n=7) |
4 讨论(Discussion)DINP是DEHP、DBP等增塑剂的替代产品, 因其类雌激素作用较弱, 正受到欧盟的推广使用.虽然DINP被认为是低毒性的塑化剂, 但其神经毒性却不容忽视.参考ECHA报告(2016), Hellwig等(1997)研究表明, 受试动物日常饮食的NOAEL为200 mg·kg-1·d-1, 设计本实验DINP高剂量暴露为200 mg·kg-1·d-1.本课题组在前期研究中发现, 该剂量(200 mg·kg-1·d-1)可表现出一定的抗雄性激素作用及肝肾毒性(Ma et al., 2014), 而且该剂量下的DINP经皮肤暴露可致Balb/c小鼠肝肾组织出现氧化损伤(晏彪, 2016), 因此, 本研究主要探究200 mg·kg-1·d-1 DINP可能导致的神经毒性, 以期寻找到有效的方法措施来缓解这种损伤.
本研究中, MWM实验被用来检测DINP处理导致的行为学变化.MWM结果表明, 200 mg·kg-1·d-1 DINP处理组小鼠的逃逸潜伏期较长, 另外, 其进入目标象限的次数、在目标象限停留的时间都出现了显著性的下降;而DINP+Mel处理组小鼠的行为学影响明显得到改善.通过上述结果对比可知, 予以Mel能改善DINP暴露后小鼠的行为.
小鼠行为学的改变与脑功能密切相关, 尤其与在记忆形成的过程中起着重要作用的脑海马组织有关.研究表明, 海马组织根据细胞组成可以分为CA1~CA4四个区域, 而CA1区域锥体细胞的功能与记忆有很大关系(Mulkey et al., 1992).小鼠脑组织病理学结果表明, 200 mg·kg-1·d-1 DINP暴露下CA1区锥体细胞出现了损伤及细胞内Nissl小体缺失.小鼠的脑组织损伤很可能和DINP暴露导致的上述细胞损伤有关.根据免疫组化的结果, DINP暴露后CA1区和大脑皮层区域的Caspase-3表达量均出现了显著上升;这些结果提示DINP暴露可能激活了小鼠脑组织中的细胞凋亡途径, 导致了小鼠脑组织的损伤.
脑组织的损伤往往和神经退行性疾病联系在一起, 越来越多的证据表明, 星形胶质细胞在神经退行性疾病的发生中扮演着重要角色, 星形胶质细胞的激活是一个常见的病理学特征.GFAP是成熟星形胶质细胞中间丝纤维的特殊组成蛋白, 常被用来作为星形胶质细胞的标志蛋白.一旦星形胶质细胞被激活, GFAP的含量就会显著性的增加(Biagini et al., 1993).本研究发现, GFAP在CA1区域和皮层区域均出现了显著性的上升, 这表明DINP暴露后星形胶质细胞可能被激活.
氧化应激是众多激活途径中的上游分子事件, 主要是体内小分子ROS的产生和清除之间的平衡出现紊乱造成的(Ma et al., 2014).神经系统耗氧量高但抗氧化能力较弱(Halliwell, 2006), 因此, 很容易受氧化应激的影响.本研究显示, 200 mg·kg-1·d-1的DINP处理后, 小鼠脑组织中ROS水平显著上升, GSH和SOD的活性显著下降, 说明小鼠脑组织中产生氧化应激.8-OH-dG和DPC的水平上升进一步体现出200 mg·kg-1·d-1的DINP暴露导致的毒性, 这些结果提示DINP暴露可导致氧化应激.ROS由细胞的新陈代谢产生, 是氧化应激最重要的生物指标, ROS过度积累导致氧化应激的程度加深, 严重的会导致组织损伤.GSH是一种常见的肽, 其主要功能是与过氧化氢反应, 可以用来清除ROS从而阻止氧化, GSH在细胞网络中为细胞提供抗氧化的保护(Kelly et al., 1998).SOD是一种重要的酶, 可以清除ROS分子进而保护细胞(Machado-Linde et al., 2012).因此, GSH含量和SOD活性的下降通常被用来衡量氧化应激的水平.高水平的ROS还会导致DNA损伤, ROS导致的DNA损伤包括DNA单链或双链的断裂, 嘌呤、嘧啶或者脱氧核糖的改变, 以及DNA的交联(Barzilai et al., 2014).鸟嘌呤是DNA中比较活跃的分子, 易受到ROS的攻击形成8-OH-dG, 8-OH-dG更易和胸腺嘧啶结合导致置换突变(Kasai et al., 2008).本研究中另外一个衡量DNA损伤的指标是DPC, DNA和蛋白质的共价交联是影响DNA正常代谢的重要因素(晏彪, 2016).高水平的氧化应激可以导致前炎症反应(Ma et al., 2014), 例如, 可以促进TNF-ɑ和IL-1β的表达.实验结果表明, 200 mg·kg-1·d-1 DINP处理后可引起实验小鼠脑组织中TNF-ɑ和IL-1β表达显著上升, 提示DINP暴露后小鼠脑组织出现了炎症反应.
褪黑素是一种具有多种活性的分子, 在体内具有多种生理功能.对于ROS的清除功能及可以穿越血脑屏障的能力提示褪黑素可能潜在的神经保护作用(Reiter et al., 2007).因此, 本实验以Mel作为DINP引起氧化应激的阻断剂, 采用与DINP联合处理的方式, 去验证Mel在200 mg·kg-1·d-1 DINP暴露下的神经保护作用(Chang et al., 2012), 并探讨其保护机制.结果显示, Mel可以较为显著地缓解DINP处理后导致的损伤, 实验小鼠脑组织中细胞损伤程度, Caspase-3和GFAP的表达量, 以及氧化应激和炎症水平均出现了显著性的下降.因此, 研究提示Mel可能是通过降低氧化应激的水平来缓解DINP暴露导致的小鼠脑损伤.
5 结论(Conclusions)本研究表明, 较高剂量(200 mg·kg-1·d-1)DINP暴露可通过氧自由基损伤激活细胞凋亡信号通路和活化星形胶质细胞导致实验小鼠脑组织的损伤;氧化应激途径可能是DINP导致小鼠脑损伤与炎症反应的上游分子事件之一, 褪黑素可通过降低DINP暴露导致的氧化应激水平起到一定的神经保护作用.本项研究有助于揭示DINP导致脑损伤的分子机理, 并为其防冶提供了一定的参考依据, 但其所致疾病的分子机制尚未完全阐明, 还有待进一步深入研究.
参考文献
| Babich M A, Chen S B, Greene M A, et al. 2004. Risk assessment of oral exposure to diisononyl phthalate from children's products[J]. Regulatory Toxicology & Pharmacology, 40(2): 151–167. |
| Barzilai A, Yamamoto K. 2004. DNA damage responses to oxidative stress[J]. Dna Repair, 3(8/9): 1109–1115. |
| Biagini G, Zoli M, Fuxe K, et al. 1993. L-deprenyl increases GFAP immunoreactivity selectively in activated astrocytes in rat brain[J]. Neuroreport, 4(7): 955–958.DOI:10.1097/00001756-199307000-00030 |
| Chang C F, Huang H J, Lee H C, et al. 2012. Melatonin attenuates kainic acid-induced neurotoxicity in mouse hippocampus via inhibition of autophagy and α-synuclein aggregation[J]. Journal of Pineal Research, 52(3): 312–321.DOI:10.1111/jpi.2012.52.issue-3 |
| Chiellini F, Ferri M, Morelli A, et al. 2013. Perspectives on alternatives to phthalate plasticized poly(vinyl chloride) in medical devices applications[J]. Progress in Polymer Science, 38(7): 1067–1088.DOI:10.1016/j.progpolymsci.2013.03.001 |
| Dimitrov M, Nikolova I, Benbasat N, et al. 2011. Acute toxicity, antidepressive and mao inhibitory activity of mangiferin isolated from Hypericum Aucheri[J]. Biotechnology & Biotechnological Equipment, 25(4): 2668–2671. |
| ECHA. 2016. CLH report. Proposal for Harmonised Classification and Labelling. Based on Regulation (EC) No 1272/2008 (CLP Regulation)[R]. Finland: European Chemicals Agency. 1-74 |
| Fouad M M K, Sayed A M E, Mahdy A N. 2013. Migration of DINP and DOP plasticisers from PVC sheets into food[J]. Environmental Management & Health, 10(5): 297–302. |
| Halliwell B. 2006. Oxidative stress and neurodegeneration:where are we now?[J]. Journal of Neurochemistry, 97(6): 1634–1658.DOI:10.1111/jnc.2006.97.issue-6 |
| Hellwig J, Freudenberger H, Jackh R. 1997. Differential prenatal toxicity of branched phthalate esters in rats[J]. Food and Chemical Toxicology, 35: 501–512.DOI:10.1016/S0278-6915(97)00008-2 |
| Howdeshell K L, Wilson V S, Furr J, et al. 2008. A mixture of five phthalate esters inhibits fetal testicular testosterone production in the sprague-dawley rat in a cumulative, dose-additive manner[J]. Toxicological Sciences, 105(1): 153–165.DOI:10.1093/toxsci/kfn077 |
| Kasai H, Kawai K, Li Y S. 2008. Analysis of 8-OH-dG and 8-OH-Gua as biomarkers of oxidative stress[J]. Genes & Environment, 30(2): 33–40. |
| Kelly K A, Havrilla C M, Brady T C, et al. 1998. Oxidative stress in toxicology:established mammalian and emerging piscine model systems[J]. Environmental Health Perspectives, 106(7): 375–384.DOI:10.1289/ehp.98106375 |
| Koch H M, Müller J, Angerer J. 2007. Determination of secondary, oxidised di-iso-nonylphthalate (DINP) metabolites in human urine representative for the exposure to commercial DINP plasticizers[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 847(2): 114–125. |
| Kovacic P. 2010. How dangerous are phthalate plasticizers? Integrated approach to toxicity based on metabolism, electron transfer, reactive oxygen species and cell signaling[J]. Medical Hypotheses, 74(4): 626–628.DOI:10.1016/j.mehy.2009.11.032 |
| Liu Y, Li C M, Lu Z, et al. 2006. Studies on formation and repair of formaldehyde-damaged DNA by detection of DNA-protein crosslinks and DNA breaks[J]. Frontiers in Bioscience, 11(1): 991–997.DOI:10.2741/1856 |
| Machado-Linde F, Pelegrin P, Sanchez-Ferrer M L, et al. 2012. 2-methoxyestradiol in the pathophysiology of endometriosis:focus on angiogenesis and therapeutic potential[J]. Reproductive Sciences, 19(10): 1018–1029.DOI:10.1177/1933719112446080 |
| Ma P, Yan B, Zeng Q, et al. 2014. Oral exposure of Kunming mice to diisononyl phthalate induces hepatic and renal tissue injury through the accumulation of ROS. Protective effect of melatonin[J]. Food & Chemical Toxicology, 68(6): 247–256. |
| Mulkey, Rosel M, Robert C. 1992. Mechanisms underlying induction of homosynaptic long-term depression in area CA1 of the hippocampus[J]. Neuron, 9(5): 967–975.DOI:10.1016/0896-6273(92)90248-C |
| Reiter R J, Tan D X, Manchester L C, et al. 2007. Medical implications of melatonin:receptor-mediated and receptor-independent actions[J]. Adv Med Sci, 52(6): 11–28. |
| Sass K J, Westerveld M, Buchanan C P, et al. 1994. Degree of hippocampal neuron loss determines severity of verbal memory decrease after left anteromesiotemporal lobectomy[J]. Epilepsia, 35(6): 1179–1186.DOI:10.1111/epi.1994.35.issue-6 |
| Schettler T. 2006. Human exposure to phthalates via consumer products[J]. International Journal of Andrology, 29(1): 134–139.DOI:10.1111/ija.2006.29.issue-1 |
| Schnerb R. 2015. Distribution of phthalates, pesticides and drug residues in the dissolved, particulate and sedimentary phases from transboundary rivers (France-Belgium)[J]. Science of the Total Environment, 521-522(1): 152. |
| 晏彪, 马萍, 吴卓, 等. 2016. 邻苯二甲酸二异壬酯皮肤暴露致Balb/c小鼠肝肾组织氧化损伤的研究[J]. 环境科学学报, 2016, 36(8): 3095–3102. |
| Yan B, Guo J, Liu X, et al. 2016. Oxidative stress mediates dibutyl phthalateinduced anxiety-like behavior in Kunming mice[J]. Environmental Toxicology & Pharmacology, 45: 45–51. |
