 , 武阳1, 焦铭1, 杨旭1,2, 马萍1, 晏彪1,2
, 武阳1, 焦铭1, 杨旭1,2, 马萍1, 晏彪1,2

1. 湖北科技学院基础医学研究中心, 环境-免疫与神经系统疾病实验室, 咸宁 437100;
2. 华中师范大学环境生物医学实验室, 武汉 430079
收稿日期: 2017-06-07; 修回日期: 2017-08-15; 录用日期: 2017-08-20
基金项目: 湖北省高等学校优秀中青年科技创新团队计划项目(No.T201717);湖北科技学院校级资助项目(No.2016-18X026)
作者简介: 陈姣娥(1972-), 女, E-mail:chenjiaoe913@sina.com
通讯作者(责任作者): 晏彪(1988—), 男, 硕士, 助教, 主要研究方向:环境医学和分子毒理学. E-mail:e21yanbiao@sina.cn
摘要: 流行病学研究表明,空气细颗粒污染物(PM2.5)的暴露与过敏性疾病有一定的联系;然而,PM2.5暴露与过敏性疾病之间的关系尚未完全阐明,特别是室内环境中PM2.5涉及到过敏或非过敏的作用不详.为了比较研究过敏与非过敏儿童室内PM2.5的细胞毒性,在武汉市洪山区10户家庭室内进行了为期3个月的采样,分别收集过敏与非过敏儿童的室内PM2.5.采用有机/元素碳测定仪对二者PM2.5成分中的含碳组分进行了分析,并通过检测昆明小鼠巨噬细胞的形态及吞噬功能影响、细胞活力、乳酸脱氢酶(LDH)漏出率等指标,来检测PM2.5暴露所致的细胞毒性.结果表明,高剂量(200 μg·mL-1)PM2.5暴露对小鼠巨噬细胞的形态及吞噬功能会产生不利的影响;与非过敏儿童的室内PM2.5暴露组相比,过敏儿童的室内PM2.5暴露组诱导巨噬细胞产生的毒性作用更明显.细胞体外测试结果提示:在相同PM2.5暴露剂量下,引起儿童过敏症的室内PM2.5成分具有重要影响.
关键词:室内PM2.5过敏性疾病巨噬细胞细胞毒性
Comparison of the cytotoxicity of the indoor PM2.5 from allergic or from non-allergic children's homes: An in vitro study
CHEN Jiao'e1
 , WU Yang1, JIAO Ming1, YANG Xu1,2, MA Ping1, YAN Biao1,2
, WU Yang1, JIAO Ming1, YANG Xu1,2, MA Ping1, YAN Biao1,2

1. Laboratory of Environment-immunological and Neurological Diseases, Research Center of Basic Medical Sciences, Hubei University of Science and Technology, Xianning 437100;
2. Laboratory of Environment Biomedicine, Central China Normal University, Wuhan 430079
Received 7 June 2017; received in revised from 15 August 2017; accepted 20 August 2017
Supported by the Fund for the Middle-aged and Youngs′ Excellent Innovation Team of Science and Technology of Hubei Province (No.T201717) and the Scientific Research Foundation for Hubei University of Science and Technology(No.2016-18X026)
Biography: CHEN Jiao′e(1972—), female, E-mail:chenjiaoe913@sina.com
*Corresponding author: YAN Biao, E-mail:e21yanbiao@sina.cn
Abstract: Epidemiological studies have shown exposure to air fine particulate matter (PM2.5) is associated with allergic diseases. However, the association between PM2.5 exposure and allergic diseases has not yet been fully elucidated, particularly the role of PM2.5 from indoor environment involved in allergy or non-allergy is unknown. To compare cytotoxicity of indoors PM2.5 samples, which collected from allergic or from non-allergic children's homes, we conducted a 3-month sampling in 10 households in Hongshan District, Wuhan City Center. The carbon composition of indoor PM2.5 was analyzed by an OC/EC analyzer (Sunset Laboratory Inc.), and the cytotoxic indicators included the phagocytic function, cell viability and lactate dehydrogenase (LDH) leakage rate of KM mice peritoneal macrophage exposed by the indoor PM2.5. Experimental results showed that ①After exposure to PM2.5 (200 μg·mL-1), the shapes and phagocytic function of the macrophages are significant change; ②The indoor PM2.5 exposure group from the homes of children with allergic symptoms induced macrophages produce more serious toxic effects than that of healthy ones. The results of this vitro study suggest that the children's allergic symptoms are potentially associated with the indoor PM2.5 compositions and their contents.
Key words: indoor PM2.5allergic diseasemacrophagescytotoxicity
1 引言(Introduction)作为评价大气污染的重要指示物之一, 可吸入细颗粒物PM2.5(空气动力学直径≤2.5 μm)污染被认为是当前国内最有害的环境暴露问题之一(阚海东, 2012).据2014年发布的2013年城市空气PM2.5年均浓度数据显示, 包括武汉在内的全国32座主要城市的PM2.5年均浓度均不符合国家标准(0.035 mg·m-3), 都达到了0.07 mg·m-3以上.武汉市环保局在2013年发布的空气质量通报称, 该年PM2.5浓度(≥80 μg·m-3)超标天数为177 d, 超标率达48.5%, 为2004年以来该市空气质量最差的一年(蔡翠, 2014).因此, 对2013年武汉中心城区洪山区的家庭住户进行室内PM2.5采集分析研究是很有必要的.
PM2.5污染与潜在的健康风险密切相关, 室内空气PM2.5暴露相比室外(大气)PM2.5污染而言, 更应该受到普遍的关注(Bai et al., 2003).美国的一项权威调查报告显示(Klepeis et al., 2001), 成人日常活动时间中每天约有80%的时间是在室内度过的, 老人和儿童在室内活动的时间甚至更高.事实上, 一些研究也表明(Geller et al., 2002), 室内PM2.5的来源与室外不同, 而且室内PM2.5的浓度或许比室外PM2.5浓度更高.根据Liu等(2004)的研究显示, 调查的北京地区49个室内公共场合中约有20%的区域PM2.5浓度超过65 μg·m-3, 反映出室内PM2.5暴露程度不容忽视.越来越多的研究也表明(Trasande et al., 2005; Liu, 2012), PM2.5的暴露与过敏性疾病有着一定的联系, PM2.5浓度越高, 其所暴露的人群患过敏性疾病的发病率就会升高;然而, 室内PM2.5暴露产生的毒性是否受微观环境的影响目前尚不清楚.
本研究对武汉市洪山区的10户家庭进行环境调查, 分别收集过敏儿童与非过敏儿童的室内PM2.5, 对二者PM2.5成分中含碳组分进行简单分析, 并通过检测PM2.5暴露对小鼠巨噬细胞的形态及吞噬功能的影响, 以细胞活力、乳酸脱氢酶漏出率等指标作为细胞毒性指示, 比较过敏与非过敏儿童室内PM2.5的细胞毒性, 以期为进一步探究室内PM2.5暴露与过敏性疾病的联系提供一定的参考依据.
2 材料与方法(Materials and methods)2.1 实验动物7周龄SPF级((24±1) g)雌性KM小鼠(实验动物合格证号:SCXK(鄂)2008-0005;实验动物质量合格证:42000600003915、42000600004123), 购买自湖北省疾病预防控制中心实验动物中心.
2.2 主要仪器与试剂仪器:PM2.5环境采样器(AirChek XR5000, 美国SKC Inc.)、QMA石英膜(直径46.2 mm, 美国Whatman)、碳气溶胶分析仪(美国Sunset Laboratory Inc.)、真空离心浓缩仪(Centrivap?, 美国Labconco)、荧光梅标仪(FLX800, 美国Bio-Tek)、超净工作台(SW-CJ-2D, 中国苏州净化)、倒置显微镜(TE2000-S, 日本Nikon).
试剂:RPMI 1640培养基、胎牛血清(Gibco)、噻唑蓝(MTT)购自美国Sigma-Aldrich公司, 小鼠LDH酶联免疫试剂盒购自南京建成生物科技有限公司, 其他化学试剂均为国产分析纯.
2.3 PM2.5采样时间和采样点采样时间为2013年10—12月, 每日采样时长均为8 h, PM2.5采样器设置的空气流量为1.5 L·min-1.采样点为武汉市洪山区的10户家庭室内, 当时监测的室内PM2.5浓度为200~500 μg·m-3, 室内温度变化为17~22 ℃, 相对湿度为55%~70%.本研究先对170户家庭中10~12岁的儿童进行问卷调查, 该问卷调查表参照American Thoracic Society-Division of Lung Disease(ATS-DLD)改进而来, 再实时走访家庭, 筛选出的10户家庭中, 儿童环境居住的时间>3年, 且将其按表 1所示进行分组, 在过敏儿童的室内PM2.5实验组中, 5个家庭的儿童出现一种或一种以上的过敏性症状;而非过敏儿童的室内PM2.5实验组中, 5个家庭的儿童健康, 没有过敏症状.
表 1(Table 1)
| 表 1 实验分组信息 Table 1 Experimental grouping information | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 实验分组信息 Table 1 Experimental grouping information
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.4 PM2.5悬液的制备采样后的QMA石英滤膜(直径46.2 mm)经干燥处理后, 将滤膜剪成1~2 cm2的小块, 置于容量瓶中用三蒸水浸润;再超声振荡3次, 每次20 min, 以洗脱滤膜表面的大颗粒物.振荡液经4层纱布过滤, 滤液经4 ℃、14000 r·min-1离心30 min, 用已称重且洁净的EP管收集下层滤液, 滤液混匀后, 再经真空离心浓缩仪处理6 h, 残留于EP管底的即为PM2.5.称重后, 用PBS配成所需浓度, 混匀并灭菌, 4 ℃保存.实验前40 kHz、20 ℃超声振荡15 min, 混匀使用.
2.5 PM2.5中含碳组分分析含碳组分(也称碳气溶胶)是PM2.5中主要的化学成分, 据调查显示(Seinfeld et al., 1998), 其在城市空气PM2.5中占比可高达40%, 通常主要分为有机碳(OC)和元素碳(EC).采用碳气溶胶分析仪对PM2.5中含碳组分进行检测, 可区分过敏与非过敏儿童室内PM2.5成分中碳来源的不同, 其检测步骤参照Gao等(2012)的研究.
2.6 PM2.5上菌落数的统计PM2.5上的附着物(如真菌)可影响PM2.5介导的细胞毒性.对PM2.5上菌落数的统计分析, 可区分过敏与非过敏儿童室内PM2.5的生物特性.将分别从过敏与非过敏儿童的起居室、卧室和室外收集2 h的PM2.5置于真菌培养基, 在恒温培养箱中培养观察, 统计第3 d和第5 d的菌落数, 并拍照记录.
2.7 巨噬细胞的分离和培养25只SPF级雌性KM小鼠随机分为3组, 分别记为空白组、过敏儿童室内PM2.5实验组、非过敏儿童室内PM2.5实验组, 两实验组各为5例, 每例的小鼠只数为2只, 实验重复2次.选择雌性实验动物的原因是:雌性小鼠的腹部较雄鼠大, 经腹腔注射1 mL 6%可溶性淀粉后, 可刺激小鼠腹腔产生更多的巨噬细胞.小鼠适应喂养3 d后, 实验按如下步骤进行:①脱颈处死实验小鼠, 然后用75%酒精浸泡1~2 min, 移入超净工作台中, 使小鼠仰卧固定于解剖板上, 用手术直剪充分剪开小鼠腹部皮肤;②用眼科镊稍提起腹腔, 并用眼科剪剪开一个小口, 从腹腔内缓慢注射约3 mL无菌PBS, 重复吹打数次后抽出洗液, 置于离心管内;③250 r·min-1离心10 min后弃上清, 用移液枪加入1~2 mL含10%小牛血清的RPMI-1640培养基, 轻轻吹打混匀, 制成细胞悬液, 同时用台盼蓝染液估计细胞的存活率, 要求细胞存活率在90%以上;④将悬浮细胞先铺板于6孔板2 h后, 用PBS洗去未贴壁细胞, 同时取少许细胞在光镜下观察, 细胞形态多样, 有钝圆形突起, 经HE染色鉴定为巨噬细胞;待巨噬细胞计数后, 调整细胞密度为l × l09个·L-1, 移入96孔板中, 每孔180 μL, 再加入不同浓度的PM2.5染毒液20 μL, 使PM2.5终浓度分别为0、10、200 μg·mL-1, 混匀后置于培养箱中培养.
2.8 PM2.5暴露浓度的选择与分组过敏与非过敏儿童室内收集的PM2.5分别暴露于巨噬细胞24 h和48 h.PM2.5暴露浓度参考贾玉巧等(2011)及郭翔等(2012)的研究, 选择设置为0 μg·mL-1 (空白)、10 μg·mL-1 (低剂量)、200 μg·mL-1(高剂量).以贾玉巧等(2011)研究中的最高浓度200 μg·mL-1作为本研究的高剂量, 以郭翔等(2012)研究中染毒浓度10 μg·mL-1作为本研究的低剂量.24 h的实验分组如下:对照组、非过敏儿童室内10 μg·mL-1 PM2.5、非过敏儿童室内200 μg·mL-1 PM2.5、过敏儿童室内10 μg·mL-1 PM2.5、过敏儿童室内200 μg·mL-1 PM2.5.48 h的实验分组如下:对照组、非过敏儿童室内200 μg·mL-1 PM2.5、过敏儿童室内200 μg·mL-1 PM2.5.
2.9 PM2.5暴露的巨噬细胞的形态观察和吞噬能力检测巨噬细胞经PM2.5暴露24 h后, 用PBS迅速吹洗2~3次, 以消除粒子的影响, 吉姆萨染色剂(1:9)染色固定, 室温干燥15 min, 再使用显微镜观察巨噬细胞形态.
巨噬细胞经PM2.5暴露48 h后, 用PBS洗去粒子后吹至悬浮, 再与鸡红细胞(CRBC)共培养30 min.随后取少许培养液制成装片, 吉姆萨染色剂染色固定.巨噬细胞的吞噬能力通过吞噬鸡红细胞进行检测, 结果用吞噬率(R)和吞噬指数(PI)表示:
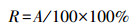 | (1) |
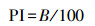 | (2) |
2.10 PM2.5暴露的巨噬细胞的细胞毒性检测巨噬细胞的细胞活力测定:PM2.5诱导的细胞毒性是通过MTT比色法测定的(Li et al., 2010).MTT是一种黄色的噻唑盐, 它在活细胞内能被脱氢酶还原成蓝色沉淀物, 实验方法简言之, 巨噬细胞(37 ℃、5% CO2培养箱中培养)经PM2.5分别暴露24 h和48 h后, 每孔加MTT染液(5 mg·mL-1, 用PBS (pH=7.4)配)20 μL, 孵育4 h后, 终止培养.小心吸弃孔内上清液, 向96孔板中每孔加入150 μL二甲基亚枫(DMSO), 再置于黑暗的培养箱中低速振荡10 min, 使结晶物充分融解.然后选择490 nm波长比色, 测定各孔的OD值.
巨噬细胞释放的乳酸脱氢酶(LDH)测定:PM2.5诱导的细胞损伤是通过乳酸脱氢酶比色法测定的(Bagchi, 1995).经PM2.5分别暴露24 h和48 h后的巨噬细胞, 会释放乳酸脱氢酶, 通过检测LDH活性作为细胞毒性指示, 具体操作根据LDH试剂盒的标准程序进行.
2.11 统计学分析实验数据采用平均值±标准差表示, 采用Origin 6.1软件进行统计分析, 组间的差异分析通过单因素方差分析(ANOVA)结合t检验(Tukey test)确定, p < 0.05为差异显著, p < 0.01为差异极显著, 统计图由GraphPad Prism 5.0软件绘制.
3 结果(Results)3.1 室内PM2.5成分中含碳组分的分析有机碳和元素碳是PM2.5成分中含碳组分的重要指标, 是区分PM2.5来源与差异的关键指标之一.图 1显示了过敏与非过敏儿童室内PM2.5的有机碳和元素碳数据.PM2.5的来源通常与有机碳和元素碳有关, 而有机碳和元素碳含量分别受季节影响而变化, 二者同一天波动范围分别在0.413~1.087、0.052~0.151 μg·m-3之间.实验数据表明, 过敏儿童室内PM2.5中有机碳和元素碳碳的含量明显高于非过敏儿童的室内PM2.5中有机碳和元素的含量, 通过研究二者PM2.5中有机碳和元素碳含量的变化, 可以区分碳气溶胶粒子的来源, 也可间接反映过敏与非过敏儿童室内PM2.5存在的差异.
图 1(Fig. 1)
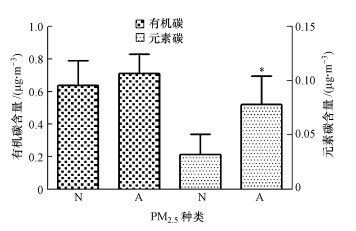 |
| 图 1 室内PM2.5的有机碳和元素碳含量(N:非过敏儿童室内PM2.5;A:过敏儿童室内PM2.5;*p < 0.05) Fig. 1The organic carbon and elemental carbon concentrations of indoor PM2.5 during 8 h |
3.2 过敏与非过敏儿童的室内菌落数分析PM2.5产生的影响很大程度上与其复杂的成分密切相关.除了分析室内PM2.5化学成分外, 还对其所处环境进行了菌落数统计分析.图 2显示了真菌培养第5 d的外观, 图 3显示了第3 d和第5 d真菌的菌落数统计结果.过敏儿童室内第3 d和第5 d真菌的菌落数平均值分别为16.6和49.0个;相应地, 非过敏儿童室内菌落数平均值分别为14.4和41.9个.图中也显示, 过敏儿童的室内真菌菌落数较多.以上实验结果表明, 随着时间的增加, 过敏儿童的室内PM2.5可能携带更多的真菌.
图 2(Fig. 2)
 |
| 图 2 第5 d的真菌外观图(G1~G5表示非过敏儿童室内实验组, G6~G10表示对应的过敏儿童室内实验组;L、B、O分别表示起居室、卧室和室外) Fig. 2Fungal appearance of 5th day |
图 3(Fig. 3)
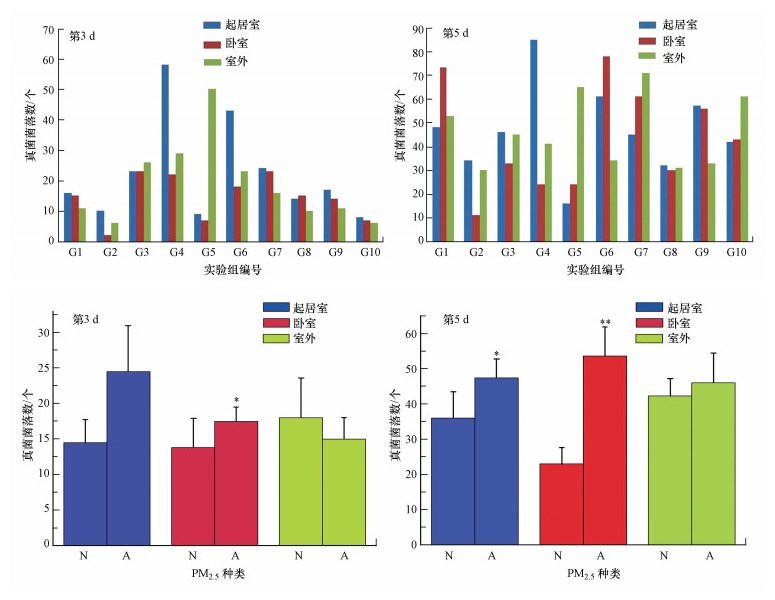 |
| 图 3 室内第3 d和第5 d的真菌菌落数(N:非过敏儿童室内PM2.5;A:过敏儿童室内PM2.5;*p < 0.05, **p < 0.01) Fig. 3Numbers of fungi colonies of indoor on the 3rd and 5th day |
3.3 PM2.5对巨噬细胞形态及吞噬功能的影响巨噬细胞与PM2.5共培养24 h后, 通过显微镜观察到巨噬细胞的形态发生了显著变化, 如图 4所示, 空白组的巨噬细胞肥大较圆, 而经PM2.5暴露后的巨噬细胞变为皱缩;且随着PM2.5浓度的增大, 核质固缩也就越明显.与空白组(生理盐水, 图 4a)比较, 暴露组的巨噬细胞似乎皱缩明显(图 4b~e).需要指出的是, 无论来自非过敏儿童的室内, 还是过敏儿童的室内, 巨噬细胞暴露在高浓度(200 μg·mL-1)PM2.5下时明显会发生不同程度的皱缩.然而, 图 4c与4e对比显示, 过敏儿童室内PM2.5对巨噬细胞的影响要比非过敏儿童室内PM2.5更加显著.
图 4(Fig. 4)
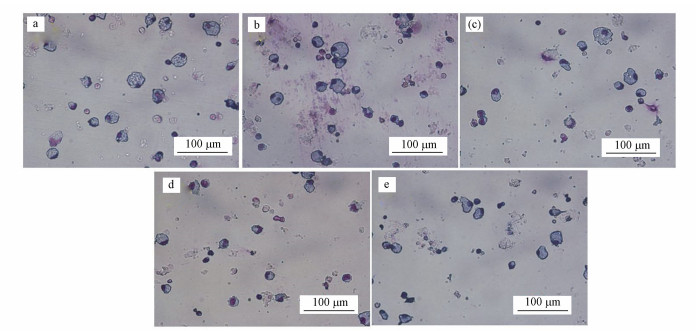 |
| 图 4 巨噬细胞经PM2.5暴露24 h后的形态图(Giemsa染色, ×20)(a.对照组, b.非过敏儿童室内10 μg·mL-1 PM2.5, c.非过敏儿童室内200 μg·mL-1 PM2.5, d.过敏儿童室内10 μg·mL-1 PM2.5, e.过敏儿童室内200 μg·mL-1 PM2.5) Fig. 4Morphological images of macrophages exposed to PM2.5 after 24 h |
巨噬细胞与PM2.5共培养48 h后, 吞噬鸡红细胞的情况如图 5所示, 高剂量(200 μg·mL-1)PM2.5暴露组中, 巨噬细胞的形态发生变化, 数量相应地减少, 对吞噬鸡红细胞的不利影响越大;而且PM2.5浓度越大, 巨噬细胞的吞噬能力下降越明显.图 5a显示, 巨噬细胞可吞噬大多数鸡红细胞, 但图 5b和5c表明, 仍有部分鸡红细胞尚未被巨噬细胞吞噬.从图 5b和5c对比可以看出, 经非过敏儿童室内PM2.5暴露后的巨噬细胞彼此间交联较为紧密, 可以聚集在鸡红细胞周围;相反, 过敏儿童室内PM2.5暴露后的巨噬细胞彼此间交联不够紧密, 并没有向鸡红细胞周围聚集.巨噬细胞的吞噬能力下降这一结果, 可以通过数据直观地反映.表 2显示的是相应的吞噬率和吞噬指数, 由表可知, 过敏儿童室内PM2.5暴露组巨噬细胞的吞噬能力减弱, 反映吞噬能力的两项关键指标都不及非过敏儿童室内PM2.5暴露组.这也从侧面反映过敏儿童室内PM2.5暴露对吞噬细胞的不利影响要比非过敏儿童室内PM2.5暴露组显著的多.
图 5(Fig. 5)
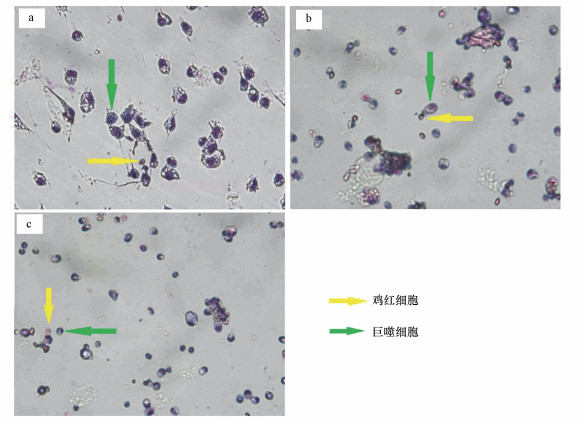 |
| 图 5 巨噬细胞经PM2.5暴露48 h后吞噬鸡红细胞(CRBC)的观察图(Giemsa染色)(a.对照组, ×40倍;b.非过敏儿童室内200 μg·mL-1 PM2.5, ×20倍;c.过敏儿童室内200 μg·mL-1 PM2.5, ×20倍) Fig. 5Effect on phagocytic response of peritoneal macrophages exposed to PM2.5 after 48 h to chicken red blood cells |
表 2(Table 2)
| 表 2 不同PM2.5暴露组的巨噬细胞吞噬能力比较 Table 2 Comparison of phagocytic function in different PM2.5 groups | ||||||||||||||||||||
表 2 不同PM2.5暴露组的巨噬细胞吞噬能力比较 Table 2 Comparison of phagocytic function in different PM2.5 groups
| ||||||||||||||||||||
3.4 PM2.5诱导的细胞毒性PM2.5诱导巨噬细胞的毒性可通过MTT比色法测定的细胞活力反映.巨噬细胞经PM2.5分别暴露24、48 h后细胞活力的变化如图 6所示.图 6a表明, 与空白组相比, 过敏儿童室内PM2.5暴露组与非过敏儿童室内PM2.5暴露组有显著差异(p < 0.05);图 6b表明, 随着PM2.5暴露时间增加至48 h, 巨噬细胞的细胞活力极显著降低(p < 0.01).此外, 巨噬细胞经PM2.5暴露后, 其中, 死细胞或受损的细胞会在培养液中释放出LDH, 通过对LDH的检测可以作为反映PM2.5对细胞通透性的指示.图 7显示的是巨噬细胞经PM2.5分别暴露24、48 h后LDH的活性.实验结果表明, 巨噬细胞经PM2.5暴露48 h后释放LDH的量明显较暴露24 h更高, 且呈时间-浓度效应关系, 即随着PM2.5暴露时间、浓度的增加, 检测出的LDH活性越高, 反映PM2.5对巨噬细胞的细胞膜损伤程度有加深趋势.
图 6(Fig. 6)
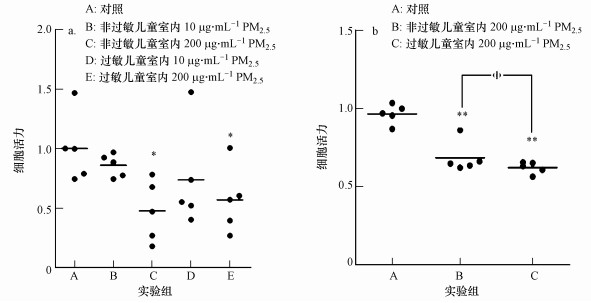 |
| 图 6 PM2.5对巨噬细胞的细胞活力的影响(n=5, *p < 0.05, **p < 0.01, Φ表示p < 0.05)(a.暴露24 h, b.暴露48 h) Fig. 6Effect of PM2.5 on cell viability of macrophages |
图 7(Fig. 7)
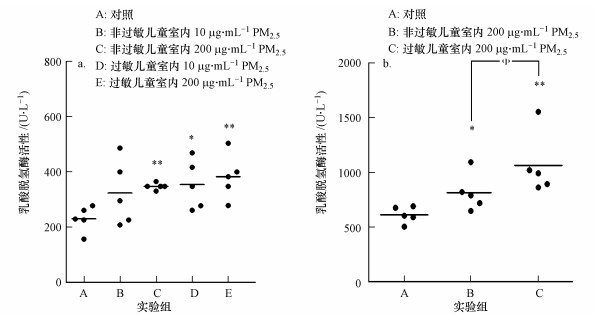 |
| 图 7 PM2.5对巨噬细胞的乳酸脱氢酶活性的影响(n = 5, *p < 0.05, **p < 0.01, Φ表示p < 0.05) (a.暴露24 h, b.暴露48 h) Fig. 7LDH activity of PM2.5 on macrophages |
4 讨论(Discussion)大量研究表明, PM2.5主要通过呼吸道进入体内, 危害人体健康, 甚至易诱发多种不良疾病(朱建超, 2012), 大量的研究有助于扩大对PM2.5的关注与再认识.一些研究指出, PM2.5产生的不利影响与其复杂的组成成分有着密切的关系(Schins et al., 2004).已有研究表明, 含碳组分作为PM2.5中主要的化学成分, PM2.5中有机碳和元素碳含量的增加会导致哮喘儿童的发病率增加(McConnell et al., 2003).本实验中, 虽然收集的PM2.5样品都来自同一地区, 但过敏儿童室内PM2.5的有机碳和元素碳含量明显与非过敏儿童室内PM2.5不同且较高, 而有机碳和元素碳是反映PM2.5中含碳组分的重要指标, 这表明过敏儿童室内PM2.5可能还有其他碳来源.根据本研究的调查统计, 在过敏儿童中, 室内墙的喷漆材料与木质地板占了相当比重, 这些材料会释放出苯及其他挥发性有机物, 容易形成二次粒子, 而且易于附着其他污染物, 包括微生物、过敏原.这也从另一个方面反映室内PM2.5的微观环境不同, 其碳来源不同, 这种成分的差异也就使得PM2.5的暴露对人体健康产生不同程度的危害.
PM2.5复杂的化学成分是造成不良健康效应的关键因素, 其携带的微生物、过敏原、甚至有毒重金属可直接进入人体.有研究指出, PM2.5上的微生物虽未得到全面评价, 但已知微生物的存在会增加PM2.5暴露致过敏性疾病的风险(Degobbi et al., 2011).因此, 除了分析PM2.5化学成分外, 附着于PM2.5上的真菌种类及其数量也是需要考虑的.本研究初步统计了过敏与非过敏儿童室内PM2.5的真菌数量, 结果表明, 过敏儿童室内PM2.5携带的真菌数量要多于非过敏儿童室内PM2.5.PM2.5的组成成分(如有机碳、元素碳等)、附着物(如真菌等)可以影响并介导PM2.5的毒性.儿童长期暴露在这样的环境下, 自然就增加了过敏性疾病发病的机率.流行病学研究强有力地显示, 城市环境中高浓度的PM2.5与儿童哮喘之间有关联(Mar et al., 2005; Nikasinovic et al., 2006);近几年国外权威的研究也证实, 儿童过敏性症状与PM2.5暴露有关(Lee et al., 2014).
巨噬细胞是免疫系统中重要的一类细胞, 其形态及功能的异常与过敏性疾病密切相关.Meng等(2007)的研究表明, PM2.5暴露会使肺泡巨噬细胞和大鼠肺细胞出现DNA损伤;Hiraiwa等(2013)的研究也指出, PM2.5诱导肺巨噬细胞发生炎症反应.本研究就巨噬细胞与PM2.5共培养24 h后的观察结果来看, 随着PM2.5暴露浓度增大, 巨噬细胞的数量有一定程度的下降, 巨噬细胞的形态也发生了显著皱缩, 当PM2.5暴露浓度增加到200 μg·mL-1时, 形态异常的巨噬细胞增多, 且部分严重的巨噬细胞会出现核固缩的现象, 这一趋势也与PM2.5暴露时间的延长结果相一致.另外, 从巨噬细胞的吞噬功能来看, 经PM2.5暴露48 h后的巨噬细胞吞噬鸡红细胞的能力明显减弱.在本实验中, 与空白组相比, 过敏儿童室内PM2.5暴露组与非过敏儿童室内PM2.5暴露组, 二者吞噬率和吞噬指数都呈明显下降趋势.然而, 过敏儿童室内PM2.5暴露组对巨噬细胞吞噬能力的不利影响更加显著.造成这些结果的原因很大程度上源于PM2.5暴露可诱导细胞产生毒性.
本研究中, 随着PM2.5暴露浓度、时间的增加, 巨噬细胞的细胞活力会降低;而乳酸脱氢酶泄露率越高, 则说明巨噬细胞受到细胞膜损伤的程度也越大.两项数据一致的反映出PM2.5对巨噬细胞有毒性作用.多项研究也证实, PM2.5暴露能使巨噬细胞功能失调, 并最终诱发哮喘或其他过敏性疾病(Kulkarni et al., 2006).通过对过敏儿童室内PM2.5与非过敏儿童室内PM2.5的比较分析, 结果表明, 同一浓度下, 前者比后者诱导巨噬细胞产生的毒性风险可能更大, 这也间接反映PM2.5暴露与儿童的过敏症有潜在关联.
5 结论(Conclusions)1) 高剂量(200 μg·mL-1)PM2.5暴露后的巨噬细胞, 其形态和吞噬功能会受到不同程度的影响.
2) 基于PM2.5暴露对巨噬细胞的细胞毒性检测比较发现, 与非过敏儿童室内PM2.5暴露组相比, 过敏儿童室内PM2.5暴露组诱导巨噬细胞产生的毒性作用更明显, 提示儿童的过敏症与室内PM2.5的组分及含量有潜在关联.
参考文献
| Bagchi D, Bagchi M, Hassoun E A, et al. 1995. In vitro and in vivo generation of reactive oxygen species, DNA damage and lactate dehydrogenase leakage by selected pesticides[J]. Toxicology, 104(1): 129–140. |
| Bai Z, Wang Z, Zhu T, et al. 2003. Developing indoor air quality related standards in China[J]. Journal of Asian Architecture & Building Engineering, 2(1): 55–60. |
| 蔡翠. 2014. 武汉市城市发展的大气污染问题与治理对策[J]. 今日湖北旬刊, 2014(2): 84–85. |
| Degobbi C, Lopes F D, Carvalho-Oliveira R, et al. 2011. Correlation of fungi and endotoxin with PM2.5 and meteorological parameters in atmosphere of Sao Paulo, Brazil[J]. Atmospheric Environment, 45(13): 2277–2283.DOI:10.1016/j.atmosenv.2010.12.005 |
| Gao B, Guo H, Wang X M, et al. 2012. Polycyclic aromatic hydrocarbons in PM2.5 in Guangzhou, southern China:Spatiotemporal patterns and emission sources[J]. Journal of Hazardous Materials, 239: 78–87. |
| Geller M D, Chang M C, Sioutas C, et al. 2002. Indoor/outdoor relationship and chemical composition of fine and coarse particles in the southern California deserts[J]. Atmospheric Environment, 36: 1099–1110.DOI:10.1016/S1352-2310(01)00340-5 |
| 郭翔, 闫庆倩, 赵学彬, 等. 2012. 不同地区大气PM2.5对大鼠肺泡巨噬细胞毒性作用的实验研究[J]. 环境与健康杂志, 2012, 29(1): 12–16. |
| Hiraiwa K, van Eeden S F. 2013. Contribution of lung macrophages to the inflammatory responses induced by exposure to air pollutants[J]. Mediators of Inflammation, 2013: 619523–619533. |
| 贾玉巧, 赵晓红, 郭新彪. 2011. 大气颗粒物PM10和PM2.5对人肺成纤维细胞及其炎性因子分泌的影响[J]. 环境与健康杂志, 2011, 28(3): 206–208. |
| 阚海东. 2012. 《环境空气质量标准》(GB3095-2012)细颗粒物(PM2.5)标准值解读[J]. 中华预防医学杂志, 2012, 46(5): 396–398. |
| Klepeis N E, Nelson W C, Ott W R, et al. 2001. The National Human Activity Pattern Survey (NHAPS):a resource for assessing exposure to environmental pollutants[J]. Journal of Exposure Analysis and Environmental Epidemiology, 11(3): 231–252.DOI:10.1038/sj.jea.7500165 |
| Kulkarni N, Pierse N, Rushton L, et al. 2006. Carbon in airway macrophages and lung function in children[J]. New England Journal of Medicine, 355(1): 21–30. |
| Lee J Y, Lee S, Bae G. 2014. A review of the association between air pollutant exposure and allergic diseases in children[J]. Atmospheric Pollution Research, 5(4): 616–629.DOI:10.5094/APR.2014.071 |
| Liu Q. 2012. Impact of fine particulate matter(PM2.5) on asthma among children:a review of recent studies[J]. Journal of Environment & Health, 29(7): 665–668. |
| Liu Y, Chen R, Shen X, et al. 2004. Wintertime indoor air levels of PM10, PM2.5 and PM1 at public places and their contributions to TSP[J]. Environment International, 30(2): 189–197. |
| Li Y, Liu D, Ai H, et al. 2010. Biological evaluation of layered double hydroxides as efficient drug vehicles[J]. Nanotechnology, 21(10): 105–117. |
| Mar T F, Jansen K, Shepherd K, et al. 2005. Exhaled nitric oxide in children with asthma and short-term PM2.5 exposure in Seattle[J]. Environmental Health Perspectives, 113(12): 1791–1794.DOI:10.1289/ehp.7883 |
| McConnell R, Berhane K, Gilliland F, et al. 2003. Prospective study of air pollution and bronchitic symptoms in children with asthma[J]. American Journal of Respiratory and Critical Care Medicine, 168(7): 790–797.DOI:10.1164/rccm.200304-466OC |
| Meng Z, Zhang Q. 2007. Damage effects of dust storm PM2.5 on DNA in alveolar macrophages and lung cells of rats[J]. Food and Chemical Toxicology, 45(8): 1368–1374.DOI:10.1016/j.fct.2007.01.014 |
| Nikasinovic L, Just J, Sahraoui F, et al. 2006. Nasal inflammation and personal exposure to fine particles PM2.5 in asthmatic children[J]. Journal of Allergy and Clinical Immunology, 117(6): 1382–1388.DOI:10.1016/j.jaci.2006.03.023 |
| Schins R P F, Lightbody J H, Borm P J A, et al. 2004. Inflammatory effects of coarse and fine particulate matter in relation to chemical and biological constituents[J]. Toxicology and Applied Pharmacology, 195(1): 1–11. |
| Seinfeld J H, Pandis S N, Seinfeld J H, et al. 1998. Atmospheric chemistry and physics:from air pollution to climate change[J]. Environment:Science and Policy for Sustainable Development, 51(7): 88–90. |
| Trasande L, Thurston G D. 2005. The role of air pollution in asthma and other pediatric morbidities[J]. Journal of Allergy and Clinical Immunology, 115(4): 689–699.DOI:10.1016/j.jaci.2005.01.056 |
| 朱建超. 2012. PM2.5的综述与思考[J]. 中国卫生检验杂志, 2012, 22(10): 2526–2528. |
