 , 刘瑜, 吴华东, 王自蕊, 阮记明, 熊六凤, 周秋白
, 刘瑜, 吴华东, 王自蕊, 阮记明, 熊六凤, 周秋白

江西农业大学动物科学技术学院, 南昌 330045
收稿日期: 2017-06-25; 修回日期: 2017-08-15; 录用日期: 2017-08-16
基金项目: 国家自然科学基金(No.31460146,31760764);江西省协同创新专项(No.JXXTCX201602-02);江西省重大项目(No.20161ACF60020)
作者简介: 隗黎丽(1976—), 女, 博士, 副教授, 主要从事鱼类免疫毒理学研究, 在国内外期刊上发表学术论文30多篇. E-mail: hbliliwei@163.com
通讯作者(责任作者): 周秋白, E-mail: zhouqiubai@163.com
摘要: 微囊藻毒素-LR(MC-LR)是蓝藻水华暴发产生的一种毒素,在水生生态系统中广泛分布.为探讨MC-LR对鱼类的肠道免疫毒性,分别对草鱼经腹腔注射不同剂量的MC-LR(25、75和100 μg·kg-1),24、48、72和96 h后取样,分别进行组织病理变化和炎症相关细胞因子表达分析.显微结构结果显示,肠道组织病理变化表现为微绒毛结构破坏并伴随淋巴细胞浸润,肠上皮细胞排列紊乱,杯状细胞数目显著增多,粘膜固有层充血,在高剂量组甚至出现粘膜固有层分离的现象,且有剂量和时间效应.采用荧光定量PCR方法检测了炎症相关细胞因子IL-1β、IL-8、IL-10、TNF-α和TGF-β的mRNA转录水平变化.结果显示促炎性细胞因子IL-1β、IL-8和TNF-α表达在低剂量组显著上升,而在高剂量组的表达多被抑制;而抗炎性细胞因子IL-10 mRNA仅在25 μg·kg-1 BW处理组表达差异变化显著,但在高剂量组表达变化差异不显著,TGF-β1的表达仅在75和100 μg·kg-1处理组分别处理72和24 h后显著降低,其他差异不显著.从以上结果推测MC-LR的肠道免疫毒性主要表现为肠黏膜结构的破坏以及产生炎性反应,其中对肠黏膜结构的破坏具有剂量依赖效应.
关键词:微囊藻毒素-LR草鱼肠道组织病理细胞因子
Effects of Microcystin-LR on the microstructure and inflammation-related cytokines of intestine in grass carp (Ctenopharyngodon idella)
WEI Lili
 , LIU Yu, WU Huadong, WANG Zirui, RUAN Jiming, XIONG Liufeng, ZHOU Qiubai
, LIU Yu, WU Huadong, WANG Zirui, RUAN Jiming, XIONG Liufeng, ZHOU Qiubai

College of Animal Science and Technology, Jiangxi Agricultural University, Nanchang 330045
Received 25 June 2017; received in revised from 15 August 2017; accepted 16 August 2017
Supported by the National Natural Science Foundation of China (No. 31460146, 31760764), the Collaborative Innovation Project of Jiangxi Province (No. JXXTCX201602-02) and the Important Project on Science of Jiangxi Province (No. 20161ACF60020)
Biography: WEI Lili (1976—), female, associate professor (Ph.D.), E-mail: hbliliwei@163.com
*Corresponding author: ZHOU Qiubai, E-mail: zhouqiubai@163.com
Abstract: Microcystin-LR (MC-LR) is one of the toxins generated by the blue-green algae blooms, and it extensively distributes in the aquatic ecosystem. In order to investigate the immune toxicity of MC-LR to intestine, the grass carp (Ctenopharyngodon idella) individuals were injected intraperitoneally with 25, 75 and 100 μg MC-LR/kg body weight (μg·kg-1), respectively, the intestine samples were took for microstructure and expressions of inflammation-related cytokines at 24, 48, 72 and 96 h. The pathological changes of intestinal tissue were characterized by the destruction of microvilli with lymphocytic infiltration, arranging in disorder of intestinal epithelial cells, significantly increasing of the number of goblet cells, and the congestion of the mucous membrane even the lining of the mucosa being separated in higher doses of groups. The damage was with a time and dose dependent manner. Another, the expressions of inflammation-related cytokines, including interleukin-1β (IL-1β), interleukin-8 (IL-1β), tumor necrosis factor α (TNF-α), interleukin-10 (IL-10) and transforming growth factor-β1 (TGF-β1) in the intestines were investigated by using quantitative real-time PCR (qRT-PCR). The results of qRT-PCR showed that the pro-inflammation cytokines, including IL-1β, IL-8 and TNF-α, were significantly upregulated in the low dose of group, however, the expressions were significantly depressed in high dose of groups. Another, the anti-inflammation cytokine, the expressions of IL-10 were significantly upregulated at 24 h in 25 μg·kg-1 body weight group, then significantly depressed, however, the changes of IL-10 mRNA in higher dose groups were not significant. Furthermore, the expressions of TGF-β1 were significantly downregulated just at 24 and 72 h respectively in 75 and 100 μg·kg-1 BW groups, and the expression of TGF-β 1 in other groups were not significant. Taking together, it was clearly demonstrated that MC-LR could damage the intestine mucosal structure of grass carp with dose independent effects and induced the inflammation reaction.
Key words: microcystin-LRgrass carpintestinehistopathologycytokines
1 引言(Introduction)随着社会经济的迅速发展, 人类的活动使得水体富营养化现象不断加剧.其中, 微囊藻毒素(Microcystins, MCs)是富营养化水体中有毒蓝藻细胞所产生的一类具有生物活性的环状七肽化合物, 其基本结构为环D-丙氨酸-L-X-赤-β-甲基天冬氨酸(Masp)-D-异天冬氨酸-L-Z-Adda-D-异谷氨酸-N-甲基脱氢丙氨酸, 其中, L为左旋, D为右旋, X、Z为两个可变的氨基酸残基;Adda为3-氨基-9-甲氧基-2, 6, 8-三甲基-l0-苯基-4, 6-二烯酸, 是MCs生物活性表达所必须的(Luukkainen et al., 1994).由于X、Z这两个可变的L-氨基酸的更替及Masp和Adda的甲基化或去甲基化产生的差异, 目前已发现的MCs的变体有100多种, 其中微囊藻毒素-LR (MC-LR)是目前已知的毒性最强的一种淡水蓝藻毒素(Puddick et al., 2015).一般认为MC-LR对真核生物的毒性机制在于其可特异性地抑制蛋白磷酸酶1(PP1)和2A (PP2A)(MacKintosh et al., 1990)而导致细胞溶解(Paulina et al., 2006)、诱导细胞凋亡(Fu et al., 2005)及DNA突变(Zhan et al., 2004)等.由于MCs在水体中广泛存在, 不仅直接影响水体质量, 造成水环境的严重污染, 而且对水体中的水生生物产生严重的胁迫, 此外, MCs还可通过水生生物间接进入人体, 从而给人类的健康带来巨大的威胁, 因此, MCs已经成为世界范围的环境问题.
早期的研究报道表明MC-LR主要是一种肝毒素, 但近年来, 越来越多的证据证明MC-LR具有免疫毒性(Chen et al., 2016; Wei et al., 2009; Rymuszka, 2013).鱼类的免疫组织和器官主要包括胸腺、脾脏、肾脏及粘膜相关淋巴组织(杨先乐, 2002), 其中黏膜相关淋巴组织(mucosa-associated lymphoid tissue, MALT), 又称黏膜免疫系统(mucosal immune system, MIS), 指黏膜固有层和上皮细胞下散在的无包膜的淋巴组织.鱼的MIS包括肠道相关淋巴组织(gut-associated lymphoid tissue, GALT)等.有报道表明肠道系统可调节包括毒物在内的一系列内源性和外源性化合物的吸收、分布、代谢和排泄(Luckenbach et al., 2014).因此, 肠道作为机体重要的免疫器官, 是机体抵抗外来抗原威胁的主要场所.最近的一项研究表明通过腹腔注射或口服MC-LR, 鱼类的肠道对MC-LR均有亲和性(Trinchet et al., 2011).鱼类长期生活在被污染的水体中, 不仅会对鱼类的组织产生严重损伤, 还会刺激鱼体诱发特异性和非特异性免疫反应.免疫反应常伴随着炎症的发生(Secombes et al., 2001), 而炎症反应常由细胞因子介导(Rombout and Berg, 1989).细胞因子是由淋巴细胞、单核巨噬细胞及一些基质、内皮细胞和成纤维细胞产生的一类小分子多肽或糖蛋白, 具有免疫调节、抗肿瘤、促进造血、参与炎症反应以及神经内分泌效应等多种生物学功能(Yoshie et al., 2001).由于细胞因子在机体内的重要作用, 已得到广泛的关注.细胞因子包括两类, 一类称为促炎性因子, 如IL-8, IL-1β和TNF-α等, 主要功能为启动免疫反应(Liu et al., 2009);还有一类称为抗炎性因子, 如IL-10和TGF-β1等, 主要功能为通过抑制促炎因子的生成而降低炎症反应对机体的损伤(Strober et al., 2002).IL-8, IL-1β, IL-10属于白细胞介素(interleukin, IL)家族, 由淋巴细胞、单核细胞或其它非单核细胞产生, 在免疫调节、造血以及炎症过程中起重要调节作用(金伯泉, 2001).TNF-α是鱼类体内存在的肿瘤坏死因子的主要成员, 具有调节白细胞迁移、增殖、分化和凋亡等活性(金伯泉, 2001), 而TGF-β1是一类具有多种生物学效应的因子, 在免疫反应中, TGF-β1除了参与炎症反应外, 还能抑制免疫细胞的增殖与分化以及某些细胞因子的产生(Kim et al., 2017).
尽管鱼类肠黏膜淋巴组织在鱼类体液和细胞免疫中均具有比较重要的作用, 但之前的研究多集中在MCs对动物和鱼类肝脏组织病理及细胞因子的影响, 而关于鱼类肠道在MC-LR作用下的病理变化及MC-LR对肠道炎症相关细胞因子表达的影响报道不多.因此, 本研究以种草鱼(Ctenopharyngodon idella L.)为试验对象, 通过腹腔注射不同剂量的MC-LR, 探讨MC-LR对草鱼肠道的病理变化及肠道细胞因子表达的影响.
2 材料与方法(Materials and methods)2.1 试剂实验所用的MC-LR为Taiwan Algal Science Inc公司产品, RevertAidTM First Strand cDNA Synthesis Kit和GoTaq qPCR Master Mix购自北京普洛麦格生物技术有限公司, TRIzol购于invitrogen公司, RNase-Free DNase Ⅰ购自Qiagen, 其他试剂为分析纯, 荧光定量PCR板和膜购于Axygen公司.
2.2 实验鱼及处理实验用草鱼平均体重为(22.13±2.17) g, 平均体长为(12.09±1.33) cm, 购自江西省南昌神龙渔业公司养殖基地.实验用草鱼在暂养期间投喂商品草鱼饲料, 试验前48 h停止投喂并将草鱼随机分为对照组和实验组, 均设置3个重复.MC-LR(纯度≥ 95%)粉末先用甲醇溶解成1 μg·μL-1的溶液, 随后用0.8%生理盐水稀释成所需浓度.根据预实验确定注射剂量为25、75和100 μg·kg-1, 对照组则注射等量的0.8%的生理盐水.经MC-LR处理24、48、72和96 h后取样, 取样时实验鱼用100 μg·mL-1的间氨基苯甲酸乙酯甲烷磺酸盐(MS-222)麻醉, 然后迅速分离新鲜的肠道, 一部分立即放入10%的中性甲醛中固定进行组织切片;另一部分置于液氮中提取RNA.
2.3 光镜样品的制备与观察组织切片采用常规梯度酒精脱水处理、石蜡包埋、切片(厚约5 μm), 二甲苯脱蜡、苏木精和伊红(H.E)染色, 二甲苯透明, 中性树胶封片, BM2000型显微系统观察并拍照.
2.4 基因表达水平分析用TRIzol试剂提取肠道组织总RNA, 经无RNase的DNA酶处理, 以去除混在RNA中的DNA.根据RevertAidTM First Strand cDNA Synthesis Kit操作手册合成第一链cDNA.qRT-PCR反应在CFX96 TouchTM Real-Time PCR Detection System上完成.炎症相关细胞因子和内参基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)引物见表 1.反应体系是:20 μL PCR反应液中包括2.0 μL 10倍稀释的cDNA模板, 10 μL GoTaq qPCR Master Mix, 0.4 μL上下游引物, 7.2 μL ddH2O.反应条件:94 ℃变性5 min, 94 ℃ 10 s, 58 ℃ 15 s, 72 ℃ 20 s进行45个循环后, 72 ℃延伸5 min.荧光定量PCR的数据用2-ΔΔCT法进行处理, 实验结果以实验组基因相对于对照组基因表达变化倍数表示.
表 1(Table 1)
| 表 1 荧光定量PCR扩增基因的引物 Table 1 The primers of genes used for quantitative real-time PCR analysis | |||||||||||||||||||||||||||||||||||||||
表 1 荧光定量PCR扩增基因的引物 Table 1 The primers of genes used for quantitative real-time PCR analysis
| |||||||||||||||||||||||||||||||||||||||
2.5 统计分析试验所有数据用SPSS 16.0软件处理, 每组数据结果用平均数±标准误差表示, 不同时间及不同浓度之间的差异采用多因素方差分析, 当p<0.05表示差异显著.
3 结果(Results)3.1 微囊藻毒素-LR对草鱼肠道显微结构的影响对照组草鱼肠道结构完好, 肠壁由粘膜层、粘膜下层、肌层和浆膜层组成, 肠绒毛连贯完整、排列整齐, 绒毛表面覆盖柱状细胞, 数量众多, 与杯细胞相间排列, 各细胞大小均匀一致;粘膜固有层结构完整, 无分离和充血症状(图 1a).25 μg·kg-1组草鱼在注射MC-LR 24 h后, 肠上皮细胞变化不明显(图 1b);48 h后, 可见粘膜固有层分离且有红细胞出现(图 1c);72 h和96 h后, 均可见微绒毛排列变得不规则, 肠上皮细胞排列紊乱, 粘膜固有层红细胞多见, 杯状细胞增多伴随淋巴细胞浸润(图 1d和1eE).75 μg·kg-1组草鱼在注射MC-LR 24 h后, 肠上皮细胞变化不明显(图 1f);48 h后, 粘膜固有层出现红细胞(图 1g);72 h后, 微绒毛排列紊乱, 粘膜固有层红细胞增多(图 1h);96 h后, 微绒毛排列更不规则, 粘膜固有层可见更多红细胞, 明显充血, 杯状细胞显著增多, 淋巴细胞浸润(图 1i).100 μg·kg-1组草鱼在注射MC-LR 24 h后即可见粘膜固有层红细胞增多(图 1j), 48 h后, 杯状细胞增多, 粘膜固有层分离(图 1k);72 h后, 粘膜固有层严重分离, 出现溶解性坏死, 微绒毛排列紊乱(图 1l), 96 h后, 可见肠上皮淋巴细胞严重浸润, 肠上皮微绒毛排列紊乱, 部分上皮细胞变性、坏死甚至脱落, 固有层分离且可见众多红细胞(图 1m).
图 1(Fig. 1)
 |
| 图 1 不同剂量MC-LR对草鱼肠道显微结构的影响 注:图 1a为对照组草鱼肠道结构;b~e为25 μg·kg-1对草鱼肠道结构的影响, 其中b、c、d、e分别代表 25 μg·kg-1处理24、48、72和96 h草鱼肠道的显微变化;f~i为75 μg·kg-1对草鱼肠道结构的影响, 其中f、g、h、i分别代表 75 μg·kg-1处理24、48、72和96 h草鱼肠道的显微变化;j~m为100 μg·kg-1对草鱼肠道结构的影响, 其中j、k、l、m分别代表 100 μg·kg-1处理24、48、72和96 h草鱼肠道的显微变化.其中, 黑色箭头表示红细胞增多, 圆形表示微绒毛排列无序, 星号表示粘膜固有层分离, 三角形表示杯状细胞增多, 白箭头表示细胞坏死. Fig. 1The effects of different dose of MC-LR on the histopathology of intestine in grass carp |
3.2 微囊藻毒素-LR对草鱼肠道炎症相关因子表达的影响3.2.1 微囊藻毒素-LR对草鱼肠道促炎性细胞因子mRNA水平的影响草鱼暴露于不同剂量MC-LR(25、75和100 μg·kg-1)不同时间后, 肠道IL-1β的mRNA相对表达结果如图 2a所示.分析结果表明, MC-LR诱导时间(24、48、72和96 h)对IL-1β mRNA水平的影响差异显著(F=17.320, p=0.000);MC-LR诱导剂量对其mRNA表达水平的影响差异亦显著(F=11.350, p=0.000), 且作用剂量和作用时间之间有交互作用(F=14.170, p=0.000).在MC-LR处理24 h后, 3个剂量处理组中IL-1β的mRNA转录水平均显著上调(p<0.05), 100 μg·kg-1 BW诱导组中IL-1β相对对照组表达量上升了5.44倍;48 h后, 25和100 μg·kg-1处理组与对照组相比, 表达显著上调(p<0.05);72和96 h后, 只有25 μg·kg-1处理组中IL-1β的mRNA表达量显著上升(p<0.05), 而75和100 μg·kg-1诱导组中IL-1β表达则下调, 且在96 h均呈现显著下调变化(p<0.05).
图 2(Fig. 2)
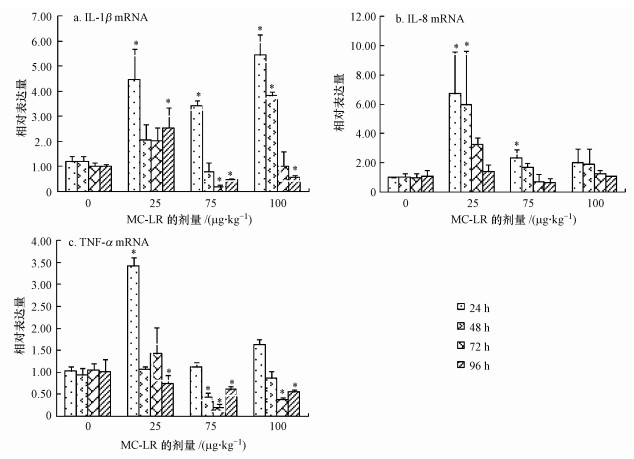 |
| 图 2 MC-LR对草鱼肠道促炎性细胞因子mRNA的影响 Fig. 2The effects of MC-LR on the pro-inflammatory cytokines mRNA levels of intestine in grass carp |
不同剂量MC-LR(25、75和100 μg·kg-1 BW)诱导草鱼不同时间后, 肠道IL-8的mRNA相对表达结果如图 2b所示.分析结果表明, 不同诱导时间(24、48、72和96 h)对IL-8 mRNA水平的影响差异显著(F=5.270, p=0.005);MC-LR剂量对其mRNA表达水平的影响差异也显著(F=12.038, p=0.000), 但作用剂量和作用时间之间无交互作用(F=1.692, p=1.32).此外, 分析发现, 仅25 μg·kg-1处理组中的IL-8 mRNA转录水平在处理24、48和72 h后与对照组相比表达量显著上升(p<0.05), 尤其是在诱导24 h后, 表达上调了6.72倍, 其他剂量组与对照组差异不显著(p>0.05).25 μg·kg-1处理组中IL-8在暴露不同时间后, 与对照组相比, 转录水平均显著上调(p<0.05), 其他剂量组在不同时间差异均不显著(p>0.05).
草鱼经不同剂量MC-LR(25、75和100 μg·kg-1 BW)诱导不同时间后, 肠道中TNF-α的mRNA相对表达结果如图 2c所示.分析结果表明, MC-LR诱导时间(24、48、72和96 h)对TNF-α mRNA水平的影响差异显著(F=21.515, p=0.000);MC-LR诱导剂量对其mRNA表达水平的影响差异也显著(F=19.475, p=0.000), 且作用剂量和作用时间之间有交互作用(F=12.125, p=0.000).25 μg MC-LR/kg BW草鱼在处理24 h后, TNF-α表达量显著上调(p<0.05), 而在处理96 h后与对照组相比表达量显著下调(p<0.05);75 μg·kg-1 BW草鱼在处理48、72和96 h后表达量显著下调(p<0.05), 100 μg ·kg-1 BW草鱼则在处理72和96 h后TNF-α mRNA水平亦显著下调(p<0.05).
3.2.2 微囊藻毒素-LR对草鱼肠道抗炎性细胞因子mRNA水平的影响草鱼经MC-LR诱导后, 肠道中IL-10的mRNA在不同剂量和不同时间的相对表达结果如3a所示.分析结果表明, MC-LR诱导不同时间(24、48、72和96 h)对IL-10 mRNA水平的影响差异显著(F=6.511, p=0.001);MC-LR诱导剂量对其mRNA表达水平的影响差异也显著(F=17.984, p=0.000), 并且作用剂量和作用时间之间有交互作用(F=2.243, p=0.045).25 μg·kg-1处理组中IL-10在处理24、48、72和96 h后, 与对照组相比, 转录水平均显著上调(p<0.05), 尤其在处理24 h后上调了3.64倍, 其他剂量组在诱导不同时间后差异均不显著(p>0.05).
草鱼肠道中TGF-β1的mRNA相对于对照组表达结果如图 3b所示.分析结果表明, MC-LR诱导不同时间(24、48、72和96 h)对TGF-β1 mRNA转录水平的影响无显著差异(F=0.285, p=0.836);MC-LR诱导剂量对其mRNA表达水平的影响也无显著差异(F=2.130, p=0.113), 且作用剂量和作用时间之间无交互作用(F=1.493, p=0.186).25 μg·kg-1诱导组草鱼在不同时间段与对照组相比, TGF-β1的mRNA转录均无显著差异, 75 μg·kg-1中的草鱼在处理72 h后与对照组相比显著下调(p<0.05), 而75 μg·kg-1BW草鱼在处理24 h后, TGF-β1的mRNA表达相对于对照组被显著抑制(p<0.05), 但其他时间段则表达变化无显著差异(p>0.05).
图 3(Fig. 3)
 |
| 图 3 MC-LR对草鱼肠道抗炎性细胞因子mRNA的影响 Fig. 3The effects of MC-LR on the anti-inflammatory cytokines mRNA levels of intestine in grass carp |
4 讨论(Discussion)MC-LR作为水体中常见且广泛存在的一种有毒物质, 研究其对鱼类的急慢性毒性效应是一项重要的基础工作.在污染物毒性测定和生物监测中经常采用急性毒性试验的方法研究有毒物质的毒性, 其中试验周期通常选择96 h, 这是标准和通用的试验方法(周永欣等, 1998).本研究采用急性毒性试验的方法研究了MC-LR对肠道的免疫毒性效应.肠道粘膜处于沟通机体内外环境的重要位置, 具有消化、吸收, 分泌和防御等重要功能(Press, 1999).MCs经口摄入后可侵蚀小肠黏膜上皮细胞和黏膜固有层屏障而被吸收(李莉等, 2014), 而最近的一项研究表明不管通过腹腔注射或是口服MC-LR, 鱼类的肠道对MC-LR均有亲和性(Trinchet et al., 2011).肠道作为鱼类黏膜免疫的重要组成部分, 为了进一步研究MC-LR对肠道的免疫毒性提供依据, 本研究采用腹腔注射的方法研究了MC-LR对草鱼肠道组织结构和炎症相关细胞因子表达的影响.显微结构实验结果发现即使低浓度的MC-LR(25 μg·kg-1)也可诱导肠道组织发生病变, 而随着MC-LR染毒剂量的增加及时间的延长, 高剂量组可使草鱼肠道组织发生充血、淋巴细胞浸润和杯状细胞数目先增加后减少以及微绒毛排列紊乱等病理现象.这些结果与其他****的研究比较类似, 如李莉等(2014)研究发现粗提MCs(相对于200 μg·kg-1)诱导银鲫(Carassius auratus)肠道病理损伤呈时间-剂量依赖性的增长, 在注射后24~48 h内, 可见肠上皮细胞排列紊乱, 结构破坏, 淋巴细胞浸润和杯状细胞数目显著增多, 并且淋巴细胞随着时间的推移逐渐向绒毛膜表面移动, 肠上皮绒毛膜甚至出现脱落和坏死.在急性经口毒性试验中, Atencio等(2008)通过光镜和电镜观察到丁鱥(Tinca tinca)肠上皮细胞空泡化、核固缩, 甚至微绒毛的丢失.此外, Trinchet等(2011)报道MC-LR可引起青鱂幼鱼消化道损伤, 主要表现为肠上皮细胞的连接丢失, 细胞溶解, 上皮细胞微绒毛破坏, 杯状细胞减少.以上研究表明MC-LR采用不同的染毒方式均可造成鱼类肠道组织结构损伤, 尽管淋巴细胞浸润可能与肠道粘膜层的免疫防御系统发挥了作用, 增加了免疫因子的分泌和吞噬作用, 但当MC-LR剂量太大, 超过了鱼体免疫防御能力, 仍可导致鱼体出现较严重的损伤.
细胞因子在调节免疫系统的免疫应答中起着重要作用, 其中IL-1β是生物机体对异物反应最快、作用最强的炎性细胞因子(Dinarello, 1997).Rymuszka等研究发现, 鲫鱼免疫细胞暴露在浓度为0.01和0.1 μg·mL-1的藻毒素中4或24 h后, IL-1β的基因表达量均增加(Rymuszka and Adaszek, 2012; 2013).本实验同样发现肠道中IL-1β在诱导24 h后表达显著上调, 但高剂量组(100 μg·kg-1)在诱导72和96 h后, 则显著下调, 这说明IL-1β对MC-LR的胁迫相应非常灵敏, 在早期反应阶段, MC-LR可促进炎症细胞因子的产生, 进而导致了机体炎症反应的发生, 但鱼体受到MC-LR高剂量和长时间胁迫后, 鱼体的免疫系统损伤严重, 抑制了免疫反应, 从而造成IL-1β表达下降.IL-8又称嗜中性粒细胞因子, 是炎症性疾病的重要介质, 在抗感染、免疫反应调节以及抗肿瘤方面有重要作用(Zimmermann et al., 2011).Li等(2013)在鳙鱼(Aristichthys nobilis)的实验中发现, MC-LR可促进IL-8表达的增加, 并呈现时间和剂量的关系.而本实验同样发现IL-8经不同剂量诱导不同时间后具有时间和剂量效应, 在诱导24和48 h后表达上调, 3个剂量的表达均增加, 但仅在25 μg·kg-1 BW诱导组中IL-8表达显著增加, 随着时间的延长, 表达呈现下降的趋势, 尽管在96 h表达量为对照组的1.38倍, 但差异已不显著.鱼类TNF-α作为一个在先天免疫和获得性免疫中发挥多种功能的炎性细胞因子, 通常在免疫刺激下由巨噬/单核细胞、T细胞、B细胞和NK细胞等多种细胞表达(Saeij et al., 2003; Grayfer and Belosevic, 2009; Wang et al., 2011).本研究中, MC-LR诱导草鱼后, TNF-α在25 μg·kg-1 BW剂量组诱导24 h后表达显著上升, 随后下降.然而Rymuszka等报道, 当银鲫暴露在浓度为0.01和0.1 μg·mL-1的藻毒素中4或者24 h, TNF-α的基因表达量则下降(Rymuszka and Adaszek, 2012; 2013).这说明在MC-LR刺激下, 低剂量短期内可大量合成并释放TNF-α, 当MC-LR的浓度超过了鱼体的承受阈值, 则鱼体的免疫机能受到抑制, 进一步抑制了TNF-α的表达.
IL-10和TGF-β1作为炎症抑制因子, 可抑制IL-1β、IL-8和TNF-α等的产生, 从而减轻组织炎症.本研究发现仅25 μg·kg-1BW处理组中IL-10在诱导24、48、72和96 h, 表达水平均显著上调(p<0.05), 而高剂量组IL-10的产生量则较低, 同样, 经不同剂量MC-LR诱导后, 草鱼肠道中TGF-β1的产生量降低, 尽管25 μg·kg-1剂量组中TGF-β1的表达会升高, 但与对照组相比差异并不显著, 但75 μg·kg-1 BW剂量组中TGF-β1在诱导72 h后表达显著下降, 100 μg·kg-1 BW剂量组中TGF-β1则在24 h后表达显著下降, 而其他均无显著差异.以上研究表明草鱼经MC-LR诱导后, 促炎性细胞因子IL-1β、IL-8和TNF-α表达上调加重了肠道黏膜的炎性反应和组织损伤, 而抗炎性细胞因子IL-10和TGF-β1等则通过抑制上述众多环节来发挥保护效应, 但由于高剂量及长时间MC-LR的诱导抑制了机体IL-10和TGF-β1的产生, 导致促炎性细胞因子和抗炎性细胞因子的失衡造成了肠黏膜组织的损伤, 进而影响整个肠黏膜免疫效应.
5 结论(Conclusions)MC-LR对肠道的急性免疫毒性主要表现为肠黏膜结构的破坏及产生炎性反应, 且MC-LR对肠道组织结构的损伤呈现剂量和时间效应.由于慢性毒性的实验周期较长、耗资较大、操作困难等原因, 目前MC-LR对鱼类的慢性毒性效应的研究数据非常有限.在今后的研究中, 我们将着重研究MC-LR对鱼类的慢性免疫毒性效应机制, 为MC-LR的风险评估及防治奠定基础.
参考文献
| Atecio L, Moreno I, Jos A, et al. 2008. Dose dependent antioxidant responses and pathological changes in tenca (Tinca tinca) after acute oral exposure to microcystis under laboratory conditions[J]. Toxicon, 52(1): 1–12.DOI:10.1016/j.toxicon.2008.05.009 |
| Chen C Y, Liu W J, Wang L, et al. 2016. Pathological damage and immunomodulatory effects of zebrafish exposed to microcystin-LR[J]. Toxicon, 118: 13–20.DOI:10.1016/j.toxicon.2016.04.030 |
| Dinarello C A. 1997. Interleukin-1[J]. Digestive Diseases and Sciences, 8: 253–265. |
| Fu W, Chen J P, Wang X M, et al. 2005. Altered expression of p53, Bcl-2 and bax induced by icrocystin-LR in vivo and in vitro[J]. Toxicon, 46(2): 171–177.DOI:10.1016/j.toxicon.2005.03.021 |
| Grayfer L, Belosevic M. 2009. Molecular characterization, expression and functional analysis of goldfish (Carassius aurutus L.) interferon gamma[J]. Developmental and Comparative Immunology, 33(2): 235–246.DOI:10.1016/j.dci.2008.09.001 |
| 金伯泉. 2001. 细胞和分子免疫学[M]. 北京: 科学出版社. |
| Kim S K, Barron L, Hinck C S, et al. 2017. An engineered transforming growth factor β (TGF-β) monomer that functions as a dominant negative to block TGF-β signaling[J]. Journal of Biological Chemistry, 292(17): 7173–7188.DOI:10.1074/jbc.M116.768754 |
| 李莉, 雷和花, 候杰, 等. 2014. 微囊藻毒素在银鲫肠道中的累积及其病理学影响[J]. 生态毒理学报, 2014, 9(6): 1189–1196. |
| Li H, Cai Y, Xie P, et al. 2013. Identification and expression profiles of IL-8 in bighead carp (Aristichthys nobilis) in response tomicrocystin-LR[J]. Archives of Environmental Contamination and Toxicology, 65(3): 537–545.DOI:10.1007/s00244-013-9910-8 |
| Liu N, Chen R, Du H, et al. 2009. Expression of IL-10 and TNF-alpha in rats with cerebral infarction after transplantation with mesenchymal stem cells[J]. Cellular & Molecular Immunology, 6(3): 207–213. |
| Luckenbach T, Fischer S, Sturm A. 2014. Current advances on ABC drug transporters in fish[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 165: 28–52. |
| Luukkainen R, Namikoshi M, Sivoven K, et al. 1994. Isolaiton and identification of 12 microcystins from strains and two bloom samples of Microcystis spp.:structure of a new hepatotoxin[J]. Toxicon, 32: 133–139.DOI:10.1016/0041-0101(94)90030-2 |
| MacKintosh C, Beattie K A, Klumpp S, et al. 1990. Cyanobacterial microcystin-LR is a potent and specific inhibitor of protein phosphatases 1 and 2A from both mammals and higher plants[J]. FEBS Letters, 264(2): 187–192.DOI:10.1016/0014-5793(90)80245-E |
| Paulina S, Bozena B, Jaromir M, et al. 2006. Damage of cell membrane and antioxidative system in human erythrocytes indubated with microcystin-LR in vitro[J]. Toxicon, 47(4): 387–397.DOI:10.1016/j.toxicon.2005.12.006 |
| Press C M. 1999. The morphology of the immune system in teleost fishes[J]. Fish and Shellfish Immunology, 9(4): 309–318.DOI:10.1006/fsim.1998.0181 |
| Puddick J, Prinsep M R, Wood S A, et al. 2014. High levels of structural diversity observed in microcystins from Microcystis CAWBG11 and characterization of six new microcystin congeners[J]. Marine Drugs, 12(11): 5372–5395.DOI:10.3390/md12115372 |
| Rombout J, Berg A. 1989. Immunological importance of the second gut segment of carp. Ⅰ. Uptake and processing of antigens by epithelial cells and macrophages[J]. Journal of Fish Biology, 35(1): 13–22.DOI:10.1111/jfb.1989.35.issue-1 |
| Rymuszka A, Adaszek L. 2012. Pro-and anti-inflammatory cytokine expression in carp blood and head kidney leukocytes exposed to cyanotoxin stress-an in vitro study[J]. Fish & Shellfish Immunology, 33(2): 382–388. |
| Rymuszka A, Adaszek L. 2013. Cytotoxic effects and changes in cytokine gene expression induced by microcystin-containing extract in fish immune cells-an in vitro and in vivo study[J]. Fish & Shellfish Immunology, 34: 1524–1532. |
| Rymuszka A. 2013. Microcystin-LR induces cytotoxicity and affects carp immune cells by impairment of their phagocytosis and the organization of the cytoskeleton[J]. Journal of Applied Toxicology, 33(11): 1294–1302. |
| Saeij J P, de Dries B J, Wiegertjes G F. 2003. The immune response of carp to Trypano plasma borreli:kinetics of immune gene expression and polyclonal lymphocyte activation[J]. Developmental and Comparative Immunology, 27(10): 859–874.DOI:10.1016/S0145-305X(03)00083-1 |
| Secombes C, Wang T, Hong S, et al. 2001. Cytokines and innate immunity of fish[J]. Developmental and Comparative Immunology, 25(8): 713–723. |
| Strober W, Fuss I J, Blumberg R S. 2002. The immunology of mucosal models of inflammation[J]. Annual Review of Immunology, 20(1): 495–549.DOI:10.1146/annurev.immunol.20.100301.064816 |
| Trinchet I, Djediat C, Huet H, et al. 2011. Pathological modifications followings sub-chronic exposure of medaka fish (Oryzias latipes) to microcystin-LR[J]. Reproductive Toxicology, 32(3): 329–340.DOI:10.1016/j.reprotox.2011.07.006 |
| Wang W L, Liu W, Gong H Y, et al. 2011. Activation of cytokine expression occurs through the TNFα/NF-κB-mediated pathway in birnavirus-infected cells[J]. Fish & Shellfish Immunology, 31(1): 10–21. |
| Wei L L, Sun B J, Chang M X, et al. 2009. The effects of cyanobacterial toxin microcystin-LR on the transcription of immune-related genes in grass carp (Ctenopharyngodon idella)[J]. Environmental Biology of Fishes, 85(3): 231–238.DOI:10.1007/s10641-009-9488-1 |
| Yoshie O, Imai T, Nomiyama H. 2001. Chemokines in immunity[J]. Advances in Immunity, 78: 57–110.DOI:10.1016/S0065-2776(01)78002-9 |
| 周永欣, 章宗涉. 1989. 水生生物毒性试验方法[M]. 北京: 农业出版社. |
| Zhan L, Sakamoto H, Sakuraba M, et al. 2004. Genotoxicity of microcystin-LR in human lymphoblastoid TK6 cells[J]. Mutation Research, 557(1): 1–6. |
| Zimmermann H W, Seidler S, Gassler N, et al. 2011. Interleukin-8 is activated in patients with chronic liver diseases and associated with hepatic macrophage accumulation in human liver fibrosis[J]. PLos One, 6(6): e21381.DOI:10.1371/journal.pone.0021381 |
