 , 吕小凡, 陈海, 王震, 杨琦
, 吕小凡, 陈海, 王震, 杨琦

中国地质大学(北京)水资源与环境工程北京市重点实验室, 中国地质大学(北京)地下水循环与环境演化教育部重点实验室, 北京 100083
收稿日期: 2017-05-14; 修回日期: 2017-06-13; 录用日期: 2017-06-13
基金项目: 北京市产学研项目(No.51900265005);国家科技重大专项(No.2009ZX07207-008,2009ZX07419-002,2009ZX07207-001,2015ZX07406005-001);中央高校基本科研业务费专项资金(No.2652013101,2652013086,2652013087);重点防控重金属汞、铬、铅、镉、砷便携/车载/在线监测仪器开发与应用示范项目(No.2012YQ060115)
作者简介: 杨慧(1994-), 女, E-mail:983748414@qq.com
通讯作者(责任作者): 杨琦, E-mail:yq@cugb.edu.cn
摘要: 实验采用共沉淀法制得CeO2负载型双金属Pd/Fe催化剂,并对催化剂的结构特征进行了X射线衍射(XRD)和扫描电子显微镜(SEM)分析.使用负载型双金属催化剂对四氯化碳进行还原脱氯研究,探究了温度、溶液初始pH值、催化剂投加量及不同钯载率对四氯化碳脱氯的影响;对比了不同催化剂包括纳米零价铁、纳米钯铁双金属和CeO2负载型双金属Pd/Fe对四氯化碳的脱氯效果.实验结果表明负载型双金属催化剂在温度为40℃,溶液初始pH为6.5,催化剂投加量为0.4 g·L-1,钯载率为0.5%的条件下,对初始浓度为5 mg·L-1的四氯化碳的去除率高达99.88%.在相同的反应条件下,纳米零价铁和纳米钯铁双金属对四氯化碳的脱氯率分别为58.25%、87.94%.此外,对四氯化碳的脱氯机制进行了探讨.
关键词:四氯化碳纳米零价铁纳米钯二氧化铈
Reductive dechlorination of carbon tetrachloride by CeO2 supported bimetallic Pd/Fe catalyst
YANG Hui
 , Lü Xiaofan, CHEN Hai, WANG Zhen, YANG Qi
, Lü Xiaofan, CHEN Hai, WANG Zhen, YANG Qi

Beijing Key Laboratory of Water Resources & Environmental Engineering, China University of Geosciences(Beijing), MOE Key Laboratory of Groundwater Circulation and Environmental Evolution, China University of Geosciences(Beijing), Beijing 100083
Received 14 May 2017; received in revised from 13 June 2017; accepted 13 June 2017
Supported by the Industry University Research Project in Beijing (No.51900265005), the National Major Science and Technology Program for Water Pollution Control and Management(No.2009ZX07207-008, 2009ZX07419-002, 2009ZX07207-001, 2015ZX07406005-001), the Fundamental Research Funds for the Central Universities(No.2652013101, 2652013086, 2652013087)and the Focus on the Prevention and Control of Heavy Metal Mercury, Chromium, Lead, Cadmium, Arsenic Portable/Vehicle/Online Monitoring Instrument Development and Application Demonstration(No.2012YQ060115)
Biography: YANG Hui(1994-), female, E-mail:983748414@qq.com
*Corresponding author: YANG Qi, E-mail:yq@cugb.edu.cn
Abstract: The CeO2 supported bimetallic Pd/Fe catalyst was prepared by coprecipitation method and characterized by X ray diffraction (XRD) and scanning electron microscopy (SEM).The reductive dechlorination of carbon tetrachloride by supported bimetallic catalyst, and the effects of initial pH, temperature, dosage of catalyst and different palladium loading rate on the removal of carbon tetrachloride were investigated. Furthermore, removal abilities of different catalysts including nano zero-valent iron, nano bimetallic Pd/Fe and CeO2 supported bimetallic Pd/Fe catalyst were compared. Results showed that at pH=6.5 and 40℃, the removal efficiency can reach 99.88% when concentration of carbon tetrachloride and CeO2 supported bimetallic Pd/Fe catalyst was 5 mg·L-1 and 0.4 g·L-1, respectively. Under the same reaction conditions, removal efficiency of nano zero-valent iron and nano bimetallic Pd/Fe were 58.25%, 87.94%, respectively. In addition, the dechlorination mechanism was also discussed.
Key words: carbon tetrachloridenano zero-valent ironpalladiumcerium dioxide
1 引言(Introduction)四氯化碳(Carbon Tetrachloride,CT)是常用的工业原料及有机溶剂,曾广泛用于制革、制药、化工等领域(陈静等,2016).由于四氯化碳易挥发、难降解,且具有生物毒性,一旦进入环境容易造成大气、水体及土壤的污染(梁峙等,2014;张军等,2015).目前,许多省份的地下水、土壤甚至某些城市的供水体系中有污染物CT检出(韩宝平等,2004;项玮等,2007).而且,已有文献报道四氯化碳具有“三致”效应(陶宏林等,2011),容易被人类皮肤、黏膜吸收,对人体健康造成不可逆的危害.因此,四氯化碳的治理尤为重要.
自1994年Gillham等提出利用零价金属还原性脱氯处理有机氯化物以来,该技术成为了一个活跃的研究领域.研究者们通过研究比较铁、锌、铝等多种零价金属,发现零价铁不仅成本低、易获取且脱氯效果相对最佳.因此,越来越多的研究者们利用零价铁去除各种有机氯化物,如三氯乙烯(Xiu et al., 2010)、四氯乙烯(Balazova et al., 2006)、氯乙酸(Chen et al., 2008)、多氯联苯(何娜等,2008)等.随着对零价铁研究的不断深入,研究者们也发现零价铁还原存在着一些问题,如零价铁对某些氯化物反应性不高,降解不完全,甚至还会生成毒性更强的中间产物;在反应过程中,铁表面容易被氧化形成金属氧化物或者金属碳酸盐的钝化层,阻碍了反应继续进行(童少平等,2005).为了改善金属铁的反应活性,研究者们通过大量的实验发现:引入第2种金属如钯(Pd)、镍(Ni)、铜(Cu)等与零价铁组成双金属体系(Pd/Fe、Ni/Fe、Cu/Fe等)可以提高反应速率(高树梅等,2007).其中钯(Pd)是一种优良的加氢催化剂,对H2有较好的吸附性能,并且能够将吸附在其表面的H2快速分解为还原性更强的·H.目前,利用Pd/Fe双金属体系降解有机氯化物应用广泛,其中包括Pd/Fe双金属还原2, 4-二氯酚(王猛等,2012)、六氯乙烷(吴双桃等,2007)、一氯乙酸(陈超等,2009)等.Choi等(2007)还研究了双金属和金属铁对2, 4, 6-三氯苯酚的还原,通过比较发现Pd/Fe双金属的反应速率是金属铁的多倍,且产生的中间含氯产物较少.然而,由于铁颗粒间具有磁性引力作用,导致纳米钯铁或者其他铁基双金属颗粒的制备过程中很容易发生团聚,使颗粒粒径增加,比表面积减小,从而会减少参与反应的活性位点(李芳等,2010),影响其对氯代有机物的去除效率.为了进一步解决纳米颗粒团聚的问题,研究者们尝试将纳米颗粒负载在某些载体上,如沸石(Christoforidis et al., 2010)、金属氧化物(Hildebrand et al., 2009)等.其中CeO2是一种性质稳定,具有多晶结构的稀土氧化物,经常作为贵金属的载体来增强材料催化性能(潘湛昌等,2004;刘子恩等,2015).
本实验引入CeO2作为载体,制备了CeO2负载型双金属Pd/Fe催化剂,并以CT为靶污染物,研究了温度、溶液初始pH值、催化剂投加量、钯载率等因素对其脱氯效果的影响.此外,还对3种不同催化剂的脱氯效果进行了比较.
2 材料与方法(Materials and methods)2.1 试剂和仪器实验试剂:六水合碳酸铵((NH4)2CO3·6H2O)、六水合硝酸铈(Ce(NO3)3·6H2O)、六氯钯酸钾(Na2PdCl4)、七水合硫酸亚铁(FeSO4·7H2O)、硼氢化钠(NaBH4)、铁粉(Fe)、盐酸(HCl)、聚乙二醇4000(PEG 4000)、乙醇、四氯化碳等.以上试剂均为分析纯.
实验仪器:GC-2014气相色谱仪,LGJ-10冷冻干燥机,D40-2F型电动搅拌机,BT100-1J蠕动泵驱动器,pH仪,FA1004分析天平,TDL-5离心机,SHA-B恒温水浴振荡器,HH-S数显恒温水浴锅,ZEISSJSM-6480LV扫描电镜
2.2 催化剂的制备2.2.1 CeO2的制备参考相关文献(杨振华,2004),在温度为40 ℃的条件下,向四口圆底烧瓶中加入浓度为0.1 mol·L-1的Ce(NO3)3·6H2O和4 g·L-1的聚乙二醇4000溶液100 mL,将浓度为0.1 mol·L-1的(NH4)2CO3·6H2O作为沉淀剂快速加入到圆底烧瓶中(Ce(NO3)3·6H2O和(NH4)2CO3·6H2O的摩尔比为2:3)并保持搅拌,反应10 min后生成前驱体,反应原理如下:
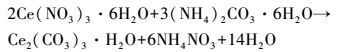 | (1) |
2.2.2 纳米零价铁(nZVI)的制备用液相还原法制备纳米零价铁.反应在室温下进行,向四口圆底烧瓶中加入浓度为0.04 mol·L-1的FeSO4·7H2O溶液100 mL,并持续通氮气15 min以去除溶液中的氧气,随后将100 mL浓度为0.2 mol·L-1的NaBH4溶液通过蠕动泵以25 r·min-1的转速滴入圆底烧瓶中,持续通入氮气并搅拌.反应生成纳米零价铁,反应原理如下(Glavee et al., 1995):
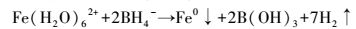 | (2) |
2.2.3 CeO2负载型双金属Pd/Fe催化剂的制备向四口圆底烧瓶中加入一定浓度的六氯钯酸钾溶液(400 mg·L-1),并通入氮气曝气10 min,随后加入适量的纳米零价铁,持续通入氮气并搅拌50 min后加入一定量的CeO2,继续搅拌至溶液上清液由橘红色变为透明(孙正男等,2015).静置沉淀后用去离子水洗涤3~5遍,再用无水乙醇洗涤2遍,经冷冻干燥后得到黑色固体粉末即为CeO2负载型双金属Pd/Fe颗粒.
2.3 实验方法配制400 mg·L-1的四氯化碳储备液,向盛有100 mL去离子水(经曝气处理)的反应瓶中加入一定量的CeO2负载型Pd/Fe催化剂和四氯化碳储备液,并立即用丁基塞与铝盖密封,将上述具有一定浓度污染物和催化剂的混合反应液置于摇床中,转速为150 r·min-1.设置不同的反应条件,包括催化剂的投加量、溶液初始pH值、温度、催化剂的钯载率及不同催化剂体系,并在开始反应后的0、5、8、15、30、50 min分别取样.
2.4 分析方法污染物浓度使用日本津岛公司GC-2014气相色谱仪进行检测,检测器为ECD,色谱柱为Rtx-1石英毛细柱(美国Restek, 30 m×0.25 mm×0.25 μm),进样口温度为220 ℃,检测器温度为320 ℃.鉴于目标污染物具有较强的挥发性,进样方式采用顶空进样.用注射器抽取1 mL的样品,并通过0.22 μm的聚四氟乙烯滤膜过滤注入盛有9 mL去离子水的顶空瓶中,用丁基塞与铝盖密封待.将封口的顶空瓶置于60 ℃恒温水浴锅中平衡1 h后手动进样.
催化剂表征:催化剂的晶型是用Bruker D8型X射线衍射仪进行测定.辐射源是CuKα(λ=0.154056 nm),扫描范围2θ=10°~80°,管电压40 kV,管电流40 mA,扫描速率为8°·min-1,步长是0.02°.扫描电子显微镜(SEM)是利用聚焦电子束在催化剂表面逐点扫描成像.采用JSM-7500型扫描电子显微镜观察催化剂表面形貌和微观形态.
3 结果与讨论(Results and discussion)3.1 CeO2负载型双金属Pd/Fe催化剂的表征对实验制备的CeO2负载型双金属Pd/Fe催化剂进行了X-射线衍射(XRD)及扫描电镜(SEM)分析,图 1中由下至上依次为实验制备纳米零价铁(nZVI)、纳米Pd/Fe双金属、CeO2负载型双金属Pd/Fe催化剂的X-射线衍射(XRD)谱图.在2θ=44.76°时,nZVI出现一个较弱的衍射峰,经过与铁的标准衍射图样对比,该峰与铁的110面衍射对应(冯婧微等,2013),由于其具有较大的比表面积和较高的反应活性,暴露在空气中极易被氧化,在2θ=35.42°出现Fe3O4的衍射峰,与之前文献报道结果一致(陈超等,2009).图中没有出现明显钯的衍射峰,这是由于该催化剂中钯的含量较少,仅有0.5%.在2θ=28.73°、33.27°、47.57°、56.46°及78°附近出现CeO2的衍射峰,图中的4个衍射峰(2θ=28.73°、33.27°、47.57°、56.46°)分别与CeO2的111、200、222、311晶面对应(潘湛昌等,2004),表明CeO2颗粒为立方多晶结构.
图 1(Fig. 1)
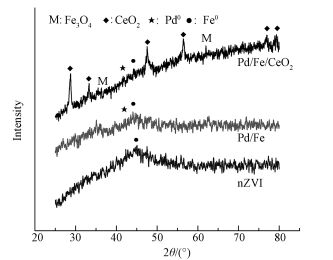 |
| 图 1 CeO2负载型双金属Pd/Fe催化剂的XRD Fig. 1XRD of CeO2 supported bimetallic Pd/Fe catalyst |
图 2a、2b依次为纳米Pd/Fe双金属颗粒及CeO2负载型双金属Pd/Fe颗粒的扫描电镜图,由图可看出纳米铁为直径100~200 nm的光滑球状,纳米钯同为球状直径约为50~100 nm搭载在铁的表面.图 2a中纳米铁表面的颗粒较大,这是由于纳米钯在铁表面发生了局部团聚现象,而图 2b中由于负载了CeO2颗粒,有效提高了纳米钯的分散性,抑制了钯的团聚(雷彬等,2015),CeO2负载型双金属Pd/Fe呈现出链状且钯颗粒在铁表面分散均匀.
图 2(Fig. 2)
 |
| 图 2 纳米Pd/Fe颗粒(a)和CeO2负载型双金属Pd/Fe催化剂(b)的SEM Fig. 2SEM image of nano bimetallic Pd/Fe(a) and CeO2 supported bimetallic Pd/Fe catalyst |
3.2 溶液初始pH值对降解CT的影响在温度为30 ℃,催化剂投加量为0.4 g·L-1,污染物初始浓度为5 mg·L-1,钯载率为0.5%,溶液初始pH值分别为3、6.5、7、8.5、10的条件下进行了批实验.结果如图 3所示.
图 3(Fig. 3)
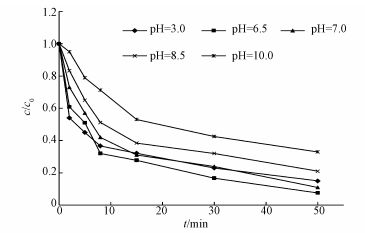 |
| 图 3 不同pH对CeO2负载型双金属Pd/Fe降解CT的影响 Fig. 3Performanceof CTdegradation by CeO2 supported bimetallic Pd/Fe catalyst under different pH |
不同pH值对CeO2负载型双金属Pd/Fe催化剂降解CT的去除率的影响顺序为pH=6.5>pH=7.0>pH=3.0>pH=8.5>pH=10.0.这是由于碱性环境中催化剂表面容易生成金属氢氧化物,形成钝化层阻碍反应的继续进行,还原脱氯反应受到抑制(陈超等,2009).在酸性条件下,纳米铁极易被腐蚀,导致钯金属从铁表面分离,从而使得催化剂活性降低.此外,纳米铁在酸性溶液中反应产生大量的氢气以微小气泡附着在铁表面,会减少CT与催化剂的有效接触面积,从而降低了CT去除率(Graham,1999;Jovanovic et al., 2005).
3.3 催化剂的投加量对降解CT的影响在温度为30 ℃,污染物初始浓度为5 mg·L-1,钯载率为0.5%,溶液初始pH值为7,催化剂投加量分别为0.1、0.2、0.3、0.4 g·L-1的条件下进行了批实验.图 4中显示出不同的催化剂用量对去除CT的影响,随着催化剂投加量的增加,CT的去除率也越来越高,且去除率分别为72.11%、75.59%、85.41%、94.23%.这是由于在反应过程中,负载型催化剂投加量的增加使得反应中活性位点数量增多,从而提高CT的去除率(Nurmi et al., 2005).由实验结果可得催化剂最佳投加量为0.4 g·L-1.
图 4(Fig. 4)
 |
| 图 4 不同催化剂投加量时CeO2负载型双金属Pd/Fe对降解CT的影响 Fig. 4Performance of CT degradation by CeO2 supported bimetallic Pd/Fe catalyst under different dosage |
3.4 不同钯载率对降解CT的影响在溶液初始pH为7.0,温度为30 ℃,催化剂投加量为0.4 g·L-1,污染物初始浓度为5 mg·L-1,钯含量分别为0.05%、0.1%、0.5%、1%的条件下,通过50 min内催化剂对CT脱氯率的变化,研究钯载率对其还原脱氯的影响.结果如图 5所示,钯载率从0.05%增加到1%时,催化剂对CT的去除率分别为58.89%、73.42%、97.71%、99.87%.随着催化剂中钯含量的增多,其催化效果越来越好.这是因为铁表面负载的钯金属为·H的形成及活化提供媒介(王向宇等,2009),钯含量越大可以产生较多的·H同时提供更多的活性点位,使CT的脱氯效果越好.且当钯载率为0.5%和1%时,反应速率和最终的CT去除率相差不大,出于经济考虑,本实验选择最优钯载率为0.5%.
图 5(Fig. 5)
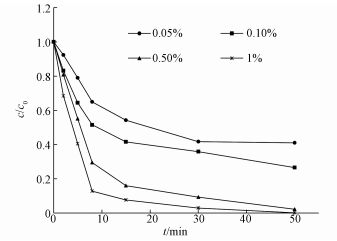 |
| 图 5 不同钯载率的CeO2负载型双金属Pd/Fe对降解CT的影响 Fig. 5Performanceof CT degradation by CeO2 supported bimetallic Pd/Fe catalyst under different palladium loading |
3.5 温度对降解CT的影响在CT初始浓度为5 mg·L-1、溶液初始pH值为7、催化剂投加量为0.4 g·L-1的条件下,取5个不同温度(10、20、30、35、40 ℃)进行实验,实验结果如图 6a所示,CeO2负载型双金属Pd/Fe催化剂对CT有着明显的去除效率,在相同的反应条件下,温度由10 ℃变化到40 ℃,CT的还原脱氯速率和去除率均逐渐增加.温度为10 ℃和20 ℃时的CT去除率分别为25.74%、50.06%.温度在30~40 ℃范围内的CT的去除率相差不大,但反应速率有明显变化,40 ℃时速率最快.还原脱氯反应可以用一级动力学描述,结果如图 6b所示.且不同温度下的速率常数k值如表 1所示.温度对脱氯反应的影响可以用公式(3)来表示:
图 6(Fig. 6)
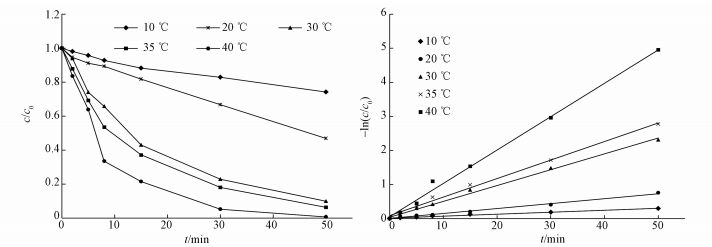 |
| 图 6 不同温度下CeO2负载型双金属Pd/Fe降解CT的影响(a)和动力学模拟(b) Fig. 6Performanceof CT degradation(a) and dynamics simulation of CT degradation(b) by CeO2 supported bimetallic Pd/Fe catalyst under different temperature |
表 1(Table 1)
| 表 1 CT降解动力学参数 Table 1 Results of kinetic parameters for CT degradation | ||||||||||||||||||||||||
表 1 CT降解动力学参数 Table 1 Results of kinetic parameters for CT degradation
| ||||||||||||||||||||||||
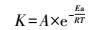 | (3) |
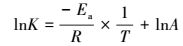 | (4) |
 | (5) |
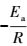
图 7(Fig. 7)
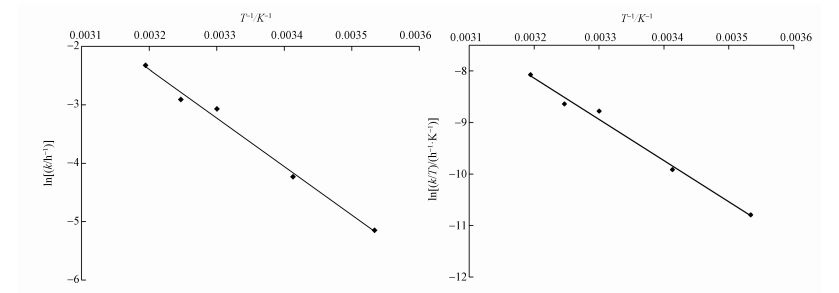 |
| 图 7 CT降解的热力学分析(a.lnk-T拟合曲线, b.ln(k/T)-T拟合曲线) Fig. 7Thermodynamic analysis of the degradation of CT(a.lnk-T, b.ln(k/T)-T) |
表 2(Table 2)
| 表 2 CT降解热力学参数 Table 2 Results of activation thermodynamics for CT degradation | ||||||||||||||||||||||||||||||||||||
表 2 CT降解热力学参数 Table 2 Results of activation thermodynamics for CT degradation
| ||||||||||||||||||||||||||||||||||||
3.6 不同催化剂对降解CT的影响实验研究了在温度为40℃,CT初始浓度为5 mg·L-1,溶液初始pH值为6.5的条件下,不同催化剂对CT的脱氯影响,包括纳米零价铁、CeO2、纳米Pd/Fe双金属及CeO2负载型双金属Pd/Fe,催化剂投加量均为0.4 g·L-1,其中纳米Pd/Fe及CeO2负载型Pd/Fe的钯载率均为0.5%.结果如图 8所示,在相同的反应时间内,纳米零价铁对CT的去除率为58.25%.通过浸渍钯金属nZVI的反应活性大幅提高,脱氯率为87.94%,这是由于钯金属作为催化剂降低了活化能,产生了更多的作为还原剂的活性·H.CeO2对CT没有明显的作用,而CeO2负载型双金属Pd/Fe几乎可以完全降解CT,去除率可达99.88%.刘子恩等(2015)研究表明CeO2作为载体在空间上对贵金属附着产生限制,抑制贵金属发生团聚且防止其发生二次长大形成大颗粒,还可以改善反应溶液中贵金属浸出现象.此外,CeO2的多晶立方结构为反应提供更多的活性点位,从而显著提高了催化剂的催化活性,CeO2负载型双金属Pd/Fe与纳米钯铁双金属相比对CT的去除率提高了10%以上.
图 8(Fig. 8)
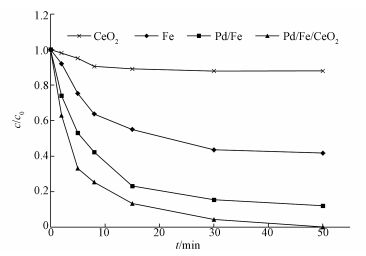 |
| 图 8 不同催化剂对降解CT的影响 Fig. 8Performanceof CT degradation by different catalysts |
近年来,利用还原性零价金属或双金属去除CT的研究十分广泛,包括利用零价铁还原脱氯,如揣小明等(2008)利用酸洗后的零价铁降解CT,反应24 h后,CT去除率达92.13%;利用双金属还原脱氯,如陶宏林等(2011)用Cu/Fe双金属去除CT,在反应9 h后CT去除率达94.33%;黄园英等(2014)用Ni/Fe双金属去除CT,在反应进行0.5 h时CT去除率达90%.本文中制备的CeO2负载型双金属Pd/Fe对CT的脱氯,在反应进行50 min后,去除率达99.88%,反应速率和CT去除率都有明显提升.
3.7 CT降解机制在CT的还原脱氯反应中,铁在反应中作为电子供体提供电子,溶液中氢离子得电子变为还原性氢,在反应中负责脱氯和氢化.而钯金属为氢的形成、活化以及游离氢原子的形成提供了一种媒介,增加了催化剂的活性.CeO2做为一种载体来协助钯金属在铁表面的分散,抑制钯的团聚,增大了催化剂表面积,提高催化剂在还原反应中的稳定性和使用寿命.
反应系统中存在3种主要的还原剂,铁金属、铁被腐蚀得到的亚铁离子及氢原子(李智灵等,2008).污染物CT在催化剂表面直接或间接被还原.直接还原:①CT在铁的表面直接获取电子被还原,金属铁作为还原剂;②金属铁进一步的腐蚀使得溶液中出现亚铁离子,Kle?ka(1984)、Doong(1992)等研究结果表明存在于溶液中的亚铁离子虽然脱氯缓慢,但其仍具有一定的还原性.反应原理如方程(6)和(7)所示.即使没有钯金属的存在,上述两种反应途径仍存在.
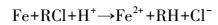 | (6) |
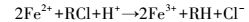 | (7) |
 | (8) |
4 结论(Conclusions)1) 采用共沉淀方法成功制备CeO2负载型双金属Pd/Fe催化剂,并且用于CT的还原脱氯.通过引入CeO2作为载体,大大提升了纳米双金属Pd/Fe的反应活性.
2) XRD和SEM结果表明CeO2可以显著改善纳米颗粒的分散性.CeO2不仅增强了催化剂活性,同时提高了催化剂在还原反应中的稳定性.
3) 在最优条件下:温度为40 ℃,溶液初始pH为6.5,催化剂投加量为0.4 g·L-1,钯载率为0.5%降解5 mg·L-1的CT,去除率高达99.88%.
参考文献
| Amonette J E, Workman D J, Kennedy D W, et al. 2000. Dechlorination of carbon tetrachloride by Fe(Ⅱ) associated with goethite[J]. Environmental Science & Technology, 34(21): 4606–4613. |
| Balá?ová A, Slodi?ka M, Keer R V. 2006. Parameter determination for reductive dechlorination of chlorinated solvents[J]. Transport in Porous Media, 65(3): 411–424.DOI:10.1007/s11242-006-0001-4 |
| Barnes R J, Riba O, Gardner M N, et al. 2010. Optimization of nano-scale nickel/iron particles for the reduction of high concentration chlorinated aliphatic hydrocarbon solutions[J]. Chemosphere, 79(4): 448–454.DOI:10.1016/j.chemosphere.2010.01.044 |
| Chen C, Wang X, Chang Y, et al. 2008. Dechlorination of disinfection by-product monochloroacetic acid in drinking water by nanoscale palladized iron bimetallic particle[J]. Journal of Environmental Sciences, 20(8): 945–951.DOI:10.1016/S1001-0742(08)62191-9 |
| Choi J H, Kim Y H, Sang J C. 2007. Reductive dechlorination and biodegradation of 2, 4, 6-trichlorophenol using sequential permeable reactive barriers:Laboratory studies[J]. Chemosphere, 67(8): 1551–1557.DOI:10.1016/j.chemosphere.2006.12.029 |
| Christoforidis K C, Louloudi M, Deligiannakis Y. 2010. Complete dechlorination of pentachlorophenol by a heterogeneous SiO2-Fe-porphyrin catalyst[J]. Applied Catalysis B Environmental, 95(3): 297–302. |
| Cheng I F, Fernando Q, Korte N. 1997. Electrochemical dechlorination of 4-chlorophenol to phenol[J]. Environmental Science & Technology, 31(4): 1074–1078. |
| 陈静, 陈海, 金歆, 等. 2017. 纳米零价铁降解水中四氯化碳的试验研究[J]. 环境科学学报, 2017, 37(2): 610–616. |
| 陈超, 王向宇, 常影, 等. 2009. 纳米钯/铁双金属颗粒对一氯乙酸的脱氯[J]. 材料科学与工艺, 2009, 17(4): 535–538. |
| 董玉明, 吴丽娜, 贺爱珍, 等. 2012. 二氧化铈纳米催化剂的制备及臭氧化应用[J]. 环境科学与技术, 2012, 35(12): 212–214.DOI:10.3969/j.issn.1003-6504.2012.12.044 |
| Farrell J, Kason M, Melitas N, et al. 2000. Investigation of the Long-Term Performance of Zero-Valent Iron for Reductive Dechlorination of Trichloroethylene[J]. Environmental Science & Technology, 34(3): 514–521. |
| Glavee G N, Klabunde K J, Sorensen C M, et al. 1995. Chemistry of borohydride reduction of iron (Ⅱ) and iron (Ⅲ) ions in aqueous and nonaqueous media. Formation of nanoscale Fe, FeB, and Fe2B powders[J]. Inorganic Chemistry, 34(1): 28–35.DOI:10.1021/ic00105a009 |
| Gillham R W, Blowes D W, OHannesin S F, et al. 1994.Use of zero-valent metals in in-situ remediation of contaminated ground water[R]. Battelle Press, Columbus, OH (United States) |
| Goran N. Jovanovic, ,?, Polona ?nidar?i? Plazl, , Ploenpun Sakrittichai, ?and, et al. 2005.Dechlorination of p-Chlorophenol in a Microreactor with Bimetallic Pd/Fe Catalyst[J]. Industrial & Engineering Chemistry Research, 44(14):5099-5106 |
| 高树梅, 王晓栋, 王宇, 等. 2007. 纳米铁颗粒降解氯代有机污染物的研究进展[J]. 环境科学与技术, 2007, 30(3): 100–102. |
| 郭丽雯. 2016. 负载型二氧化铈纳米金催化剂的制备及性能研究[D]. 济南: 山东大学http://cdmd.cnki.com.cn/Article/CDMD-10422-1016164951.htm |
| Hara J, Ito H, Suto K, et al. 2005. Kinetics of trichloroethene dechlorination with iron powder[J]. Water Research, 39(6): 1165–1173.DOI:10.1016/j.watres.2004.12.011 |
| Helland B R, Alvarez P J J, Schnoor J L. 1995. Reductive dechlorination of carbon tetrachloride with elemental iron[J]. Journal of Hazardous Materials, 41(2/3): 205–216. |
| Hildebrand H, Mackenzie K, Kopinke F D. 2009. Pd/Fe3O4, nano-catalysts for selective dehalogenation in wastewater treatment processes-Influence of water constituents[J]. Applied Catalysis B Environmental, 91(1/2): 389–396. |
| 韩宝平, 王小英, 朱雪强, 等. 2004. 某市岩溶地下水四氯化碳污染特征研究[J]. 环境科学学报, 2004, 24(6): 982–988. |
| 何娜, 李培军, 任婉侠, 等. 2008. 钯/铁双金属对土壤中2, 2', 3, 4, 4', 5, 5'-七氯联苯的催化脱氯研究[J]. 环境科学, 2008, 29(7): 1924–1929. |
| 黄园英, 刘菲, 汤鸣皋, 等. 2004. 纳米级Ni/Fe颗粒降解四氯化碳批实验研究[J]. 山东农业大学学报自然科学版, 2004, 35(4): 565–568. |
| Kle?ka G M, Gonsior S J. 1984. Reductive dechlorination of chlorinated methanes and ethanes by reduced iron (Ⅱ) porphyrins[J]. Chemosphere, 13(3): 391–402.DOI:10.1016/0045-6535(84)90097-3 |
| 刘子恩, 葛雪莹, 荔雅文, 等. 2015. 不同结构类型贵金属-二氧化铈纳米材料的制备及催化性能[J]. 科学通报, 2015(24): 2288–2303. |
| 雷彬, 张旭, 谭文松, 等. 2015. Klebsiella Pneumoniae ECU-15生物纳米钯催化剂的制备、表征及其合成机理初探[J]. 高校化学工程学报, 2015, 29(4): 873–880. |
| 李芳. 2013. 改性纳米钯/铁双金属颗粒对2, 4-二氯苯酚降解脱氯研究[D]. 昆明: 昆明理工大学http://cdmd.cnki.com.cn/Article/CDMD-10674-1015528555.htm |
| 李智灵, 杨琦, 尚海涛, 等. 2008. 负载型纳米Pd/Fe对氯代烃脱氯机理研究[J]. 环境科学, 2008, 29(4): 978–984. |
| Nurmi J T, Tratnyek P G, Sarathy V, et al. 2005. Characterization and properties of metallic iron nanoparticles:spectroscopy, electrochemistry, and kinetics[J]. Environmental Science & Technology, 39(5): 1221–1230. |
| 潘湛昌, 杨文霞, 张环华, 等. 2004. 纳米二氧化铈的电化学制备与表征[J]. 化工新型材料, 2004, 32(10): 31–33.DOI:10.3969/j.issn.1006-3536.2004.10.009 |
| 孙正男, 杨琦, 纪冬丽, 等. 2015. 纳米Fe3O4/CeO2-H2O2非均相类Fenton体系对3, 4-二氯三氟甲苯的降解[J]. 环境科学, 2015, 36(6): 2154–2160. |
| Támara M L, Butler E C. 2004. Effects of iron purity and groundwater characteristics on rates and products in the degradation of carbon tetrachloride by iron metal[J]. Environmental Science & Technology, 38(6): 1866–1876. |
| 陶宏林, 单爱琴, 李海花, 等. 2011. Cu/Fe双金属去除四氯化碳的研究[J]. 安徽农业科学, 2011, 39(17): 10377–10379.DOI:10.3969/j.issn.0517-6611.2011.17.100 |
| 童少平, 胡丽华, 康艳. 2005. Ni/Fe二元金属脱氯降解对氯苯酚的研究[J]. 环境科学, 2005, 26(4): 65–65. |
| Wang Y, Zhou D, Wang Y, et al. 2012. Automatic pH control system enhances the dechlorination of 2, 4, 4'-trichlorobiphenyl and extracted PCBs from contaminated soil by nanoscale Feo and Pd/Feo[J]. Environmental Science and Pollution Research, 19(2): 448–457.DOI:10.1007/s11356-011-0587-0 |
| Wang X Y, Chen C, Chang Y, et al. 2009. Dechlorination of chlorinated methanes by Pd/Fe bimetallic nanoparticles[J]. Journal of Hazardous Materials, 161(2/3): 815–823. |
| Wu L, Ritchie S M. 2006. Removal of trichloroethylene from water by cellulose acetate supported bimetallic Ni/Fe nanoparticles[J]. Chemosphere, 63(2): 285–292.DOI:10.1016/j.chemosphere.2005.07.021 |
| Xu W Y, Gao T Y. 2007. Dechlorination of carbon tetrachloride by the catalyzed Fe-Cu process[J]. Journal of Environmental Sciences, 19(7): 792–799.DOI:10.1016/S1001-0742(07)60133-8 |
| Xiu Z M, Jin Z H, Li T L, et al. 2010. Effects of nano-scale zero-valent iron particles on a mixed culture dechlorinating trichloroethylene[J]. Bioresource Technology, 101(4): 1141–1146.DOI:10.1016/j.biortech.2009.09.057 |
| 项玮, 韩宝平, 朱雪强. 2007. 岩溶含水层四氯化碳人体健康风险评价[J]. 农业环境科学学报, 2007, 26(5): 1702–1706. |
| 杨振华, 宋晓岚. 2006. 利用沉淀法制备CeO2纳米粉体[J]. 郑州大学学报工学版, 2006, 27(1): 82–85. |
| 张军, 白孝康, 李晶晶, 等. 2015. 超声协同下镍铁双金属化合物催化降解水溶液中的四氯化碳[J]. 环境工程学报, 2015, 9(4): 1693–1697.DOI:10.12030/j.cjee.20150428 |
| Zhang W, Wang C B, Lien H L. 1998. Treatment of chlorinated organic contaminants with nanoscale bimetallic particles[J]. Catalysis Today, 40(4): 387–395.DOI:10.1016/S0920-5861(98)00067-4 |
| 钟邦克. 2002. 精细化工过程催化作用[M]. 北京: 中国石油化工出版社. |
