 , 丁丽丽1
, 丁丽丽1
 , 贺雪濛1, 顾卓江2, 任洪强1
, 贺雪濛1, 顾卓江2, 任洪强1

1. 南京大学环境学院, 污染控制与资源化研究国家重点实验室, 南京 210023;
2. 浙江海正药业有限公司, 杭州 311404
收稿日期: 2017-06-12; 修回日期: 2017-08-24; 录用日期: 2017-09-05
基金项目: 国家科技支撑计划项目(No.2014BAC08B04)
作者简介: 张璐璐(1993—), 女, E-mail: zhanglulu_nju@163.com
通讯作者(责任作者): 丁丽丽, E-mail: dinglili@nju.edu.cn
任洪强, E-mail: hqren@nju.edu.cn
摘要: 以溶解态木质素模拟废水为研究对象,考察了不同直流电场条件下活性污泥反应器(R1,无电流,悬浮污泥)、电极生物膜反应器(R2,电流I=10~60 mA,无悬浮污泥)与电极生物膜-活性污泥反应器(R3,I=10~60 mA,悬浮污泥)中木质素废水的处理效能、污泥生理特性(活菌比、木质素过氧化物酶(LiP)、三磷酸腺苷(ATP)等)、细胞膜磷脂脂肪酸组成及微生物群落结构的差异.结果表明:相同的外加电流下,R3的木质素去除率均高于R2(p < 0.05),其中,30 mA时达到最大值30.19%±0.47%,分别为R1、R2木质素去除率的2.01倍和1.46倍.反应器R2在20~40 mA时的总氮去除效果最好,达到71.96%±5.79%.分析R1、R3悬浮污泥发现,外加电流升高不改变悬浮污泥的活菌比(p>0.05),木质素去除率受LiP酶活影响不大;与低电流(10~30 mA)相比,高电流(40~60 mA)下悬浮污泥中C15:0 ANTEISO的含量降低,长链磷脂脂肪酸(C19、C20)的相对含量增加;R3悬浮污泥中Flavobacterium、Pseudomonas和Janthinobacterium等可降解木质素的菌属在10 mA外加电流的刺激下相对丰度均最高.在电极微生物方面,与R3相比,R2阴极微生物中具有反硝化能力的Methyloversatilis成为优势菌属,阳极微生物中存在更多具有电子传递能力的菌属(Pseudomonas、Ralstonia).冗余分析(RDA)表明,悬浮污泥中Mycobacterium(降解木质素的好氧细菌)丰度与电流(I)显著正相关(p < 0.05),与不饱和脂肪酸(UFA)显著负相关(p < 0.05).
关键词:木质素废水电-生物强化废水处理效能磷脂脂肪酸电极生物膜微生物群落结构
The performance, sludge characteristics and microbial community in lignin wastewater treatment by direct current enhanced activated sludge approach
ZHANG Lulu1
 , DING Lili1
, DING Lili1
 , HE Xuemeng1, GU Zhuojiang2, REN Hongqiang1
, HE Xuemeng1, GU Zhuojiang2, REN Hongqiang1

1. State Key Laboratory of Pollution Control and Resource Reuse, School of Environment, Nanjing University, Nanjing 210023;
2. Hisun Pharmaceutical Company Limited, Hangzhou 311404
Received 12 June 2017; received in revised from 24 August 2017; accepted 5 September 2017
Supported by the National Key Technology R&D Program(No.2014BAC08B04)
Biography: ZHANG Lulu(1993—), female, E-mail: zhanglulu_nju@163.com
*Corresponding author: DING Lili, E-mail: dinglili@nju.edu.cn
REN Hongqiang, E-mail: hqren@nju.edu.cn
Abstract: This study aims to investigate the effect of different intensity of direct currents (DC) on the removal of soluble lignin using three kinds of sequencing batch reactors (SBRs), and compared the sludge physiological characteristics (viability, LiP, ATP, etc.), phospholipid fatty acid (PLFA) of suspended sludge and microbial community structure between different kinds of SBRs. The three SBRs, referred to as Activated Sludge Reactor (R1, activated sludge only, no current), Bio-electrode Reactor (R2, I=10~60 mA, no activated sludge) and Bio-electrode Activated Sludge Reactor (R3, activated sludge, I=10~60 mA), were operated with synthetic wastewater. Under the same DC intensity, the lignin removal in R3 was always higher than that in R2(p < 0.05). The highest lignin removal (30.19%±0.47%) in R3 was achieved at 30 mA and was 1.01 and 0.46 times higher than that in R1 and R2, respectively. The total nitrogen (TN) removal in R2 reached up to 71.96%±5.79% at 20~40 mA, much higher than the other two reactors. The viability of suspended sludge was not affected by the increase of the currents (p>0.05) and LiP enzyme activity appeared to be irrelevant to lignin removal. PLFA analysis revealed that high currents (40~60 mA) led to the decrease of C15:0 ANTEISO content and increase of long chain fatty acids (C19, C20) in comparison with low currents (10~30 mA). High-throughput 16S rRNA sequencing verified that the highest abundance of lignin-degrading bacteria like Flavobacterium, Pseudomonas and Janthinobacterium were observed in R3 under 10 mA current. For microorganisms on electrodes, a denitrifier-Methyloversatilis dominated the biofilm of cathode in R2. Besides, more genera possessing the electron transfer ability were detected in biofilm of anode in R2 (Pseudomonas, Ralstonia). RDA analysis indicated that Mycobacterium (one kind of lignin-degrading aerobic bacteria) in activated sludge were significantly positively correlated with current I (p < 0.05) and negatively correlated with UFA (p < 0.05).
Key words: lignin wastewaterelectrolytic stimulationwastewater treatment efficiencyphospholipid fatty acid (PLFA)bio-electrodemicrobial community
1 引言(Introduction)木质素及其降解物是造纸废水的重要成分, 占总CODCr的50%左右(苏维丰等, 2004).由于木质素具有复杂的苯环结构, 因此, 传统生物处理对其降解耗时长、去除率低.目前, 已经筛选到的降解木质素的细菌大多是好氧细菌(谢长校等, 2015), 主要集中在放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)等(Bugg et al., 2011), 部分能在厌氧情况下生长.纯培养功能菌则对菌种培养条件的要求较高、重复性较差, 降解过程非常缓慢(张盼, 2015).
研究表明, 外加直流电场能有效提高微生物强化难降解物质(苯酚、对氯硝基苯、茜素黄R、2, 4-二氯苯酚等)的处理效率(Ailijiang et al., 2016; Zhu et al., 2014; Sun et al., 2015; Cao et al., 2016; Liu et al., 2015), 其影响因素主要包括环境条件(如温度、pH、氧气等)、电场作用方式(如电流密度和持续时间)和反应器构型等(宓益磊等, 2009b).不同功能菌适宜的溶解氧条件不同, 较高的溶解氧可以提高好氧微生物活性和促进有机物循环功能菌群的增殖(宋亭等, 2016).Krishna等(2014)利用生物电化学系统(BET)处理实际制浆造纸废水, 结果发现, 在pH=7时, 与厌氧处理(AnT)相比, BET系统的COD(BET/AnT, 55%/51%)、硝酸盐(33.5%/19.1%)、磷酸盐(33%/19%)和硫酸盐(58%/41%)去除率更高.宓益磊等(2009a)利用电-活性污泥耦合技术处理酸性大红GR, 结果发现, 在15 mA微电流条件下电-生物技术能克服50 mg·L-1酸性大红GR对好氧生物处理的抑制作用.目前采用BET系统处理木质素废水的研究尚鲜见报道.已有研究为Liu等(2011)利用活性污泥反应器处理木质素模拟废水, 结果发现, 木质素去除率低于20%, 并且好氧微生物无法完全降解木质素.因此, 是否可采用电-活性污泥法有效强化木质素降解仍有待研究.
直流电场会导致微生物生理特性、细胞膜磷脂组成和群落结构的差异.She等(2006)研究发现, 阴极产生的H2可能作为质子供体可提高脱氢酶系统活性, 从而导致NAD/NADH平衡的转化.Velasco-Alvarez等(2011)的研究表明, 低电流(0.42 mA·cm-2, 24 h)能促进Aspergillus niger的分解代谢, 减少生物量的产生, 总ATP含量瞬间升高, 从而导致十六烷的生物降解率提高约15%.Wick等(2010)利用PLFA技术研究了暴露于恒定电场(1.4 V·cm-1、1.0 mA·cm-2)中的土壤微生物群落的变化, 结果发现, 外加电场8 d后, 饱和脂肪酸含量受到显著影响(p < 0.05), 电极附近的样品与中心土壤样品相比, 饱和直链脂肪酸的含量更高, 这可能是由于电场对流动细胞膜的胁迫作用.目前, 有关电场胁迫条件下微生物群落结构的研究主要集中在极板上附着的生物膜方面, 而在悬浮的活性污泥微生物群落结构的电场影响方面较少涉及.阳极生物膜中Shewanella(Kim et al., 1999)、Geobacter(Bond et al., 2003)、Pseudomonas、Desulfovibrio(Logan, 2009)等菌属都曾被报道具有很高的电子传递能力.Ailijiang等(2016)利用生物电化学反应器处理模拟苯酚废水, 结果发现, 在间歇直流电场运行方式下, 生物膜中Zoogloea和Desulfovibrio等菌属的相对丰度显著提高.电极生物膜功能微生物包括能够进行细胞外电子传递的功能菌和其他协作的功能菌(刘充等, 2015).与生物膜法相比, 活性污泥法群落结构具有明显的差异性, 且活性污泥处于曝气搅动之中, 特定功能微生物难以富集, 因此, 直流电场对悬浮的活性污泥微生物的影响与电极-生物膜法不同(赵梦君等, 2010).
基于此, 本研究以溶解态木质素模拟废水为研究对象, 考察活性污泥反应器、电极生物膜反应器及电极生物膜-活性污泥反应器中木质素废水的处理效能, 探究不同电流强度对悬浮污泥生理特性的影响, 并利用磷脂脂肪酸(PLFA)及16S rRNA基因高通量测序研究不同电流强度下微生物细胞膜磷脂组成和群落结构的差异, 以期为电场强化技术处理木质素废水的工程应用提供理论依据.
2 材料与方法(Materials and methods)2.1 反应器的启动与运行实验包括3个平行运行的SBR反应器, 反应器有效体积为2 L, 其中, R1为常规SBR反应器(对照组, 无电流); R2、R3反应器内设固定在壁上的卡槽以固定电极, 所用电极为一对石墨电极, 有效面积为60 cm2(长20 cm、宽5 cm、厚6 mm), 极板距离7 cm, 两电极分别与直流稳压电源的正、负极连接, R2内无接种污泥, R3内含接种污泥.R1、R3接种污泥取自南京某污水处理厂, 污泥浓度控制在3000 mg·L-1.R2每天换水时清理悬浮污泥(污泥浓度 < 30 mg·L-1).为了强化难降解有机物木质素的降解, 加入易降解的葡萄糖为共基质.实验室配制的模拟废水的进水COD为530 mg·L-1(COD(木质素磺酸钠): COD(葡萄糖)=1: 1.2), 由300 mg·L-1的C6H12O6及200 mg·L-1木质素磺酸钠组成, 此外每升废水包含117.2 mg NH4Cl、26.9 mg KH2PO4、55 mg MgSO4·7H2O、25 mg CaCl2·2H2O和0.6 mL微量元素混合液.其中, 每升微量元素混合液包含1.5 g FeCl3·6H2O、0.18 g KI、0.12 g ZnSO4·7H2O、0.15 g H3BO3、0.12 g MnCl2·4H2O、0.15 g CoCl2·6H2O、0.03 g CuSO4·5H2O、0.06 g Na2MoO4·2H2O和10 g EDTA-4Na.反应器运行周期为24 h(包括进水0.5 h, 曝气22 h, 沉淀1 h, 出水0.5 h), 排水比为1/2, 污泥负荷为0.12 kg·kg-1·d-1(以每kg MLSS中的COD(kg)计), 污泥停留时间为10 d, 进水pH为7.6±0.1, 溶解氧控制在3~5 mg·L-1, 温度维持在(25±2) ℃.
2.2 实验方法R1为不加电流的对照反应器, R2、R3反应器两电极分别与直流稳压电源的正、负极连接且以10 mA的弱电流进行驯化, 具体运行方式如下:1~41 d(第1阶段), R2、R3外加电流10 mA; 42~53 d(第2阶段), 外加电流20 mA; 54~65 d(第3阶段), 外加电流30 mA; 66~77 d(第4阶段), 外加电流40 mA; 78~89 d(第5阶段), 外加电流50 mA; 90~101 d(第6阶段), 外加电流60 mA.同时在每个阶段对R1、R3反应器中悬浮污泥进行微生物活菌比、三磷酸腺苷(ATP)、比耗氧速率(SOUR)、酶活、PLFA、微生物群落结构等的测定.
2.3 分析项目和方法2.3.1 常规指标测定污泥浓度(MLSS)、COD、NH3-N、TN的测定均参照国标法(国家环境保护总局, 2002).微生物活菌比采用LIVE/DEAD? Bacteria Viability Kit (BacLightTM, MolecuLar Probes, Invitrogen L7012)染色法测定, 结果用活菌百分比表示(Proia et al., 2013).ATP采用荧光素-荧光素酶法测定(Ailijiang et al., 2016).比耗氧速率(SOUR)的测定参照Hao等(2009)的方法.
2.3.2 木质素磺酸钠浓度测定紫外分光光度法(UV)是用来测定木质素及其衍生物的常用方法, 木质素及木材提取物中的酚羟基离子在280 nm处存在一个相对稳定的吸收峰.因此, 在制浆造纸行业中该吸收峰通常被用来指示木质素及大部分木材提取物的浓度(Liu et al., 2011).通过实验室分析, 本实验中所用的木质素磺酸钠溶液在紫外276 nm(UV276)处存在一个稳定的吸收峰.当木质素浓度低于0.2 g·L-1时, 其浓度与吸光度呈现出明显的线性关系.
2.3.3 木质素过氧化物酶(LiP)测定采用黄丹莲等(2005)报道的方法, 取0.6 mL黎芦醇溶液(10 mmol·L-1)、1.2 mL酒石酸缓冲液(250 mmol·L-1, pH=3.0)与1.2 mL粗酶液混匀, 在30 ℃下, 于反应液中加入60 μL H2O2溶液(20 mmol·L-1)启动酶促反应, 并在310 nm波长下测定30 min前后反应液吸光度的变化.一个酶活力单位(U)定义为每分钟氧化黎芦醇产生1 μmol黎芦醛所需的酶量.
2.3.4 细胞膜磷脂脂肪酸分析PLFA的提取方法根据Balser等报道的方法进行了适当修正(Kao-Kniffin & Balser, 2007; Smithwick et al., 2005), 通过对活性污泥样品的提取、分离及皂化、甲基化、萃取等一系列前处理后, 将提取出的PLFA采用安捷伦7800A气相色谱进行测定.气相色谱各参数由MIDI Sherlock程序设置调用(Niu et al., 2013; Xue et al., 2008).
2.3.5 微生物群落结构检测采用16S rRNA基因高通量测序(Miseq, Illumina)进行检测.污泥样品DNA的提取及PCR扩增采用周莉娜等(2016)报道的方法.经琼脂糖凝胶电泳鉴定PCR产物后, 采用纯化试剂盒(Cycle-Pure Kit, OMEGA Bio-tek, Inc.)纯化后送至江苏中宜金大分析检测有限公司进行Miseq测序.
2.4 数据统计与分析常规水质指标的数据处理采用Origin 9.2软件, 微生物活菌比结果采用ImageJ软件进行分析, Miseq数据经Sickle及Mothur降噪后, 通过RDP分类处理.采用SPSS statistics 22.0.0分析软件进行单因素方差分析(AVONA), 用于检验不同物种对于各项环境因素是否具有显著性差异, 当p < 0.05时, 认为具有显著性差异.PCA与RDA分析采用Canoco软件.
3 结果与讨论(Results and discussion)3.1 电流强度对反应器运行效能的影响反应器运行情况如图 1所示.图 1a反映了反应器进、出水COD情况, 进水COD为(530.0±7.9) mg·L-1, 第1~41 d(第1阶段)时, R1、R3的平均COD去除率分别为73.71%±2.39%和78.88%±1.75%(p < 0.05).第1 d时, R2反应器的COD去除率仅为25.16%, 此时由于反应器中无接种污泥, 因此, COD的去除仅为10 mA电流的作用.第5 d开始, R2反应器的COD去除率升到65.16%, 此时观察到R2反应器的极板上已有少量微生物附着.第42~53 d(第2阶段)与54~65 d(第3阶段)时, 电流由20 mA升高到30 mA, 与R1相比, R2、R3的COD去除率分别提高了2%(p < 0.05)和7%(p < 0.05), 出水COD分别为(139.72±5.75)和(112.47±6.06) mg·L-1; 第66 d电流再次升高后, R2与R3的COD去除率开始下降, 最终与R1的COD去除率基本一致.
图 1(Fig. 1)
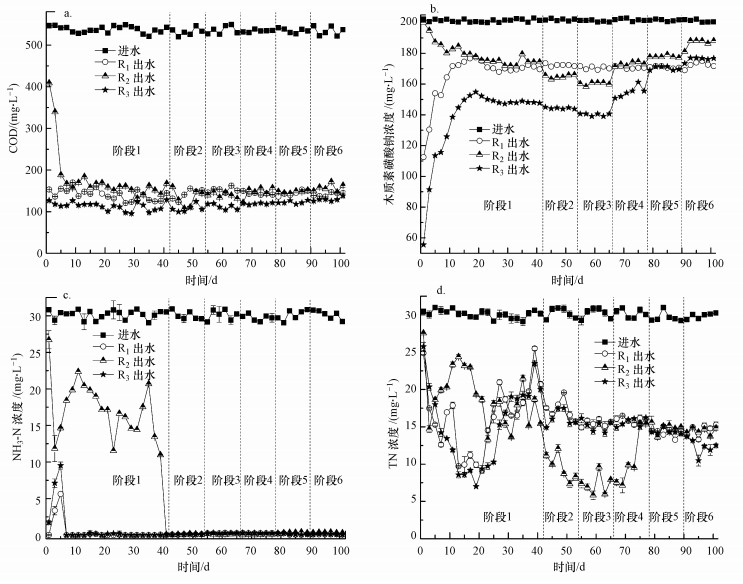 |
| 图 1 反应器进出水水质情况 (a.COD, b.木质素磺酸钠, c.NH3-N, d.TN) Fig. 1Dynamics of the influent and the effluent concentrations of reactors (a.COD, b.sodium lignosulfonate, c.NH3-N, d.TN) |
反应器木质素磺酸钠进出水浓度如图 1b所示.1~20 d时, 由于R1、R3中活性污泥对木质素的去除存在污泥吸附作用, 第1 d木质素去除率分别快速地达到44.37%和72.51%. 10 mA条件下R3具有更高的木质素去除率, 可能是由于电场使污泥吸附性能提高(朱现信, 2005).随着污泥吸附量逐渐达到饱和及微生物的降解, 第20 d木质素去除率分别达到12.59%和23.99%.据报道, 以葡萄糖为碳源, 不同溶解氧的活性污泥工艺启动初期(1~10 d), COD去除率由75%上升到90% (Ma et al., 2016), 由此推测, R1、R3启动期(1~20 d)共基质葡萄糖与木质素的去除呈相反趋势.由于R2无接种污泥, 因此, 1~5 d的情况与电解反应器相近, 木质素平均去除率为3.73%±2.66%.靳培培(2014)研究了进水苯酚浓度为100 mg·L-1, 电场强度分别为0、1.0、2.0、3.0、4.0、7.5 V·cm-1时的电化学反应器(无活性污泥、无电极生物膜)对苯酚的降解率, 结果发现, 降解率分别为2.71%、3.88%、4.84%、7.46%、9.33%、12.79%.可见电化学反应对污染物的降解具有一定的作用, 但降解效率较低.对照组R1的木质素平均去除率(第31~101 d的平均值)为15.02%±0.80%. R3的木质素去除率始终高于R2, 且均随外加电流的增大呈先升后降趋势, 在30 mA时木质素去除率均最大.10 mA时, R3稳定后木质素的去除率为26.71%±0.39%, 是R1的1.78倍(p < 0.05);而R2(13.44%±1.32%)低于对照组R1 (p < 0.05).30 mA时, R3、R2反应器的木质素去除率达到最大, 分别为30.19%±0.47%和20.69%±0.54%, 分别为R1的2.01倍(p < 0.05)和1.38倍(p < 0.05).电流增加到40 mA时, 木质素去除率开始下降, 分别为22.81%±1.76%(R3)和14.16%±0.85%(R2); 60 mA时两个反应器的木质素去除率均低于R1.因此, 一定的外加电流可以提高活性污泥对木质素的去除率, 30 mA为降解木质素的最佳电流取值.
图 1c所示为电流作用对NH3-N去除的影响.R1、R3的NH3-N去除率随时间变化趋势一致, 第1~5 d均在68.70%~99.93%范围内小幅波动, 随后阶段反应器的NH3-N去除率均高于99%, 说明活性污泥存在条件下氨氮快速氧化, 不受电流影响.R2反应器在第1阶段NH3-N去除率波动较大, 平均为43.03%±17.32%, 其出水氨氮浓度由第1 d的26.72 mg·L-1快速降低到第5 d的14.66 mg·L-1.这是由于前5 d未采用缓冲溶液控制反应器pH, 反应器水质偏酸(pH≈5), 同时R2极板生物膜量较少, 推测氨氮在阳极上发生电化学氧化反应形成氮气去除(6·OH+2NH3→N2+6H2O (Marselli et al., 2003)).周明明等(2015)报道酸性条件下氨氮的去除率比中性条件高.第5 d后, 调控溶液pH值为中性, 氨氮的去除率下降.随着第1阶段R2电极生物膜挂膜完成, 第41 d, R2反应器(10 mA)的NH3-N去除率达到99%以上, 随后阶段均维持在该水平, 出水氨氮浓度为(0.20±0.13) mg·L-1.庞朝晖等(2015)利用短程电极生物膜处理养殖废水中的高氨氮, 进水氨氮浓度为400 mg·L-1时, 在100 mA以内氨氮的去除率随电流的增加而明显提高, 且氨氮去除率均高于90%.
图 1d所示为TN进、出水浓度随时间的变化.整个过程中, R1与R3的TN去除率变化趋势基本一致(除第6阶段显著差异), 说明R3的TN去除在50 mA范围内不受电流影响, 主要由活性污泥脱氮微生物去除.第1~41 d(第1阶段)时, R1与R3的出水TN浓度先快速降低到第20 d的9.91和7.01 mg·L-1, 随后逐步升高到25.50和23.50 mg·L-1(第40 d).第1~20 d的TN去除率上升是由于R1与R3硝化反硝化微生物活性逐步升高(许德超等, 2014), 该阶段木质素主要为污泥递减吸附过程, 而从第20 d开始, 由于降解木质素的微生物活性逐步升高, 推测R1、R3系统中一定浓度的难降解的木质素及其中间代谢产物抑制微生物的脱氮作用(Hume et al., 2002), 导致TN去除率降低并在第1阶段结束时达到稳定; R2的出水TN浓度在1~40 d与其出水氨氮浓度的变化趋势相近.由图 1c中R2在第1阶段的氨氮出水浓度可以计算得出, 第1~40 d出水TN浓度中82.58%~97.88%是由氨氮构成, 因此, 推测该阶段R2的TN去除率(< 56%)主要是由于氨氮氧化受到限制引起.第2~4阶段, R1与R3的出水TN浓度均稳定在14.18~19.58 mg·L-1; 值得注意的是, 此时R2的TN去除率随电流升高而显著增强, 为71.96%±5.79%, 出水TN浓度为(8.46±1.73) mg·L-1. R2的电极生物膜反硝化是一个电化学作用和生物反硝化作用相结合的过程(赵国智, 2011), 即部分反硝化菌利用废水中的有机物或者电解产生的H2为电子供体, 将NO3--N还原为N2.本研究中, 40 mA电流处理后期(75 d之后)及第5阶段, 电流升高到50 mA以后, R2的TN去除率逐步降低并稳定在50.77%±1.98%.这可能是高电流下, 反硝化菌的活性受到抑制, 也可能是超过最佳电流后, 阴极产生的氢过多, 在生物膜内形成“氢抑制”现象, 抑制反硝化进行(Flora et al., 1994; Sakakibara et al., 1994).由于电极生物膜-活性污泥系统中, 影响脱氮的因素复杂, 包括环境条件(pH、温度、溶解氧)、操作条件(碳源、C/N比、氮负荷、污泥量、运行时间)、电极电化学参数、反应器结构、群落结构等因素(吕江茜等, 2010; Mook et al., 2013; 孙振世, 2001), 因此, R2的TN去除率高于R3的原因及机理差异有待进一步探讨.
综上, 30 mA电流条件下, 在污泥负荷为0.12 kg·kg-1·d-1时, 电极生物膜-活性污泥反应器(R3)木质素去除率最高, 为活性污泥反应器(R1)的2.01倍(p < 0.05);20~40 mA时电极生物膜反应器(R2)总氮去除率最大, 为71.96%±5.79%.
3.2 电流强度对活性污泥微生物活性的影响漆酶、木质素过氧化物酶(LiP)和锰过氧化物酶(MnP)是最常见的木质素降解酶.目前, 关于细菌降解木质素产MnP的报道非常少(谢长校等, 2015).LiP主要来源于真菌, 但最近有研究发现细菌也可分泌LiP(谢长校等, 2015).在本研究中, 未检出漆酶和锰过氧化物酶, 仅测出木质素过氧化物酶.R1、R3反应器的木质素过氧化物酶(LiP)酶活变化情况如图 2a所示.稳定期R1(0 mA)活性污泥平均LiP酶活为(149.13 ±12.05) U·g-1(以protein计, 下同)(第31~101 d平均值).随着电流增加, R3活性污泥中的LiP酶活呈先增后降趋势, 酶活峰值出现在20 mA时.10 mA时, R3活性污泥LiP酶活平均为(175.16±0.01) U·g-1, 略高于对照组R1, 但其木质素去除率为R1的1.69倍; 电流升高到20 mA时, LiP酶活高达(435.82±3.09) U·g-1, 但此时木质素去除率仅提高2%;30 mA时LiP酶活降为(358.07±11.37) U·g-1, 木质素去除率却升高到最大值30.19%±0.47%;相比于10 mA电流条件下, 40 mA和50 mA时的LiP平均酶活虽较高(p < 0.05), 但其木质素去除率却较低.由此可见, 木质素去除率受LiP酶活影响较弱.
图 2(Fig. 2)
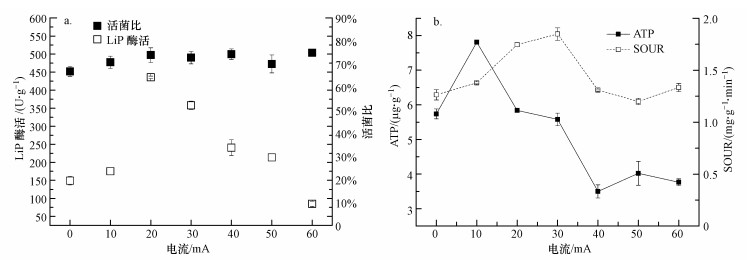 |
| 图 2 不同电流下悬浮污泥木质素过氧化物酶(LiP)的酶活、活菌比(a)及三磷酸腺苷(ATP)含量、SOUR变化情况(b) (I=0 mA为R1, 第31~101 d的平均值(n=18);I=10~60 mA为R3, 每个电流条件下测定的平均值(n=3)) Fig. 2The fluctuation of LiP activity and live/dead values(a) and adenosine triphosphate (ATP) concentrations and SOUR(b) of activated sludge microorganism under different currents |
微生物活菌比可以用来判定活性污泥在受到电流胁迫下细胞膜的损伤程度(图 2a).R3各电流下的活性污泥活菌比(70.80%±2.67%、73.92%±3.15%、72.80%±2.70%、74.32%±2.28%、70.08%±3.89%、74.95%±0.37%)相比于R1(66.85%±2.12%)有所上升, 统计学分析表明, 不同电流强度下并无显著性差异(p > 0.05).这表明在10~60 mA的外加电流下, 反应器里面的大部分细菌的细胞膜都很完整, 未出现大量细菌的凋亡.
在直流电场的处理过程中, ATP含量可以作为评价微生物代谢活性的生物指标(Velasco-Alvarez et al., 2011).R1、R3反应器的ATP含量变化情况如图 2b所示, 稳定期R1(0 mA)活性污泥ATP含量为(5.74±0.14) μg·g-1(以MLSS计, 下同)(第31~101 d平均值); 10 mA时, R3活性污泥的ATP含量最高, 为(7.81±0.04) μg·g-1; 其次是20 mA与30 mA时, 分别为(5.84±0.01)和(5.58±0.18) μg·g-1; 而40、50、60 mA时ATP含量分别为(3.50±0.19)、(4.02±0.34)和(3.77±0.1) μg·g-1, 显著低于R1 (p < 0.05).说明30 mA以内不会影响微生物代谢活性, 而过高的电流强度则会抑制微生物代谢活性.Wang等(2017)的研究表明, 利用微生物电解池(MEC)处理高硫酸盐废水时, 与控制组相比, 0.5 mA时ATP含量增加, 2.5 mA和3.5 mA时, ATP含量急剧下降, 与本研究结论类似.
比耗氧速率(SOUR)可作为表征污泥活性的重要指标(荣宏伟等, 2016), 从微生物呼吸速率角度反映活性污泥生理状态和基质代谢状况.R1、R3反应器的SOUR变化情况如图 2b所示, 稳定期R1(0 mA)活性污泥SOUR为(1.26±0.05) mg·g-1·min-1(以每g MLSS每分钟消耗的O2量(mg)计, 下同) (第31~101 d平均值), 10 mA时, R3活性污泥的SOUR升高, 为(1.38±0.01) mg·g-1·min-1, 20 mA与30 mA时SOUR继续升高, 分别为(1.75±0.02)和(1.85±0.06) mg·g-1·min-1, 40、50、60 mA时R3活性污泥SOUR降低, 分别为(1.31±0.01)、(1.2±0.03)、(1.33±0.04) mg·g-1·min-1.由此可见, 不同电流下, 活性污泥SOUR变化趋势与木质素去除率基本一致.
综上, 在悬浮污泥中, 随着外加电流的增加(0~60 mA), LiP酶活、ATP、SOUR等活性指标均呈先升后降趋势, 而活菌比则不受影响(p > 0.05).
3.3 电流强度对活性污泥微生物细胞膜磷脂脂肪酸的影响不同电流强度下各组样品的PLFA组成情况如表 1所示, 其中, 在各组样品中PLFA组成成分含量均低于0.5%的因其含量过低而不具体列出, 磷脂脂肪酸的碳链长度主要分布在C11~C20之间, 共检测到20种类型的磷脂脂肪酸, 其中, 占主要比重的磷脂脂肪酸为C15: 0 ANTEISO、C16: 00和C18: 00.R1(0 mA)活性污泥C15: 0 ANTEISO含量为23.12%.总体而言, 高电流下C15: 0 ANTEISO的含量(16.52%(40 mA)、24.06%(50 mA)、13.86%(60 mA))较低电流下含量低(24.55%(10 mA)、26.77%(20 mA)、25.62%(30 mA)).由于C15: 0 ANTEISO相比于其它支链脂肪酸具有较低的相变温度(23 ℃)(Kaneda, 1991), 因此, 微生物可以更好地维持其流动性.另外, 60 mA条件下检测出的磷脂脂肪酸的碳链长度变长(C19、C20).Ma等(2016)的研究表明, 当反应器达到稳定运行阶段时, 长链脂肪酸的含量增加(C原子数> 18).
表 1(Table 1)
| 表 1 不同电流下活性污泥整体PLFA情况 Table 1 The whole PLFA profiles of activated sludge under different currents | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 不同电流下活性污泥整体PLFA情况 Table 1 The whole PLFA profiles of activated sludge under different currents
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
据Fang等(2007)报道, 外界环境条件影响微生物细胞膜不饱和脂肪酸的含量.图 3反映了不同电流下活性污泥微生物细胞膜磷脂的组成情况.如图 3a所示(其中, SFA、AFA、IFA、UFA、OFA分别代表饱和、反式异构、异构、不饱和和其他脂肪酸), R1活性污泥不饱和脂肪酸的含量为2.22%.高电流(40~60 mA)下不饱和脂肪酸的含量(2.21%~4.17%)较低电流(10~30 mA)下不饱和脂肪酸的含量高(0.37%~1.78%).相反, 低电流(10~30 mA)下支链脂肪酸的含量(38.66%~41.53%)高于高电流(40~60 mA)下支链脂肪酸的含量(24.56%~39.95%).据报道, 支链脂肪酸含量的降低可能是一种防止细胞膜流动过快的防御机制, 从而实现最优生长(Fang et al., 2007). Nenninger等(2014)的研究表明, 主要长链脂肪与主要短链脂肪酸的比值增大, 代表着细胞膜磷脂流动性降低.如图 3b所示, 本研究中, 主要长链脂肪酸与主要短链脂肪酸分别为C18和C15, 总体而言, 高电流下C18/C15值(0.68~1.45)较低电流(0.66~0.69)高, 因此, 推测高电流下细胞膜磷脂流动性可能降低.
图 3(Fig. 3)
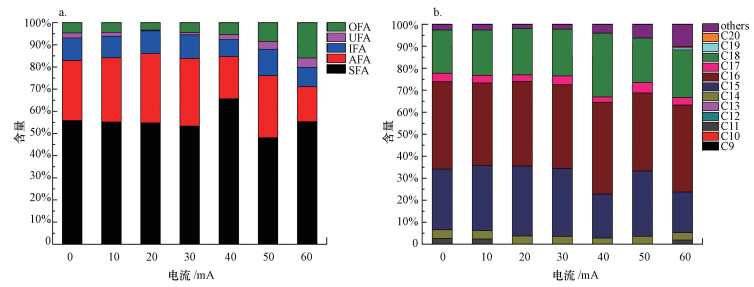 |
| 图 3 不同电流下活性污泥微生物细胞膜磷脂组成 (a.根据脂肪酸结构, b.根据脂肪酸碳原子个数; I=0 mA为R1, I=10~60 mA为R3) Fig. 3PLFA profiles of the activated sludge microorganism under different currents (a. by structure, b. by the number of carbon atoms) |
图 4为不同电流强度下活性污泥PLFA组成主成分分析结果.PC1和PC2分别代表了63.9%和26.9%的差异, 结果主要分布在4个区域.主成分分析显示, S1、S2、S3与空白之间的差异度较小, 其微生物细胞膜PLFA组成具有一定的相似性, 且以C14~C16支链脂肪酸为主; 另外3个区域分别代表了S4、S5、S6样品, 其与空白组差异度相对较大.S4与其它样品之间差异度最大, 其PLFA组成以C16和C18饱和脂肪酸为主; S5的PLFA组成以C15饱和脂肪酸与C17支链脂肪酸为主; S6的PLFA组成则以C18~C20为主.可见随着电流的升高, 检测出的磷脂脂肪酸的碳链长度变长.
图 4(Fig. 4)
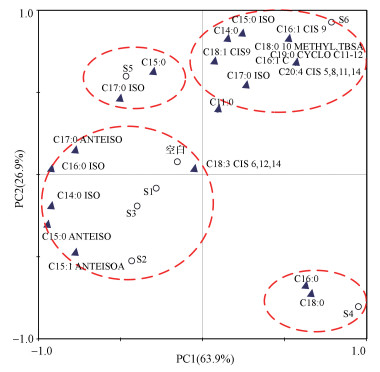 |
| 图 4 磷脂脂肪酸主成分分析 (空白(R1):0 mA; S1~S6(R3):10~60 mA) Fig. 4Principal component analysis of PLFA profile (Blank(R1):0 mA; S1~S6(R3):10~60 mA) |
3.4 电流强度对微生物群落结构的影响通过16S rRNA基因高通量测序技术对活性污泥的微生物群落结构进行分析, 结果如图 5所示.由图 5可知, R1(0 mA)活性污泥以变形菌门(Proteobacteria, 42.24%)为主, 其次为放线菌门(Actinobacteria, 27.24%).另外, 相对丰度低于10%的门类微生物包括拟杆菌门(Bacteroidetes, 9.22%)、酸杆菌门(Acidobacteria, 3.90%)、TM7(3.78%)、硝化螺菌(Nitrospira, 2.85%)等14个门.高电流下放线菌门的相对丰度(20.74%(40 mA)、21.13%(50 mA)、23.13%(60 mA))低于低电流下的相对丰度(30.25%(10 mA)、39.39%(20 mA)、33.79%(30 mA)), 而变形菌门的相对丰度在高电流下增加(51.93%(40 mA)、51.21%(50 mA)、52.51%(60 mA)).据报道, 能够降解木质素的好氧细菌种类较多, 目前主要集中在放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)等(Bugg et al., 2011).本研究的结果表明, 低电流能够促进放线菌门丰度的增加, 而变形菌门则具有更高的电流耐受力.变形菌门是石油精炼、丙烯酸类高聚物、制药、乳清粉加工、钢铁和宠物食品加工等污水处理厂中的优势菌门(Ibarbalz et al., 2013; Ma et al., 2015).
图 5(Fig. 5)
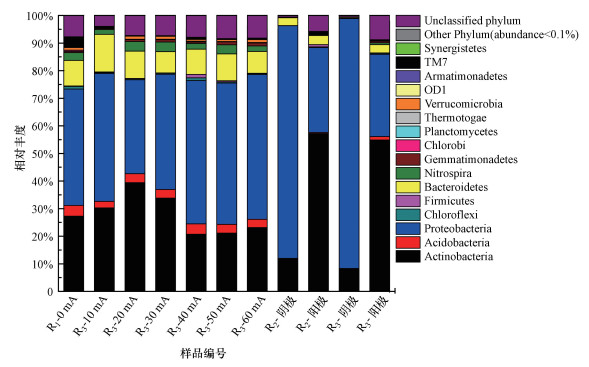 |
| 图 5 不同电流强度下各反应器活性污泥微生物群落结构的演变(门水平, 相对丰度 > 0.10%) Fig. 5Abundances of different phylum (abundance>0.10%) of activated sludge microorganisms in reactors under different currents |
阴极和阳极微生物群落结构在门水平上差异较大.R2阴极微生物以变形菌门(Proteobacteria, 84.32%)为主, 除变形菌门占主体外, 其次是放线菌门(Actinobacteria, 11.89%)和拟杆菌门(Bacteroidetes, 2.86%).而阳极微生物则以放线菌门(Actinobacteria, 57.20%)为主, 其次是变形菌门(Proteobacteria, 30.81%)、拟杆菌门(Bacteroidetes, 3.29%)和TM7(1.09%).R3阴极微生物以变形菌门(Proteobacteria, 90.55%)为主, 其次是放线菌门(Actinobacteria, 8.18%).阳极微生物以放线菌门(Actinobacteria, 54.90%)为主, 其次是变形菌门(Proteobacteria, 29.83%)、拟杆菌门(Bacteroidetes, 2.99%)和酸杆菌门(Acidobacteria, 1.20%).可见R2、R3反应器电极微生物在门水平上相似度较高.阴极微生物群落结构均较单一, 且以变形菌门为主, 而阳极则以放线菌门为主.目前, 在微生物燃料电池研究中发现的大部分具有细胞外电子传递功能的微生物都属于变形菌门.已有研究表明, 由于阴极反应将造成电极表层的氧气浓度降低甚至变成厌氧区, 因此, 会造成电极表面持菌量下降(曹宏斌等, 2001), 这可能是阴极表面微生物群落结构单一的原因.
如图 6所示, 在属水平上, R1(0 mA)的优势微生物(相对丰度> 0.20%)包括Micropruina(17.88%, 放线菌门)、TM7_genera_incertae_sedis(3.78%, TM7门)、Nakamurella(2.90%, 放线菌门)、Nitrospira(2.85%, 硝化螺菌)、Microlunatus(1.44%, 放线菌门)、Amaricoccus(1.37%, 变形菌门).总体而言, R3活性污泥在高电流下的Micropruina相对丰度(12.24%(40 mA)、13.23%(50 mA)、12.76%(60 mA))较低电流下的相对丰度低(23.11%(10 mA)、33.76%(20 mA)、27.57%(30 mA)).而高电流下Nakamurella的相对丰度(4.28%(40 mA)、3.35%(50 mA)、4.86%(60 mA))则高于低电流下的相对丰度(2.05%(10 mA)、2.19%(20 mA)、2.77%(30 mA)).已有研究表明, 在以葡萄糖为碳源时, Nakamurella和Micropruina能在细胞内储存大量的糖类聚合物(Begum et al., 2012; Tice et al., 2010), 进而成为优势菌.Amaricoccus相对丰度随着外加电流的增加大致呈上升趋势(1.75%(10 mA)、3.09%(20 mA)、3.92%(30 mA)、3.80%(40 mA)、5.45%(50 mA)、6.12%(60 mA)).在适当的电流强度下, Nitrospira相对丰度增加, 20、30 mA时其相对丰度较高, 分别为3.44%和3.47%.Nitrospira属于亚硝酸氧化菌, 与处理装置的硝化功能直接有关.Nitrospira相对丰度的增加体现了反应器硝化能力的提高.TM7相对丰度在外加电流下降低, 各电流下其相对丰度均低于1%.在10 mA电流下, Flavobacterium(6.16%)、Pseudomonas(13.89%)和Janthinobacterium(5.93%)相对丰度显著高于R1(0.17%、0.11%、0.05%).Flavobacterium为革兰氏阴性菌, 属拟杆菌门, 是一类能够降解木质素的非丝状细菌.该菌属被认为具有电化学活性, 相关报道较少, 目前用于燃料电池氧化还原酶活性指示菌(刘充等, 2015).Pseudomonas为革兰氏阴性菌, 属Gamma变形菌, 据李海涛等(2010)的研究, Pseudomonas菌属可降解低分子量木质素, 曾被报道具有很高的电子传递能力(刘充等, 2015), 是目前微生物燃料电池(MFC)中研究最多的功能菌属之一.Janthinobacterium是一种革兰氏阴性土壤细菌, 具有不同的能量代谢能力, 耐寒、耐紫外线及其他的环境压力.
图 6(Fig. 6)
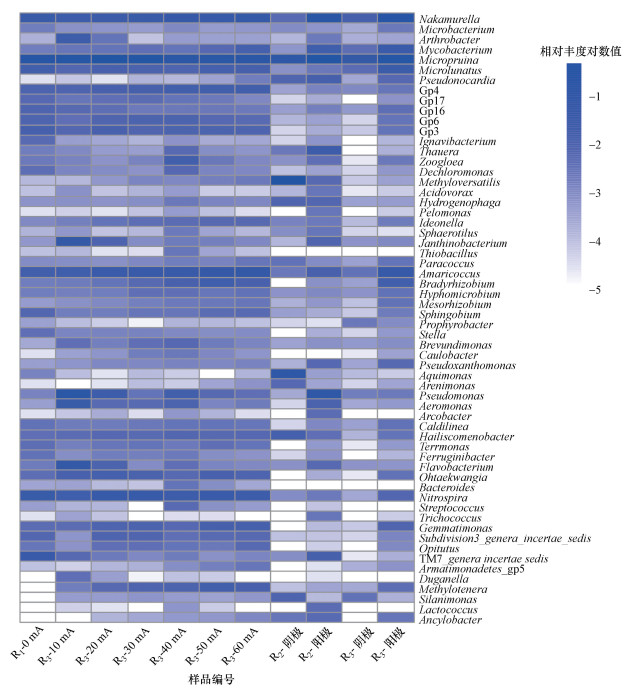 |
| 图 6 不同电流强度下各反应器活性污泥微生物群落结构热图(属水平, 相对丰度 > 0.20%, 图中相对丰度以10为底取对数) Fig. 6Heat map of genera (abundance>0.20%, the abundance was indicated by a color gradient after log10 transformation) of activated sludge microorganisms in reactors under different currents |
阴极和阳极微生物群落结构在属水平上差异较大.R2阴极优势微生物(相对丰度 > 0.20%)包括Methyloversatilis(37.07%, 变形菌门)、Micropruina(9.16%, 放线菌门)、Aquimonas(9.12%, 变形菌门)、Haliscomenobacter(1.16%, 拟杆菌门); 阳极优势微生物(相对丰度 > 0.20%)包括Micropruina(27.69%, 放线菌门)、Nakamurella(14.42%, 放线菌门)、Pseudomonas(8.24%, 变形菌门)、Thauera(1.99%, 变形菌门)、Mycobacterium(1.73%, 放线菌门)、Ralstonia(1.28%, 变形菌门)、Pseudonocardia(1.12%, 放线菌门)、TM7_genera_incertae_sedis(1.09%, TM7门).R3阴极优势微生物(相对丰度 > 0.20%)包括Micropruina(5.66%, 放线菌门)、Nakamurella(1.15%, 放线菌门); 阳极优势微生物(相对丰度 > 0.20%)包括Micropruina(24.32%, 放线菌门)、Nakamurella(19.14%, 放线菌门)、Amaricoccus(4.44%, 变形菌门)、Mycobacterium(3.04%, 放线菌门)、Microlunatus(2.60%, 放线菌门)、Bradyrhizobium(1.41%, 变形菌门).R2、R3反应器阴极微生物在属水平上差异较大.Methyloversatilis是专性甲基利用型微生物, Zhang等(2015)研究发现, 在混合营养的反硝化生物反应器中, 异养的Methyloversatilis和Thauera菌成为优势菌属.R2阴极微生物中Methyloversatilis是优势菌属, 这可能是R2反应器第2~4阶段脱氮效率高的原因.R2、R3阳极微生物在属水平上差异较小, 其中, R2反应器中Pseudomonas和Ralstonia菌属成为优势菌属, 且均被报道具有很高的电子传递能力.可见与R3相比, R2阳极微生物中存在更多具有电子传递能力的菌属.
3.5 微生物群落与PLFA组成和电流强度的相关性分析冗余分析(RDA)被用来研究微生物群落与PLFA组成和电流强度之间的关系(图 7).RDA1和RDA2分别可以代表 61.5%和32.6%的总差异.电流I与Gemmatimonas、Methylotenera、Gp4、Mycobacterium、Amaricoccus、Nakamurella和Bradyrhizobium显著正相关(p < 0.05);饱和脂肪酸(SFA)与Zoogloea显著正相关(p < 0.05);不饱和脂肪酸(UFA)与Mycobacterium、Nakamurella显著正相关(p < 0.05), 与Micropruina显著负相关(p < 0.05);反式异构脂肪酸(AFA)与Micropruina显著正相关(p < 0.05), 与Nakamurella显著负相关(p < 0.05).这些菌属随着电流强度的不同, 其相对丰度均发生了较大的变化.且已有研究表明, Mycobacterium(Wenzel et al., 2002)是一类能够降解木质素的好氧细菌, 而其相对丰度与电流大小显著正相关(p < 0.05), 可见随着外加电流的增大, 其相对丰度增加.综上可以看出, 不同电流驯化出不同的微生物群落, 进而对微生物细胞膜PLFA组成产生了影响, 二者的变化是影响出水水质的重要原因.RDA分析显示, 各样品间有较明显的差异, S1与各样品间差异均较大, S2与S3样品间差异较小, S4、S5、S6间差异较小, 空白与S1~S6之间的差异度均较大.
图 7(Fig. 7)
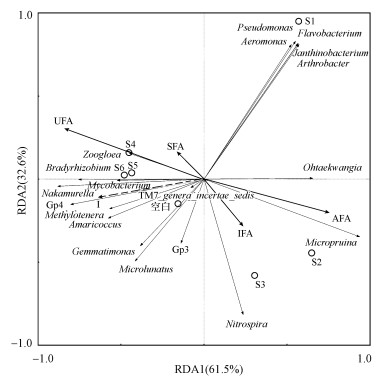 |
| 图 7 微生物群落结构与PLFA组成和电流强度的RDA分析 (SFA、UFA、AFA、IFA分别为饱和、不饱和、反式异构和异构脂肪酸; I:电流; 空白(R1):0 mA; S1~S6(R3):10~60 mA) Fig. 7RDA analysis of microbial community composition in relation to PLFA composition and current (SFA, UFA, AFA and IFA represent saturated, unsaturated, anteiso and iso fatty acid; I represents current; Blank (R1): 0 mA; S1~S6 (R3): 10~60 mA) |
4 结论(Conclusions)1) 30 mA电流条件下, 电极生物膜-活性污泥反应器(R3)木质素去除率最高, 为活性污泥反应器(R1)的2.01倍(p < 0.05).
2) 外加电流会影响活性污泥微生物的细胞膜磷脂组成, 高电流(40~60 mA)与低电流(10~30 mA)相比, 微生物细胞膜磷脂流动性可能降低.
3) 外加电流会改变活性污泥微生物群落结构, R3的悬浮污泥中Flavobacterium、Pseudomonas、Janthinobacterium等可降解木质素的菌属在外加电流的刺激下, 其相对丰度均有所上升.无接种污泥的R2反应器阳极微生物中存在更多具有电子传递能力的菌属.
4) Mycobacterium是一类能够降解木质素的好氧细菌, 其相对丰度与电流大小显著正相关(p < 0.05), 与不饱和脂肪酸(UFA)显著负相关(p < 0.05).
参考文献
| Ailijiang N, Chang J, Liang P, et al. 2016. Electrical stimulation on biodegradation of phenol and responses of microbial communities in conductive carriers supported biofilms of the bioelectrochemical reactor[J]. Bioresource Technology, 201: 1–7.DOI:10.1016/j.biortech.2015.11.026 |
| Begum S A, Batista J R. 2012. Microbial selection on enhanced biological phosphorus removal systems fed exclusively with glucose[J]. World Journal of Microbiology and Biotechnology, 28(5): 2181–2193.DOI:10.1007/s11274-012-1024-3 |
| Bond D R, Lovley D R. 2003. Electricity production by Geobacter sulfurreducens attached to electrodes[J]. Applied and Environmental Microbiology, 69(3): 1548–1555.DOI:10.1128/AEM.69.3.1548-1555.2003 |
| Bugg T D, Ahmad M, Hardiman E M, et al. 2011. The emerging role for bacteria in lignin degradation and bio-product formation[J]. Current Opinion in Biotechnology, 22(3): 394–400.DOI:10.1016/j.copbio.2010.10.009 |
| 曹宏斌, 李鑫钢, 孙津生, 等. 2001. 直流电对硝化细菌活性的影响[J]. 环境科学学报, 2001, 21(4): 420–425. |
| Cao Z, Zhang M, Zhang J, et al. 2016. Impact of continuous and intermittent supply of electric assistance on high-strength 2, 4-dichlorophenol (2, 4-DCP) degradation in electro-microbial system[J]. Bioresource Technology, 212: 138–143.DOI:10.1016/j.biortech.2016.03.165 |
| Fang J S, Lyon D Y, Wiesner M R, et al. 2007. Effect of a fullerene water suspension on bacterial phospholipids and membrane phase behavior[J]. Environmental Science & Technology, 41(7): 2636–2642. |
| Flora J R V, Suidan M T, Biwas P, et al. 1994. Numerical modeling of a biofilm-electrode reactor used for enhanced denitrification[J]. Water Science and Technology, 29: 517–524. |
| 国家环境保护总局. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社. |
| Hao X, Wang Q, Zhang X, et al. 2009. Experimental evaluation of decrease in bacterial activity due to cell death and activity decay in activated sludge[J]. Water Research, 43(14): 3604–3612.DOI:10.1016/j.watres.2009.05.019 |
| 黄丹莲, 曾光明, 黄国和, 等. 2005. 白腐菌固态发酵条件最优化及其降解植物生物质的研究[J]. 环境科学学报, 2005, 25(2): 232–237. |
| Hume N P, Fleming M S, Horne A J. 2002. Plant carbohydrate limitation on nitrate reduction in wetland microcosms[J]. Water Research, 36(3): 577–584.DOI:10.1016/S0043-1354(01)00276-7 |
| Ibarbalz F M, Figuerola E L M, Erijman L. 2013. Industrial activated sludge exhibit unique bacterial community composition at high taxonomic ranks[J]. Water Research, 47(11): 3854–3864.DOI:10.1016/j.watres.2013.04.010 |
| 靳培培. 2014. 电化学-活性污泥耦合技术处理苯酚废水研究[D]. 苏州: 苏州大学. 22-23 |
| Kaneda T. 1991. Iso-fatty and anteiso-fatty acids in bacteria-biosynthesis, function, and taxonomic significance[J]. Microbiological Reviews, 55(2): 288–302. |
| Kao-Kniffin J, Balser T C. 2007. Elevated CO2 differentially alters belowground plant and soil microbial community structure in reed canary grass-invaded experimental wetlands[J]. Soil Biology & Biochemistry, 39(2): 517–525. |
| Kim B H, Kim H J, Hyun M S, et al. 1999. Direct electrode reaction of Fe(Ⅲ)-reducing bacterium, Shewanella putrefaciens[J]. Journal of Microbiology and Biotechnology, 9(2): 127–131. |
| Krishna K V, Sarkar O, Venkata Mohan S. 2014. Bioelectrochemical treatment of paper and pulp wastewater in comparison with anaerobic process:integrating chemical coagulation with simultaneous power production[J]. Bioresource Technology, 174: 142–151.DOI:10.1016/j.biortech.2014.09.141 |
| 李海涛, 姚开, 何强, 等. 2010. 木质素的生物降解及其应用[J]. 皮革科学与工程, 2010, 20(6): 27–31. |
| 刘充, 刘文宗, 王爱杰. 2015. 微生物电解池阳极生物膜功能菌群构建及群落特征分析[J]. 微生物学通报, 2015, 42(5): 845–852. |
| Liu S, Song H, Wei S, et al. 2015. Effect of direct electrical stimulation on decolorization and degradation of azo dye reactive brilliant red X-3B in biofilm-electrode reactors[J]. Biochemical Engineering Journal, 93: 294–302.DOI:10.1016/j.bej.2014.11.002 |
| Liu Z, Liang J, Du W, et al.2011.Study on the aerobic biodegradation of lignin by activated sludge reactor[C].2011 International Symposium on Water Resource and Environmental Protection, ISWREP 2011. Xi'an, China:1999-2002 |
| Logan B E. 2009. Exoelectrogenic bacteria that power microbial fuel cells[J]. Nature Reviews Microbiology, 7(5): 375–381.DOI:10.1038/nrmicro2113 |
| 吕江茜, 张祥, 李飞飞. 2010. 电极生物膜在脱氮方面的研究进展[J]. 山西建筑, 2010, 36(4): 199–201. |
| Ma Q, Qu Y Y, Shen W L, et al. 2015. Bacterial community compositions of coking wastewater treatment plants in steel industry revealed by Illumina high-throughput sequencing[J]. Bioresource Technology, 179: 436–443.DOI:10.1016/j.biortech.2014.12.041 |
| Ma S J, Ding L L, Huang H, et al. 2016. Effects of DO levels on surface force, cell membrane properties and microbial community dynamics of activated sludge[J]. Bioresource Technology, 214: 645–652.DOI:10.1016/j.biortech.2016.04.132 |
| Marselli B, Garcia-Gomez J, Michaud P A, et al. 2003. Electrogeneration of hydroxyl radicals on Boron-Doped Diamond electrodes[J]. Journal of the Electrochemical Society, 150(3): 79–83.DOI:10.1149/1.1553790 |
| 宓益磊, 樊金红, 马鲁铭. 2009a. 电-生物耦合技术对偶氮染料的去除研究[J]. 环境工程学报, 2009a, 3(8): 1457–1461. |
| 宓益磊, 樊金红, 马鲁铭. 2009b. 电-生物强化技术在水处理中的应用[J]. 水处理技术, 2009b, 35(1): 34–38. |
| Mook W T, Aroua M K T, Chakrabarti M H, et al. 2013. A review on the effect of bio-electrodes on denitrification and organic matter removal processes in bio-electrochemical systems[J]. Journal of Industrial and Engineering Chemistry, 19(1): 1–13.DOI:10.1016/j.jiec.2012.07.004 |
| Nenninger A, Mastroianni G, Robson A, et al. 2014. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli[J]. Molecular Microbiology, 92(5): 1142–1153.DOI:10.1111/mmi.2014.92.issue-5 |
| 庞朝晖, 彭彩红, 周书葵. 2015. 短程电极生物膜处理养殖废水中高氨氮的试验研究[J]. 工业水处理, 2015, 35(7): 43–46.DOI:10.11894/1005-829x.2015.35(7).043 |
| Proia L, Lupini G, Osorio V, et al. 2013. Response of biofilm bacterial communities to antibiotic pollutants in a Mediterranean river[J]. Chemosphere, 92(9): 1126–1135.DOI:10.1016/j.chemosphere.2013.01.063 |
| 荣宏伟, 张耀坤, 张朝升, 等. 2016. INT-ETS活性及AUR和SOUR表征污泥活性的比较[J]. 环境科学研究, 2016, 29(5): 767–773. |
| Sakakibara Y, Flora J R V, Suidan M T, et al. 1994. Modeling of electrochemically-activated denitrifying biofilm[J]. Water Research, 28: 1077–1086.DOI:10.1016/0043-1354(94)90193-7 |
| She P, Song B, Xing X H, et al. 2006. Electrolytic stimulation of bacteria Enterobacter dissolvens by a direct current[J]. Biochemical Engineering Journal, 28(1): 23–29.DOI:10.1016/j.bej.2005.08.033 |
| Smithwick E A H, Turner M G, Metzger K L, et al. 2005. Variation in NH4+ mineralization and microbial communities with stand age in lodgepole pine (Pinus contorta) forests, Yellowstone National Park (USA)[J]. Soil Biology & Biochemistry, 37(8): 1546–1559. |
| 宋亭, 于衍真, 冯岩. 2016. 电-生物耦合技术在废水处理中的研究进展[J]. 中国资源综合利用, 2016, 34(3): 35–40. |
| 苏维丰, 柴立元, 王云燕. 2004. 造纸黑液综合治理的研究进展[J]. 工业水处理, 2004, 24(11): 4–8. |
| Sun Q, Li Z, Wang Y, et al. 2015. A horizontal plug-flow baffled bioelectrocatalyzed reactor for the reductive decolorization of Alizarin Yellow R[J]. Bioresource Technology, 195: 73–77.DOI:10.1016/j.biortech.2015.06.086 |
| 孙振世, 柯强, 陈英旭. 2001. SBR生物脱氮机理及其影响因素[J]. 中国沼气, 2001, 19(2): 14–17. |
| Tice H, Mayilraj S, Sims D, et al. 2010. Complete genome sequence of Nakamurella multipartita type strain (Y-104T)[J]. Standards in Genomic Sciences, 2(2): 168–175.DOI:10.4056/sigs.721316 |
| Velasco-Alvarez N, Gonzalez I, Damian-Matsumura P, et al. 2011. Enhanced hexadecane degradation and low biomass production by Aspergillus niger exposed to an electric current in a model system[J]. Bioresource Technology, 102(2): 1509–1515.DOI:10.1016/j.biortech.2010.07.111 |
| Wang K, Sheng Y, Cao H, et al. 2017. Impact of applied current on sulfate-rich wastewater treatment and microbial biodiversity in the cathode chamber of microbial electrolysis cell (MEC) reactor[J]. Chemical Engineering Journal, 307: 150–158.DOI:10.1016/j.cej.2016.07.106 |
| Wenzel M, Schonig I, Berchtold M, et al. 2002. Aerobic and facultatively anaerobic cellulolytic bacteria from the gut of the termite Zootermopsis angusticollis[J]. Journal of Applied Microbiology, 92(1): 32–40.DOI:10.1046/j.1365-2672.2002.01502.x |
| Wick L Y, Buchholz F, Fetzer I, et al. 2010. Responses of soil microbial communities to weak electric fields[J]. Science of the Total Environment, 408(20): 4886–4893.DOI:10.1016/j.scitotenv.2010.06.048 |
| 谢长校, 孙建中, 李成林, 等. 2015. 细菌降解木质素的研究进展[J]. 微生物学通报, 2015, 42(6): 1122–1132. |
| 许德超, 陈洪波, 李小明, 等. 2014. 静置/好氧/缺氧序批式反应器(SBR)脱氮除磷效果研究[J]. 环境科学学报, 2014, 34(1): 152–159. |
| Xue D, Yao H Y, Ge D Y, et al. 2008. Soil microbial community structure in diverse land use systems:A comparative study using biolog, DGGE, and PLFA analyses[J]. Pedosphere, 18(5): 653–663.DOI:10.1016/S1002-0160(08)60060-0 |
| Zhang L, Zhang C, Hu C, et al. 2015. Sulfur-based mixotrophic denitrification corresponding to different electron donors and microbial profiling in anoxic fluidized-bed membrane bioreactors[J]. Water Research, 85: 422–431.DOI:10.1016/j.watres.2015.08.055 |
| 张盼. 2015. 木质素降解方法的研究进展[J]. 广东化工, 2015, 42(6): 100–101. |
| 赵国智. 2011. 电极生物膜反硝化去除地下水中硝酸盐氮的实验研究[D]. 杭州: 浙江大学. 7-8 |
| 赵梦君, 樊金红, 马鲁铭. 2010. 电-生物技术强化废水处理的机理及应用[J]. 四川环境, 2010, 29(2): 55–60. |
| 周莉娜, 苏润华, 马思佳, 等. 2016. 基于PLFA法分析亚硝氮、硝氮和氨氮对厌氧微生物细菌群落的影响[J]. 环境科学学报, 2016, 36(2): 499–505. |
| 周明明. 2015. 电化学氧化去除氨氮的机理及其应用[D]. 杭州: 浙江工业大学. 28-30 |
| Zhu L, Gao K, Qi J, et al. 2014. Enhanced reductive transformation of p-chloronitrobenzene in a novel bioelectrode-UASB coupled system[J]. Bioresource Technology, 167: 303–309.DOI:10.1016/j.biortech.2014.05.116 |
| Zhu T, Zhang Y, Quan X, et al. 2015. Effects of an electric field and iron electrode on anaerobic denitrification at low C/N ratios[J]. Chemical Engineering Journal, 266: 241–248.DOI:10.1016/j.cej.2014.12.082 |
| 朱现信. 2005. 高压静电场促进活性污泥絮体沉淀和改善其活性的研究[D]. 北京: 北京工业大学. 44-45 |
