 , 刘倩1,2, 周群芳1,2
, 刘倩1,2, 周群芳1,2
 , 江桂斌1,2
, 江桂斌1,21. 中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室, 北京 100085;
2. 中国科学院大学资源环境学院, 北京 100049
收稿日期: 2017-09-12; 修回日期: 2017-11-07; 录用日期: 2017-11-16
基金项目: 中国科学院战略性先导科技专项B类(No.14040302);中国科学院前沿科学重点研究项目(No.QYZDJ-SSW-DQC017)
作者简介: 张冰洁(1992—), 女, E-mail:zbjiecrystal@163.com
通讯作者(责任作者): 周群芳, E-mail:zhouqf@rcees.ac.cn
摘要: 对二甲苯作为一种重要的苯系物化工原料,生产使用量非常大.进入人体的对二甲苯主要在肝脏中代谢,生成对甲基苄醇和对甲基苯甲酸.目前,关于对二甲苯及其代谢物的肝脏毒性数据仍不够充分.本研究以人肝癌细胞(HepG2)作为实验模型,在细胞层面评价了对二甲苯及其代谢产物(对甲基苄醇和对甲基苯甲酸)的毒性效应,着重探讨了化合物对细胞活力、细胞膜完整性、细胞凋亡的影响.研究结果显示,对二甲苯及其代谢产物对HepG2细胞的急性毒性大小顺序为:对甲基苄醇>对甲基苯甲酸>对二甲苯.显然,对二甲苯在机体内发生代谢转化后具有毒性增加的趋势.另外,对二甲苯及其代谢产物暴露能够引起细胞膜破损,导致细胞坏死,并诱导一定程度的细胞凋亡现象.该研究发现为对二甲苯作为常见溶剂的生产使用提供了安全性评价的重要科学数据.
关键词:对二甲苯代谢物HepG2细胞细胞活力细胞毒性
The cellular toxicities of p-xylene and its metabolites based on HepG2 cell model
ZHANG Bingjie1,2
 , LIU Qian1,2, ZHOU Qunfang1,2
, LIU Qian1,2, ZHOU Qunfang1,2
 , JIANG Guibin1,2
, JIANG Guibin1,2 1. State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
2. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049
Received 12 September 2017; received in revised from 7 November 2017; accepted 16 November 2017
Supported by the Strategic Priority Research Program of the Chinese Academy of Science(No.14040302) and the Chinese Academy of Sciences(No.QYZDJ-SSW-DQC017)
Biography: ZHANG Bingjie (1992—), female, E-mail:zbjiecrystal@163.com
*Corresponding author: ZHOU Qunfang, E-mail:zhouqf@rcees.ac.cn
Abstract: As one of the most important industrial chemicals, p-xylene is widely used in diverse commercial products, including gasoline, paints, glues and thinners. P-xylene is produced in large amount. However, the knowledge on p-xylene and its metabolites' hepatic toxicity is still far from enough. Based on human hepatocellular carcinoma cell line (HepG2), the cellular toxicities were evaluated for p-xylene and its two main metabolites, 4-methybenzyl alcohol and p-toluic acid. The cellular viability, membrane integrity and apoptosis were investigated upon the treatments of those three chemicals, respectively. The results showed that the toxic potency for these three chemicals was 4-methybenzyl alcohol > p-toluic acid > p-xylene, indicating the metabolism process of p-xylene increased its toxicity. This study provided a new evidence for the risk assessment of p-xylene exposure. Cellular toxicity analysis showed that the integrity of cellular membrane was damaged, which induced the cellular necrosis combined with increased apoptosis by all these 3 chemicals. This study greatly helped to explain the potential risks of p-xylene during its production and usage.
Key words: p-xylene and its metabolitesHepG2 cell modelcell viabilitycellular toxicity
1 引言(Introduction)对二甲苯是一种重要的化工原料, 主要用于生产精对苯二甲酸(PTA)(宫雨等, 2017), 而PTA是生产重要化工高分子材料聚对苯二甲酸乙二醇酯(简称聚酯)的主要原料(常敏, 2016).我国既是PX生产大国, 也是世界上最大的PX消费国(钱伯章, 2015).2016年我国PX产量达970×104 t, 同比增长6%(骆红静等, 2017), 新增项目7个, 新增产能500×104 t以上.有研究表明, 在石油炼化过程中会排放大量的苯系物, 其中包括对二甲苯.这些化学品主要来自于储罐无组织排放、溶剂挥发、生产装置泄漏、工艺排放及废水运输与处理过程挥发等等(Lyu et al., 2016).在长三角石化厂炼油区内间/对二甲苯的排放量为所测苯系物之首, 浓度高达30.33 μg·m-3(Mo et al., 2015).在某些职业暴露中, 间/对二甲苯的非致癌风险危害熵值(HQ)高达0.08, 远高于甲苯等其它苯系物(林瑜等, 2015).由此可见, 对二甲苯对人体可能存在着不可忽视的暴露风险.另外, 监测北京典型城区环境空气中16种苯系物, 间/对二甲苯、甲苯及乙苯的浓度水平在4个季节中均居于前5位(杨婷等, 2017), 表明对二甲苯的非职业暴露也应引起关注.
通常来说, 二甲苯暴露途径主要有3种:吸入、皮肤吸收与口服摄入.在职业性接触中, 二甲苯主要经呼吸道进入身体(陈丹等, 2017).二甲苯溶液由于其非极性与脂溶性特征, 也可经完整皮肤吸收, 如果长时间接触, 可有效通过皮肤渗入机体(环境保护部, 2009).进入机体的对二甲苯90%以上通过肝脏代谢, 少量通过呼吸或尿液排出.采用人体肝脏微粒体的研究显示, 对二甲苯的代谢主要通过细胞色素P450催化甲基发生羟基化反应生成甲基苄醇, 醇基团进一步氧化成羧基, 即对甲基苯甲酸, 在与甘氨酸或葡萄糖醛酸结合下, 生成甲基马尿酸, 最后通过尿液排出(Luttrell, 2012).
国内外研究****对由3种同分异构体组成的二甲苯混合物进行了大量的毒理学研究.水生生物毒理学实验显示, 二甲苯暴露会造成斑马鱼出现明显不适症状, 表现为在水中剧烈无序游动, 并发生死亡现象.二甲苯对斑马鱼胚胎可产生致死、致畸作用, 可严重影响斑马鱼的正常发育(范亚维, 2009).二甲苯与甲苯、乙苯联合暴露时, 其毒性作用主要表现为相加作用(李学峰等, 2013);与甲醛同时暴露时, 毒性具有协同作用(张婷等, 2012).另有研究发现, 二甲苯暴露对生物体可产生一定的神经毒性效应(Yan et al., 2002), 对脑组织具有明显的损伤作用(张自强等, 2014);还可引起生殖毒性(位兰等, 2011a)、胚胎发育毒性(吕丹瑜等, 2006)、呼吸系统毒性(位兰等, 2011b).另外, 通过对水生植物的暴露研究显示, 二甲苯也可表现出明显的毒性效应(严莎, 2012;王摆等, 2014).
由于对二甲苯主要在机体肝脏中进行代谢, 因此研究对二甲苯的肝脏毒性具有重要意义.人群职业暴露调查显示, 二甲苯暴露可引起人血液转氨酶水平的瞬态升高(Klaucke et al., 1982), 并造成肝脏细胞形成空泡(Morley et al., 1970).细胞超微结构分析显示, 二甲苯的暴露可造成实验动物肝细胞内质网增生(Ungvary, 1990)、线粒体畸形、自噬体增多等现象(Tatrai et al., 1980).二甲苯与甲醛、苯、甲苯的混合暴露会引起小鼠肝脏的萎缩和退行性改变(李崇磊等, 2012).另外, 对二甲苯暴露还可引起肝脏器官的肿大(Ungvary et al., 1980), 影响肝脏内抗氧化酶系的活性(上官旖旎等, 2011), 细胞色素P450的水平增加, 并提高其他外源性物质代谢酶的含量(Simmoons et al., 1991).虽然目前已有一些研究报道在个体、细胞与分子水平上阐释了对二甲苯混合物或对二甲苯的肝脏毒性效应, 但关于对二甲苯代谢物的肝脏毒性效应尚不明确, 因此针对对二甲苯及其代谢物开展相关毒理学效应研究具有重要意义.本研究基于人肝癌细胞模型HepG2, 在细胞活力研究的基础上, 比较了对二甲苯以及其主要代谢产物(对甲基苄醇与对甲基苯甲酸)的毒性大小, 评价了化合物暴露对细胞膜完整性、细胞坏死以及细胞凋亡的影响, 为对二甲苯及其主要代谢产物的环境暴露风险评价提供了基础毒性数据.
2 材料与方法(Materials and methods)2.1 实验仪器、试剂与材料2.1.1 实验仪器二氧化碳培养箱(3111型, Thermo Fisher Scientific, USA)、生物安全柜(ZSB-900IIA2, 上海智城分析仪器制造有限公司)、全波长多功能酶标仪(Varioskan Flash, Thermo Fisher Scientific, USA)、细胞分析仪(Muse, Merk Millipore, GER)、倒置显微镜(CKX31, Olympus, JP)、低温高速台式离心机(Fresco21, Thermo Fisher Scientific, USA)、低速离心机(LD5-2B, 北京雷勃尔离心机有限公司)、电热恒温水浴箱(SY-1210, Safe Temp, USA)、涡旋震荡器(QL-866, 其林贝尔仪器制造有限公司)、电热恒温培养箱(DHP420型, 北京市永光明医疗仪器厂).
2.1.2 实验试剂与材料人肝癌细胞HepG2购于中国医学科学院基础医学研究所基础医学细胞中心.DMEM高糖培养基、磷酸盐缓冲液(PBS)购于美国HyClone公司, 胎牛血清(FBS)及青链霉素混合液(双抗)均购于美国Gibco公司.对二甲苯(纯度为99%以上)、对甲基苯甲酸(纯度为98%以上)购于美国Sigma-Aldrich公司, 对甲基苄醇(纯度为98%以上)购于百灵威公司.CytoTox-ONE均质细胞膜完整性检测试剂盒购于美国Promega公司, Muse Count Viability Kit与Muse Annexin V Dead Cell Kit均购于美国Merck Millipore公司.实验过程中使用的其它试剂均购于美国Sigma-Aldrich公司.
对二甲苯母液浓度为8 mol·L-1, 对甲基苄醇、对甲基苯甲酸的母液采用二甲基亚砜(DMSO)配制, 浓度分别为2.5 mol·L-1与2 mol·L-1.
2.2 HepG2细胞培养与暴露HepG2细胞采用加入10%(V/V)FBS、100 U·mL-1青霉素及100 μg·mL-1链霉素的DMEM高糖培养基进行培养.培养条件为37 ℃、5%CO2, 每1~2 d更换1次培养基, 细胞长至80%~90%汇合时进行传代.采用处于对数生长期的细胞进行暴露实验.给药前4 h, 细胞培养液替换为含1%牛血清白蛋白(BSA)的DMEM高糖培养基作为暴露用培养基.使用暴露培养基将3种目标化合物进行梯度稀释获得系列暴露溶液.根据对甲基苄醇、对甲基苯甲酸暴露体系中引入的最高DMSO浓度, 设置2.5% (V/V)DMSO作为溶剂对照.在本研究所涉及的所有测试中, 溶剂对照组与空白对照组实验结果均无显著性差异, 因此溶剂的引入未对本研究的毒性测试造成明显影响, 后续描述中将溶剂对照组命名为阴性对照组.由于对二甲苯本身为液体, 可直接稳定分散在培养基中, 因此对于该化合物暴露效应分析比较基于空白对照组.
2.3 细胞活力测定按照80万/孔的密度将细胞接种于6孔板.根据预实验中暴露浓度筛选结果, 将HepG2细胞分别暴露于对二甲苯(10、20、30、40、50、60、80、100 mmol·L-1)、对甲基苄醇(5、10、15、20、25 mmol·L-1)和对甲基苯甲酸(10、20、30、40、50 mmol·L-1), 暴露时间为24 h.另外, 向未给药的空白对照组中加入等体积的暴露用培养基.
暴露结束后, 将6孔板每孔的活细胞及上清液中残留的死细胞分别收集到离心管中, 在室温下以180 g离心5 min, 吸弃上清液, 离心管底部细胞用暴露用培养基重悬.吸取450 μL Muse Count Viability Kit检测试剂盒中检测试剂(使用前平衡至室温)至1.5 mL离心管中, 再加入50 μL细胞悬液, 混合均匀后, 染色5~10 min.利用Muse细胞分析仪进行样品检测, 并统计在不同暴露浓度下细胞的存活率.
2.4 乳酸脱氢酶(LDH)释放测定按照2.5万/孔的密度将细胞接种于96孔板.将HepG2细胞分别暴露于对二甲苯(10、20、30、40、50、60、80、100 mmol·L-1)、对甲基苄醇(5、10、15、20 mmol·L-1)和对甲基苯甲酸(10、20、30 mmol·L-1), 暴露时间为24 h.另外, 向未给药的空白对照组中加入等体积的暴露用培养基.
药物暴露24 h后, 将96孔板置于室温20~30 min.向用于阳性对照测试的培养孔中加入2 μL细胞裂解液, 使细胞充分裂解.每孔吸弃100 μL上清液后, 按照CytoTox-ONE均质细胞膜完整性检测试剂盒的操作流程, 向每个测试孔中加入相应检测试剂, 轻摇30 s, 室温放置10 min, 使其充分反应.加入终止液后, 利用酶标仪检测(激发光560 nm, 发射光590 nm).测试结果以阳性对照组细胞膜破损率为100%, 分析比较其它各实验组细胞膜的相对受损情况.
2.5 细胞凋亡测试按照细胞活力测试实验中所述方法进行细胞铺板和化合物暴露, 24 h后将6孔板每孔的活细胞及上清液中残留的死细胞分别收集到离心管中, 在室温下以180 g离心5 min, 吸弃上清液, 离心管底部细胞用暴露用培养基重悬.每组取100 μL细胞悬液置于1.5 mL离心管中, 按照Muse Annexin V Dead Cell Kit检测试剂盒的操作流程进行染色, 最后利用细胞分析仪进行样品检测.按照试剂盒说明书中的分析方法, 将实验获得的双参数散点图根据各暴露组所对应的空白或阴性对照组细胞群分布情况设定十字交叉线进行分相分析, 以获得各实验组中健康细胞、早期凋亡或晚期凋亡细胞的比例.
2.6 统计分析每个处理组均平行设置3个复孔, 每个实验独立重复3次, 以确定实验分析的可重复性.实验结果以平均值±标准差表示.除对二甲苯暴露组与空白对照组进行显著性差异分析外, 其它各暴露组均与阴性对照组进行显著性差异分析, 检验方法采用单因素方差分析(ANOVA).当*p<0.05时, 认为有显著性差异;当* *p<0.01时, 认为有极显著性差异.
3 结果与讨论(Results and discussion)3.1 对二甲苯及其代谢物对HepG2细胞活力的影响由图 1可知, 对二甲苯、对甲基苯甲酸和对甲基苄醇对HepG2暴露24 h, 均可造成细胞活力的明显抑制作用, 并且这种抑制作用随暴露浓度增加而增强, 存在明显的剂量-效应关系.利用logistic方程拟合原始数据, 计算得出对二甲苯、对甲基苯甲酸和对甲基苄醇的24 h IC50分别为(53.03 ± 0.51)、(31.06 ± 0.25)、(13.26 ± 0.13) mmol·L-1.由此可见, 3种化合物对HepG2的细胞毒性顺序为:对甲基苄醇>对甲基苯甲酸>对二甲苯.对甲基苄醇与对甲基苯甲酸作为对二甲苯在体内的代谢产物(Luttrell, 2012), 其细胞毒性显著高于对二甲苯本身, 表明对二甲苯在体内的代谢过程可导致其毒性作用增加.
图 1(Fig. 1)
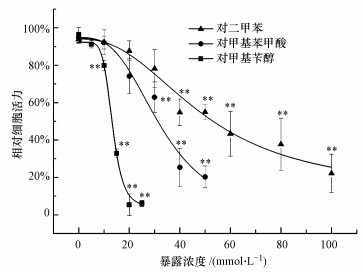 |
| 图 1 HepG2暴露于对二甲苯及其代谢物中24 h后的细胞活力变化(实验结果表示为平均值±标准差, * *p<0.01) Fig. 1Effects of p-xylene and its metabolites on cellular viability of HepG2 after 24 h exposure (the result is expressed as mean ± standard deviation (SD), * *p < 0.01) |
3.2 对二甲苯及其代谢物对HepG2细胞膜完整性的影响LDH是细胞中普遍存在的一种糖酵解酶(Cho et al., 2008).当细胞膜结构受到破坏后, LDH会释放到细胞外, 因此LDH的胞外释放是评价细胞膜完整性的重要指标, 被广泛应用于细胞毒理学分析中(Han et al., 2011).预实验结果显示, 高浓度对甲基苯甲酸和对甲基苄醇本身会干扰LDH的检测, 因此进行该实验研究时选取了对LDH测试无干扰的暴露浓度, 对甲基苯甲酸与对甲基苄醇的浓度分别控制在30 mmol·L-1与20 mmol·L-1以内, 实验结果如图 2所示.显然, 对二甲苯、对甲基苯甲酸和对甲基苄醇对细胞膜的完整性均有不同程度的影响, 且存在明显的剂量-效应关系.通过计算得出对二甲苯、对甲基苯甲酸和对甲基苄醇诱导HepG2细胞LDH释放的24 h EC20分别为(29.80±0.51)、(18.03±0.15)和(10.41±0.10) mmol·L-1, 3种化合物对细胞膜破坏能力的大小顺序为对甲基苄醇>对甲基苯甲酸>对二甲苯, 这与细胞活力的测试结果一致.相比较而言, 通过logistic方程拟合得到的对二甲苯、对甲基苯甲酸和对甲基苄醇对HepG2细胞活力的24 h IC20分别为(25.76±0.51)、(18.44±0.26)和(9.98±0.13) mmol·L-1, 这些数值与上述LDH分析结果大致相当.细胞膜完整性破坏一般发生在细胞坏死或细胞凋亡的晚期(管增伟等, 2000), 为客观评价化合物对细胞的毒性效应, 在细胞活力与细胞膜完整性评价基础上, 化合物可能对细胞凋亡产生的诱导效应值得深入探讨.
图 2(Fig. 2)
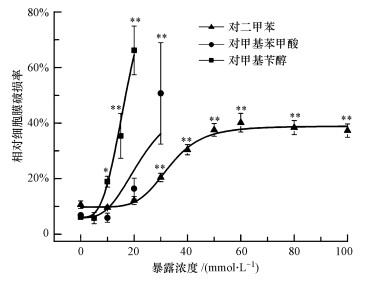 |
| 图 2 HepG2暴露于对二甲苯及其代谢物中24 h后细胞膜完整性的变化情况(实验结果表示为平均值±标准差, *p<0.05, * *p<0.01) Fig. 2Effects of p-xylene and its metabolites on cell membrane integrity of HepG2 after 24 h exposure (the result is expressed as mean±SD, *p < 0.05, * *p < 0.01) |
3.3 对二甲苯及其代谢物对HepG2细胞凋亡的影响细胞凋亡是指在特定的生理或病理条件下, 由基因控制的细胞程序性死亡的过程(赵彦超, 2013).在细胞凋亡的早期, 磷酯酰丝氨酸, 一种分布在细胞膜内表面带负电荷的磷脂, 会从细胞膜的内侧翻转到细胞膜的表面, 进而暴露在细胞外环境中(潘春留, 2009).利用这一凋亡特征, 通过Annexin V-FITC/PI双标记法可以准确地评价细胞的凋亡水平(张伟等, 2014).通过流式细胞仪分析3种化合物诱导HepG2细胞凋亡效应的实验结果(图 3).与相应的空白或阴性对照相比, 3种化合物都不同程度地引起了细胞出现早期或晚期凋亡现象, 并且化合物暴露引起的细胞早期与晚期凋亡/死细胞数目与暴露浓度呈现一定的相关性.
图 3(Fig. 3)
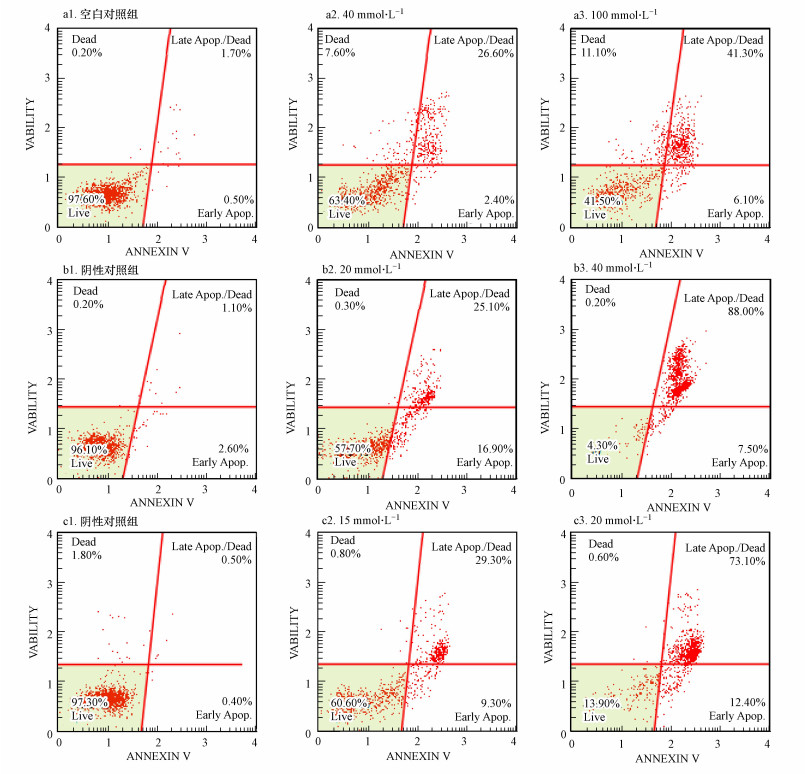 |
| 图 3 对二甲苯(a)、对甲基苯甲酸(b)、对甲基苄醇(c)暴露24 h对HepG2细胞凋亡的流式分析结果 Fig. 3The flow cytometry analysis results of cell apoptosis of HepG2 after 24 h exposure of p-xylene (a), p-toluic acid (b) and 4-methybenzyl alcohol (c) |
通过对不同相细胞数目的统计学分析显示, 随着3种化合物暴露浓度升高, 活细胞比例下降, 凋亡细胞和坏死细胞总比例上升, 且呈现明显的剂量依赖关系(图 4).对二甲苯、对甲基苯甲酸和对甲基苄醇诱导HepG2细胞凋亡发生的最低有效浓度(LOECs)分别为40、10和15 mmol·L-1(图 5).当暴露浓度为20 mmol·L-1时, 对二甲苯、对甲基苯甲酸、对甲基苄醇暴露组早期凋亡、晚期凋亡/死细胞所占比例和分别为10%、40%和80%.显然, 这3种化合物诱导细胞凋亡的能力顺序为:对甲基苄醇>对甲基苯甲酸>对二甲苯, 这一结果与前面的细胞活力与细胞膜完整性测试结果完全一致.
图 4(Fig. 4)
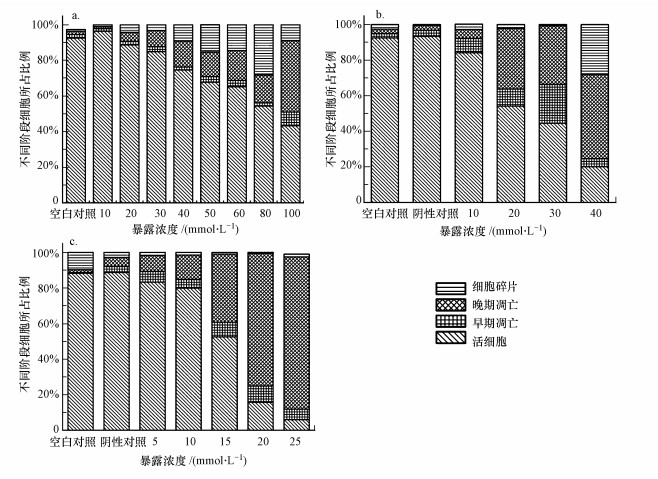 |
| 图 4 对二甲苯(a)、对甲基苯甲酸(b)、对甲基苄醇(c)暴露24 h后HepG2在不同凋亡阶段的细胞分布情况 Fig. 4Different apoptosis stages distribution among the apoptosis HepG2 cell after 24 h exposure to p-xylene (a), p-toluic acid (b) and 4-methybenzyl alcohol (c) |
图 5(Fig. 5)
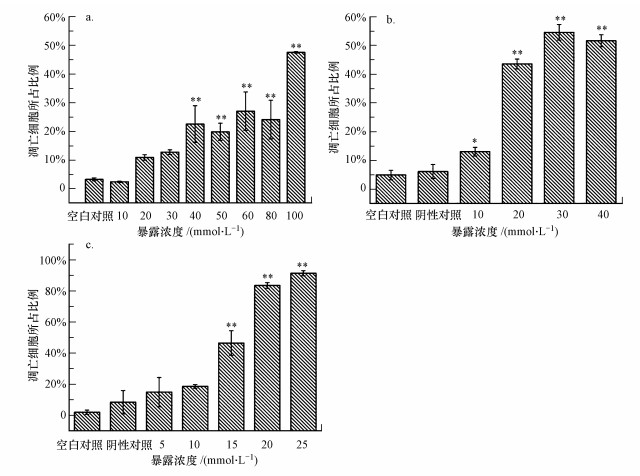 |
| 图 5 对二甲苯(a)、对甲基苯甲酸(b)、对甲基苄醇(c)暴露24 h后HepG2凋亡细胞所占比例(实验结果表示为平均值±标准差, *p<0.05, * *p<0.01) Fig. 5The proportion of apoptosis cells in HepG2 after 24 h of exposure to p-xylene (a), p-toluic acid (b) and 4-methybenzyl alcohol (c) (the result is expressed as mean ± SD, *p < 0.05, * *p < 0.01) |
4 结论(Conclusions)3种化合物均可明显抑制HepG2细胞活力、破坏细胞膜完整性、诱导细胞凋亡, 且呈现出典型的剂量-效应关系.3种化合物细胞毒性顺序为对甲基苄醇>对甲基苯甲酸>对二甲苯.由此可见, 对二甲苯在肝脏中的生物代谢过程可能导致其毒性效应增强, 因此对这种化合物进行生物安全性评价时应给予一定关注.另外, 对二甲苯及其代谢物共存情况下可能引起的混合毒性效应仍需深入研究.本研究获得的关于对二甲苯及其代谢产物的基础毒理学数据, 对这类化合物的健康风险评价具有重要的科学指导意义.
参考文献
| 常敏. 2016. 2015年中国聚对苯二甲酸乙二醇酯市场分析及前景展望[J]. 中国石油和化工经济分析, 2016(9): 61–63. |
| 陈丹, 张志娟, 高飞龙, 等. 2017. 珠江三角洲某炼油厂苯系物的健康风险评价[J]. 中国环境科学, 2017, 37(05): 1961–1970.DOI:10.3969/j.issn.1000-6923.2017.05.045 |
| Cho M H, Niles A, Huang R L, et al. 2008. A bioluminescent cytotoxicity assay for assessment of membrane integrity using a proteolytic biomarker[J]. Toxicology in Vitro, 22(4): 1099–1106.DOI:10.1016/j.tiv.2008.02.013 |
| 范亚维. 2009. 水体甲苯、乙苯和二甲苯对斑马鱼的毒性效应[J]. 生态毒理学报, 2009, 4(1): 136–141. |
| Han X, Gelein R, Corson N, et al. 2011. Validation of an LDH assay for assessing nanoparticle toxicity[J]. Toxicology, 287(1/3): 99–104. |
| 宫雨, 秦曼曼, 姜洪殿, 等. 2017. 对我国PX产业发展的战略思考[J]. 现代化工, 2017, 37(03): 1–5. |
| 管增伟, 王盛兰, 李勇, 等. 2000. 凋亡细胞细胞膜和线粒体的动态变化[J]. 卫生研究, 2000(02): 21–24. |
| 黄树辉, 马建腾, 章尼娜, 等. 2013. 微囊藻毒素-LR和二甲苯对斑马鱼胚胎的毒性作用[J]. 环境与健康杂志, 2013, 30(04): 308–311. |
| Klaucke D N, Johansen M, Vogt R L. 1982. An outbreak of xylene intoxication in a hospital[J]. American Journal of Industrial Medicine, 3(2): 173–178.DOI:10.1002/(ISSN)1097-0274 |
| 李崇磊, 王凡, 刘薇, 等. 2012. 甲醛及苯系物混合暴露对小鼠肺脏的氧化损伤作用[J]. 生态毒理学报, 2012, 7(01): 87–92. |
| 李学峰, 周启星, 罗义. 2013. 甲苯、乙苯和二甲苯对中华新米虾的毒性效应[J]. 中国环境科学, 2013, 33(03): 530–537.DOI:10.3969/j.issn.1000-6923.2013.03.022 |
| 林瑜, 叶芝祥, 杨怀金. 2015. 制鞋工业区环境空气中BTEX污染特征及健康风险评价[J]. 环境科学与技术, 2015, 38(S1): 445–448. |
| 骆红静, 赵睿. 2017. 中国对二甲苯市场2016年回顾与展望[J]. 当代石油石化, 2017, 25(05): 25–28.DOI:10.3969/j.issn.1009-6809.2017.05.005 |
| Luttrell W E. 2012. Toxic tips:Xylene[J]. Journal of Chemical Health and Safety, 19(02): 34–5.DOI:10.1016/j.jchas.2012.01.008 |
| 吕丹瑜, 刘雅琼, 刘宁, 等. 2006. 二甲苯对妊娠小鼠及胚胎发育的毒性作用[J]. 解剖学报, 2006(03): 355–359.DOI:10.3321/j.issn:0529-1356.2006.03.024 |
| Lyu X P, Chen N, Guo H, et al. 2016. Ambient volatile organic compounds and their effect on ozone production in Wuhan, central China[J]. Science of the Total Environment, 541: 200–209.DOI:10.1016/j.scitotenv.2015.09.093 |
| Mo Z W, Shao M, Lu S H, et al. 2015. Process-specific emission characteristics of volatile organic compounds (VOCs) from petrochemical facilities in the Yangtze River Delta, China[J]. Science of the Total Environment, 533: 422–431.DOI:10.1016/j.scitotenv.2015.06.089 |
| Morley R, Eccleston D W, Douglas C P, et al. 1970. Xylene poisoning:A report on one fatal case and two cases of recovery after prolonged unconsciousness[J]. Bmj-British Medical Journal, 3(5720): 442–443.DOI:10.1136/bmj.3.5720.442 |
| 潘春留. 2009. 流式细胞术研究细胞凋亡的方法与技术[J]. 现代生物医学进展, 2009, 9(04): 790–793. |
| 钱伯章. 2015. 中国对二甲苯产能与需求分析[J]. 上海化工, 2015, 40(03): 34–38.DOI:10.3969/j.issn.1004-017X.2015.03.008 |
| 上官旖旎, 赵金龙, 陈婷, 等. 2011. 对二甲苯对大弹涂鱼肝脏和白肌抗氧化酶活性的影响[J]. 水产科学, 2011, 30(01): 6–10.DOI:10.3969/j.issn.1003-1111.2011.01.002 |
| Simmons J E, Allis J W, Grose E C, et al. 1991. Assessment of the hepatotoxicity of acute and short-term exposure to inhaled p-xylene in F-344 rats[J]. Journal of Toxicology and Environmental Health, 32(3): 295–306.DOI:10.1080/15287399109531483 |
| Tatrai E, Ungvary G. 1980. Changes induced by o-xylene inhalations in the rat liver[J]. Acta Medica Academiae Scientiarum Hungaricae, 37(2): 211–216. |
| Ungvary G. 1990. The effect of xylene exposure on the liver[J]. Acta Morphol Hung, 38: 245–258. |
| Ungvary G, Tatrai E, Hudak A, et al. 1980. Studies on the embryotoxic effects of ortho-, meta-and para-xylene[J]. Toxicology, 18(1): 61–74.DOI:10.1016/0300-483X(80)90038-4 |
| 王摆, 高士博, 董颖, 等. 2014. 6种苯系物对球等鞭金藻和新月菱形藻的生长抑制[J]. 生态毒理学报, 2014, 9(02): 233–238. |
| 位兰, 李梦云, 张自强, 等. 2011. 二甲苯对小鼠肺组织损伤的初步研究[J]. 动物医学进展, 2011, 32(09): 62–65.DOI:10.3969/j.issn.1007-5038.2011.09.016 |
| 位兰, 罗来强, 张自强, 等. 2011. 二甲苯对小鼠卵巢组织损伤的研究[J]. 中国兽医科学, 2011, 41(09): 950–953. |
| 严莎. 2012. 苯系物对我国典型鱼类和水生植物的毒害效应及其水质基准的研究[D]. 天津: 南开大学. 45-96http://cdmd.cnki.com.cn/Article/CDMD-10055-1013174799.htm |
| Yan S Y, Guo F T, Zhu Q, et al. 2002. Experimental study of the toxic effect of xylene on primary cultured neurocytes[J]. Journal of Navy Medicine, 23(03): 200–202. |
| 杨婷, 李红, 单玄龙, 等. 2017. 北京市典型城区环境空气中苯系物的污染特征、人体健康风险评价与来源分析[J]. 生态毒理学报, 2017(05): 1–39. |
| 张婷, 原福胜, 白雪, 等. 2012. 甲醛和二甲苯联合染毒对小鼠的神经毒性研究[J]. 环境与健康杂志, 2012, 29(02): 155–160. |
| 张伟, 梁智辉. 2014. Annexin V-FITC/PI双标记与Hoechst33342/PI双标记流式细胞术检测细胞凋亡的比较[J]. 细胞与分子免疫学杂志, 2014, 30(11): 1209–1212. |
| 张自强, 刘玉梅, 朱雪敏, 等. 2014. 二甲苯对小鼠脑组织损伤的研究[J]. 中国兽医杂志, 2014, 50(07): 78–80.DOI:10.3969/j.issn.0529-6005.2014.07.029 |
| 赵彦超. 2013. 细胞凋亡通路研究进展[J]. 现代医学, 2013(4): 285–288. |
