4.河北工程大学能源与环境工程学院,邯郸 056038
1.State Key Joint Laboratory of Environmental Simulation and Pollution Control, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
2.Laboratory of Water Pollution Control Technology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
4.School of Energy and Environmental Engineering, Hebei University of Engineering, Handan 056038, China
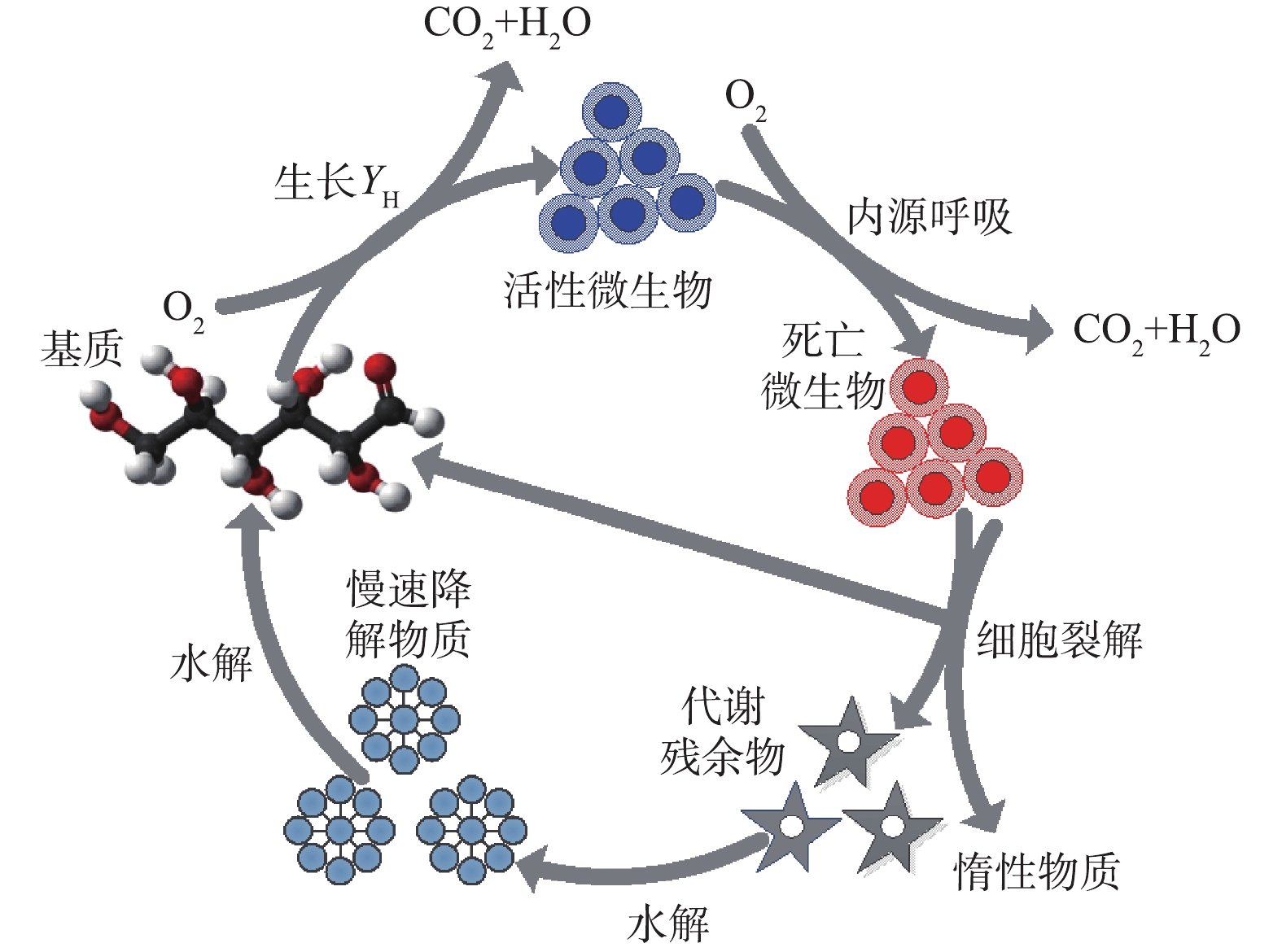
解决剩余污泥问题的关键是将污泥原位减量技术(过程处理)与剩余污泥处理处置技术(末端处理)相结合,对污泥实施联合处理。污泥原位减量技术是在保证出水达标的前提下,尽量促进微生物降解有机物产能用于热逸散而非增殖的一种污水处理技术,其(非生物捕食)主要通过溶胞-隐性生长、解耦联代谢和维持代谢等方式影响污泥中微生物的增殖、衰亡和水解,进而降低剩余污泥产量。为系统了解当前污泥减量技术的驱动机制及关键问题,在分析污泥增殖和微生物新陈代谢途径的基础上,梳理了减量技术对微生物生长(电子受体、代谢解偶联及维持能)、衰减(饥饿、噬菌体、温度、辐射、极端环境及生物抗性)及水解(水解及水解强化)的影响机制及内部驱动,明确了基于微生物代谢过程的减量技术的不足及其对污水处理效果的影响;在总结各类原位减量技术利弊的基础上,展望了污泥原位减量技术的应用前景。
The in-situ sludge reduction technology (process treatment) combined with the excess sludge treatment and disposal technology (end treatment) is the key to solving the sludge problem. The in-situ sludge reduction technology is a sewage treatment technology that promotes microbial degradation of organic matter as much as possible for heat dissipation rather than growth under the premise of ensuring that the effluent meets the standard. It (non-biological predation) mainly uses lysing-recessive growth, decoupling metabolism, and maintenance metabolism affect the proliferation, decay, and hydrolysis of microorganisms in the sludge, thereby inhibiting sludge proliferation and reduce the sludge production. In order to systematically learn about the driving mechanism and key problems for current sludge volume reduction technologies, based on the systematic analysis of sludge proliferation and the microbial metabolism pathways, the impact mechanism and internal driving of the reduction technologies on the microbial growth (electronic balance, metabolic uncoupling and maintenance energy), attenuation (hunger, phage, temperature, radiation, extreme environment and bio-resistance) and hydrolysis (hydrolysis and hydrolysis-enhancement) process were combed, and the deficiencies of reduction technologies based on microbial metabolic process and their impacts on wastewater treatment were clarified. Then various types of in-situ reduction based on the pros and cons of technology were summarized, the application prospects of sludge in-situ reduction technologies are prospected.
.
Sludge growth process
| [1] | 国家统计局城市社会经济调查司. 中国城市建设统计年鉴[M]. 北京: 中国统计出版社, 2018. |
| [2] | 金文标, 王建芳, 赵庆良, 等. 好氧-沉淀-厌氧工艺剩余污泥减量性能和机理研究[J]. 环境科学, 2008, 29(3): 726-732. doi: 10.3321/j.issn:0250-3301.2008.03.031 |
| [3] | WANG G, SUI J, SHEN H, et al. Reduction of excess sludge production in sequencing batch reactor through incorporation of chlorine dioxide oxidation[J]. Journal of Hazardous Materials, 2011, 192(1): 93-98. |
| [4] | 冯权, 邢新会, 刘则华. 以剩余污泥减量化为目标的废水生物处理技术研究进展[J]. 化工进展, 2004, 23(8): 832-836. doi: 10.3321/j.issn:1000-6613.2004.08.007 |
| [5] | 宁欣强, 乔文文, 张蕾, 等. 基于磷脂脂肪酸法分析A+OSA污泥减量工艺微生物群落结构[J]. 环境工程学报, 2015, 9(10): 5024-5030. |
| [6] | KHURSHEED A, SHARMA M K, TYAGI V K, et al. Specific oxygen uptake rate gradient: Another possible cause of excess sludge reduction in oxic-settling-anaerobic (OSA) process[J]. Chemical Engineering Journal, 2015, 281: 613-622. doi: 10.1016/j.cej.2015.06.105 |
| [7] | WANG Y, LI Y, WU G. SRT contributes significantly to sludge reduction in the OSA-based activated sludge process[J]. Environmental Technology Letters, 2017, 38(3): 305-315. doi: 10.1080/09593330.2016.1192223 |
| [8] | LOBOS J, WISNIEWSKI C, HERAN M, et al. Effects of starvation conditions on biomass behaviour for minimization of sludge production in membrane bioreactors[J]. Water Science & Technology, 2005, 51(6/7): 35-44. |
| [9] | HE M H, WEI C H. Performance of membrane bioreactor (MBR) system with sludge Fenton oxidation process for minimization of excess sludge production[J]. Journal of Hazardous Materials, 2010, 176(1/2/3): 597-601. |
| [10] | MA H, ZHANG S, LU X, et al. Excess sludge reduction using pilot-scale lysis-cryptic growth system integrated ultrasonic/alkaline disintegration and hydrolysis/acidogenesis pretreatment[J]. Bioresource Technology, 2012, 116: 441-447. doi: 10.1016/j.biortech.2012.03.091 |
| [11] | WEI Y, VAN HOUTEN R T, BORGER A R, et al. Minimization of excess sludge production for biological wastewater treatment[J]. Water Research, 2003, 37(18): 4453-4467. doi: 10.1016/S0043-1354(03)00441-X |
| [12] | GUO J S, FANG F, YAN P, et al. Sludge reduction based on microbial metabolism for sustainable wastewater treatment[J]. Bioresource Technology, 2019, 297: 122506. |
| [13] | HAN H, HEMP J, PACE L A, et al. Adaptation of aerobic respiration to low O2 environments[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(34): 14109-14114. doi: 10.1073/pnas.1018958108 |
| [14] | WEIJERS S R, VANROLLEGHEM P A. A procedure for selecting best identifiable parameters in calibrating activated sludge model No. 1 to full-scale plant data[J]. Water Science & Technology, 1997, 36(5): 69-79. |
| [15] | 李颖, 文莹, 关国华, 等. 微生物生理学[M]. 北京: 科学出版社, 2009. |
| [16] | ORHON D, S?ZEN S, ARTAN N. The effect of heterotrophic yield on the assessment of the correction factor for anoxic growth[J]. Water Science and Technology, 1996, 34(5/6): 67-74. |
| [17] | RUSSELL J B, COOK G M. Energetics of bacterial growth: balance of anabolic and catabolic reactions[J]. Microbiology and Molecular Biology Reviews, 1995, 59(1): 48-62. |
| [18] | MCCARTY P L. Energetics of organic matter degradation[M]//MITCHELL R. Water Pollution Microbiology. New York, NY, USA, Wiley, 1972. |
| [19] | MCCARTY P L. Stoichiometry of biological reactions[J]. Progress in Water Technology, 1975, 7(1): 157-172. |
| [20] | KUBA T, SMOLDERS G J F, VAN LOOSDRECHT M C M, et al. Biological phosphorus removal from wastewater by anaerobic-anoxic sequencing batch reactor[J]. Water Science & Technology, 1993, 27(5/6): 241-252. |
| [21] | SPERANDIO M, URBAINV, AUDIC J M, et al. Use of carbon dioxide evolution rate for determining heterotrophic yield and characterising denitrifying biomass[J]. Water Science & Technology, 1999, 39(1): 139-146. |
| [22] | 冯芬, 杨恬然, 陈萍, 等. 化能异养微生物呼吸与发酵比较[J]. 生物学杂志, 2016(5): 83-86. doi: 10.3969/j.issn.2095-1736.2016.05.083 |
| [23] | MIKLóS M, MENTEL M, HELLEMOND J J V, et al. Biochemistry and evolution of anaerobic energy metabolism in eukaryotes[J]. Microbiology & Molecular Biology Reviews, 2012, 76(2): 444-95. |
| [24] | EKAMA G, WENTZEL M. Biological Wastewater Treatment Principles, Modelling and Design[M]. Glasgow: IWA Publishing, 2008. |
| [25] | 李亚新. 活性污泥法理论与技术[M]. 北京: 中国建筑工业出版社, 2007. |
| [26] | MITCHELL P. Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism[J]. Nature, 1961, 191(4784): 144-148. doi: 10.1038/191144a0 |
| [27] | LIU Y, TAY J. Strategy for minimization of excess sludge production from the activated sludge process[J]. Biotechnology Advances, 2001, 19(2): 97-107. doi: 10.1016/S0734-9750(00)00066-5 |
| [28] | OlSCHEWSKI A, PAPP R, NAGARAJ C, et al. Ion channels and transporters as therapeutic targets in the pulmonary circulation[J]. Pharmacology & Therapeutics, 2014, 144(3): 349-368. |
| [29] | HALSEY C M, BENHAM D A, JIJIR D, et al. Influence of the lipid environment on valinomycin structure and cation complex formation[J]. Spectrochimica Acta, 2012, 96: 200-206. doi: 10.1016/j.saa.2012.05.022 |
| [30] | TERADA H. Uncouplers of oxidative phosphorylation[J]. Environmental Health Perspectives, 1990, 87(1): 213-218. |
| [31] | GOSTOMSKI P A, VELA R J D. Metabolic uncouplers for controlling biomass accumulation in biological waste treatment systems[J]. Reviews in Environmental Science and Bio/Technology, 2017, 17(1): 1-18. |
| [32] | FANG F, HU H L, QIN M M, et al. Effects of metabolic uncouplers on excess sludge reduction and microbial products of activated sludge[J]. Bioresource Technology, 2015, 185: 1-6. doi: 10.1016/j.biortech.2015.02.054 |
| [33] | XIAO B, LI H, YAN H, et al. Evaluation of the sludge reduction effectiveness of a metabolic uncoupler-tetrakis (hydroxymethyl) phosphonium sulfate in anaerobic/anoxic/oxic process[J]. Desalination & Water Treatment, 2016, 57(13): 5772-5780. |
| [34] | LI P, LI H, LI J, et al. Evaluation of sludge reduction of three metabolic uncouplers in laboratory-scale anaerobic-anoxic-oxic process[J]. Bioresource Technology, 2016, 221: 31-36. doi: 10.1016/j.biortech.2016.09.019 |
| [35] | PAVEL P. Biodegradability of Organic Substances in the Aquatic Environment[M]. Boca Raton, CRC Press, 1990. |
| [36] | CHUDOBA P, CAPDEVILLE B, CHUDOBA J. Explanation of biological meaning of the So/Xo ratio in batch cultivation[J]. IWA Publishing, 1992, 26(5): 743-751. |
| [37] | LIU Y, CHEN G H, PAUL E. Effect of the So/Xo ratio on energy uncoupling in substrate-sufficient batch culture of activated sludge[J]. Water Research, 1998, 32(10): 2883-2888. doi: 10.1016/S0043-1354(98)00071-2 |
| [38] | RUSSELL J B, COOK G M. Energetics of bacterial growth: Balance of anabolic and catabolic reactions[J]. Microbiological Reviews, 1995, 59(1): 48-62. doi: 10.1128/MMBR.59.1.48-62.1995 |
| [39] | COOK G M, RUSSELL J B. Energy-spilling reactions of Streptococcus bovis and resistance of its membrane to proton conductance[J]. Applied and Environmental Microbiology, 1994, 60(6): 1942-1948. doi: 10.1128/AEM.60.6.1942-1948.1994 |
| [40] | RUSSELL J. Energy-Yielding and Energy-Consuming Reactions[M]. The Rumen Microbial Ecosystem. Berlin, Springer Netherlands, 1997. |
| [41] | 梁鹏, 黄霞, 钱易, 等. 污泥减量化技术的研究进展[J]. 环境污染治理技术与设备, 2003, 4(1): 44-52. |
| [42] | 李鹤超, 肖本益, 严红. 污泥减量化与处理处置技术研究与应用现状[J]. 能源与节能, 2014(5): 90-91. doi: 10.3969/j.issn.2095-0802.2014.05.038 |
| [43] | CHUDOBA P, CHUDOBA J, CAPDEVILLE B. The aspect of energetic uncoupling of microbial growth in the activated sludge process: OSA system[J]. Water Science & Technology, 1992, 26(9): 2477-2480. |
| [44] | CHUDOBA P, MOREL A, CAPDEVILLE B. The case of both energetic uncoupling and metabolic selection of microorganisms in the OSA activated sludge system[J]. Environmental Technology, 1992, 13(8): 761-770. doi: 10.1080/09593339209385207 |
| [45] | CHEN G, AN K, SABY S, et al. Possible cause of excess sludge reduction in an oxic-settling-anaerobic activated sludge process (OSA process)[J]. Water Research, 2003, 37(16): 3855-3866. doi: 10.1016/S0043-1354(03)00331-2 |
| [46] | CHON D H, ROME M, KIM Y M, et al. Investigation of the sludge reduction mechanism in the anaerobic side-stream reactor process using several control biological wastewater treatment processes[J]. Water Research, 2011, 45(18): 6021-6029. doi: 10.1016/j.watres.2011.08.051 |
| [47] | FERRENTINO R, LANGONE M, MERZARI F, et al. A review of anaerobic side-stream reactor for excess sludge reduction: Configurations, mechanisms, and efficiency[J]. Critical Reviews in Environmental Science and Technology, 2016, 46(4): 382-405. doi: 10.1080/10643389.2015.1096879 |
| [48] | YE F X, ZHU R F, LI Y. Effect of sludge retention time in sludge holding tank on excess sludge production in the oxic-settling-anoxic (OSA) activated sludge process[J]. Journal of Chemical Technology & Biotechnology: International Research in Process, Environmental & Clean Technology, 2008, 83(1): 109-114. |
| [49] | SABY S, DJAFER M, CHEN G H. Effect of low ORP in anoxic sludge zone on excess sludge production in oxic-settling-anoxic activated sludge process[J]. Water Research, 2003, 37(1): 11-20. doi: 10.1016/S0043-1354(02)00253-1 |
| [50] | LOW E W, CHASE H A. The effect of maintenance energy requirements on biomass production during wastewater treatment[J]. Water Research, 1999, 33(3): 847-853. doi: 10.1016/S0043-1354(98)00252-8 |
| [51] | 郝晓地, 朱景义, 曹亚莉, 等. 污水生物处理系统中内源过程的研究进展[J]. 环境科学学报, 2009, 29(2): 231-242. doi: 10.3321/j.issn:0253-2468.2009.02.002 |
| [52] | PIRT S J. Maintenance energy: A general model for energy-limited and energy-sufficient growth[J]. Archives of Microbiology, 1982, 133(4): 300-302. doi: 10.1007/BF00521294 |
| [53] | PIRT S J. The maintenance energy of bacteria in growing cultures[J]. Proceedings of the Royal Society of London(Series B), 1965, 163(991): 224-231. |
| [54] | VAN L M C M, MOGENS H. Maintenance, endogeneous respiration, lysis, decay and predation[J]. Water Science & Technology, 1999, 39(1): 107-117. |
| [55] | WUNDERLICH R, BARRY J, GREENWOOD D, et al. Start-up of a high-purity, oxygen-activated sludge system at the Los Angeles County Sanitation Districts’ Joint Water Pollution Control Plant[J]. Water Pollution Control Federation, 1985, 57(10): 1012-1018. |
| [56] | TECK H C, LOONG K S, SUN D D, et al. Influence of a prolonged solid retention time environment on nitrification/denitrification and sludge production in a submerged membrane bioreactor[J]. Desalination, 2009, 245(1/2/3): 28-43. |
| [57] | LAERA G, POLLICE A, SATURNO D, et al. Zero net growth in a membrane bioreactor with complete sludge retention[J]. Water Research, 2005, 39(20): 5241-5249. doi: 10.1016/j.watres.2005.10.010 |
| [58] | LAWRENC E, ALONZO W, MCCART Y, et al. Unified basis for biological treatment design and operation[J]. Journal of the Sanitary Engineering Division, 1971, 97(6): 930-933. |
| [59] | WATSON T G. Effects of sodium chloride on steady-state growth and metabolism of Saccharomyces cerevisiae[J]. Journal of General Microbiology, 1970, 64(1): 91-99. doi: 10.1099/00221287-64-1-91 |
| [60] | STRACHAN L F, FREITAS D S L M, LEAK D J, et al. Minimisation of biomass in an extractive membrane bioreactor[J]. Water Science & Technology, 1996, 34(5/6): 273-280. |
| [61] | HAMODA M F, AL-ATTAR I M S. Effects of high sodium chloride concentrations on activated sludge treatment[J]. Water Science and Technology, 1995, 31(9): 61-72. doi: 10.2166/wst.1995.0345 |
| [62] | GIKAS P. Kinetic responses of activated sludge to individual and joint nickel (Ni(II)) and cobalt (Co(II)): An isobolographic approach[J]. Journal of Hazardous Materials, 2007, 143(1/2): 246-256. |
| [63] | ANTONIADIS V, ROBINSON J S, ALLOWAY B J. Effect of short-term pH fluctuations on cadmium, nickel, lead, and zinc availability to ryegrass in a sewage sludge-amended field[J]. Chemosphere, 2008, 71(4): 759-764. doi: 10.1016/j.chemosphere.2007.10.015 |
| [64] | CAI Y, ZHAO X, ZHAO Y, et al. Optimization of Fe2+ supplement in anaerobic digestion accounting for the Fe-bioavailability[J]. Bioresource Technology, 2018, 250: 163-170. doi: 10.1016/j.biortech.2017.07.151 |
| [65] | YEKTA S S, GUSTAVSSON J, SVENSSON B H, et al. Sulfur K-edge XANES and acid volatile sulfide analyses of changes in chemical speciation of S and Fe during sequential extraction of trace metals in anoxic sludge from biogas reactors[J]. Talanta, 2012, 89: 470-477. doi: 10.1016/j.talanta.2011.12.065 |
| [66] | THANH P M, KETHEESAN B, YAN Z, et al. Effect of ethylenediamine-N, N′-disuccinic acid (EDDS) on the speciation and bioavailability of Fe2+ in the presence of sulfide in anaerobic digestion[J]. Bioresource Technology, 2017, 229: 169-179. doi: 10.1016/j.biortech.2016.12.113 |
| [67] | ZHANG W, ZHANG L, LI A. Enhanced anaerobic digestion of food waste by trace metal elements supplementation and reduced metals dosage by green chelating agent [S, S]-EDDS via improving metals bioavailability[J]. Water Research, 2015, 84: 266-277. doi: 10.1016/j.watres.2015.07.010 |
| [68] | SAJANI L S, MOHAN P M. Characterization of a cobalt-resistant mutant of Neurospora crassa with transport block[J]. BioMetals, 1997, 10(3): 175-183. doi: 10.1023/A:1018347627172 |
| [69] | LOWE K L, STRAUBE W, LITTLE B, et al. Aerobic and anaerobic reduction of Cr (VI) by Shewanella oneidensis effects of cationic metals, sorbing agents and mixed microbial cultures[J]. Acta Biotechnologica, 2003, 23(2/3): 161-178. |
| [70] | GIKAS P, ROMANOS P. Effects of tri-valent (Cr(III)) and hexa-valent (Cr(VI)) chromium on the growth of activated sludge[J]. Journal of Hazardous Materials, 2006, 133(1/2/3): 212-217. |
| [71] | RUSSELL J B, WALLACE R J. Energy-Yielding and Energy-Consuming Reactions[M]. Springer, Dordrecht, 1997. |
| [72] | MORBY A P, TURNER J S, HUCKLE J W, et al. SmtB is a metal-dependent repressor of the cyanobacterial metallothionein gene smtA: Identification of a Zn inhibited DNA-protein complex[J]. Nucleic Acids Research, 1993, 21(4): 921-925. doi: 10.1093/nar/21.4.921 |
| [73] | GILLER K E, WITTER E, MCGRATH S P. Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils: A review[J]. Soil Biology and Biochemistry, 1998, 30(10/11): 1389-1414. |
| [74] | STASINAKIS A S, MAMAIS D, THOMAIDIS N S, et al. Effect of chromium Cr(VI) on bacterial kinetics of heterotrophic biomass of activated sludge[J]. Water Research, 2002, 36(13): 3341-3349. doi: 10.1016/S0043-1354(02)00018-0 |
| [75] | CABRERO A, FERNANDEZ S, MIRADA F, et al. Effects of copper and zinc on the activated sludge bacteria growth kinetics[J]. Water Research, 1998, 32(5): 1355-1362. doi: 10.1016/S0043-1354(97)00366-7 |
| [76] | 李冰, 李玉瑛. 镍、铬对活性污泥真实产率的影响[J]. 环境污染与防治, 2007, 29(2): 151-154. doi: 10.3969/j.issn.1001-3865.2007.02.019 |
| [77] | SILVER S. Bacterial resistances to toxic metal ions: A review[J]. Gene, 1996, 179(1): 9-19. doi: 10.1016/S0378-1119(96)00323-X |
| [78] | WHITE D G, ALEKSHUN M N, MCDERMOTT P F. Frontiers in Antimicrobial Resistance: A Tribute to Stuart B. Levy[M]. Washington D C: ASM Press, 2005. |
| [79] | ?ENG?R S S, BARUA S, GIKAS P, et al. Influence of heavy metals on microbial growth kinetics including lag time: Mathematical modeling and experimental verification[J]. Environmental Toxicology and Chemistry, 2009, 28(10): 2020-2029. doi: 10.1897/08-273.1 |
| [80] | VAN L M C M, HENZE M. Maintenance, endogeneous respiration, lysis, decay and predation[J]. Water Science and Technology, 1999, 39(1): 107-117. doi: 10.2166/wst.1999.0024 |
| [81] | 鞠小丽, 陈亮, 陈克平, 等. 程序性细胞死亡 Pyroptosis 最新研究进展[J]. 安徽医科大学学报, 2017, 52(3): 456-461. |
| [82] | 刘文龙, 彭永臻, 苗圆圆, 等. 好氧饥饿对膨胀污泥硝化性能及污泥特性的影响[J]. 化工学报, 2015, 66(3): 1142-1149. doi: 10.11949/j.issn.0438-1157.20141138 |
| [83] | 张秀芳, 刘永健. 浮游植物细胞程序化死亡研究进展[J]. 生态环境学报, 2007, 16(6): 1801-1806. doi: 10.3969/j.issn.1674-5906.2007.06.042 |
| [84] | COHEN S S, BARNER H D. Studies on unbalanced growth in Escherichia Coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 1954, 40(10): 885-893. doi: 10.1073/pnas.40.10.885 |
| [85] | LEE S H, ONUKI M, SATOH H, et al. Isolation, characterization of bacteriophages specific to Microlunatus phosphovorus and their application for rapid host detection[J]. Letters in Applied Microbiology, 2010, 42(3): 259-264. |
| [86] | OTAWA K, LEE S, YAMAZOE A, et al. Abundance, diversity, and dynamics of viruses on microorganisms in activated sludge processes[J]. Microbial Ecology, 2007, 53(1): 143-152. doi: 10.1007/s00248-006-9150-9 |
| [87] | 吴疆, 邓磊, 范昕建. 细菌程序化死亡的研究现状[J]. 生物医学工程学杂志, 2011, 28(1): 199-202. |
| [88] | 张小霞, 张忠信. 病毒对细胞凋亡的影响及作用机理[J]. 中国病毒学, 2002, 17(3): 289-295. |
| [89] | 任杰, 林炜铁, 罗小春, 等. 硝化菌保藏特性及衰减动力学研究[J]. 中国生物工程杂志, 2007, 27(12): 61-65. |
| [90] | SIEGRIST H, BRUNNER I, KOCH G, et al. Reduction of biomass decay rate under anoxic and anaerobic conditions[J]. Water Science & Technology, 1999, 39(1): 129-137. |
| [91] | SLAZER R. Contribution to the determination of kinetic parameters for nitrification in activated sludge plants treating industrial wastewaters[D]. Vienna: Institute of Water Quality, Technical University of Vienna, 1992. |
| [92] | TOM G L V, CHAIM D M, NICO B, et al. Temperature impact on sludge yield, settleability and kinetics of three heterotrophic conversions corroborates the prospect of thermophilic biological nitrogen removal[J]. Bioresource Technology, 2018, 269: 104-112. doi: 10.1016/j.biortech.2018.08.012 |
| [93] | TIJHUIS L, VAN LOOSDRECHT M C M, HEIJNEN J J. A thermodynamically based correlation for maintenance Gibbs energy requirements in aerobic and anaerobic chemotrophic growth[J]. Biotechnology and Bioengineering, 1993, 42(4): 509-519. doi: 10.1002/bit.260420415 |
| [94] | BRDJANOVIC D, SLAMET A, VAN LOOSDRECHT M C M, et al. Impact of excessive aeration on biological phosphorus removal from wastewater[J]. Water Research, 1998, 32(1): 200-208. doi: 10.1016/S0043-1354(97)00183-8 |
| [95] | WANG J L, WANG J Z. Application of radiation technology to sewage sludge processing: A review[J]. Journal of Hazardous Materials, 2007, 143(1/2): 2-7. |
| [96] | KIM T H, NAM Y K, PARK C, et al. Carbon source recovery from waste activated sludge by alkaline hydrolysis and gamma-ray irradiation for biological denitrification[J]. Bioresource Technology, 2009, 100(23): 5694-5699. doi: 10.1016/j.biortech.2009.06.049 |
| [97] | CHU L, WANG J, WANG B. Effect of gamma irradiation on activities and physicochemical characteristics of sewage sludge[J]. Biochemical Engineering Journal, 2011, 54(1): 34-39. doi: 10.1016/j.bej.2011.01.004 |
| [98] | HE S B, WANG B Z, WANG L, et al. A novel approach to treat combined domestic wastewater and excess sludge in MBR[J]. Journal of Environmental Sciences, 2003, 15(5): 674-679. |
| [99] | OH Y K, LEE K R, KO K B, et al. Effects of chemical sludge disintegration on the performances of wastewater treatment by membrane bioreactor[J]. Water Research, 2007, 41(12): 2665-2671. doi: 10.1016/j.watres.2007.02.028 |
| [100] | VENTURA J S, SEO S, CHUNG I, et al. Enhanced reduction of excess sludge and nutrient removal in a pilot-scale A2O-MBR-TAD system[J]. Water Science and Technology, 2011, 63(8): 1547-1556. doi: 10.2166/wst.2011.201 |
| [101] | 邹海明, 吕锡武, 史静, 等. 双污泥反硝化除磷-诱导磷结晶工艺中污泥的衰减特征[J]. 中南大学学报(自然科学版), 2014, 45(3): 997-1003. |
| [102] | BOLLMANN A, SCHMIDT I, SAUNDERS A M, et al. Influence of starvation on potential ammonia-oxidizing activity and amoA mRNA levels of nitrosospira briensis[J]. Applied and Environmental Microbiology, 2005, 71(3): 1276-1282. doi: 10.1128/AEM.71.3.1276-1282.2005 |
| [103] | 占新华, 周立祥, 吴慧兰. 不同无害化处理对污泥中有机组分的影响[J]. 中国环境科学, 2005, 25(1): 1-5. doi: 10.3321/j.issn:1000-6923.2005.01.001 |
| [104] | CHANG J, CHUDOBA P, CAPDEVILLE B. Determination of the maintenance requirements of activated sludge[J]. Soft Computing, 1993, 18(6): 1177-1188. |
| [105] | GOEL R K, NOGUERA D R. Evaluation of sludge yield and phosphorus removal in a Cannibal solids reduction process[J]. Journal of Environmental Engineering, 2006, 132(10): 1331-1337. doi: 10.1061/(ASCE)0733-9372(2006)132:10(1331) |
| [106] | HUANG B, WANG H C, CUI D, et al. Treatment of pharmaceutical wastewater containing β-lactams antibiotics by a pilot-scale anaerobic membrane bioreactor (AnMBR)[J]. Chemical Engineering Journal, 2018, 341(1): 238-247. |
| [107] | DONG Q, PARKER W, DAGNEW M. Impact of FeCl3, dosing on AnMBR treatment of municipal wastewater[J]. Water Research, 2015, 80: 281-293. doi: 10.1016/j.watres.2015.04.025 |
| [108] | GOUVEIA J, PLAZA F, GARRALON G, et al. A novel configuration for an anaerobic submerged membrane bioreactor (AnSMBR). Long-term treatment of municipal wastewater under psychrophilic conditions[J]. Bioresource Technology, 2015, 198: 510-519. doi: 10.1016/j.biortech.2015.09.039 |
| [109] | SHIN C, MCCARTY P L, KIM J, et al. Pilot-scale temperate-climate treatment of domestic wastewater with a staged anaerobic fluidized membrane bioreactor (SAF-MBR)[J]. Bioresource Technology, 2014, 159: 95-103. doi: 10.1016/j.biortech.2014.02.060 |
| [110] | JIANG Y F, WANG L, WANG B Z, et al. Sludge ozonation and its effect on performance of submerged membrane bio-reactor[J]. Journal of Harbin Institute of Technology, 2007, 14(6): 807-811. |
| [111] | DO K U, BANU R J, SON D H, et al. Influence of ferrous sulfate on thermochemical sludge disintegration and on performances of wastewater treatment in a new process: Anoxic-oxic membrane bioreactor coupled with sludge disintegration step[J]. Biochemical Engineering Journal, 2012, 66: 20-26. doi: 10.1016/j.bej.2012.04.013 |
| [112] | YOON S H, KIM H S, LEE S. Incorporation of ultrasonic cell disintegration into a membrane bioreactor for zero sludge production[J]. Process Biochemistry, 2004, 39(12): 1923-1929. doi: 10.1016/j.procbio.2003.09.023 |
| [113] | 王亚炜, 肖庆聪, 阎鸿, 等. 基于微波预处理的源头污泥减量研究[J]. 中国给水排水, 2013, 29(15): 19-23. doi: 10.3969/j.issn.1000-4602.2013.15.005 |
| [114] | 王琳, 王宝贞, 张相忠. 利用臭氧氧化实现污泥减量[J]. 中国给水排水, 2003, 19(5): 38-40. doi: 10.3321/j.issn:1000-4602.2003.05.011 |
| [115] | 安东, 崔福义, 刘冬梅, 等. 宾县水库水经ClO2与Cl2预处理的副产物[J]. 哈尔滨工业大学学报, 2004, 36(5): 627-630. doi: 10.3321/j.issn:0367-6234.2004.05.018 |
| [116] | 张自杰, 林荣枕, 金儒霖. 排水工程[M]. 5版. 北京: 中国建筑工业出版社, 2015. |

 下载:
下载:  点击查看大图
点击查看大图