全文HTML
--> --> -->神经细胞活性的调节, 通常是利用细胞外环境的局部微小扰动来实现的[2], 目前主要有电刺激、超声刺激、磁刺激、光刺激以及光遗传学方法等几种刺激方式[3-6]. 电刺激方法历史悠久, 操作简单且可以精确定量, 但是刺激时需要侵入细胞或者活体, 空间选择性较差[7]. 对神经细胞或神经网络进行刺激的光遗传学工具已成为研究神经回路功能成熟且强大的方法之一[8]. 与电刺激不同, 它利用基因控制要刺激的神经细胞不同亚型的离子通道, 激发或抑制神经细胞活动. 最初的光遗传学方法是利用病毒载体, 将光感基因导入到特定类型的细胞中, 再用特定波长的光照刺激细胞, 使细胞选择性兴奋或抑制, 具有低侵入性和良好的特异性. 但该方式也存在缺陷, 外源基因的引入会带来潜在风险, 用转染病毒来表达光敏蛋白[9]在实际操作中也存在危险性, 并且考虑到伦理问题, 基因工程和转染人体细胞的过程也可能会削弱光遗传学在相关研究中的应用. 通过光刺激细胞来控制细胞膜活动或细胞内信号已成为神经科学研究的一个主要途径. 然而, 传统的可见光激发波段在组织中穿透深度有限(< 100 μm), 近红外光在组织中的散射小、穿透深度大, 且空间选择性好[10,11]. 近些年来, 利用近红外光调节神经细胞活动成为研究热点.
研究表明, 光热效应可以引起细胞膜电容变化, 产生动作电位[12]. de Boer等[13]使用低功率脉冲近红外光证明了小鼠皮层神经细胞的光激活, 还利用这种方法来刺激水螅的个体上皮肌细胞并引起身体收缩. Shapiro等[14]的研究表明, 红外光可以改变细胞膜表面离子的分布从而引起膜电容的变化. 然而, 进一步实验和建模显示, 利用近红外光对神经细胞直接刺激方法并不十分精准, 且多次刺激同一部位时, 不能获得持续增强的效果, 还会导致细胞损伤. 随着研究的深入, 人们发现借助金纳米棒(gold nanorods, GNRs)可以提高细胞刺激效应. 当入射光的波长与GNRs共振频率相匹配时, GNRs可以有效地将吸收的光能转化为热能, 称为局域表面等离子体共振(localized surface plasmon resonance, LSPR). LSPR将量子化的电子振荡限制在纳米级的体积内, 从而大幅度提高光刺激的空间选择性. Paviolo等[12]报道了对GNRs孵育的NG108-15神经细胞进行钙成像, 发现在激光照射时, 细胞内的游离钙水平会升高. 同样, Jo?o等[15] 通过照射细胞膜附近的GNRs对培养的螺旋神经节神经细胞进行刺激, 结果表明增加了大鼠坐骨神经中复合动作电位的幅度. Flavie等[11]利用800 nm的脉冲光刺激标记有GNRs的神经细胞, 实验显示这种刺激会使神经细胞中游离的Ca2+瞬时增加. 通过无损、非侵入性的方式对目标区域进行刺激, 并用相应的Ca2+荧光指示剂进行光学成像, 利用Ca2+空间动态变化[16]来表征局部的Ca2+瞬变状态. 这种纳米粒子辅助光学刺激[11]的方法为控制神经细胞活动和细胞信号传导提供了一种新方案.
本文利用和GNRs共振吸收峰波长相匹配的800 nm近红外脉冲光, 激发标记有GNRs和Fluo-4, AM的神经细胞中的Ca2+. 并且采用双光子激发荧光共聚焦显微镜(two photon excited fluorescence confocal microscope, TPEFCM)对Ca2+激活进行成像研究. 由于神经细胞在体外难以培养且不能无限增殖, 因此选用同种细胞系的电生理类型的人神经母细胞瘤细胞(SH-SY5Y)[17]进行实验研究. 利用1.5 mW的激光功率对整个视场进行重复扫描(大约50个细胞, 2个培养皿), 在SH-SY5Y细胞中引起大范围的Ca2+荧光强度的变化, 在这种激光强度下, 可以引起细胞中Ca2+的反复振荡. 在功率为3.2 mW的激光刺激下, 可观察到瞬态Ca2+激活现象. 对未标记GNRs的SH-SY5Y细胞进行同等条件下的光激活, 结果表明未标记GNRs的SH-SY5Y细胞Ca2+的激活现象相对较弱, 且与标记GNRs的SH-SY5Y细胞相比, 平均出现光激活的时间是60 s. 实验结果表明, GNRs对神经细胞Ca2+激活起到增强和促进作用. 研究工作证明了借助GNRs增强神经细胞Ca2+光激活的可行性, 阐述了光刺激引起离子通道变化的亚细胞生物机制.
2.1.GNRs的表面功能化修饰
将GNRs (西安瑞禧生物)置于4 ℃冰箱半小时, 通过离心(Eppendorf 公司5417R型, 30 min, 12500 r/min, 4 °C)将过量的CTAB除去, 并添加10 μL的链霉抗生物素蛋白Streptavidin (SA) (#85881, Sigma-Aldrich, MO, USA)溶液, 37 ℃搅拌24 h过夜, 通过离心(Eppendorf公司5417R型, 30 min, 12500 r/min, 4 °C)从修饰的GNRs-SA中除去未反应的过量SA, 然后倾析上清液并重新分散在500 μL水中. GNRs-SA分散液在200 μL的100 μmol/L伴刀豆球蛋白A (Concanavalin A, Con A) (#C5275, Sigma-Aldrich, MO, USA)水溶液中孵育30 min, 备后续实验使用.2
2.2.试剂和药物
Ca2+指示剂(Fluo-4, AM)购自赛默飞世尔科技(美国纽约州格兰德岛), 二甲基亚砜(DMSO)溶液以及氯化钙(CaCl2)购自西格玛奥德里奇 (美国密苏里州圣路易斯), Pluronic F-127粉末购自上海翊圣生物科技有限公司, Ca2+螯合剂BAPTA-AM购自大连美仑生物技术有限公司.2
2.3.细胞培养
将人神经母细胞瘤细胞(SH-SY5Y)(武汉普诺赛公司)在含有10%胎牛血清(fetal bovine serum, FBS)和1%链霉素、青霉素溶液的DMEM高糖培养基(Gibco, Invitrogen, NY, USA)中, 于37 °C, 5% CO2的潮湿培养箱中进行培养. 为了进行细胞成像, 将SH-SY5Y细胞以1∶12的传代比率种在35 mm玻璃培养皿中.2
2.4.双光子激发荧光共聚焦显微成像系统
利用尼康双光子激发共聚焦显微镜装置(A1R MP, 尼康, 日本), 使用60 × 油镜(NA=1.4, 尼康, 日本)来采集荧光图像[18,19] (系统光路如图1所示). 共聚焦显微成像由多色连续波(continuous wave, CW)激光器和相应的解扫描检测单元组成, 双光子激发荧光显微成像采用自动可调谐超快激光器, 脉冲宽度100 fs左右, 重复频率80 MHz, 波长可调范围为700—1300 nm. 实验中利用共聚焦系统488 nm CW 激光来检测Fluo-4, AM荧光, 并进行明场成像, 同时选用GNRs的等离子体共振吸收峰800 nm处的脉冲光来照射GNRs, 引起细胞膜温度的快速变化, 瞬间改变细胞膜电容, 产生去极化电流使细胞膜去极化, 从而打开Ca2+通道产生动作电位[20,21], 并对Fluo-4, AM进行双光子成像, 462—638 nm的带通滤波片用于收集发射光. 由于GNRs没有发射, 故不存在串扰等问题. 获得的图像视场大小为211.63 μm × 211.63 μm. 采用4幅图平均, 并对调色盘LUTS (look up tables)调整进行图像拍摄.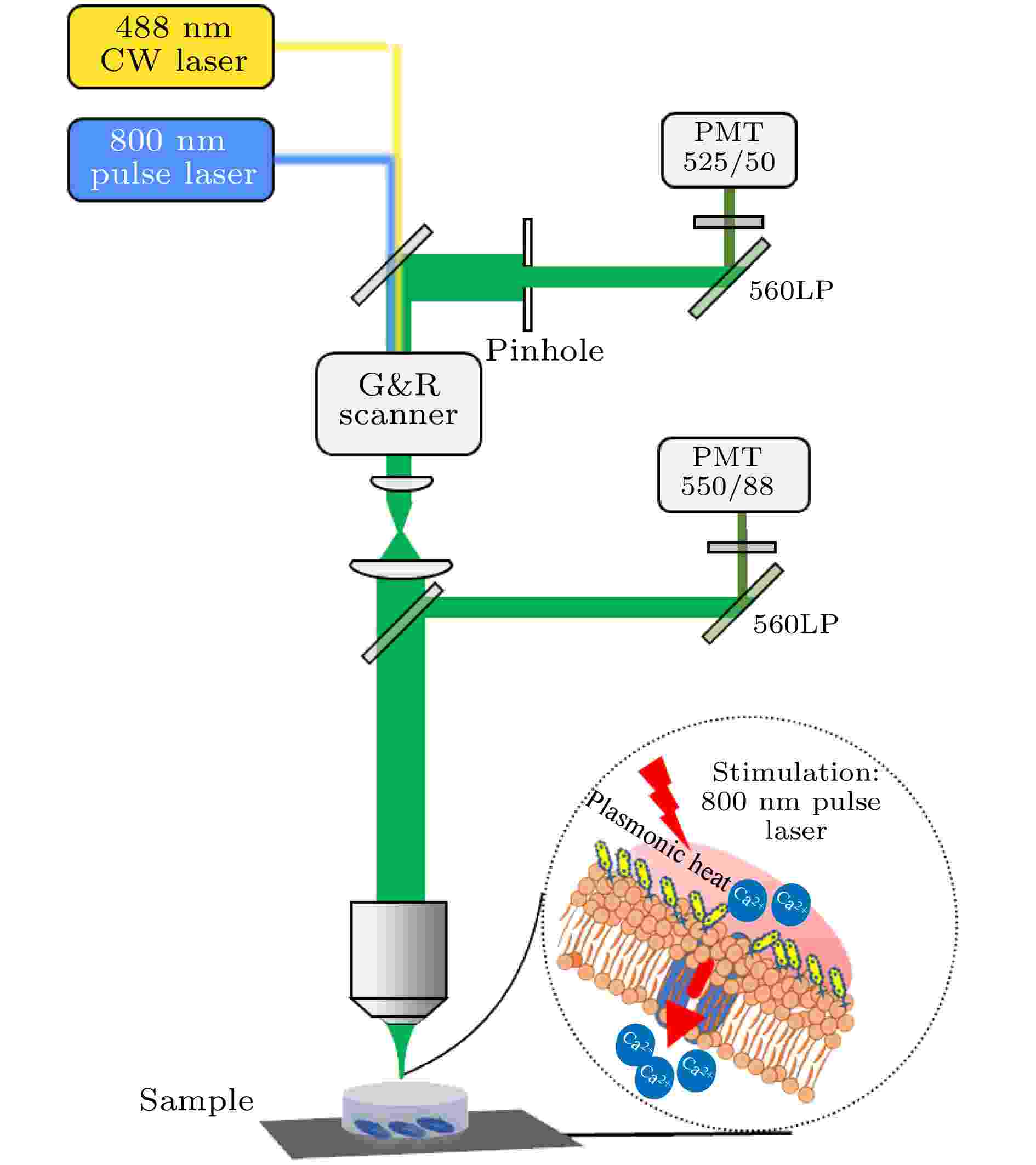 图 1 双光子激发荧光共聚焦显微系统光路示意图(G&R Scanner为振镜扫描仪, LP为长通滤波片, PMT为光电倍增管)
图 1 双光子激发荧光共聚焦显微系统光路示意图(G&R Scanner为振镜扫描仪, LP为长通滤波片, PMT为光电倍增管)Figure1. Schematic diagram of two-photon excited fluorescence confocal microscopy system. The abbreviations in the figure are as follows: G&R Scanner is a Galvo-resonance scanner, LP is a long-pass filter, and PMT is a photomultiplier tube.
2
2.5.神经细胞内Ca2+消耗
通过KOH将BAPTA-AM缓冲液的pH值调节至7.4, 实验过程中加入最终浓度为200 μmol/L 的BAPTA-AM 进行细胞内Ca2+的消耗.2
2.6.相对荧光强度ΔF/F分析
在静息电位时, 细胞内Ca2+浓度通常为50—100 nmol/L, 但当神经细胞活动时, 细胞内Ca2+浓度能上升10—100倍. 也就是说, 神经细胞中的Ca2+浓度与生理活动息息相关, 利用Ca2+指示剂的荧光强度与细胞中的Ca2+浓度的对应关系, 可以对神经细胞活动进行检测. 使用尼康软件NIS-Elements AR对Ca2+的荧光强度进行测量及数据导出, 并在Image J中调整亮度/对比度来优化图像, Ca2+的相对荧光强度用ΔF/F表示, 其中ΔF/F = (F – F0)/F0 为荧光强度的变化量. F – F0为荧光强度的变化量, F0为初始Ca2+的荧光强度.3.1.近红外光刺激GNRs热扩散模型
为了分析GNRs对神经细胞光激活信号的增强作用, 理论上对GNRs增强光热效应改变膜电容进行分析. GNRs在与吸收光谱匹配的光源激发下会产生LSPR[22], LSPR弛豫过程通常在0.1—1 ps, 之后在100 ps—10 ns的时间范围内通过热传导迅速将产生的热传递到周围环境[23]. 首先, 对激光刺激定位到细胞膜上的GNRs产生的热量及其扩散到细胞内过程进行了热力学分析, 并使用Matlab对所建立的模型进行求解. 当入射光的频率与GNRs等离子体共振频率匹配时, 使用Gans理论计算GNRs的吸收截面. Gans理论将Mie理论应用到球形纳米颗粒[24], 假设GNR为球形, 来模拟GNR的纵向表面等离子激元. GNRs产生的热(QGNR)用单位体积时间的能量来表示[25]:









1) GNR作为单层均匀分布, 与细胞膜之间的距离为100 nm;
2)从宏观上看, GNR产生的热量沿GNR层均匀分布;
3) GNR产生热量, 被视为恒定热源;
4)热量沿垂直于细胞膜的Z轴从恒定热源流出.
基于这些假设, 可以使用下面的一维热扩散方程式[26]计算温度分布:
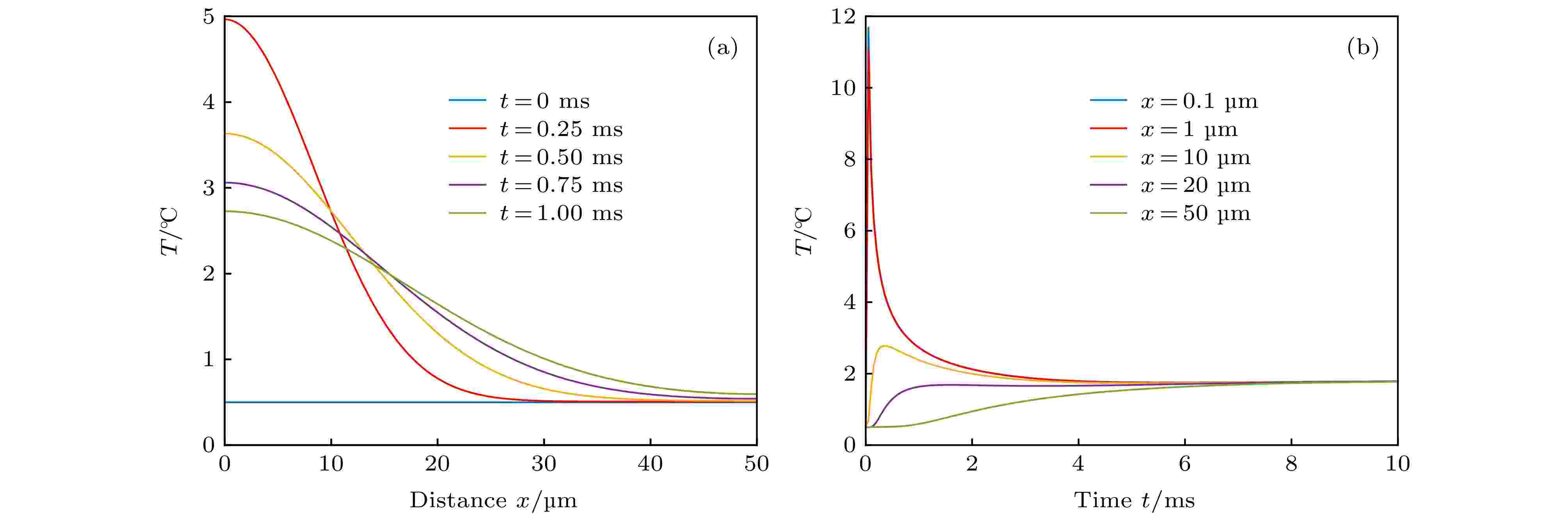 图 2 温度随时间t和距离x变化的函数 (a)时间一定时, 温度随着距离的增加而衰减; (b) 距离一定时, 温度随着时间的增加而衰减; 在此模型中, 选用520 W·cm–2, 间隔为0.5 ms的矩形脉冲作为激发光源
图 2 温度随时间t和距离x变化的函数 (a)时间一定时, 温度随着距离的增加而衰减; (b) 距离一定时, 温度随着时间的增加而衰减; 在此模型中, 选用520 W·cm–2, 间隔为0.5 ms的矩形脉冲作为激发光源Figure2. Temperature as a function of time t and distance x: (a) When the distance is constant, the temperature decays with increasing time; (b) when the time is constant, the temperature decays with increasing distance. In this model, a rectangular pulse of 520 W·cm–2 with an interval of 0.5 ms is selected as the excitation light source.
2
3.2.光热效应改变细胞膜电容电流原理
根据细胞膜的等效电路模型[27]可知: 磷脂双分子层是个绝缘体, 即它是一个不让电流通过且电阻无限大的电阻器, 细胞膜不是个完美的绝缘体—即使在静息状态, 离子也可以通过特定的通道流过细胞膜. 这些离子通道可以通过平行的电流来模拟, 这些通道可以看作一个个平行的电流通路模型, 每一个通路都包含一个特定电阻的电阻器, 电压等于离子平衡电位的电池. 电容效应与经典理论一致, 电解质溶液中脂质膜的总电容反映了磷脂双分子层的核心电容和膜两侧双层膜离子的串联电容的组合, 利用Gouy-Chapman-Stern (GCS)关于双分子层电容理论[14]—建立总电容模型, 从泊松方程推导出, 模拟带电表面与电解质溶液的接触, 将相关的介电常数和离子组成考虑在内, GCS通过平衡电力和热力, 影响带电表面附近的离子空间分布, 计算了系统的电容. 使用GCS模型, 模拟由温度相关的电容变化产生的电流[26], 使用耦合方程(6)和(7), 对磷脂双分子层两侧的表面势φo和 (φi – Vm), 即膜电位与温度的函数求解, 计算即可求得净膜电容.










4.1.GNRs表面功能化修饰及表征
为了降低GNRs的毒性以及将其定位到SH-SY5Y细胞膜上, 利用SA来实现GNRs的表面功能化修饰. 图3为未修饰和已修饰SA的GNRs的可见吸收光谱和透射电子显微镜(transmission electron microscope, TEM)图像. 可知, 表面功能化后, GNRs在820 nm处的吸收峰发生20 nm的蓝移, 这种偏移是局部介电常数和GNRs表面上吸收层的有效厚度变化的结果[28]. GNRs表面功能化前后的粒径分别为90.98和151.73 nm.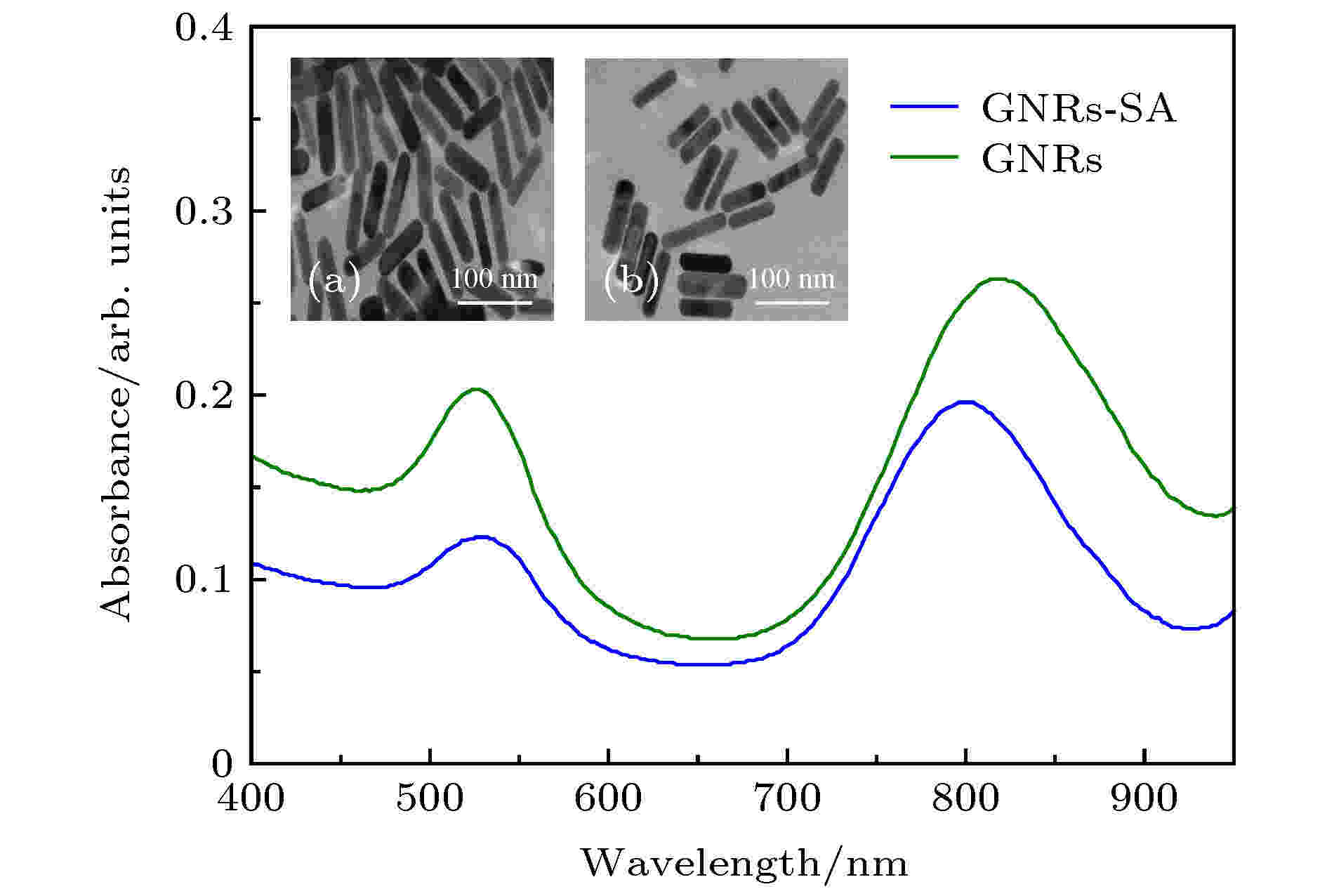 图 3 GNRs与GNRs-SA的(a) 可见近红外吸收光谱以及(b) TEM图(比例尺: 100 nm; 近红外区GNRs\GNRs-SA的吸收峰分别在820和800 nm)
图 3 GNRs与GNRs-SA的(a) 可见近红外吸收光谱以及(b) TEM图(比例尺: 100 nm; 近红外区GNRs\GNRs-SA的吸收峰分别在820和800 nm)Figure3. (a) Visible near-infrared absorption spectra and (b) TEM images of GNRs and GNRs-SA, scale bar: 100 nm. the absorption peaks of GNRs\GNRs-SA in the near infrared region were at 820 nm and 800 nm, respectively.
2
4.2.GNRs增强Ca2+光激活
将GNRs-SA, ConA, Fluo-4, AM和SH-SY5Y细胞共同孵育20 min, 使GNRs定位到SHSH5Y细胞膜上, 同时选用488 nm的CW激光器, 利用二向色镜(495 nm长通)结合带通滤光片(500—550 nm)对Fluo-4, AM标记的SH-SY5Y细胞进行了Ca2+成像. 为了用800 nm的脉冲光在神经细胞上产生GNRs的等离子体共振激发, 首先以0.5 mW的飞秒激光扫描整个视野, 同时监测Fluo-4, AM的荧光. 对整个视场进行重复扫描会在神经细胞中引起局部Ca2+升高, 连续扫描15 min, 检测到有Ca2+动态变化(如图4(a)和图4(c)). 在此激光强度下, 会引起重复刺激. 再对未与GNRs-SA一起孵育的神经元的整个区域进行飞秒激光的重复扫描, 在0.5 mW的功率扫描下, 未观察到神经细胞中明显的Ca2+升高. 当激光功率提高到1.5 mW时, 观察到Ca2+荧光的增加(如图4(b)和图4(d)), 这些结果表明, 使用800 nm的脉冲光刺激定位到SHSH5Y细胞膜上的GNRs可以在神经细胞中增强诱导Ca2+瞬变. 经过多次重复实验(大约300个细胞, 30个培养皿)的结果如图5所示, 红色表示平均最小激发时间, 绿色表示平均相对荧光强度的最大变化值. 可以看出, 不加GNRs时平均激发时间需要60 s, 神经细胞被光激活后的Ca2+的ΔF/F的平均值为56%, 而加了GNRs之后的平均激发时间只需10 s, 且细胞被光激活之后的Ca2+的ΔF/F的平均值为75%, 这表明, GNRs标记细胞膜有光激活增强的作用.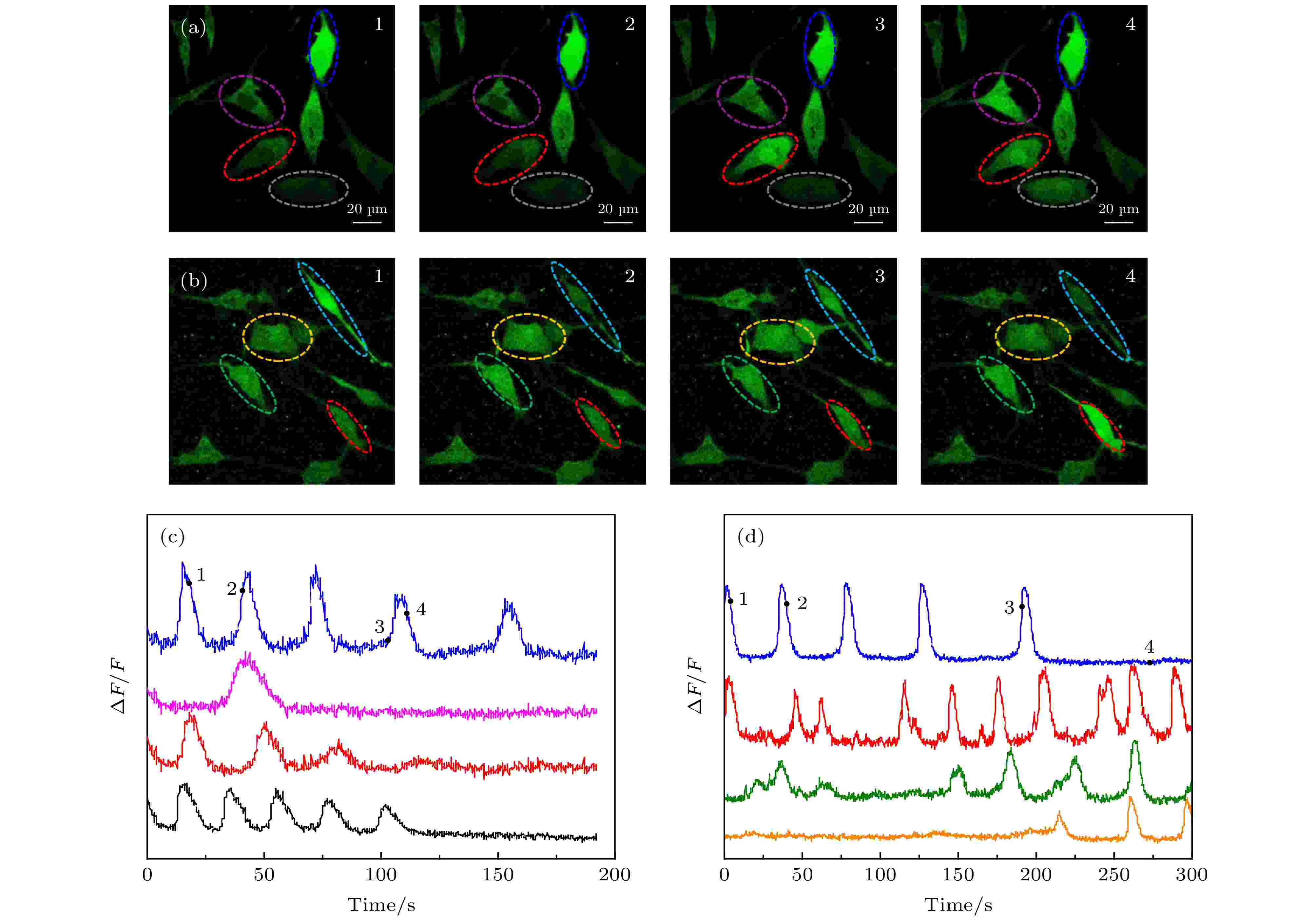 图 4 仅Fluo-4, AM标记与Fluo-4, AM, Con A和GNRs-SA同时标记的SH-SY5Y细胞光激活成像 (a) Fluo-4, AM, Con A和GNRs-SA标记的SH-SY5Y不同时刻的荧光图像; (b) Fluo-4, AM标记的SH-SY5Y不同时刻的荧光图像; (c) Fluo-4, AM, Con A和GNRs-SA标记的SH-SY5Y相对荧光强度随时间变化的曲线, 数字“1, 2, 3, 4”跟(a)中图像的时间点(25 s, 54 s, 99 s, 116 s)相对应, 四条曲线对应(a)中不同颜色圈出的细胞; (d) Fluo-4, AM标记的SH-SY5Y相对荧光强度随时间变化的曲线, 数字“1, 2, 3, 4”跟(b)中图像的时间点(1 s, 32 s, 127 s, 187 s)相对应, 四条曲线对应(b)中不同颜色圈出的细胞
图 4 仅Fluo-4, AM标记与Fluo-4, AM, Con A和GNRs-SA同时标记的SH-SY5Y细胞光激活成像 (a) Fluo-4, AM, Con A和GNRs-SA标记的SH-SY5Y不同时刻的荧光图像; (b) Fluo-4, AM标记的SH-SY5Y不同时刻的荧光图像; (c) Fluo-4, AM, Con A和GNRs-SA标记的SH-SY5Y相对荧光强度随时间变化的曲线, 数字“1, 2, 3, 4”跟(a)中图像的时间点(25 s, 54 s, 99 s, 116 s)相对应, 四条曲线对应(a)中不同颜色圈出的细胞; (d) Fluo-4, AM标记的SH-SY5Y相对荧光强度随时间变化的曲线, 数字“1, 2, 3, 4”跟(b)中图像的时间点(1 s, 32 s, 127 s, 187 s)相对应, 四条曲线对应(b)中不同颜色圈出的细胞Figure4. Photoactivation SH-SY5Y cells imaging of only Fluo-4 labeled and labeled with Fluo-4, AM, Con A and GNRs-SA. (a) The fluorescence images of Fluo-4, AM and GNRs-SA labeled SH-SY5Y cells at different times. (b) the fluorescence images of Fluo-4, AM labeled SH-SY5Y cells at different times. (c) the changing of relative fluorescence intensity of Fluo-4, AM, Con A and GNRs-SA labeled SH-SY5Y cells with time. the numbers “1, 2, 3, 4” correspond to the time points (25 s, 54 s, 99 s, 116 s) of the image in (a), and the four curves correspond to the cells circled in different colors in (a). (d) The changing of relative fluorescence intensity of Fluo-4, AM labeled SH-SY5Y cells with time. the numbers “1, 2, 3, 4” correspond to the time points (1 s, 32 s, 127 s, 187 s) of the image in (b). four curves correspond to cells circled in different colors in (b).
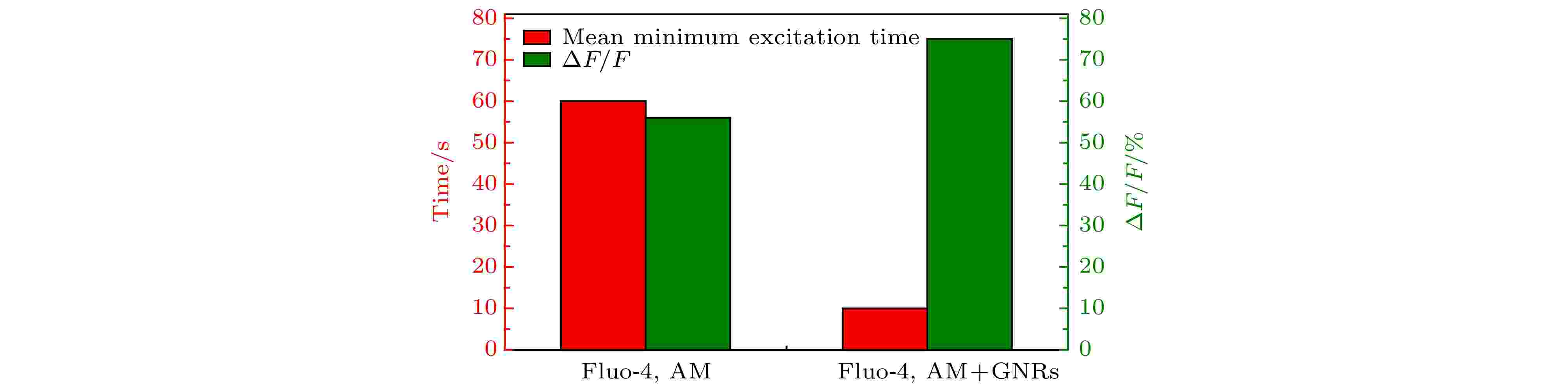 图 5 仅Fluo-4, AM标记和Fluo-4, AM, Con A和GNRs-SA同时标记的SH-SY5Y细胞光刺激的平均(细胞数n = 300)最小激发时间以及光激活引起相对荧光强度的变化值
图 5 仅Fluo-4, AM标记和Fluo-4, AM, Con A和GNRs-SA同时标记的SH-SY5Y细胞光刺激的平均(细胞数n = 300)最小激发时间以及光激活引起相对荧光强度的变化值Figure5. For Fluo-4, AM labeled and Fluo-4, AM, Con A and GNRs-SA labeled SH-SY5Y cells at the same time, the average photoactivation (cell number n = 300) minimum excitation time and the changes in relative fluorescence intensity caused by photoactivation.
在光激活Ca2+过程中, 神经细胞内外的Ca2+会有交换, 为了确定光激活Ca2+的动态变化是源自细胞内钙还是细胞外钙, 使用200 μmol/L的BPATA钙离子螯合剂进行处理, 其中图6(a)和图6(c)的FITC通道表示488 nm CW激光激发, 500—550 nm的带通滤波片收集, BF表示正常明场成像, Merge代表两通道的叠加图. 如图6(e)所示, 在BPATA处理后1 min内, 细胞内的钙浓度逐渐降低, 5 min后加入200 μmol/L的Ca2+溶液, 在Ca2+处理的几十秒内, 细胞内钙浓度显著增加, 结果表明, 在不加Con A, GNRs-SA的情况下, 加入Ca2+溶液后, ΔF/F达到44%, 而在先加Con A, GNRs-SA再加入Ca2+溶液后, ΔF/F达到72%. 因此证明GNRs确实能使细胞外的Ca2+流入细胞内, 引起钙内流, 起到增强神经细胞钙离子光激活的作用. 与红外光直接刺激细胞进行光激活相比, GNRs辅助的光学刺激方法显著降低了光激活所需的辐射暴露程度, 利用近红外光来代替容易被水吸收的红外光, 很大程度上能够减小由于加热导致的组织损伤[20].
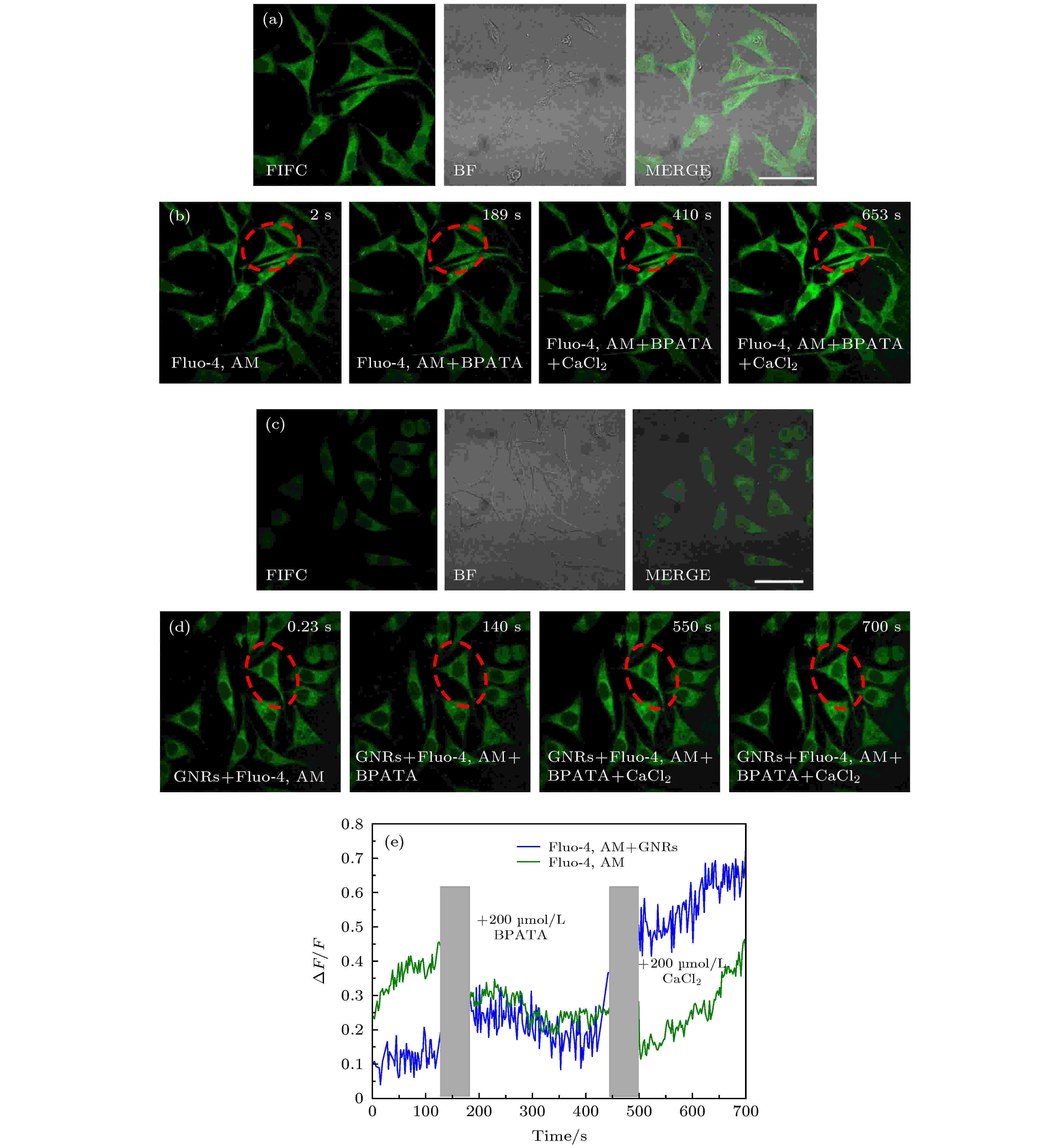 图 6 验证光激活时Ca2+的变化来源(其中FITC表示使用500—550 nm的带通滤波片来采集荧光, BF表示透射成像, Merge表示两通道的叠加图) (a) Fluo-4, AM染色后SH-SY5Y细胞的荧光图像和透射光图像 (比例尺: 50 μm); (b) Fluo-4, AM染色后SH-SY5Y细胞不同时刻的双光子荧光图像; (c) Fluo-4, AM与2 μmol/L Con A, GNRs-SA孵育后SH-SY5Y细胞的荧光图像和透射光图像 (比例尺: 50 μm); (d) Fluo-4, AM与2 μmol/L Con A, GNRs-SA 孵育后SH-SY5Y细胞不同时刻的双光子荧光图像; (e) 图(b)和(d)中红色虚线所圈区域的ΔF/F在相继添加200 μmol/L BPATA与200 μmol/L CaCl2后的变化曲线
图 6 验证光激活时Ca2+的变化来源(其中FITC表示使用500—550 nm的带通滤波片来采集荧光, BF表示透射成像, Merge表示两通道的叠加图) (a) Fluo-4, AM染色后SH-SY5Y细胞的荧光图像和透射光图像 (比例尺: 50 μm); (b) Fluo-4, AM染色后SH-SY5Y细胞不同时刻的双光子荧光图像; (c) Fluo-4, AM与2 μmol/L Con A, GNRs-SA孵育后SH-SY5Y细胞的荧光图像和透射光图像 (比例尺: 50 μm); (d) Fluo-4, AM与2 μmol/L Con A, GNRs-SA 孵育后SH-SY5Y细胞不同时刻的双光子荧光图像; (e) 图(b)和(d)中红色虚线所圈区域的ΔF/F在相继添加200 μmol/L BPATA与200 μmol/L CaCl2后的变化曲线Figure6. Verify the changing of the source of Ca2 + during photoactivation. Among them, FITC indicates the use of a 500—550 nm band-pass filter to collect fluorescence, BF indicates transmission imaging, and Merge indicates an overlay of two channels. (a) Fluorescence and TD image of SH-SY5Y cells with Fluo-4, AM staining (scale bar: 50 μm). (b) Two-photon fluorescence images of SH-SY5Y cells labeled with Fluo-4, AM at different times. (c) Fluorescence and TD images of SH-SY5Y cells with Fluo-4, AM staining after adding 2 μmol/L Con A, GNRs-SA (scale bar: 50 μm). (d) Time-series two-photon fluorescence images of SH-SY5Y cells labeled with Fluo-4, AM staining after adding 2 μmol/L Con A, GNRs-SA. (e) The change curves of the ΔF/F of the red virtual circle areas in panel (b) and (d) after adding 200 μmol/L BPATA and 200 μmol/L CaCl2.
