
西北工业大学 化学与化工学院, 陕西 西安 710072
2020-01-13 收稿, 2020-03-12 录用
基金项目: 陕西省自然科学基金(2018JM2019)和西北工业大学研究生创意创新种子基金(ZZ2019221,ZZ2019233)资助
*通讯作者: 欧植泽
摘要: 以正硅酸乙酯(TEOS)和二乙氧基二甲基硅烷(DEDMS)为原料,制备了两种不同的二氧化硅纳米粒子SNP1和SNP2。利用透射电镜和动态光散射对二氧化硅纳米粒子进行了表征,结果表明SNP1和SNP2的尺寸分别为13.5 nm和25.9 nm。动态光散射实验测得SNP1和SNP2的Zeta电位分别为-5.74 mV和-2.28 mV。设计合成了Turn-on型荧光探针菲并咪唑衍生物PIP-S,并将其负载于二氧化硅纳米粒子SNP1和SNP2上以改善其水溶性。通过紫外-可见光谱法和荧光光谱法研究了探针PIP-S在水溶液中对汞离子的识别特性,发现PIP-S在有机溶剂DMF中对汞离子的检测限为1.32 nmol·L-1;而负载于SNP1和SNP2后,对水中汞离子的检测限分别为8.37 nmol·L-1和14.75 nmol·L-1。此结果证实负载PIP-S的二氧化硅纳米粒子对汞离子具有良好选择性、高灵敏度和快速响应,且不受其他金属离子的干扰。
关键词: 二氧化硅纳米粒子汞离子荧光传感器菲并咪唑
Fluorescent Sensing of Hg2+ by Phenanthroimidazole Derivative Supported on Silica Nanoparticles
JIA Hongdan, XING Wenli, SONG Yujiao, ZHENG Shehong, GAO Yunyan, OU Zhize

School of Chemistry and Chemical Engineering, Northwestern Polytechnical University, Xi'an 710072, Shaanxi, P. R. China
*Corresponding author: OU Zhize
Abstract: By using tetraethoxysilane (TEOS) and diethoxydimethylsilane (DEDMS) as starting materials, two silica nanoparticles SNP1 and SNP2 are prepared. SNP1 and SNP2 are characterized using transmission electron microscopy (TEM) and dynamic light scattering (DLS). The average diameters of SNP1 and SNP2 determined from the TEM image are about 13.5 nm and 25.9 nm. Dynamic light scattering (DLS) data show that the Zeta potentials of SNP1 and SNP2 are -5.74 mV and -2.28 mV, respectively. A turn-on fluorescence probe PIP-S based on phenanthroimidazole is designed and synthesized, which can be supported on SNP1 and SNP2 to improve their water solubility. UV-Vis and fluorescence spectroscopy are employed to investigate the specific recognition of Hg2+ by PIP-S. The detection limit (LOD) of PIP-S toward Hg2+ is determined to be 1.32 nmol·L-1 in DMF. The detection limits of PIP-S supported on SNP1 and SNP2 for Hg2+ in aqueous solution are 8.37 nmol·L-1 and 14.75 nmol·L-1, respectively. These results showed that PIP-S supported on SNP1 and SNP2 can detect Hg2+ with good selectivity and high sensitivity, and without the interference of other metal ions.
Key words: silica nanoparticlesmercury ionfluorescent sensorphenanthroimidazole
汞离子是毒性最强的重金属离子之一,易于与各种生物分子反应,在浓度非常低的情况下也能造成各种疾病,例如肩痛和Hunter-Russell综合征等[1-3]。汞离子还会通过食物链在人体中富集,严重威胁人类的身体健康[4, 5]。鉴于汞离子的高毒性,我国规定生活饮用水中汞含量不得高于1 μg·L-1,工业废水中汞的总含量不得高于50 μg·L-1,因此对水中汞离子进行定量检测非常重要。
荧光检测法具有操作简单、灵敏度高、选择性好的优点,广泛用于检测各种物质。基于汞离子与配体之间的配位作用或汞离子引发的不可逆的化学反应,可构建汞离子荧光传感器[6-8]。相对于配位作用而言,基于特定化学反应的汞离子荧光传感器具有更好的选择性和抗干扰能力。利用Hg2+对硫缩醛的特殊反应活性,可以设计基于分子内电荷转移(ICT)机制的Hg2+荧光传感器[9]。富电子的硫缩醛基团与汞离子发生脱保护反应后,生成吸电子的醛基,使化合物的ICT效应增强,表现为荧光峰位红移、荧光强度显著变化等。苯并恶二唑、香豆素、萘酰亚胺、四苯乙烯等多种荧光基团已用于制备含硫缩醛基团的汞离子传感器[10]。含硫缩醛基团的汞离子荧光传感器具有很高的灵敏度,其检测限可达到nmol·L-1级,甚至是pmol·L-1级[11]。
菲并咪唑类衍生物具有合成简单、稳定性好,荧光量子产率高等优点,在光电器件和发光材料等领域中备受关注[12]。近年来,基于菲并咪唑衍生物的Hg2+荧光传感器已有报道,这些传感器的检测限一般在25~250 nmol·L-1范围内[13-16]。然而,这些荧光传感器大多水溶性差,不利于在水溶液中进行检测。如将荧光分子与二氧化硅纳米粒子结合,构建纳米结构的传感器,可提高传感器的灵敏度,并可实现在水相中对汞离子的检测[17]。基于此思路,本文设计合成了一种以硫缩醛为识别基团、菲并咪唑为荧光基团的荧光传感器PIP-S(图 1),并将其负载于二氧化硅纳米粒子上,可实现在水溶液中对汞离子的检测,且检测限小于15 nmol·L-1。
图 1
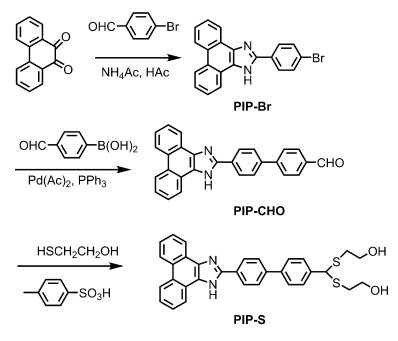 | 图 1 硫缩醛修饰的菲并咪唑衍生物PIP-S的合成路线 |
1 实验部分1.1 试剂与仪器试剂:二乙氧基二甲基硅烷(DMDES)、正硅酸乙酯(TEOS)、F127(PEO106-PPO70-PEO106)、9, 10-二苯基蒽、对苯二甲醛、2-巯基乙醇、对甲苯磺酸、9, 10-菲醌、4-溴苯甲醛、4-甲酰基苯硼酸、醋酸钯、三苯基膦均购自梯希爱(上海)化成工业发展有限公司。Hg(NO3)2·H2O、Al(NO3)3·9H2O、Cr(NO3)3·9H2O、(CH3COO)2Pb、SnCl2·2H2O、LiCl、NaCl、Mg(NO3)2、KCl、FeCl3、CoCl2、CaCl2、ZnCl2、(NH4)2Fe(SO4)2·6H2O、Ni(NO3)2、Cu(NO3)2、AgNO3、Cd(NO3)2及其它化学品均为分析纯,购自北京化工厂。所用溶剂均经过干燥,并在使用前重蒸处理。如无特殊说明,实验中所用缓冲溶液均为磷酸盐缓冲溶液(PBS,pH 7.4,10 mmol·L-1)。
仪器:1H NMR光谱采用Bruker Avance 400核磁共振光谱仪测定,13C NMR光谱采用Bruker Avance 600核磁共振光谱仪测定,质谱(MS)采用Bruker solariX FT-ICR-MS仪测定。稳态吸收和荧光发射光谱分别采用Hitachi UV-3010(日本)紫外可见分光光度计和Hitachi F-4600(日本)荧光光谱仪测定。
1.2 二氧化硅纳米粒子的合成根据文献合成二氧化硅纳米粒子SNP1和SNP2[18]。将0.6 g F127溶解在9.0 mL HCl(0.85 mol·L-1)溶液中,室温搅拌2 h,加入正硅酸乙酯(TEOS)(0.3 g,1.44 mmol),搅拌40 min。再加入60 mg二乙氧基二甲基硅烷(DEDMS),室温搅拌4 h。反应液在4000 r/min条件下离心15 min,除去大颗粒硅胶,再用截留分子量为8000~14400的透析袋透析3次,每次12 h。用0.22 μm的Teflon过滤器过滤,得到SNP1。SNP2的制备过程与SNP1类似,只是DEDMS的加入量为120 mg。将上述得到的SNP1和SNP2溶液转移到25 mL容量瓶中,用蒸馏水定容,再用PBS(pH 7.4,10 mmol·L-1)进一步稀释10倍后用于测试。
1.3 化合物PIP-CHO的合成参照文献[19]合成PIP-Br,具体步骤如下:将菲醌(1.0 g,4.80 mmol)溶解于30 mL冰乙酸中,依次加入4-溴苯甲醛(0.89 g,4.80 mmol)、醋酸铵(1.0 g,13.0 mmol),100 ℃下反应8 h。反应液冷却至室温后,倒入冰水中,用Na2CO3溶液调节pH为7~8,抽滤,滤饼用水(15 mL)洗3次。利用柱色谱纯化粗产物,以CH2Cl2/甲醇(20:1,V/V)为洗脱剂,得化合物PIP-Br(0.93 g,52.0%)。
将PIP-Br(0.40 g,1.07 mmol)、醋酸钯(0.024 g,0.107 mmol)、三苯基磷(0.28 g,1.07 mmol)、4-甲酰基苯硼酸(0.32 g,2.14 mmol),碳酸钠(0.57 g,5.37 mmol)加到反应瓶中,再加入1 mL水和10 mL DMF的混合液,在80 ℃下氮气气氛搅拌反应20 h。冷却至室温,减压蒸馏除去溶剂后,利用柱色谱纯化粗产物,以CH2Cl2/甲醇(20:1,V/V)为洗脱剂,得黄色固体,为PIP-CHO(0.56 g,67.0%)。1H NMR(DMSO-d6,400 MHz):13.57(s,1H),10.09(s,1H),8.90~8.85(m,2H),8.64~8.58(m,2H),8.48~8.46(m,2H),8.07~8.04(m,6H),7.80~7.74(m,2H),7.68~7.64(m,2H)。
1.4 化合物PIP-S的合成将PIP-CHO(0.20 g,0.50 mmol)溶于20 mL干燥的无水乙醇中,依次加入无水硫酸钠(2.0 g,14.1 mmol)、对甲苯磺酸(0.60 g,3.48 mmol)、2-巯基乙醇(0.6 mL,8.56 mmol),80 ℃下氮气保护搅拌反应24 h。冷却至室温,减压浓缩除去大部分溶剂后,倒入CH2Cl2和CH3OH的混合溶液中,搅拌条件下加入Na2CO3溶液,调节pH为7~8。抽滤,得白色滤饼。以CH2Cl2/THF(4/1,V/V)为洗脱剂,通过柱色谱法纯化粗产物,得化合物PIP-S(0.10 g,38.0%)。1H NMR(DMSO-d6,400 MHz):13.53(s,1H),8.90~8.85(m,2H),8.64~8.58(m,2H),8.43~8.42(m,2H),7.96~7.95(m,2H),7.82~7.72(m,4H),7.72~7.64(m,2H),7.59~7.57(m,2H),5.35(s,1H),4.86~4.85(m,2H),3.58~3.55(m,4H),2.74~2.70(m,2H),2.63~2.59(m,2H)。13C NMR(DMSO-d6,150 MHz):148.8,140.6,140.0,138.6,137.1,129.4,128.2,127.8,127.7,127.6,127.2,127.0,126.9,126.7,125.4,125.2,124.1,123.7,122.3,122.0,121.9。EMI-MS:537.1,calcd for C32H28N2O2S2,536.7。
1.5 光谱滴定及光物理性质在10 mL容量瓶中,将PIP-S的DMSO母液加入到二氧化硅纳米粒子(SNP1和SNP2)的溶液中,室温搅拌30 min,使PIP-S负载于硅胶纳米粒子上。逐渐加入不同体积Hg2+溶液,混合均匀,避光搅拌10 min,进行紫外-可见吸收光谱和荧光发射光谱测试。化合物对Hg2+的检测限(limit of detection,LOD)通过公式(1)计算:
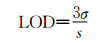 | (1) |
1.6 选择性与竞争性测试配制PIP-S化合物浓度为10 μmol·L-1的二氧化硅纳米粒子溶液(SNP1或SNP2),分别加入金属离子(Li+、Na+、Ca2+、Mg2+、Al3+、Sn2+、Ni2+、Fe3+、Ag+、K+、Pb2+、Fe2+、Cd2+、Hg2+、Cr3+、Zn2+、Co2+、Cu2+),混合均匀,静置10 min。测定加入金属离子前后的紫外-可见吸收光谱和荧光发射光谱,研究化合物对Hg2+的选择性。
竞争性实验为加入上述离子后,再加入20 μmol·L-1的Hg2+溶液,混合均匀,测试溶液的荧光发射光谱,判断其它金属离子与Hg2+的竞争性。离子选择性和竞争性实验中,Hg2+浓度为20 μmol·L-1,Li+、Na+、K+、Mg2+、Ca2+等离子的浓度为1.0 mmol·L-1,其它金属离子的浓度为40 μmol·L-1。
2 结果与讨论2.1 二氧化硅纳米粒子的合成与表征二氧化硅纳米粒子具有水溶性好、毒性低、化学性质稳定和可提高染料荧光效率等优点,被广泛应用于生物成像、电子学、传感器等领域[20-23]。本文以嵌段共聚物F127为模板,正硅酸乙酯(TEOS)和二乙氧基二甲基硅烷(DEDMS)为前驱体,通过调节硅氧烷原料配比制备了分散性良好的二氧化硅纳米粒子SNP1和SNP2,并利用透射电镜研究了所得二氧化硅纳米颗粒的形貌和微观结构(图 2)。SNP1和SNP2的尺寸分别为13.5 nm和25.9 nm,且分布范围较窄。SNP2的粒径比SNP1大,可能是由于在SNP2的制备过程中使用了更多的DEDMS。DEDMS可以和二氧化硅的表面的Si—O反应,因此增加DEDMS的量,所得二氧化硅纳米粒子的粒径增大[24]。
图 2
 | 图 2 二氧化硅纳米粒子SNP1(a,b)和SNP2(c,d)的TEM图 |
动态光散射(DLS)数据表明,SNP1和SNP2的平均粒径分别约为16.2 nm和33.8 nm(图 3),分布系数(particle dispersion index,PDI)均小于0.3,说明得到的纳米粒子具有良好的分散性。DLS测得的平均粒径大于TEM测得的尺寸,是因为DLS测得的是流体动力学尺寸,而TEM测得的是干的粒子的粒径[25]。SNP1和SNP2均带负电荷,其中SNP1的Zeta电位为-5.74 mV,而SNP2的Zeta电位为-2.28 mV。SNP2的负表面电荷密度低于SNP1,可能是因为在SNP2的制备中使用了较多的DEDMS。DEDMS可以与Si—OH基团结合,减少了表面Si-OH的数量[26]。二氧化硅纳米粒子溶液在存放一个月后仍然分散性良好,表明这些二氧化硅纳米粒子在水性介质中具有良好的稳定性[27]。
图 3
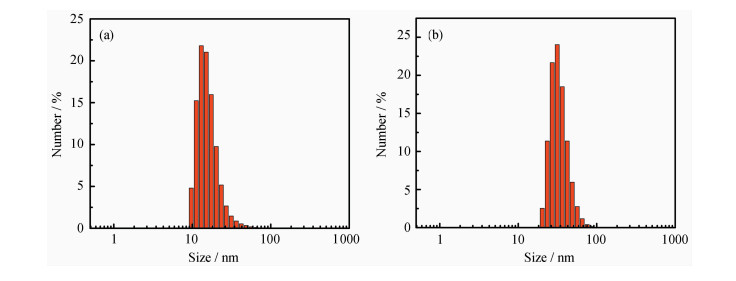 | 图 3 二氧化硅纳米粒子SNP1(a)与SNP2(b)的动态光散射图 |
2.2 吸收光谱滴定和荧光光谱滴定首先,采用紫外-可见吸收光谱研究了化合物PIP-S在DMF溶液中与Hg2+的相互作用,如图 4所示。在DMF溶液中,PIP-S在341、354和374 nm有吸收峰。随着Hg2+的加入,341 nm和354 nm处的吸收峰强度逐渐下降,而374 nm处的吸收峰逐渐增强,且在360 nm处出现等吸收点。等吸收点的存在表明Hg2+与PIP-S发生了化学反应,有新物质产生。
图 4
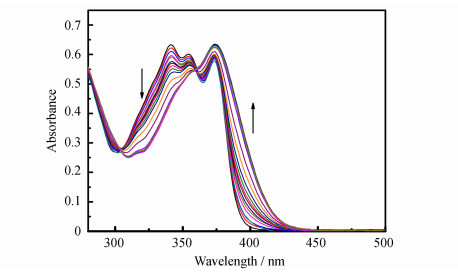 | 图 4 Hg2+对PIP-S(10 μmol·L-1)的DMF溶液的紫外-可见吸收光谱的影响(汞离子浓度为0~20 μmol·L-1) |
荧光光谱滴定实验可进一步探究Hg2+与PIP-S的相互作用。如图 5所示,化合物PIP-S在DMF溶液中的荧光较弱,随着Hg2+的逐渐加入,在529 nm处的荧光强度显著增强(图 5a)。当Hg2+浓度达到8 μmol·L-1时,荧光强度达到最大值(图 5a插图)。以529 nm处的荧光强度(F)对Hg2+浓度(0~4.0 μmol·L-1)作图,得到线性关系良好的直线(R2 = 0.9945)(图 5b)。根据公式(1)计算得PIP-S对Hg2+的检测限为1.32 nmol·L-1。
图 5
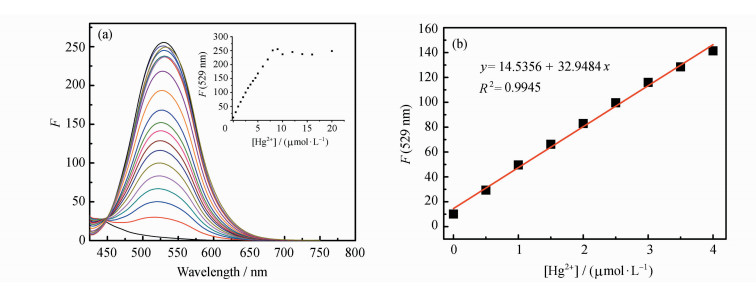 | 图 5 (a) PIP-S在DMF中对Hg2+的荧光滴定光谱;(b) 529 nm处的荧光强度(F)对Hg2+浓度(0~4.0 μmol·L-1)响应的线性关系图(λem=410 nm)插图:529 nm处的荧光强度(F)对Hg2+浓度(0~20.0 μmol·L-1)作图 |
化合物PIP-S在SNP1水溶液中对Hg2+的荧光滴定光谱如图 6所示,在未加入Hg2+时,PIP-S在SNP1中的荧光很弱,随着Hg2+的加入,480 nm处的荧光强度逐渐增强(图 6a)。Hg2+浓度为10 μmol·L-1时,480 nm处的荧光强度达到最大(图 6a插图)。以480 nm处的荧光强度(F)对Hg2+浓度(0~3.0 μmol·L-1)作图(图 6b),呈现良好的线性关系(R2=0.9996)。根据公式(1)计算得到PIP-S在SNP1水溶液中对Hg2+的检测限为8.37 nmol·L-1。在SPN-2水溶液中进行荧光滴定,经计算得PIP-S在SNP2水溶液中对Hg2+的检测限为14.75 nmol·L-1。不同二氧化硅纳米粒子溶液中,PIP-S对汞离子的荧光响应和检测限有差异,可能是由于SNP1和SNP2中的微环境不同引起的[28]。汞离子可与PIP-S中的硫原子配位,在水溶液中可以促进PIP-S中的硫缩醛基团水解,并转化为相应的醛PIP-CHO[10, 11] (图 7)。PIP-CHO具有较强的ICT效应,在极性溶剂如DMF中荧光峰位于529 nm,而在极性较低的二氧化硅纳米粒子中,荧光峰蓝移至480 nm。上述结果表明,采用二氧化硅纳米粒子作为载体能够在水中对汞离子进行检测,检测限能达到nmol·L-1级别,与国家饮用水汞离子浓度标准(5 nmol·L-1,1 μg·L-1)接近。
图 6
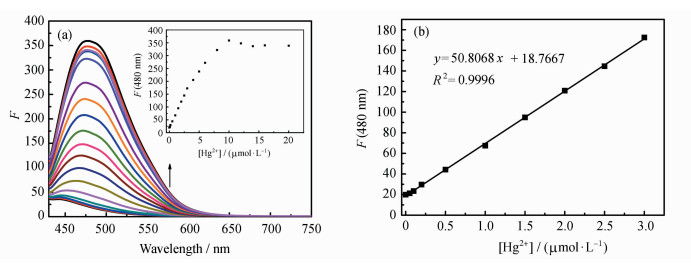 | 图 6 (a) PIP-S在SNP1水溶液中对Hg2+的荧光滴定光谱;(b) 480 nm处的荧光强度(F)对Hg2+(0~3.0 μmol·L-1)的线性关系图(λex=410 nm)插图:480 nm处的荧光强度(F)对Hg2+浓度(0~20.0 μmol·L-1)作图 |
图 7
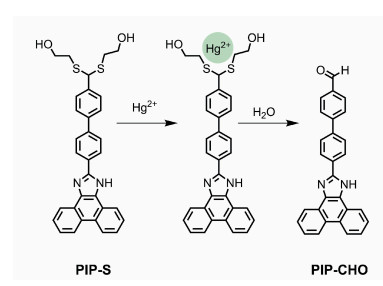 | 图 7 汞离子催化硫缩醛PIP-S的水解机理 |
2.3 PIP-S对汞离子的选择性为研究化合物PIP-S在SNP1中对Hg2+的选择性,加入不同金属离子(Li+、Cu2+、Ca2+、Mg2+、Al3+、Sn2+、Ni2+、Fe3+、Ag+、K+、Pb2+、Fe2+、Cd2+、Hg2+、Cr3+、Zn2+、Co2+、Na+)后进行紫外-可见吸收光谱和荧光发射光谱测试(图 8a和8b)。加入Hg2+后,PIP-S的吸收光谱和发射光谱均发生了很大的变化;而加入其它金属离子后,PIP-S的吸收光谱和荧光光谱都变化不大。此外,我们还研究了Hg2+与其他离子共存时PIP-S的荧光响应图。其它金属离子存在时,PIP-S在480 nm处的荧光较弱,再加入Hg2+后,荧光强度明显增强(图 8c)。以上结果表明,化合物PIP-S(10 μmol·L-1)在SNP1中对Hg2+具有很好的选择性,且不受其它金属离子干扰。化合物PIP-S在SNP2中也对Hg2+具有很好的选择性且不受其它金属离子的干扰。
图 8
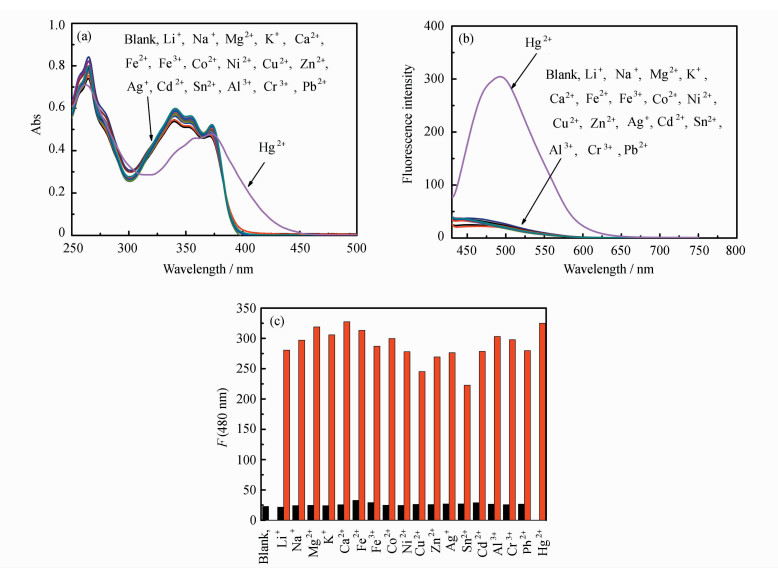 | 图 8 在SNP1溶液中,化合物PIP-S在不同金属离子存在时的(a)紫外-可见吸收光谱和(b)荧光发射光谱(λex=410 nm);(c)化合物PIP-S在SNP1中Hg2+与其他离子共存时在480 nm处的荧光强度,黑色柱状图为PIP-S与其他金属离子作用的图形,红色柱状图为PIP-S与Hg2+作用的图形 |
2.4 时间响应性我们分别研究了化合物PIP-S在SNP1和SNP2溶液中的响应时间。如图 9所示,在PIP-S的SNP1和SNP2溶液中加入20 μmol·L-1的Hg2+后,荧光强度都迅速增强,在10 min内荧光强度达到饱和,表明化合物PIP-S对Hg2+的响应时间很短,可实现对Hg2+的快速检测。
图 9
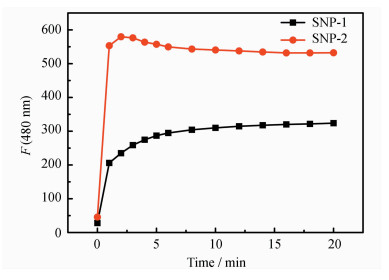 | 图 9 化合物PIP-S(10 μmol·L-1)的SNP1和SNP2溶液中加入Hg2+(20 μmol·L-1)的时间响应曲线 |
3 结论本文制备了两种二氧化硅纳米粒子SNP1和SNP2,合成了硫缩醛修饰的菲并咪唑衍生物PIP-S,并对其进行了表征。研究了SNP1和SNP负载的PIP-S对Hg2+的响应性。PIP-S对Hg2+具有很高的灵敏度,检测限为nmol·L-1级,与国家饮用水标准相当。实验结果说明二氧化硅纳米粒子负载的荧光探针PIP-S可以选择性快速检测水中的Hg2+。
参考文献
| [1] | Aragay G, Pons J, Merkoci A. Recent trends in macro-, micro-, and nanomaterial-based tools and strategies for heavy-metal detection[J]. Chemical Reviews, 2011, 111(5): 3433-3458. DOI:10.1021/cr100383r |
| [2] | Li M, Gou H L, Al-Ogaidi I, et al. Nanostructured sensors for detection of heavy metals:a review[J]. ACS Sustainable Chemistry Engineering, 2013, 1(7): 713-723. DOI:10.1021/sc400019a |
| [3] | Samanta P, Desai A V, Sharma S, et al. Selecitive recognition of Hg2+ ion in water by a functionalized metal-organic framework (MOF) based chemodosimeter[J]. Inorganic Chemistry, 2018, 57(5): 2360-2364. DOI:10.1021/acs.inorgchem.7b02426 |
| [4] | 孟祥明, 刘磊, 郭庆祥. 铅、汞、镉离子的荧光传感器研究进展[J]. 化学进展, 2005, 17(1): 45-54. DOI:10.3321/j.issn:1005-281X.2005.01.005 |
| [5] | Dorea J G, Donangelo C M. Early (in uterus and infant) exposure to mercury and lead[J]. Clincal Nutrition, 2006, 25(3): 369-376. DOI:10.1016/j.clnu.2005.10.007 |
| [6] | Yoon S, Miller E W, He Q, et al. A bright and specific fluorescent sensor for mercury in water, cells, and tissue[J]. Angewandte Chemie, 2007, 46(35): 6658-6661. DOI:10.1002/anie.200701785 |
| [7] | Wani M A, Thakur N, Pandey M D, et al. A reusable multichannel anthraimidazoledione based receptor for Hg2+ and Cu2+ ions:Ultrasensitive, economical and facile detection of Hg2+ in real water sources through fluorescence readout[J]. New Journal of Chemistry, 2017, 41(18): 10000-10008. DOI:10.1039/C7NJ02097J |
| [8] | Choi M G, Kim Y H, Ji E N, et al. Hg2+-selective chromogenic and fluorogenic chemodosimeter based on thiocoumarins[J]. Chemical Communications, 2009, 24: 3560-3562. |
| [9] | Wu C, Wang J, Shen J, et al. Coumarin-based Hg2+ fluorescent probe:synthesis and turn-on fluorescence detection in neat aqueous solution[J]. Sensors Actuators B Chemical, 2017, 243: 678-683. DOI:10.1016/j.snb.2016.12.046 |
| [10] | Tang Y, Lee D, Wang J, et al. Development of fluorescent probes based on protection-deprotection of the key functional groups for biological imaging[J]. Chemical Society Reviews, 2015, 44(15): 5003-5015. DOI:10.1039/C5CS00103J |
| [11] | Liu K, Xu Z, Yin M, et al. A multifunctional perylenedii-mide derivative (DTPDI) can be used as a recyclable specific Hg2+ ion sensor and an efficient DNA delivery carrier[J]. Journal of Materials Chemistry B, 2014, 2(15): 2093-2096. DOI:10.1039/C3TB21801E |
| [12] | 陈文铖, 李振声, 佟庆笑. 不对称刚性扭曲菲并咪唑分子的设计合成及其深蓝电致发光性能研究[J]. 影像科学与光化学, 2017, 35(5): 720-728. |
| [13] | Guo Y, Yan Y, Zhi X, et al. Phenanthroimidazole-based thiobenzamide as an effective sensor for highly selective detection of mercury(Ⅱ)[J]. Bioorganic Medicinal Chemistry Letters, 2013, 23(11): 3382-3384. DOI:10.1016/j.bmcl.2013.03.083 |
| [14] | Yan Y, Zhang R, Yu X, et al. A selective and sensitive phenanthroimidazole-based reactive ratiometric sensor for recognition of Hg2+ ions in aqueous solution[J]. Chempluschem, 2014, 79(12): 1676-1680. |
| [15] | Hu J, Hu Z, Liu S, et al. A new ratiometric fluorescent chemodosimeter based on an ICT modulation for the detection of Hg2+[J]. Sensors and Actuators B Chemical, 2016, 230: 639-644. DOI:10.1016/j.snb.2016.02.125 |
| [16] | Gao Y, Yi N, Ou Z, et al. Thioacetal modified phenan-throimidazole as fluorescence probe for rapid and sensitive detection of Hg2+ in aqueous solution assisted by surfactant[J]. Sensors and Actuators B Chemical, 2018, 267: 136-144. DOI:10.1016/j.snb.2018.04.017 |
| [17] | Marcelo G A, Pires S M G, Faustino M A F, et al. New dual colorimetric/fluorimetric probes for Hg2+ detection & extraction based on mesoporous SBA-16 nanoparticles containing porphyrin or rhodamine chromophores[J]. Dyes and Pigments, 2019, 161: 427-437. DOI:10.1016/j.dyepig.2018.09.068 |
| [18] | Chi F, Guo Y, Liu J, et al. Size-tunable and functional core-shell structured silica nanoparticles for drug release[J]. Journal of Physical Chemistry C, 2010, 114(6): 2519-2523. DOI:10.1021/jp910460j |
| [19] | Zhang P, Wang J, Huang H, et al. Unexpected high photothemal conversion efficiency of gold nanospheres upon graf-ting with two-photon luminescent ruthenium (Ⅱ) complexes:A way towards cancer therapy?[J]. Biomaterials, 2015, 63: 102-114. DOI:10.1016/j.biomaterials.2015.06.012 |
| [20] | Burns A, Sengupta P, Zedayko T, et al. Core/shell fluorescent silica nanoparticles for chemical sensing:towards single particle laboratories[J]. Small, 2006, 2(6): 723-726. DOI:10.1002/smll.200600017 |
| [21] | Ye H, Cai S, Li S, et al. One-pot microwave synthesis of water-dispersible, high fluorescence silicon nanoparticles and their imaging applications in vitro and in vivo[J]. Analytical Chemistry, 2016, 88(23): 11631-11638. DOI:10.1021/acs.analchem.6b03209 |
| [22] | Zhu G, Huang Y, Bhave G, et al. In situ growth of fluorescent silicon nanocrystals in monolithic microcapsule as a photostable, versatile platform[J]. Nanoscale, 2016, 8(34): 15645-15657. DOI:10.1039/C6NR03829H |
| [23] | Zhu L, Peng X, Li H, et al. On-off-on fluorescent silicon nanoparticles for recognition of chromium (Ⅵ) and hydrogen sulfide based on the inner filter effect[J]. Sensors and Actuators B:Chemical, 2017, 238: 196-203. DOI:10.1016/j.snb.2016.07.029 |
| [24] | O'Sullivan M, Vincent B. Aqueous dispersions of silica shell/water-core microcapsules[J]. Journal of Colloid and Interface Science, 2010, 343(1): 31-35. DOI:10.1016/j.jcis.2009.11.008 |
| [25] | Weerasekera H A, Silvero M J, da Silvaa D R C, et al. A database on the stability of silver and gold nanostructures for applications in biology and biomolecular sciences[J]. Biomaterials Science, 2017, 5(1): 89-97. |
| [26] | Atalay S, Barisik M, Beskok A, et al. Surface charge of a nanoparticle interacting with a flat substrate[J]. The Journal of Physical Chemistry C, 2014, 118(20): 10927-10935. DOI:10.1021/jp5023554 |
| [27] | Zanarini S, Rampazzo E, Bonacchi S, et al. Iridium doped silica-peg nanoparticles:enabling electrochemiluminescence of neutral complexes in aqueous media[J]. Journal of the American Chemical Society, 2009, 131(40): 14208-14209. DOI:10.1021/ja906666e |
| [28] | Fan J, Ding L, Fang Y. Surfactant aggregates encapsulating and modulating:an effective way to generate selective and discriminative fluorescent sensors[J]. Langmuir, 2019, 35(2): 326-341. |
