 ,1,2,3, 渠鸿竹
,1,2,3, 渠鸿竹 ,1,2,3, 方向东
,1,2,3, 方向东 ,1,2,3
,1,2,3Omics big data and medical artificial intelligence
Xinyue Wang ,1,2,3, Hongzhu Qu
,1,2,3, Hongzhu Qu ,1,2,3, Xiangdong Fang
,1,2,3, Xiangdong Fang ,1,2,3
,1,2,3通讯作者: 渠鸿竹,博士,副研究员,研究方向:基因组学、精准医学大数据。E-mail:quhongzhu@big.ac.cn;方向东,博士,研究员,研究方向:医学遗传学、精准医学大数据。E-mail:fangxd@big.ac.cn
编委: 朱波峰
收稿日期:2021-06-18修回日期:2021-08-31
| 基金资助: |
Received:2021-06-18Revised:2021-08-31
| Fund supported: |
作者简介 About authors
王昕玥,在读博士研究生,研究方向:基因组学。E-mail:

摘要
随着高通量测序技术和计算机科学的飞速发展,组学数据量指数倍增长,多组学分析优势逐渐显现,人工智能应用也愈加广泛。本文介绍了近年来多组学数据分析和人工智能各自在医学领域的应用进展,同时也介绍了两者相结合应用的案例以及优势,最后简单阐述多组学分析和人工智能在现阶段面临的挑战,旨在为医学行业提供新的研究思路,助推精准医学发展应用。
关键词:
Abstract
With the rapid development of high-throughput sequencing technology and computer science, the amount of large omics data has increased exponentially, the advantages of multi-omics analysis have gradually emerged, and the application of artificial intelligence has become more and more extensive. In this review, we introduce the application progress of multi-omics data analysis and artificial intelligence in the medical field in recent years, and also show the cases and advantages of their combined application. Finally, we briefly explain the current challenges of multi-omics analysis and artificial intelligence in order to provide new research ideas for the medical industry and to promote the development and application of precision medicine.
Keywords:
PDF (589KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
王昕玥, 渠鸿竹, 方向东. 组学大数据和医学人工智能. 遗传[J], 2021, 43(10): 930-937 doi:10.16288/j.yczz.21-215
Xinyue Wang.
随着5G技术的成熟,大数据、物联网、云计算等也在快速发展,社会逐渐从信息时代进入智能时代,各行各业也都在争相推进智能化的脚步。在医疗行业中,医学影像、病患信息等数据海量且复杂,人工整理或解读效率低下,而人工智能可以快速精确地处理大数据,并挖掘其背后的潜在信息。与此同时,随着高通量测序技术的发展,单组学分析技术日益成熟与完善,而多组学大数据的整合分析,已成为研究者们探索生命机制的新方向,在此大背景下,结合组学数据的医疗行业的智能化发展建设已成必然趋势。本文介绍了近年来多组学整合分析和人工智能在医学领域中各自的应用以及结合应用的最新研究成果。
1 组学和人工智能的概念
组学(omics)主要包括基因组学(genomics)、转录组学(transcriptomics)、表观组学(epigenomics)、蛋白组学(proteomics),代谢组学(metabolomics),脂类组学(lipidomics), 免疫组学(immunomics),糖组学(glycomics)等,是各类组学的统称。每一类组学为此类特征的系统集合,比如第一个被定义的基因组学,是对一个生物体所有基因进行集体表征和量化,并研究它们之间的相互关系及对生物体的影响。目前,单一组学的研究比较成熟,但挖掘到的数据信息受限,只能在某一层面解释特征与目标疾病的相关性,无法探究因果关系。多组学的整合分析,可使人们更宏观地了解到目标疾病的全貌,理解目标疾病的发生发展机制,为攻克疑难杂症提供更全面的信息[1]。人工智能(artificial intelligence, AI)是研究、开发用于模拟、延伸和扩展人的智能的理论、方法、技术及应用系统的一门新的技术科学[2]。1950年,“人工智能之父”图灵提出计算机是否拥有人类智能这一问题。1956年,美国达特茅斯会议首次提出“人工智能”这一术语,标志着人工智能这一新兴学科的正式诞生。其本质是通过大量的样本训练来模拟人脑的思维方式,或用以执行人类的行为活动。其研究涵盖领域十分广泛,主要分为自然语言处理、机器学习(machine learning, ML)、机器人、计算机视觉、语言图像识别和知识图谱六大方向。目前,专家系统、护理机器人、手术机器人、计算机辅助诊断等产品都在医疗行业中起着重要作用[3]。
机器学习是一种可用于实现人工智能的方法,其传统的算法包括决策树、逻辑回归、聚类、随机森林、支持向量机、深度学习等[4]。从方法上来分,机器学习算法可以分为监督学习、无监督学习、半监督学习、深度学习和强化学习。其中,深度学习(deep learning, DL)是建立于模拟人脑进行分析学习的神经网络,典型的深度学习模型有循环神经网络、递归神经网络、卷积神经网络、深度信任网络、生成式对抗网络和自编码器等。人工智能、机器学习和深度学习的关系如图1所示。
图1
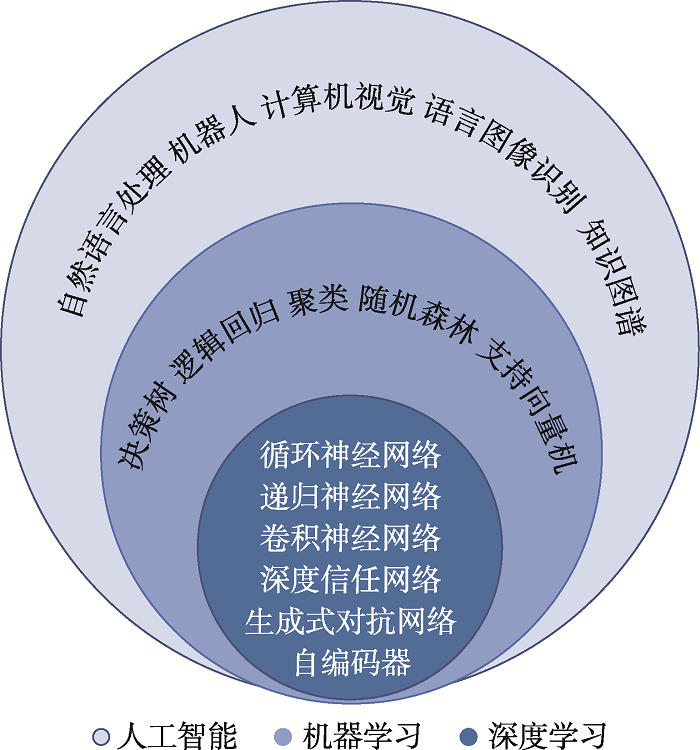 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1人工智能、机器学习和深度学习的关系示意图
Fig. 1Schematic diagram of the relationship between artificial intelligence, machine learning, and deep learning
2 组学大数据与人工智能在医学中的应用
2.1 多组学在医学中的应用
随着测序技术的发展及组学新技术的不断涌现,不同种类的组学数据指数级增长,对多组学大数据的整合分析,已成为科学家探索生命机制和疾病演变的新方向。通过DNA甲基化和基因表达数据的整合分析,可以鉴定疾病发生发展相关的分子标志物。Mens等[5]使用了来自大规模全基因组关联研究(genome- wide association study, GWAS)的公开数据来搜索与各种心脏代谢特征相关的miRNA相关序列的遗传变异,包括脂质和肥胖相关特征、血糖指数、血压、2型糖尿病(type 2 diabetes, T2D)和冠心病(coronary heart disease, CHD)患病率,发现了67个已鉴定miRNA中的180个SNP与心脏代谢特征相关。然后,文章使用鹿特丹研究(The Rotterdam Study)参与者的DNA甲基化和miRNA表达数据进一步研究相关miRNA与心脏代谢特征之间的联系,其中38个miRNA的CpG位点的DNA甲基化水平与研究性状相关。此外作者从67个已鉴定miRNA中进一步发现了与研究性状相关的8个miRNA。整合不同组学结果表明miR-10b-5p、miR-148a-3p、miR-125b-5p和miR-100-5p与心脏代谢的脂质性状密切相关,这些可以被视为潜在的2型糖尿病和冠心病早期诊断或进展的生物标志物。
Yuan等[6]使用多个项目的转录组和/或DNA甲基化数据证明了45种结直肠癌(colorectal cancer, CRC)变体中29种的易感性可能是由基因调节的顺式作用介导的,并且确定了66个推测的易感基因。DIP2B和SFMBT1通过破坏细胞行为(包括迁移、侵袭和上皮间质转化)在CRC的发生中起着至关重要的作用。
以序列为中心的蛋白质组、基因组和转录组数据的整合分析,可以为基因表达调控、信号网络、疾病亚型和临床预测提供新的见解。Cohen等[7]结合游离DNA突变和循环蛋白质生物标志物开发了一种新的基于血液的预测方法CancerSEEK,不仅可以实现癌症早诊,还可以定位这些癌症的起源器官。研究将CancerSEEK应用于1 005名患有卵巢癌、肝癌、胃癌、胰腺癌、食道癌、结直肠癌、肺癌或乳腺癌的患者上,能够定位癌症的起源器官并鉴定出5种肿瘤类型(卵巢癌、肝癌、胃癌、胰腺癌和食道癌)的早期存在,其灵敏度介于69%~98%,特异性为99%。
Yang等[8]为了确定早期结CRC的潜在靶点,对来自II期CRC患者进行了无标记蛋白质组学分析,共鉴定出2 968种蛋白质,再从癌症基因组图谱(The Cancer Genome Atlas, TCGA)结肠腺癌库中检索到相应的RNA测序数据,筛选出111种关键候选蛋白,最终由病理图像数据确定了三个潜在靶点:蛋白质精氨酸脱亚胺酶2 (PADI2)、IgG结合蛋白的Fc片段(FCGBP)和磷酸丝氨酸转氨酶1。
肉瘤代表一组高度组织学和分子异质性的罕见恶性肿瘤,预后较差。 Zhang等[9]从癌症蛋白质组图谱(The Cancer Proteome Atlas, TCPA)上下载了肉瘤患者的蛋白质组表达谱以及临床信息,发现55种蛋白质与患者的总生存期(overall survival, OS)相关。基于蛋白质组学特征开发了肉瘤患者的预后模型,模型包括七种蛋白:AMPKALPHA、CHK1、S6、ARID1A、RBM15、ACETYLATUBULINLYS40和MSH6。再使用TCGA中肉瘤患者的转录组数据集验证预后模型的性能,证明模型可能是指导临床实践的有效工具。
这些研究表明,多组学大数据的集成为了解跨细胞组织多个层面的因果关系提供了机会,在医学领域应用中具有巨大潜力,可以得到比单组学分析更全面,更精确的结果。
2.2 人工智能在医学中的应用
2.2.1 人工智能在影像中的应用医学影像主要包括医学影像计算机断层扫描(computer tomography, CT)、磁共振成像(magnetic resonance imaging, MRI)、正电子发射计算机断层显像(positron emission tomography-computer tomography, PET-CT)、X射线、超声等技术[10]。人工智能在医学影像上已经应用到图像分割、图像分类、图像配准和目标检测等场景中[11],其可以实现图像质量的改善提升,且对于理解图像信息,辅助诊断分类都起着极大的作用,还可以迅速完成图像分割配准等更高级的操作。
在图像配准方面,De Silva等[12]使用了一种可以纵向对齐多模态视网膜图象的深度学习配准算法。在彩色眼底照相(color fundus photography, CFP)、眼底自发荧光(fundus autofluorescence, FAF)和红外反射(infrared reflectance, IR)三种图像模式实验中,单模态纵向配准实验获得54~59 µm的误差,相较于传统的配准方法(平均误差在39~53 µm范围内),展示出了更高的准确性。对于多模态横断面配准实验,该方法平均误差在66~69 µm范围内,而传统方法则错误颇多。在图像分类方面,Jiang等[13]对111例乳房动态对比材料增强(dynamic contrast material-enhanced, DCE)MRI检查的图像分别通过传统的计算机辅助评估软件和AI进行分类测试,发现使用AI方法图像分类准确性更高,平均AUC从0.71提高到0.76。在图像分割方面,Hoseini等[14]提出了一种大容量深度卷积神经网络(deep convolutional neural network, DCNN)的方法,可以更准确,更快速地分割脑部MRI图像,在BraTS2016脑肿瘤数据集的完整区域、核心区域和增强区域的准确性分别为0.90、0.85和0.84。
2.2.2 人工智能在癌症研究中的应用
人工智能在肿瘤学研究的各个方面的应用增长迅速,应用范围包括癌症风险预测、癌症检测和分类分期、癌症药物发现和再利用、预后分析等,有助于医生为每位患者制定高度个性化的癌症预防和治疗计划。
对于癌症诊断,主要是对癌症患者的图像和非癌性病变的影像学图像利用人工智能方法提取差异特征,构建诊断模型。Jeyaraj等[15]开发了一种具有两个分层的新结构深度卷积神经网络(convolutional neural network, CNN),分析样本多维高光谱图像辅助口腔癌诊断,准确度为94.5%。Luo等[16]利用1 036 496个内窥镜图像开发了一种胃肠道人工智能诊断系统(GRAIDS),经外部验证和与专业内镜医师的诊断结果比较,GRAIDS表现出良好的诊断性能,其准确性为0.915~0.977,灵敏度为0.942,堪比专业内镜医师(0.945)。Li等[17]开发了一个基于CNN的新模型来分析窄带成像放大内窥镜(magnifying endoscopy with narrow band imaging, M-NBI)观察到的胃粘膜病变图像,用于胃癌的早期诊断,该模型准确率、敏感性和特异性分别为90.91%、91.18%和90.64%,其中敏感性显著高于专家组判定,准确率和特异性与专家组未有差异。同样,基于4204张影像利用CNN方法建立的黑色素瘤诊断模型,灵敏度、特异性都超过了皮肤科医生的检验结果[18],表明了人工智能在大数据时代的优越性。
在风险预测方面,人工智能可辅助医生决策,降低患者就医成本,提高其生活质量。Kudo等[19]使用仅接受内镜切除术或T1 CRC手术切除术的入选患者的临床病理记录,构建了一个T1大肠癌淋巴结转移风险的人工智能预测模型(artificial neural network, ANN),该模型(AUC=0.84)在识别初次内镜手术切除后的转移淋巴结风险上效果明显优于美国指南(AUC=0.77),为T1期大肠癌患者是否进行淋巴结清除手术,提供了辅助预测手段。
肿瘤的分级用于评价恶性肿瘤侵袭转移的程度,指导临床治疗和患者预后管理。Bulten等[20]使用患者穿刺活检切片和病理报告开发了一项可根据Gleason评分标准对前列腺活检样本分级评分的深度学习系统,这个系统在诊断和分级方面性能卓越,区分恶性肿瘤的AUC为0.990,判断≥2级和≥3级的AUC分别为0.978和0.974,该系统对100份活检样本的分级结果(kappa=0.854)优于专家判定(kappa= 0.819),可降低人工判定带来的主观性错误并节约时间成本。
在预后分析方面,人工智能也表现出良好的预测效果, Arya等[21]提出了一个两阶段的人类乳腺癌预后预测多模式模型,即第一阶段使用卷积神经网络提取特征,第二阶段输入提取的特征进而在基于堆栈的集成模型中得到分类结果,该集成模型的结果比现有的多模式CNN方法更好(AUC=0.93,准确度为90.2%)。
2.2.3 人工智能在辅助医学上的应用
人工智能还能辅助医生做一些识别、监控管理疾病的工作,将人工智能的数据整合、分析与判断能力与人类医生的诊疗经验相结合,提供辅助医疗的处理逻辑,分担医生压力、提高工作效率。
对于术后分析,Frit等[22]收集了来自医疗中心接受气管插管手术的患者数据构建了一个可以预测术后30天死亡率的多路径卷积神经网络深度学习模型,在纳入的95,907名患者数据中,最终有941名患者在手术后1个月内死亡。该模型预测术后30天死亡率结果AUC为0.867, 95%CI为0.835~0.899。
对于监控管理慢性病,以往用于测量视网膜血管口径的方法离不开人工操作,图片质量好坏直接影响测定时间长短,且人工测量差异较大。为了提高效率,Cheung等[23]开发了一种深度学习CNN模型(SIVA-DLS),可以全自动地从视网膜照片中去测量视网膜血管的口径,且结果与人工测量结果具有高度的一致性,相关系数在0.82~0.95之间。除此之外,该研究还证明了SIVA-DLS测量的视网膜血管口径与心血管疾病有关。
人工智能在医学中的应用如表1所示。除此之外,医学领域的康复护理机器人在很大程度上也应用了人工智能技术,可以帮助行动不便的病人日常生活和术后康复[3],也可以辅助医生进行手术,提高医疗效率,节省医疗资源,应用十分广泛。
Table 1
表1
表1人工智能在医学中的应用
Table 1
| 应用 | 研究内容 | 方法 | 结果 | 啊啊啊啊 |
|---|---|---|---|---|
| 影像 | 黄斑变性 | DLOVLP | 单模态纵向配准实验平均误差为54~59 µm,多模态横断面配准实验平均误差为66~69 µm | [12] |
| 乳腺DCE MRI | AI系统 | AI分析平均AUC从0.71提高到0.76 | [13] | |
| 分割脑部MRI图像 | 大容量深度卷积神经网络 | 完整区域,核心区域和增强区域的准确性分别为0.90、0.85和0.84 | [14] | |
| 癌症 研究 | 口腔癌诊断 | 分层深度卷积神经网络 | 准确度为94.5% | [15] |
| 上消化道癌诊断 | GRAIDS | 内部验证集准确性为0.955,外部验证集准确性结果为0.915~0.977,且灵敏度堪比专业内镜医师 | [16] | |
| 胃粘膜病变 | 卷积神经网络 | 敏感性显著高于专家组结果,准确率和特异性与专家组未有差异 | [17] | |
| 黑色素瘤图像 | 卷积神经网络 | CNN的灵敏度和特异性均高于专家 | [18] | |
| 结直肠癌转移至淋巴结风险 | 人工神经网络 | AUC=0.84 | [19] | |
| 前列腺活检评分 | 深度学习 | 良恶性AUC=0.990 (0.982~0.996);观察者数据集中,kappa比专家组高 | [20] | |
| 乳腺癌预后预测 | 基于堆叠集成的卷积神经网络 | AUC=0.93,准确度为90.2% | [21] | |
| 辅助 医学 | 预测术后30天死亡率 | 多路径卷积神经网络 | AUC=0.867 (0.835~0.899) | [22] |
| 测量视网膜血管口径 | SIVA-DLS | 与人工测量结果相关系数在0.82~0.95之间 | [23] |
新窗口打开|下载CSV
2.3 组学大数据与人工智能的联合应用
组学大数据和人工智能各自在医学领域都发挥着巨大的潜能与优势,两者结合应用,即高维数据集的可用性加上高性能计算机以及创新的机器学习架构[24],不仅可以提高数据利用率,更能优化单组学或非人工智能研究的结果。卵巢癌是女性生殖器官常见的恶性肿瘤之一,初始症状不明显,很难及早发现,复发率较高,治愈率较差,死亡率超过宫颈癌及子宫内膜癌之和,高居妇科癌症首位。Hira等[25]开发了基于可变自动编码器(variational autoencoder, VAE)改进的最大平均差异VAE (maximum mean discrepancy-variational autoencoder, MMD-VAE)技术,而后开发了VAE和MMD-VAE的深度学习框架。VAE是一种训练被正则化以避免过度拟合,并确保潜在空间具有良好的特性来支持生成过程的自编码器。MMD-VAE则是将VAE的损失函数替换成使用最大平均差异。通过单一组学(基因组、转录组、表观组)、综合二组学(基因组+转录组、表观组+转录组、基因组+表观组)和三组学(基因组+转录组+表观组)的数据分析,研究卵巢癌的癌症样本识别、分子亚型聚类和分类以及生存分析。结果显示,VAE和MMD-VAE优于现有的降维(PCA、t-SNE)技术,且在亚型聚类和分类以及生存分析中,综合二组学和三组学的结果比基于单组学更好,且在多组学数据集分析中MMD-VAE性能比VAE更出色。
Zhao等[26]构建了一个可扩展且可解释的深度学习框架DeepOmix用来集成多组学数据和生存预测,该团队使用突变、拷贝数变化、基因表达和DNA甲基化四种组学数据,将DeepOmix应用在八个不同的癌症(膀胱尿路上皮癌、乳腺浸润癌、头颈部鳞状细胞癌、低级别胶质瘤、肾透明细胞癌、肺腺癌、卵巢浆液性囊腺癌和胃腺癌)数据集的预后分析,经与其他五种最新方法(BLockForest、DeepHit、DeepSurv、glmBoost、IPF_LASSO)比较,在其中的六个数据集中,DeepOmix的预后预测结果表现均为最佳。文章中还提到DeepOmix除了可以使用四种类型的组学数据之外,还可以集成更复杂的蛋白质数据。
Xu等[27]提出了一种新的分层集成深度灵活神经森林框架(HI-DFNForest),集成多组学数据用于肿瘤亚型分类。文章针对乳腺浸润性癌、多形性胶质母细胞瘤和卵巢癌三种肿瘤,分别使用 DNA 甲基化数据、miRNA表达数据、基因表达数据或者将三类数据整合来进行亚型分类。结果显示无论在哪种肿瘤数据集中,多组学整合数据分类的准确性(分别为0.846、0.885、0.840)都高于单组学(DNA甲基化:0.731、0.596、0.640;miRNA表达:0.769、0.539、0.640;基因表达:0.808、0.865、0.760)。
多组学分析产生的数据较之单一组学分析更多更复杂,针对具体的生物医学科学问题,多组学也可以凭借多维度多角度的优势更为全面地解释该问题。所以多组学相较单组学更为需要人工智能的辅助。而将人工智能技术应用于多组学大数据上,将会是实现精准医疗和个性化医疗的重要步骤。现有研究表明多组学数据与人工智能结合应用,结果会更优于单组学分析。
3 医学应用的挑战
大数据产业的发展和人工智能的兴起,促进了数据量的增长。国家政策的扶持,为组学大数据和人工智能的发展带来了前所未有的机遇,同时也面临诸多挑战。大规模各种组学数据的产生,为疾病的发病机制的研究,提供了丰富的数据资源。但是组学数据的分析由于缺乏统一的标准,根据不同流程,产生不同的结果,导致数据整合过程艰难复杂;不同种类组学数据质量参差不齐,由于某些组学技术还处于初步发展阶段,检测方法尚不成熟,导致数据质量差;组学数据种类多,亟需开发相互整合的分析技术;组学数据由于在机构、医院之间分散保存,缺乏有效的集成技术,阻碍了利用大批量的数据进行人工智能的训练测试。
人工智能应用于医学研究同样面临多方面的挑战。现下研究多为监督学习,但是无监督学习更贴近人工智能,大量的数据集还需要熟练的医生来进行标注,此过程需要耗费大量的人力物力精力[28]。人工智能计算过程不透明,“黑箱”的可解释性不强[29],在医院层面存在责任划分归属问题。并且各家医院之间信息共享率低,开发出来的人工智能算法不一定具有普遍适应性。此外,随着越来越多人工智能产品投入临床使用,数据安全形势逐渐严峻,病人的隐私保护问题凸显,要开发相应技术并且具备相应的法律法规和伦理规范去约束管制[30]。
4 结语与展望
组学大数据和人工智能相辅相成,组学大数据的增长与整合使得临床对人工智能的需求日益增大,而人工智能的发展又可以很好地利用组学大数据推动医疗行业的发展。虽存在诸多问题,但前景一片广阔,加之机遇良多,因此,更需要从国家政府到企业研究机构再到医护人员与病患的一致合作,为未来精准医学和个性化医学的实现打下坚实基础。(责任编委: 朱波峰)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
