 ,1,2,3
,1,2,3The effects of m 6A modification in central nervous system function and disease
Jiabin Shi1,2,3, Dayong Wang1,2,3, Qing Xia1,2,3, Xu Gao ,1,2,3
,1,2,3通讯作者: 高旭,博士,教授,研究方向:遗传改变模式动物的建立及复杂疾病机制研究,抗体药物发现。E-mail:gaoxu_671227@163.com
编委: 王晓群
收稿日期:2020-07-21修回日期:2020-10-21网络出版日期:2020-12-20
| 基金资助: |
Received:2020-07-21Revised:2020-10-21Online:2020-12-20
| Fund supported: |

摘要
6-甲基腺嘌呤(N 6-methyladenosine, m 6A)是一种重要的RNA修饰,参与细胞内mRNA的整个代谢活动,调控基因的表达,调节多种生物过程,在大脑组织中丰度较高。稳定的m 6A修饰有助于胚胎大脑发育、记忆力的形成,在维持中枢神经系统的功能中起到重要作用。当m 6A修饰水平及相关蛋白表达水平发生改变时,将会引起神经系统功能异常,包括脑组织发育迟缓、轴突再生能力障碍、记忆力改变以及干细胞更新和分化紊乱等。近年来的研究还发现,m 6A修饰及其相关蛋白在阿尔茨海默症、帕金森症、脆性X染色体综合征、抑郁症和胶质母细胞瘤等众多神经系统疾病的发展进程中扮演关键角色。本文主要综述了近年来在中枢神经系统中m 6A修饰调控机制研究的相关进展,重点介绍了m 6A修饰介导的基因表达调控对中枢神经系统生物学功能以及多种相关疾病的影响,以期为中枢神经系统疾病提供新的研究靶点和治疗方向。
关键词:
Abstract
N 6-methyladenosine (m 6A) is an important RNA modification, which is highly active in brain tissues, participates in global intracellular mRNA metabolism, and regulates gene expression and a variety of biological processes. Stable m 6A modification contributes to the normal embryonic brain development and memory formation and plays an important role in maintaining the functions of the central nervous system. However, changes in the level of m 6A modification and the expression of its related proteins cause abnormal nervous system functions, including brain tissue development retardation, axon regeneration disorders, memory changes, and stem cell renewal and differentiation disorders. Recent studies have also found that m 6A modification and its related proteins play key roles in the development of various nervous system diseases, such as Alzheimer's disease, Parkinson's disease, fragile X-chromosome syndrome, depression and glioblastoma. In this review, we summarize the research progresses of m 6A modification regulation mechanism in the central nervous system in recent years, and discusses the effects of gene expression regulation mediated by m 6A modification on the biological functions of the central nervous system and related diseases, thereby providing some insights on the new research targets and treatment directions for the central nervous system diseases.
Keywords:
PDF (753KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
史佳宾, 王大勇, 夏晴, 高旭. m 6A修饰对中枢神经系统功能及疾病的影响 . 遗传[J], 2020, 42(12): 1156-1167 doi:10.16288/j.yczz.20-233
Jiabin Shi.
近年来,随着对RNA m6A甲基化功能的不断研究,发现m6A修饰水平的动态改变能够直接影响RNA代谢、蛋白质功能。目前已在多个与肿瘤相关的癌基因中发现m6A修饰的身影,提示m6A修饰有可能是控制肿瘤发生、抗肿瘤免疫的重要调控修饰[1]。此外m6A修饰还具有调控生物机体昼夜节律、DNA损伤修复、脂肪生成、神经发生和大脑发育等分子功能。m6A修饰即mRNA上的腺嘌呤第6位N在甲基转移酶复合物(methyltransferase complex, MTC)的作用下发生甲基化反应形成的一种甲基化修饰,它是一个受到甲基化转移酶和去甲基化转移酶共同调控的可逆过程。利用高通量测序等方法对m6A修饰进行检测发现,m6A修饰通常富集在终止密码子和非编码区附近,RNA在甲基化转移酶的催化作用下发生甲基化,在去甲基化转移酶催化作用下去除甲基化,m6A甲基化位点可被识别蛋白识别,参与并调控转录后修饰过程[2]。目前在真核生物中已发现100多种不同类型的RNA修饰,包括6-甲基腺嘌呤(N6-methyladenosine, m6A)、1-甲基腺嘌呤(N1-methyladenosine, m1A)、5-甲基胞嘧啶(5-methylcytidine, m5C)、5-羟甲基胞嘧啶(5-hydroxylmethylcytidine, hm5C)、肌苷修饰(inosine, I)、假尿苷修饰(pseudouridine, ψ)等,其中m6A修饰丰度最高,m6A修饰和m5C修饰均能够调控RNA代谢过程等重要的生物学功能,目前研究者发现了m6A修饰在机体生物学功能中的多种调控机制,但是对于mRNA中m5C修饰的具体作用方式并不完全清楚[3]。在大脑中存在着丰富的m6A修饰,该修饰通过调控mRNA代谢使神经系统正常行使其功能。当参与m6A修饰的关键酶表达异常时,m6A修饰水平会发生改变,从而影响mRNA代谢紊乱,转录和翻译障碍等分子功能,继而导致机体神经系统的生理功能障碍。本文对m6A修饰的基本概念、m6A修饰调控RNA代谢的分子机制以及m6A修饰在中枢神经系统及疾病中的生物学作用等方面进行了相关的阐述,以期能够更深入了解m6A修饰的作用方式,探寻m6A修饰与中枢神经系统疾病发展的关联。
1 影响m6A修饰的相关酶和识别蛋白
m6A是一种重要的表观遗传学修饰,需要写入基因(Writers),擦除基因(Erasers),读取基因(Readers)编码的多种调控蛋白共同参与[4]。甲基化转移酶复合物参与m6A修饰的产生,去甲基化转移酶(FTO和ALKBH5)等能够去除m6A,二者在细胞内共同维持mRNA的甲基化和非甲基化之间的动态平衡。Readers编码的蛋白是一类RNA结合蛋白,这种蛋白能够识别发生m6A修饰的位点并与m6A结合,与甲基化转移酶复合物和去甲基化转移酶共同参与调控mRNA的代谢活动。m6A修饰的多样性和可逆性使m6A修饰在参与机体中枢神经系统功能的调控中具有更复杂的生理机制(表1)。Table 1
表1
表1m6A修饰的相关酶在中枢神经系统中的功能与作用
Table 1
| 类别 | 基因 | 功能 | 作用 | 参考文献 |
|---|---|---|---|---|
| 甲基化转移酶 (Writers) | METTL3 | 影响Dapk1、Fadd、Ngfr的mRNA半衰期 | METTL3缺失可使m6A修饰异常,导致小脑发育不全、长期记忆能力减弱,影响干细胞的自我更新和分化 | [10] |
| METTL14 | 识别并影响Pten蛋白的翻译 | METTL14敲除可影响轴突再生能力 | [11] | |
| ZC3h13 | ZC3h13使Zc3h13-WTAP-Virilizer-Hakai复合物留在核内,提高mESC内的mRNA m6A修饰水平 | ZC3h13敲除将导致复合物从细胞核转移到细胞质,使m6A水平降低,破坏mESC自我更新并诱导进行分化 | [12] | |
| 去甲基化转移酶 (Erasers) | FTO | FTO可抑制突触神经节中Syp基因mRNA的转录,降低Spy的蛋白水平 | 降低FTO的表达后可提高Syp蛋白水平,从而提高记忆能力 | [13] |
| 识别蛋白 (Readers) | YTHDF1 | YTHDF1识别并结合发生m6A修饰的GRIN1、GRIN2A、GRIA1、CAMK2A、CAMK2B基因的mRNA,促进翻译过程 | YTHDF1缺失引起相关蛋白的翻译异常,导致记忆力下降 | [14] |
| YTHDF3 | YTHDF3可特异性识别胞浆中发生m6A修饰的Apc基因mRNA,与YTHDF1共同调控翻译过程 | YTHDF1和YTHDF3缺失引起Apc蛋白翻译异常,可导致神经元发育异常,突触传递能力降低 | [15] |
新窗口打开|下载CSV
1.1 Writers
m6A修饰的甲基化转移酶复合物,主要由METTL3、METTL14、WTAP和KIAA1429组成[5,6],还包括ZFP217、RBM15、RBM15B、HAKAI (CBLL1)、ZC3H13等组分。其中METTL3是甲基化转移酶的核心组分,起催化作用,METTL14负责募集RNA,二者形成异源二聚体,共同促进m6A修饰的产生。WTAP负责稳定复合物的作用,RBM15、RBM15B 负责协助METTL3与WTAP结合,使它们可以准确定位到靶位点,与其他蛋白共同参与m6A修饰的产生。此外,还有新的与甲基化相关的酶类陆续被发现,例如METTL5可通过与甲基化转移酶激活剂TRMT112结合形成异源二聚体的方式,参与18S rRNA的m6A修饰,ZCCHC4也是一种m6A修饰酶,它可参与28S rRNA上A4220位的m6A修饰[7]。METTL16作为甲基化转移酶不仅可以催化U6 snRNA发生甲基化,还能够结合蛋氨酸腺苷转移酶II(MAT2A) 3'UTR中的发卡结构(hp1),调节MAT2A mRNA的稳定性和剪接,进而调控S-腺苷甲硫氨酸(SAM)的稳态[8,9]。这些研究结果提示可能还存在其他可以调控m6A生成及变化的作用因子,在未来的研究中有待发现。1.2 Erasers
m6A修饰的去甲基化转移酶,可催化已发生m6A修饰的碱基进行去甲基化,目前只鉴定出ALKB家族的肥胖相关蛋白(FTO)和ALKB同源蛋白5(ALKBH5)属于该类转移酶[16,17,18]。2007年,研究者发现FTO是一种与肥胖相关的基因[19,20]。2011年美国芝加哥大学的何川教授首次证实FTO能够催化m6A发生去甲基化,证明m6A修饰是动态可逆的过程[17]。随着不断对FTO介导的m6A修饰机制的深入研究,发现FTO能将m6A依次氧化成不稳定的中间产物N6-羟甲基腺苷(hm6A)和N6-甲酰腺苷(f6A),然后转变成正常的腺苷酸(A),并且由于FTO定位不同,发生去甲基化的对象也不同,在细胞核内FTO介导发生m6A去甲基化反应,细胞质内FTO介导发生N6,2′-O二甲基腺苷(m6Am)去甲基化反应[21,22]。此外研究者在2013年发现了第二种去甲基化转移酶:ALKBH5蛋白,该蛋白主要利用氧化性催化RNA上m6A发生去甲基化反应,FTO和ALKBH5这两种蛋白水平的变化都会对m6A修饰水平产生显著的影响[16]。1.3 Readers
m6A结合蛋白,包括YTH结构域蛋白(YTHDF1-3)、异质核糖核酸蛋白(hnRNPC、hnRNPG、hnRNPA2B1)以及胰岛素样生长因子2结合蛋白(IGF2BP1、IGF2BP2、IGF2BP3)等。这类蛋白能够识别mRNA上发生甲基化的碱基位点,通过直接或间接的方式与其结合,从而影响RNA的代谢[23]。其中,RNA结合蛋白YTHDF1能够在细胞质中与翻译起始因子协调促进RNA翻译过程。RNA结合蛋白YTHDF2可与发生m6A甲基化的mRNA结合,与CONT1相互作用,使靶mRNA去腺苷酸化,调控mRNA的降解。RNA结合蛋白YTHDF1与YTHDF3共同协调作用促进转录翻译过程,YTHDF3影响YTHDF2介导的mRNA降解过程。RNA结合蛋白IGF2BP识别并结合m6A位点可增强mRNA稳定性并促进翻译过程[24]。RNA结合蛋白HNRNPA2B1识别细胞核内pri-miRNA上的m6A修饰调控外显子的选择性剪接[25]。随着对RNA识别位点的精确定位以及高通量测序等技术的应用,研究者不断发现了各种m6A结合蛋白,这使m6A的调控功能具有了更多的复杂性和多样性。2 m6A修饰在RNA代谢中的作用
m6A修饰参与mRNA代谢的整个过程,与RNA结合蛋白通过直接或间接的结合方式,在RNA成熟体加工、RNA可变剪接、RNA出核转运、RNA翻译和RNA稳定等过程中发挥不可替代的作用。2.1 m6A修饰参与miRNA成熟体的加工过程
microRNA (miRNA)是一类长度为18~25nt的内源性单链非编码RNA,通过碱基互补配对的方式阻止mRNA的翻译或使mRNA降解,miRNA是调控转录后基因表达的重要分子。miRNA成熟的第一步是RNA结合蛋白DGCR8识别初级转录本(pri-miRNA),招募与III型核糖核酸酶Drosha并形成复合体,然后裂解双链RNA,产生具有茎环结构的precursor miRNAs (pre-miRNA)。研究者于2015年首次证实了m6A修饰水平改变能够影响miRNA的成熟过程,这是由于m6A甲基化转移酶METTL3介导pri-miRNA发生甲基化反应,然后被DGCR8特异性识别并与该位点结合,从而剪切双链RNA产生pre-miRNA。且当降低METTL3表达时,DGCR8与pri-miRNA的结合能力下降,导致pre-miRNA表达量降低,而pri-miRNA含量增加,证明METTL3介导的m6A修饰参与了miRNA的加工过程[26]。此外,RNA结合蛋白HNRNPA2B1能够识别并结合细胞核内pri-miRNA上的m6A修饰,与DGCR8协同作用,调控外显子的选择性剪接,促进pri-miRNA的加工,因此HNRNPA2B1作为m6A的阅读蛋白在一定程度上影响着pri-miRNA的加工成熟过程[25]。2.2 m6A修饰参与RNA的可变剪接
RNA的剪接过程是RNA代谢过程中的重要一环,其中包括精确的切除内含子和正确的连接外显子,从而确保产生具有生物学功能的成熟mRNA。随着研究者们的不断研究,发现剪接的外显子和内含子上均存在显著的m6A修饰,因此提示我们由m6A结合蛋白介导的m6A修饰参与并调控mRNA的选择性剪接过程。例如,m6A修饰的RNA因短双螺旋结构被破坏发生去折叠,暴露隐藏的蛋白质结合位点,可被异质核糖核蛋白hnRNPC和hnRNPG识别并结合,从而促进其外显子的连接。RNA结合蛋白YTHDC1可直接与m6A位点结合,募集剪接因子SRSF3,阻断SRSF10,从而促进外显子的连接,参与m6A修饰有关的RNA剪接过程的调控[27]。2.3 m6A修饰参与mRNA的出核转运过程
研究者发现加工成熟的mRNA在TAP-P15复合体和衔接蛋白的协同作用下从细胞核中转移到细胞质中,然后在细胞质中进行翻译表达或者降解,而m6A修饰水平的变化可以影响mRNA的出核转运过程。例如去甲基化转移酶ALKBH5通过调控ASF/SF2的磷酸化水平,影响mRNA的出核过程,当ALKBH5缺失时,ASF/SF2的磷酸化水平降低,增强了与TAP-P15复合体的相互作用,促进mRNA出核[16]。甲基化转移酶METTL3的表达降低可使mRNA的出核转运过程受到抑制,RNA结合蛋白ALKBH5表达降低将导致mRNA向细胞质运输的能力增强[16,28]。此外,SRSF3是NXF1介导的出核转运途径中的关键因子,YTHDC1与SRSF3相互作用,促进发生m6A修饰的mRNA出核。mRNA的出核转运过程是连接mRNA转录和翻译的关键过程,而m6A相关蛋白介导的m6A修饰能够影响该途径中的关键因子,因此m6A修饰对该过程的调控可能是影响基因表达的重要原因。2.4 m6A修饰促进mRNA翻译
真核生物中mRNA的翻译包括起始、翻译和终止3个阶段,其中起始阶段最为关键。翻译起始机制有两种,分别为经典的帽依赖性扫描机制和非帽依赖性翻译机制[29]。在成熟的mRNA外显子上还存在着丰富的m6A修饰,它通过调控不同的翻译起始机制来影响转录本的翻译过程。例如,m6A修饰的结合蛋白YTHDF1可将发生甲基化的mRNA与核糖体偶联,招募翻译起始因子3 (eIF3)增强翻译的限速步骤,以此促进mRNA的翻译过程[30]。甲基化转移酶METTL3以不依赖甲基化转移酶活性的方式也参与了mRNA的翻译过程,在人类肺癌细胞中METTL3通过与翻译起始相关因子相关作用,增强了表皮生长因子受体(EGFR)、TAZ等重要癌基因的mRNA翻译,促进了癌细胞的生长,虽然在此研究中并未发现m6A修饰的直接作用,但它可能以其他某种方式参与了该过程,具体还有待人们进行深入研究[31]。此外在成年哺乳动物的神经系统中,甲基化转移酶METTL14和RNA结合蛋白YTHDF1的缺失能够抑制因损伤引起的蛋白翻译过程,从而降低外周神经系统的轴突再生功能[11]。2.5 m6A影响mRNA的稳定性
mRNA降解是mRNA代谢过程中的最后一步,RNA结合蛋白YTHDF2是第一个证明了m6A修饰参与mRNA降解的蛋白。该蛋白具有双结构域,羧基末端YTH结构域可选择性的与发生甲基化的mRNA结合,而其氨基末端的功能结构域将结合了YTHDF2的mRNA传递到细胞质中,通过招募CCR4-NOT去腺苷酸复合物从而使mRNA发生降解[32,33]。研究发现,降低斑马鱼胚胎中YTHDF2的表达,可以减弱发生m6A修饰的mRNA的降解能力,导致合子基因组的激活受阻,细胞周期暂停,影响正常发育[23]。3 m6A修饰在中枢神经系统及疾病中的生物学作用
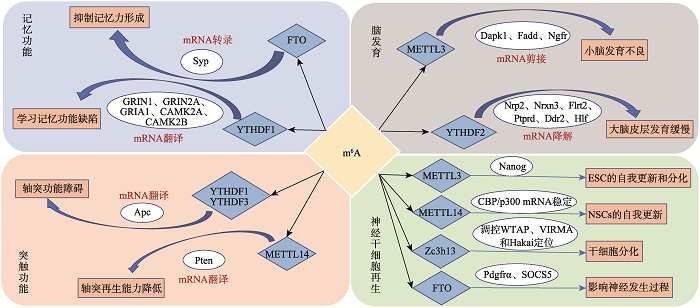
中枢神经系统(central nervous system, CNS)是机体神经系统中的重要组成部分,包括脑和脊髓,作用是接收传入机体的信息,并进行整合、存储、加工,中枢神经系统是机体学习和记忆的重要基础。近年来,众多研究表明m6A修饰在中枢神经系统中丰富存在,由RNA结合蛋白介导的m6A修饰调控各种神经传导通路的激活,对神经元的发育、分化和再生均发挥着不可替代的作用,m6A修饰的改变对机体脑组织的发育、学习记忆能力、干细胞的更新和分化、突触再生等生物学功能有重要影响(图1)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1m6A修饰在中枢神经系统中的作用
Fig. 1The effect of N6-methyladenosine in central nervous system
3.1 m6A修饰影响脑的发育及其功能
m6A修饰参与机体的多种生命活动,与生物学功能密切相关。已有研究发现,在大脑的成熟过程中,可检测到m6A甲基化水平的上调,表明大脑中RNA的m6A修饰与脑组织的发育和功能具有重要的联系[11]。研究发现在不同脑区以及不同类型的神经细胞中,m6A修饰水平均不相同,常见甲基化mRNAs的m6A修饰水平显著高于特异性甲基化mRNAs的m6A修饰水平,小鼠小脑的m6A修饰水平高于大脑皮层,神经元中RNA的m6A修饰水平高于胶质细胞,这些结果均证明m6A修饰具有区域特异性和异质性,不同靶mRNA、不同的甲基化位点以及不同的甲基化水平都会对脑组织的生物学功能产生影响[34]。研究表明,YTHDF2缺失可促使大脑皮层中的神经干细胞发生不对称分裂,使神经前体细胞数量减少,最终分化成熟的神经元数量明显低于正常发育的脑组织中的成熟神经元数量,导致大脑皮层发育缓慢且伴随功能异常[35]。METTL3介导的m6A修饰在哺乳动物小脑的发育和功能中也发挥着不可替代的作用,将小鼠大脑中的METTL3基因条件性敲除后,m6A修饰水平失调,导致小脑中促凋亡相关基因Dapk1、Fadd、Ngfr的mRNA半衰期延长,剪接过程出现异常,蛋白表达障碍,最终引起小脑发育不全[10]。综上所述,m6A修饰经多种调控机制影响着脑组织的生长发育和生物功能。m6A甲基化转移酶、去甲基化转移酶以及RNA结合蛋白的表达异常,都将导致大脑神经细胞发育迟缓,神经元再生障碍,最终导致脑组织发育异常。
3.2 m6A修饰可增强记忆能力
学习和记忆是大脑的重要功能之一,记忆力的形成需要由基因表达和蛋白质合成共同协作完成。已有研究发现,m6A修饰水平的改变与记忆的形成相关。例如,研究者利用Cre/LoxP系统在小鼠大脑的皮层和海马区中特异性敲除甲基化转移酶METTL3,发现METTL3可通过调控m6A修饰影响IEG蛋白的翻译过程,导致IEG蛋白分泌不足,记忆巩固能力降低。给予一定训练后记忆能力可恢复,而过表达METTL3发现长期记忆能力显著增强,证明m6A修饰直接影响长期记忆力形成,并且个体的记忆差异经反复学习可得到补偿。综上所述,m6A修饰通过影响蛋白质的合成直接参与调控长期记忆力的形成[36]。记忆力的形成还受到m6A结合蛋白YTHDF1的影响[14]。在成年小鼠海马中,m6A修饰与结合蛋白YTHDF1结合,促进成年小鼠海马神经元刺激下的靶mRNA的翻译,增强海马依赖的学习与记忆能力。敲除YTHDF1基因可导致突触传递受损,小鼠学习记忆功能产生缺陷,使YTHDF1再表达后,则可以修复突触功能的缺陷。
FTO具有抑制记忆力形成的作用,在大脑中高度富集。在小鼠海马神经元中的细胞核、树突等位置均可检测到FTO的表达。Spy是一种与突触定位相关的基因,FTO能够抑制Spy的表达。在外界条件刺激下,降低海马背侧FTO的表达可提高Spy基因mRNA的转录,提高Spy的蛋白水平,显著增强小鼠的记忆力,表明FTO能够抑制记忆力形成,进一步证实了m6A修饰与记忆力形成的相关性,提示m6A可能是参与记忆力形成的新型调控因子[13]。
3.3 m6A调控神经干细胞的自我更新和分化
对小鼠和人类胚胎干细胞中m6A修饰进行定位,发现m6A修饰在进化过程中呈现高度保守性和稳定性[37]。m6A在众多mRNA和长链非编码RNA确定的基序上富集,通过标记不稳定的转录本而发挥其功能。例如甲基化转移酶METTL3基因的敲除或失活将导致m6A修饰水平降低,分化时影响Nanog基因的表达,使ESC从自我更新向分化的过程中受损。研究发现,在小鼠胚胎的神经干细胞(neural stem cell, NSCs)中,利用Cre/loxp系统特异性敲除甲基化转移酶METTL14,并观察细胞表型,可发现NSCs增殖能力降低,细胞分化提前,证明m6A可能具有增强NSCs自我更新的能力[38]。组蛋白修饰是NSCs基因表达和活性变化的重要基础。该研究还发现METTL14缺失能够增强组蛋白CBP和p300的mRNA稳定性,导致H3K27ac表达水平升高,NSCs中特异性组蛋白修饰水平增加。综上所述,m6A修饰能通过改变组蛋白mRNA的稳定性来调控组蛋白修饰,促进NSCs增殖,使其正常分化,以保障NSCs细胞库的储备。这种新型的基因调控机制在细胞生命活动中发挥着重要作用,将有助于研究神经系统疾病的干细胞治疗和基因靶向治疗。
Zc3h13通过影响m6A修饰调控mESC的自我更新过程[12]。在小鼠胚胎干细胞(embryonic stem cell, ESCs)敲除Zc3h13基因后,mRNA中整体m6A水平显著下降,WTAP、Virilizer和Hakai从细胞核转移到细胞质中,mESC的自我更新受阻且提前进行分化。证明Zc3h13通过将 WTAP-Virilizer-Hakai复合物准确定位到核内,来促进m6A甲基化反应,继而调控mESC的自我更新。
FTO作为m6A去甲基化转移酶,能够动态调控神经干细胞的增殖和分化[39]。最新研究发现,FTO的缺失可导致STAT3通路中关键调控因子Pdgfrα的表达增加和SOCS5的表达减少,继而引起STAT3通路的过度激活,最终导致成体神经干细胞的增殖和神经元分化异常,影响神经发生过程。此外,FTO的缺失还能抑制MMP-9因子表达,控制神经营养因子BDNF的加工过程,从而引起下丘脑-垂体-肾上腺轴(thehypothalamic-pituitary-adrenal axis, HPA)通路异常激活,最终导致小鼠神经元分化异常,应激水平升高现象,影响机体的认知功能[40]。
3.4 m6A调控轴突再生
突触能够将数十亿个神经元连接到功能性神经元和神经胶质回路中,通过改变传递效率来影响神经元活动,是神经网络结构和脑功能的基本特征[41]。在哺乳动物神经系统受损时,m6A修饰参与调控蛋白合成和轴突再生。例如坐骨神经受损,小鼠背根神经节(dorsal root ganglion, DRG)中许多m6A修饰的再生相关基因的mRNA水平提高,促进蛋白质合成。若敲低DRGs中的METTL14或RNA结合蛋白YTHDF1,将抑制再生相关基因的蛋白翻译过程,并降低体内神经系统的轴突再生功能。此外,在成熟中枢神经系统中,METTL14介导的m6A修饰能够调控抑癌基因Pten的表达,影响视网膜神经元轴再生能力[11]。另有研究揭示了神经胶质细胞在信息传导和调控突触产生过程中的重要作用,发现了由突触前末梢、突触后末梢和神经胶质细胞构成的三突触[42]。在三突触中可检测到丰富的突触定位转录组,它具有促进突触局部蛋白合成的重要功能,突触局部蛋白在维持神经元的持续性活动中发挥了重要作用,研究认为局部翻译失调是神经发育与神经精神疾病的重要病理机制[43,44]。在突触定位转录组中存在着m6A修饰,m6A选择性修饰三突触所有细胞内的不同转录本,甲基化转移酶介导的m6A修饰能够改变mRNA的转化率,调节突触RNA的翻译过程。此外通过敲除RNA结合蛋白YTHD1和YTHDF3,抑制突触定位转录组成员Apc的mRNA翻译过程,将会引发神经元形态异常、突触传递减弱的现象[15]。综上所述,m6A可通过调控mRNA来控制翻译过程,继而影响突触功能,引起神经系统异常。3.5 m6A在中枢神经系统疾病发生发展中的作用
大脑中m6A修饰水平的改变会对大脑的发育及正常神经细胞的功能产生影响,在中枢系统相关疾病中,m6A修饰改变引起的神经系统重要功能异常是许多神经系统疾病发生的潜在原因。阿尔茨海默疾症(Alzheimer's disease, AD)作为最典型的神经退行性疾病之一,是最常见的痴呆类型。AD的经典病理学特征为老年斑和神经纤维缠结,患者表现出明显的认知功能障碍及记忆力损伤[45,46,47]。FTO作为m6A去甲基化转移酶在神经疾病中是一种新兴因子,早有研究发现FTO基因中的单核苷酸多态性(single nucleotide polymorphism, SNP)参与多种神经疾病的发生和发展,近年研究陆续证明了FTO参与大脑发育和神经发生等多个神经系统相关的生物学过程[48]。Tau蛋白过度磷酸化形成的神经纤维缠结是AD的典型病理特征之一。研究者构建了具有神经特异性敲除FTO的3 xTg-AD小鼠,并在3 xTg-AD小鼠脑组织中检测到FTO的mRNA水平及蛋白水平显著升高,将3 xTg-AD小鼠神经元中敲除FTO导致TSC1的总水平和磷酸化水平上调,降低了mTOR信号的激活。以上结果表明FTO能通过增加mTOR上游抑制剂TSC1的mRNA水平来激活mTOR信号通路,促进Tau蛋白磷酸化,进而推动AD疾病的发展[49]。最新研究提出了另一种相反观点,对比APP/PS1转基因小鼠和对照组C57BL/6小鼠RNA上m6A甲基化水平,发现APP/PS1转基因小鼠的皮质和海马中m6A甲基化更高,而且在AD小鼠中,m6A甲基化转移酶METTL3的表达升高,而m6A去甲基化转移酶FTO的表达降低,并分析突触、神经元发育和生长有关的途径,提出m6A可能对AD的疾病发展起推动作用[50]。虽然还不能确定m6A修饰对AD的影响,但是目前的研究结果有助于我们探寻AD病理机制和选择治疗靶点。
帕金森症(Parkinson's disease, PD)也是一种常见的神经退行性疾病,发病病因尚不明确,主要表现为静止性震颤、运动迟缓、肌强直和姿势平衡障碍,主要病理改变为中脑黑质多巴胺能神经元的变性死亡和路易小体形成,从而引起纹状体多巴胺含量减少、多巴胺与乙酰胆碱递质失衡。有研究发现,在神经毒素6-羟基多巴胺(6-OHDA)诱导的PC12细胞和PD大鼠脑纹状体中检测到m6A修饰水平降低,在多巴胺能神经元内过表达甲基化转移酶FTO或利用m6A抑制剂降低m6A修饰水平,能够诱导NMDAR1受体的表达,促进氧化应激和Ca2+内流,导致多巴胺能神经元凋亡,结果表明FTO介导的m6A修饰通过调控NMDAR1的表达影响多巴胺能神经元细胞发育,因此提示我们FTO在PD的疾病进程可能发挥重要作用[51]。
脆性X染色体综合征(fragile X syndrome, FXS)是由于脆性X智力低下蛋白(FMRP)功能异常引起的一种X连锁不完全外显性遗传的单基因病。FMRP是一种由FMR1基因编码的RNA结合蛋白,在大脑神经元中高度表达,可调节突触相关基因的转录翻译。研究发现,FMRP能够与其mRNA上的m6A位点结合,维持mRNA的稳定性。而且FMRP还以非RNA的方式与YTHDF2相互作用,表明FMRP可能与YTHDF2共同调节m6A修饰介导的mRNA稳定性[52]。FMRP和m6A修饰的关系为寻找FXS的治病机制和治疗靶点提供了新的思路。
抑郁症(major depressive disorder, MDD)是一种多因素精神类疾病,病因及发病机制尚不清楚,临床表现为情绪低落、缺乏兴趣、食欲不佳和睡眠质量差等。已有研究结果表明FTO基因与MDD的发病风险相关,且对汉族人群的m6A修饰基因与MDD的相关性进行数据分析,显示m6A修饰很有可能影响MDD的发病机制[53]。最新研究发现,在星形胶质细胞中过表达环状RNA STAG1 (circular RNA STAG1, circSTAG1)可抑制ALKBH5向细胞核中转运,降低FAAH基因mRNA的m6A修饰水平,导致FAAH降解,从而显著减轻星形细胞功能障碍和抑郁行为[54]。ALKBH5介导的m6A修饰与circSTAG1之间的联系很有可能成为治疗MDD的新靶点。
胶质母细胞瘤(glioblastoma multiforme, GBM)是一种星形细胞肿瘤中恶性程度最高的胶质瘤,具有很强侵袭性和致死性。mRNA水平的调节影响肿瘤的多个方面,包括生长、胶质瘤干细胞自我更新和肿瘤发生。近年来有部分研究表明,在胶质瘤干细胞(glioma stem cells, GSC)中敲除METTL3、METTL14降低了m6A修饰水平,能够增强GSC的增殖能力,促进肿瘤生长。叉头框蛋白质M1 (forkhead box protein M1, FOXM1)是一种在细胞周期调节、自我更新和肿瘤发生中起关键作用的转录因子。研究发现,ALKBH5缺失可以使FOXM1的mRNA发生过度甲基化,导致FOXM1的mRNA水平和蛋白水平显著降低,抑制了GSC的增殖能力和致瘤性,表明ALKBH5在胶质母细胞瘤中起积极调节的作用。因此猜测m6A修饰可能成为胶质母细胞瘤治疗的靶点,但也有研究证明m6A修饰在GSC中水平升高,在胶质母细胞瘤中起致癌作用,因此m6A修饰对GSC的影响还存在争议。
4 结语与展望
m6A作为RNA修饰中丰度最高的修饰,在调控基因表达、细胞命运和维护中枢神经系统功能中发挥重要的作用。m6A修饰水平由甲基化转移酶和去甲基化转移酶共同调节,在RNA结合蛋白的作用下影响着RNA的代谢过程。m6A修饰在脑组织中的丰度比其他组织中高,说明m6A修饰在大脑的正常功能以及神经发育的不同阶段均起着至关重要的作用,在维护神经系统正常的功能中也扮演重要角色。首先m6A修饰水平失衡及其关键酶表达水平的异常将导致大脑皮层和小脑发育缺陷。其次在胚胎神经发生、干细胞更新和分化的过程也需要m6A修饰的精确调控。m6A修饰还影响着机体记忆力的形成、长期记忆力的巩固以及学习能力,当METTL3、FTO等关键调控蛋白表达异常时,将引起记忆功能的改变。m6A修饰在神经损伤诱导的轴再生过程中也是不可或缺的重要一环,m6A修饰能够促进损伤后局部蛋白翻译,提高轴再生相关的蛋白质水平,影响突触功能。总的来说,m6A修饰对中枢神经系统的影响是毋庸置疑的,但是其中的调控作用机制还需要进一步探索。m6A修饰不仅与记忆功能、神经再生、神经元的突触功能直接相关,还能影响神经元凋亡、细胞增殖和分化,这些都是阿尔茨海默症、帕金森等神经疾病中至关重要的表现及功能变化。由此猜测,m6A在神经疾病进程中必将扮演着重要角色,很有可能成为研究神经疾病治疗机制的突破点。所以揭示m6A及其关键酶在神经疾病中的作用至关重要。
随着科学技术的高速发展,除了现有用于检测m6A的技术如ChIP-seq、PAR-CLIP、MeRIP-seq外,还逐渐涌现出一些研究单个m6A的技术[55]。目前已有研究成功构建了基于dCas13b的特定读码器,主要用来研究特定的内源性单链RNA的调控功能[56]。此外为了研究单个m6A修饰的作用,研究者开发出了m6A修饰编辑器[57]。该编辑器是利用CRISPR- Cas9分别与m6A甲基转移酶融合物、去甲基化转移酶(FTO或ALKBH5)结合,从而对RNA的特定位点进行m6A的安装和去除,在不改变主序列的前提下改变RNA二级结构。最新研究中,研究者还构建出了更为高效精准的编辑器:TRM编辑器,该编辑器以CRISPR-Cas13为基础,利用融合蛋白和向导RNA,构建出dCas13-M3nls和dCas13-M3M14nes两种TRM编辑器,在大肠杆菌中实现高效率、低脱靶的RNA编辑[58]。并且在HEK293T细胞中利用TRM编辑器发现在Actb 基因mRNA的A1216位点发生m6A修饰,能够降低mRNA的水平,有助于研究m6A修饰水平对mRNA丰度的调控作用以及 mRNA转录本中特定位点的m6A修饰对RNA剪接的调控过程。m6A的修饰可以在组学测序及m6A芯片的帮助之下进行表达谱层面的分析,预测及验证m6A修饰改变在疾病或生物功能中的作用。此外随着技术的进步,各种精准编辑RNA特定位点的m6A编辑修饰工具将陆续被研发出来,最终实现单一RNA特定位点m6A修饰改变,并研究其对基因功能及生物功能的影响。m6A修饰的功能研究将更加的精准,其在大脑中的功能也将陆续被揭示出来。
关于m6A修饰的功能研究还有一些问题有待解决,例如在特定mRNA亚型上的不同位点发生的m6A修饰,它的调控功能是否有差异;RNA结合蛋白与不同位点的m6A结合是否会影响RNA命运;甲基化转移酶、去甲基化转移酶和阅读蛋白之间是否存在某种作用方式;它们相互之间是否存在协调或拮抗的作用,在机体正常生理情况下和异常情况下,作用方式是否发生改变。这些问题等待着人们去进行解析。也许这些工作的揭示会帮助研究者对复杂的大脑功能与疾病的机制进行进一步的探索。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
