 ,1,2,3
,1,2,3In vitro genotoxicity study of silver nanoparticles and titanium dioxide nanoparticles
Haimei Zhu1, Pengcheng Huang2, Tiantian Zhao3, Changhui Zhou2,3, Ruowan Li3, Chunrong Yu2,3, Zhiyong Chen2, Linfeng Gu2, Yan Chang ,1,2,3
,1,2,3通讯作者: 常艳,博士,研究员,研究方向:遗传及生殖毒理学方向。E-mail:ychang@ncdser.com
编委: 周钢桥
收稿日期:2020-07-18修回日期:2020-10-8网络出版日期:2020-12-20
| 基金资助: |
Received:2020-07-18Revised:2020-10-8Online:2020-12-20
| Fund supported: |
作者简介 About authors
朱海美,在读硕士研究生,专业方向:毒理学方向,E-mail:
黄鹏程,硕士,专业方向:毒理学方向,E-mail:
朱海美和黄鹏程为并列第一作者。。

摘要
纳米物质以其独特的物理性质广泛用于化妆品、医药和食品工业,但它们的安全性和遗传毒性仍然存在争议。本研究拟采用基于人成淋巴TK6细胞的体外彗星实验整合体外PIG-A基因突变实验对纳米银颗粒(AgNPs)和纳米二氧化钛颗粒(TiO2NPs)的致DNA断裂作用和致突变性进行初步研究。本研究探究了最高至200 μmol/L浓度时,TK6细胞暴露于两种纳米物质4 h时的彗星实验和经过暴露24 h以及10 d基因突变表达期后的PIG-A基因突变结果。同时,本研究还检测了TK6细胞暴露于纳米颗粒4 h及24 h对纳米物质的摄取能力。在纳米物质摄取实验中,随着纳米物质浓度的升高,TK6细胞在流式细胞仪检测图中的侧向散射角(side scatter, SSC)呈现浓度与时间依赖性升高,表明TK6细胞可摄取两种纳米颗粒。在4 h彗星实验中,AgNPs可导致彗星尾DNA荧光%强度呈现浓度依赖性显著升高,为阳性结果。而TiO2NPs则不能诱导彗星尾DNA荧光%强度呈现浓度依赖性显著升高,但最高浓度组尾DNA荧光%超过本实验室阴性历史对照数据,为可疑结果。而在体外PIG-A基因突变实验结果中,AgNPs和TiO2NPs均不能诱导TK6细胞的PIG-A基因突变率出现阳性升高。AgNPs可导致TK6细胞出现DNA损伤,但不能诱导PIG-A基因突变率升高。TiO2NPs既不能诱导TK6细胞出现DNA损伤,也不能诱导PIG-A基因突变率升高,TiO2NPs的遗传毒性有待进一步验证。
关键词:
Abstract
Nanoparticles are widely used in cosmetic, pharmaceutical, and food industries, but their safety and genetic toxicity are still unclear. In this study, the genotoxicity of silver nanoparticles (AgNPs) and titanium dioxide nanoparticles (titanium dioxide nanoparticles) were evaluated by in vitro comet assay and PIG-A assay in TK6 cells. We exposed TK6 cells to two types of nanoparticles at the highest concentration of 200 μmol/L for 4 h and conducted the in vitro comet assay. We examined the mutation results of PIG-A gene in vitro after 4 h, 24 ho and 10 days of exposure, respectively. We also examined the endocytosis of nanoparticles in TK6 cells exposed to nanoparticles for 24 h. In the endocytosis assay, with the increase of nano-material concentration, the side scatter (SSC) of TK6 cells in flow cytometry showed a concentration-dependent and time-dependent increase, indicating that TK6 cells could uptake both types of nanoparticles. In the comet assay, AgNPs could induce a concentration-dependent increase in DNA tail intensity. However, titanium dioxide NPs could not induce the concentration-dependent increase of DNA fluorescence intensity of comet tail. In the PIG-A assay, both AgNPs and TiO2NPs did not induce PIG-A gene mutation frequency in TK6 cells. The results showed that AgNPs could induce DNA damage in TK6 cells, but could not induce increase of PIG-A gene mutation frequency. TiO2NPs neither induce DNA damage in TK6 cells nor increase PIG-A mutation frequency. Further tests are needed to determine whether TiO2NPs are genotoxic.
Keywords:
PDF (753KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
朱海美, 黄鹏程, 赵田田, 周长慧, 李若婉, 于春荣, 陈志勇, 顾林峰, 常艳. 纳米银颗粒及纳米二氧化钛颗粒的体外遗传毒性研究. 遗传[J], 2020, 42(12): 1192-1200 doi:10.16288/j.yczz.20-161
Haimei Zhu.
纳米物质独特的粒子直径可使得纳米物质的物理性质,包括表面效应、光效应、体积效应等发生改变。纳米物质现已广泛应用于食品、化妆品、医药和材料等科学领域。纳米粒子(nanoparticle, NP)的国际标准定义为尺寸在纳米级别(粒径范围1~100 nm),长轴和短轴无显著差异的微小粒子。近几十年来,纳米银粒子(AgNPs)因其与实体纳米粒子不同的特性而被认为是一种极具前景的材料。其主要特点是高表面积体积比,这使得这种纳米结构在生物、电子、医药、环境修复、生物传感器、农业和食品工业等领域得到了广泛的应用[1]。AgNPs在电气、医疗保健、食品和纺织产品方面的全球消费量以及AgNPs供应商数量激增[2]。纳米二氧化钛颗粒(TiO2NPs)也被广泛应用于工业、表面涂层材料、食品、饲料、杀菌剂和兽药等。研究报道TiO2NPs可在肾、肝、肺、脾、脑和生殖器官中积累[3]。由于纳米物质的广泛应用,使其遗传毒性研究越来越受重视。目前对纳米物质的遗传毒性研究常采用化合物遗传毒性标准组合实验,如Ames实验、体内/外微核、染色体畸变实验等[4]。但在Ames实验中因纳米物质不易穿透细菌细胞壁,Ames实验可能不适用于纳米物质遗传毒性的检测;体外双核微核试验中添加的细胞松弛素B,可能影响细胞对纳米物质的胞吞作用。因此,需开发或改进体外遗传毒性评价系统[5]。
Singh等[6]最早创建了最原始的碱性彗星试验,称为单细胞凝胶电泳试验。1990年Olive等[7]以彗星形状来形容DNA在凝胶中的形状因此将此试验方法命名为彗星试验,他们也介绍了评价DNA迁移的指标DNA的尾密度。尾DNA密度指标的应用进一步发展了彗星细胞的检测方法,即用软件检测彗星细胞的荧光强度,其荧光强度现已成为彗星试验中评价DNA损伤的主要指标[8]。目前彗星实验已经成为应用最广泛的评价DNA在细胞及组织内损伤和修复的方法。
过去10年中,用于评估内源性磷脂酰肌醇聚糖A类基因(PIG-A基因)突变方法的开发、验证和应用已取得较为快速的发展。研究人员已经探索了少数几种哺乳动物细胞株用于体外PIG-A基因突变试验的可能性。Kruger等[9]率先使用了人成淋巴母细胞系TK6细胞,建立了通过流式细胞术检测TK6细胞中GPI(-)频率(PIG-A基因突变率)的方法。Rees等[10]对比了TK6细胞和MCL-5细胞应用于PIG-A基因突变试验的利弊,同时对流式细胞术的检测方法进行优化。
本研究主要通过本实验室前期建立的体外彗星试验和体外PIG-A基因突变试验方法对两种常用纳米物质的遗传毒性进行评价,以初步预测纳米银颗粒(AgNPs)和纳米二氧化钛颗粒(TiO2NPs)的体外遗传毒性。
1 材料与方法
1.1 材料及主要仪器
人成淋巴TK6细胞购自美国模式培养物集存库(American type culture collection, ATCC);AgNPs和TiO2NPs均购自南京先丰纳米物质科技有限公司;RPMI-1640培养基、热灭活马血清、磷酸缓冲液溶液(PBS)和L-谷氨酰胺购自美国Gibco公司;牛白蛋白(BSA)购自国药集团化学试剂有限公司;APC鼠抗人CD19抗体、PE鼠抗人CD55抗体、PE鼠抗人CD59抗体和核酸染料7-氨基放线菌素D (7-Aminoactinomycin D, 7-AAD)均购自美国BD Bioscience公司;氢氧化钠、二甲亚砜、浓盐酸购自国药集团化学试剂有限公司;SYBR Gold 染液购自Invitrogen (货号:S11494);流式细胞仪为BD公司Accuri™ C6 PLUS;细胞计数仪购自丹麦Chemometec公司(型号NucleoCounter®NC-100),彗星试剂盒及电泳仪购自美国Trevigen 公司;Comet Assay IV彗星分析软件为Perceptive Instruments (英国)。1.2 细胞培养
复苏本实验室建立的已清除PIG-A突变阳性的TK6细胞,培养于含10%马血清和4 mmol/L L-谷氨酰胺的RPMI-1640完全培养基中,在37℃、CO2体积分数为5%的加湿条件下悬浮培养。每周传代2~3次,保证细胞密度在1~10×105/mL之间。准备足够量的对数生长期细胞供试验使用。1.3 受试物配制
纳米物质AgNPs和TiO2NPs均为不溶性纳米物质,其在H2O或DMSO等溶剂中均不可溶解。因此,本研究中在进行纳米物质受试物配制时,均使用灭菌注射用水(本研究阴性对照)配制,超声波振荡15 min以上制成纳米物质混悬液。在进行加样时,使用移液器反复吹打,尽可能保证混悬液的均匀分散状态,且加样体积为10% (v/v)。纳米物质的表征及受试浓度见表1,纳米银与纳米二氧化钛的透射电镜图见图1。Table 1
表1
表1纳米颗粒表征及受试浓度
Table 1
| 纳米物质 | 纯度 | 粒径范围(nm) | 比表面积(m2/g) | 振实密度(g/cm3) | 外观描述 | 受试浓度(μmol/L) |
|---|---|---|---|---|---|---|
| AgNPs | >99.9% | 60~80 | ≥3 | ≥2.5 | 黑色粉末 | 20、60、200 |
| TiO2NPs | 99% | 15~25 | 77.37 | - | 白色蓬松粉末 | 20、60、200 |
新窗口打开|下载CSV
1.4 供试品加样及彗星、纳米物质摄取和体外PIG-A基因突变实验方法
传代至对数生长期的TK6细胞,调整细胞密度至3×105/mL。将细胞转移到T25细胞培养瓶中并加入不同浓度的受试物AgNPs或TiO2NPs溶液或阴性对照/阳性对照(彗星实验以50 μmol/L的过氧化氢(H2O2)处理TK6细胞10 min为阳性对照;体外PIG-A基因突变实验以 200 μmol/L的甲磺酸乙酯(EMS)为阳性对照),每个浓度重复3瓶。轻轻振荡混匀后放入培养箱培养。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1两种纳米物质材料的透射电镜图
Fig. 1Transmission electron microscope image of two nanomaterials
A:AgNPs;B:TiO2NPs。
4 h后融化低熔点琼脂糖,37℃保存待用。每瓶吸取30 μL细胞悬液(将剩余细胞放入培养箱中继续培养)与300 μL低熔点琼脂糖混匀后取30 μL涂布于彗星玻片孔中。2~8℃、避光冷却10 min后浸入裂解液中裂解过夜(16 h)。第2 d,将玻片使用2~8℃预冷的去离子水清洗后浸入解旋液中解旋20 min,然后进行碱性(pH>13)彗星电泳,电泳条件设置为电压0.7 v/cm,电流300 mA。电泳20 min。电泳后的玻片经中和、无水乙醇脱水、干燥和荧光染色后采用Comet assay IV彗星分析软件分析各浓度彗星尾DNA% (标准步骤参考彗星试剂盒附带说明书)。
用于体外PIG-A基因突变实验的细胞培养箱继续培养至24 h,每瓶取100 μL细胞悬液,使用PBS稀释10×后使用流式细胞仪分析细胞群的SSC值和浓度关系。SSC值反应细胞的内部复杂程度,细胞摄取纳米颗粒后的其内部复杂程度增加,SSC值的增加可反映细胞对纳米颗粒的摄取量。
剩余细胞用于体外PIG-A基因突变实验。首先采用流式细胞仪计数细胞密度,计数相对细胞增值数(RICC)。再每瓶取200万细胞经离心、洗涤后调整细胞密度至0.8×105/mL,进入基因PIG-A基因突变表达期传代。细胞分别在第4、6、8、10 d分别使用细胞计数仪进行计数,计算每个处理组在表达期内的RICC变化并且每次传代调整细胞密度至0.8×105/mL(不足0.8×105/mL时,按照原密度接种),第10 d调整细胞密度为1×105/mL传代。
RICC计算公式如下:
$RICC(\%)=\frac{处理组细胞密度-接种细胞密度*}{对照组细胞密度-接种细胞密度}×100\%$
*:接种细胞密度为每次调整接种时的细胞密度。
1.5 结果判定标准
各浓度组彗尾DNA%含量的中位数和PIG-A基因突变率均以x?±s表示。彗尾DNA %含量的中位数均数相对于阴性对照组呈现显著增加(具有统计学差异,P<0.05或P<0.01)则判定为彗星实验阳性;体外PIG-A基因突变实验中至少一个浓度的PIG-A基因突变率与阴性对照相比有2倍以上增加且呈现浓度-效应关系,判定为PIG-A基因突变阳性。1.6 彗星结果统计方法
计算每孔75个彗星细胞的彗尾DNA%含量的中位数,以各组织两孔或多孔彗尾DNA%中位数的均值作为该组织彗尾DNA%含量的个体数据;计算各组肝脏彗尾DNA%个体数据的均数和标准差。将受试物各剂量组的彗尾DNA%含量分别与阴性对照组的彗尾DNA%含量进行统计分析比较,采用如下方法进行统计:(1)用Levene's检验检测数据的方差齐性,当方差齐(P>0.05),则进行单因素方差分析(ANOVA);当方差不齐(P≤0.05),则Dunnett t检验进行组间比较(0.05和0.01水平)。(2)当方差分析结果有统计学差异(P≤0.05),则进一步用Dunnett T3检验进行组间比较(0.05和0.01水平);当方差分
析结果无统计学差异(P>0.05),则统计结束。分析统计软件采用SPSS 21.0。
2 结果与分析
2.1 4 h彗星实验结果
彗星实验中各浓度计数150个细胞(每个浓度2个复孔,每孔计数75个细胞),实验数据由SPSS软件统计分析其各浓度的尾DNA%中位数的均值。阳性对照组尾DNA%含量中位数的均值相对于阴性对照组显著增加(P<0.01),表明实验系统成立。AgNPs各浓度组尾DNA%含量中位数的均数相对于阴性对照组均有统计学显著增加(P<0.05或P<0.01),且呈现浓度依赖性增加,AgNPs的4 h体外彗星实验结果判定为阳性(图2A)。TiO2NPs各浓度组尾DNA%含量中位数均数相对于阴性对照组均无显著性差异(P>0.05)。TiO2NPs的4 h体外彗星实验结果判定为阴性(图2B)。
图2
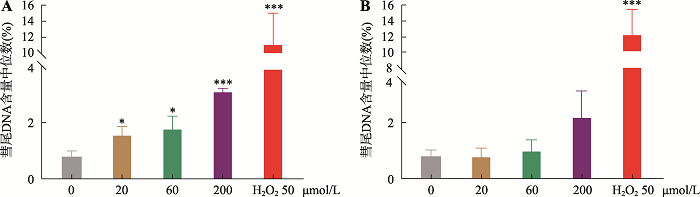 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2AgNPs和TiO2NPs 4 h彗星实验结果
A:AgNPs彗星实验结果;B:TiO2NPs 彗星实验结果。*:P<0.05;***:P<0.01 (与阴性对照组相比)。H2O2为阳性对照。
Fig. 2Results of AgNPs and TiO2NPs 4 h Comet test
2.2 4 h及24 h纳米物质摄取实验
本实验中AgNPs处理后TK6细胞的SSC值呈现浓度相关性升高;相比于阴性对照组,SSC值分别升高1.02、1.05和1.29倍(4 h)及1.14、1.25和1.67倍(24 h) (图3, A和C)。TK6细胞暴露于TiO2NPs后,在4 h及24 h检测20、60和200 μmol/L的TiO2NPs处理后细胞的流式细胞术SSC值同样呈现浓度相关性升高;相对于阴性对照组,SSC值分别升高1.12、1.15、和1.23倍(4 h)及1.12、1.23和1.34倍(24 h) (图3, B和D)。上述结果表明,TK6细胞能够摄取两种纳米物质AgNPs和TiO2NPs,且呈现浓度和时间相关性升高。图3
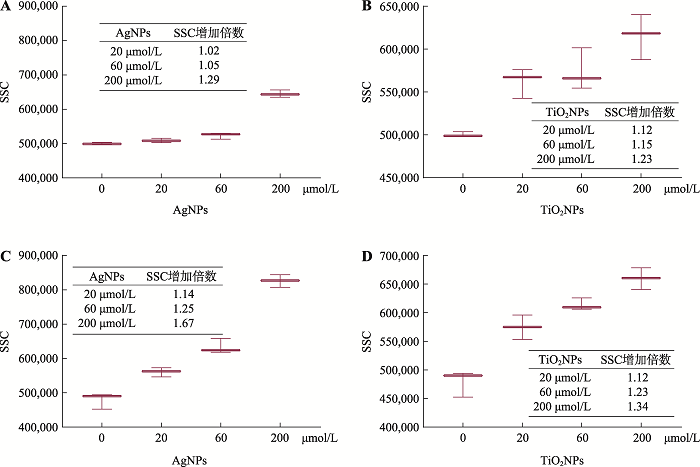 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3AgNPs和TiO2NPs细胞摄取实验结果
A:4 h AgNPs SSC浓度-反应关系;B:4 h TiO2NPs SSC浓度-反应关系;C: 24 h AgNPs SSC浓度-反应关系;D:24 h TiO2NPs SSC浓度-反应关系。
Fig. 3Results of AgNPs and TiO2NPs cell uptake tests
2.3 体外PIG-A基因突变实验RICC结果
在体外PIG-A基因突变实验中,受试物组RICC呈现先升后降趋势,最后逐渐恢复正常水平(图4)。AgNPs和TiO2NPs高浓度在24 h (第2 d)均具有较高的细胞毒性,但是在受试物去除后其RICC能快速恢复,其RICC在第2 d达到最低,随后逐渐回升至与阴性对照组同等水平。图4
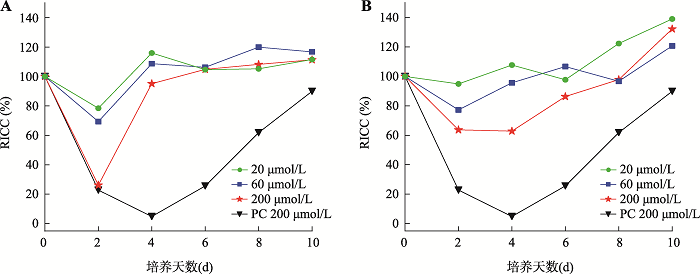 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4受试物在+/-S9条件下,第2 d至第10 d各浓度组RICC变化曲线
A:4种浓度下AgNPs RICC变化曲线;B:4种浓度下TiO2NPs RICC变化曲线。PC (阳性对照):200 μmol/L的EMS。+S9:添加肝微粒体代谢酶的体外活化系统;-S9:无肝微粒体代谢酶体外代谢活化系统。
Fig. 4Under the +/-S9 condition, the RICC change curve of each concentration group of Day 2-Day 10
2.4 体外PIG-A基因突变实验结果
本实验中,根据流式细胞仪SSC结果表明TK6细胞在24 h时可摄取AgNPs或TiO2NPs,且随着暴露浓度的提高,两者的RICC均呈现剂量依赖性降低,表明纳米颗粒暴露充分,且可被细胞摄取。PIG-A基因表达期末(第10 d),在最高至200 μmol/L时,AgNPs和TiO2NPs仍不能诱导TK6细胞的PIG-A基因突变率呈现浓度相关性升高,体外PIG-A基因突变实验结果均为阴性。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5受试物在-S9条件下体外PIG-A基因突变检测结果
A: 不同浓度下AgNPs 24 h-S9突变率;B:不同浓度下TiO2NPs 24 h-S9突变率。PC (阳性对照):200 μmol/L的EMS;*:PIG-A基因突变率超过阴性对照组至少2倍为阳性。
Fig. 5Results of the test substance in vitro PIG-A gene mutation detection under -S9 conditions
3 讨论
本研究选择两种纳米物质TiO2NPs和AgNPs作为受试物,使用体外彗星实验联合体外PIG-A基因突变实验方法检测其致DNA断裂性和诱变性,初步探讨两种纳米物质的遗传毒性。流式细胞术中细胞的侧向散射角(SSC)反映了细胞内部的复杂程度[12]。体外培养的细胞系为单一种类细胞群体,其SSC荧光强度不随培养时间等变化。细胞接触纳米物质后,细胞通过胞吞的方式将纳米物质摄取进入细胞内部,并以囊泡的形式存在于细胞质中。当细胞通过胞吞左右吞噬摄取纳米颗粒后,细胞质中大量的纳米颗粒可增加细胞内部复杂程度,进而导致流式细胞仪检测时SSC值的增大。因此通过细胞暴露于纳米物质后检测细胞的SSC值可反应细胞对纳米物质的摄取量,以反映纳米物质对细胞的暴露水平[13]。研究结果提示TK6细胞在暴露24 h时其SSC值相对于阴性对照组显著升高,表明本实验中TK6细胞暴露充分,可被TK6细胞摄取,且有浓度-效应关系。
AgNPs具有高效的抗菌活性,且不易产生抗药性,因此AgNPs常被用于材料、电器、生物医药等领域[13]。根据多项体外遗传毒性实验结果,AgNPs可在体外培养细胞中诱导微核率升高或者彗星尾DNA含量增高,但不同实验室的实验结果并非完全一致[12]。目前研究者们对于AgNPs的毒性是由纳米颗粒引起的还是银离子引起,或两者共同引起还存在争议[14]。有体外研究报道称AgNPs在分散液中可以释放出Ag+,且是纳米银产生细胞毒性的重要原因[15]。也有报道称AgNPs所释放的银离子含量微乎其微,用电感耦合等离子体-质谱仪(inductively coupled plasma-mass spectrometry, ICP-MS)并未检测到Ag+的释放[16]。一些体内实验研究结果也提示,纳米银的毒性不仅仅只取决于释放出的Ag+。如Kawata等[17]发现AgNPs处理的肝脏肿瘤细胞中出现微核,这些微核不能完全被银离子配体半胱氨酸所清除。究其原因与纳米银颗粒大小、形状、团聚状态及表面功能化等有关,有研究报道称20~80 nm的AgNPs的毒性主要来源于Ag+的释放,而10 nm的AgNPs由于尺寸较小更易穿透细菌的细胞膜,毒性主要归于自身的尺寸效应[18]。Liu等[19]也发现5 nm纳米银比20 nm和50 nm纳米银更加容易进入人肝癌细胞,诱导更强的细胞增殖、细胞膜损伤、活性氧产生、细胞周期抑制和细胞凋亡。因此对于本实验中对AgNPs中银离子的含量测定及同浓度下的Ag+引起的遗传毒性需进行进一步探究。
本研究中AgNPs的4 h彗星实验结果为阳性,而体外PIG-A基因突变实验结果为阴性。文献报道AgNPs的遗传毒性可能由Ag纳米颗粒诱导细胞内活性氧(reactive oxygen species, ROS)升高,进而导致DNA损伤,但是该损伤多发生在纳米颗粒暴露于细胞后短时间内,且该损伤能够被细胞修复[20]。因此,推测本研究中AgNPs体外PIG-A基因突变实验结果为阴性的原因是由于纳米物质导致的DNA损伤被修复(彗星阳性),无法诱导TK6细胞产生可稳定遗传的PIG-A基因突变(体外PIG-A基因突变阴性)。
TiO2NPs常用于白色无机染料或者化妆品中。TiO2NPs遗传毒性检测多采用体外微核实验或体外彗星实验,结果也存在阴性/阳性两种结果[21,22]。本研究中TiO2NPs的彗星实验结果为阴性,而体外PIG-A基因突变实验结果为阴性。文献报道TiO2NPs可能的遗传毒性与AgNPs相似,均可诱导细胞内ROS升高,进而导致DNA损伤[23],该损伤为可修复的DNA损伤[24];也有文献报道其遗传毒性可能由光催化或表面毒性吸附导致[25]。TiO2NPs的遗传毒性作用机制仍有待阐明。
综上所述,本研究采用具有P53基因功能的TK6细胞,使用体外彗星实验和体外PIG-A基因突变实验方法检测两个常用纳米物质TiO2NPs和AgNPs的致DNA断裂性和诱变性,初步证实彗星实验适用于纳米物质的遗传毒性,而对于PIG-A基因突变实验是否适用于纳米物质的遗传毒性评价有待进一步研究。本研究采用的方法简便、快速,在纳米物质的遗传毒性体外检测方面有较大的开发前景。
致谢
感谢上海益诺思生物技术股份有限公司遗传毒理实验室的经费等支持!参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
