Research progress of proteins related to sperm tail development
Yanan Zhong, Changmin Niu, Mengmeng Xia, Ying ZhengDepartment of Histology and Embryology, School of Medicine, Yangzhou University, Yangzhou 225001, China通讯作者: 郑英,教授,博士生导师,研究方向:生殖医学。E-mail:yzzkl@163.com
编委: 苗龙
收稿日期:2019-12-25修回日期:2020-04-2网络出版日期:2020-06-20
| 基金资助: |
Editorial board:
Received:2019-12-25Revised:2020-04-2Online:2020-06-20
| Fund supported: |
作者简介 About authors
钟亚楠,在读硕士研究生,专业方向:生殖医学。E-mail:415833840@qq.com。

摘要
精子尾部结构与其运动功能密切相关。精子的运动能力直接决定了精子能否正常运输到输卵管与卵子受精。精子尾部的形成和发育是一个极其复杂的过程,由多种蛋白质精细调控。研究发现,多种精子尾部发育相关蛋白的缺陷可导致少、弱、畸形精子症。本文根据精子尾部的超微结构顺序,对近年来精子尾部发育相关蛋白的研究进展进行综述,以期为男性不育症的遗传学诊断和治疗提供理论基础和实践的可能。
关键词:
Abstract
The structure of sperm tail is closely related to its motor function, which directly determines whether the sperm can be normally transported to fallopian tube and fertilize the ovum. The formation and development of sperm tail is a very complex process, which is finely regulated by various kinds of proteins. Research finds that defects of various sperm tail development related proteins can lead to oligospermia, asthenozoospermia and teratospermia. Based on the ultrastructure of sperm tail, we summarize the recent research progress of the proteins related to sperm tail development, thereby providing the theoretical basis and practical possibility for the diagnosis and treatment of male infertility.
Keywords:
PDF (585KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
钟亚楠, 牛长敏, 夏蒙蒙, 郑英. 精子尾部发育相关蛋白研究进展. 遗传[J], 2020, 42(6): 524-535 doi:10.16288/j.yczz.19-309
Yanan Zhong.
精子尾部结构与精子运动功能密切相关,具有正常尾部结构的精子才能游动。精子尾部分为颈段、中段、主段和末段4个部分(图1),其中颈段由前端的小头、中间的中心粒、后端的节柱组成。在精子头部细胞核末端形成了植入窝,基底板紧贴核膜,小头连着基底板,节柱向轴丝延伸。人精子颈段含有近端中心粒和远端中心粒2个中心粒,前者与小头相邻,后者嵌入在节柱中。中段的中轴为轴丝,外面依次包绕着外周致密纤维和线粒体鞘;主段外侧没有线粒体鞘,代之以纤维鞘;末段仅有轴丝,其外侧包裹着细胞膜(图1)。轴丝贯穿精子尾部全长,其由“9+2”微管结构组成,即中心为2条中央微管,外侧环绕着9条外周双联微管。外周双联微管由A、B两个亚单位构成,A亚单位上附有外动力蛋白臂(outer dynein arm, ODA)和内动力蛋白臂(inner dynein arm, IDA),并发出放射辐(radial spokes, RS)向中央微管呈放射状分布,将中央微管与外周微管连接起来。在精子尾部中段和主段的轴丝外侧有9根外周致密纤维(outer dense fiber, ODF),它是精子尾部的骨架,与精子尾部弹性回缩有关。精子的线粒体鞘(mitochondrial sheath, MS)是由线粒体呈螺旋状缠绕而成,为精子运动提供能量。精子尾部主段ODF外侧的纤维鞘(fibrous sheath, FS)是由背侧纵柱、腹侧纵柱和环形肋组成,FS是调整精子尾部摆动的平面,为调节鞭毛弯曲和确定鞭毛摆动的形状提供机械支撑,并作为参与信号转导的蛋白质和产生精子运动所需能量的糖酵解酶的支架[1]。在精子尾部中段和主段连接处有一种环状结构称为annulus,由丝状物构成,它与质膜紧密相连,也称为Jensen’s环。在轴丝开始从精子细胞延伸时,annulus就已经形成,它最初位于鞭毛基部,在精子的伸长和分化过程中沿着轴丝向中段和主段交界处迁移。Annulus的完整性是精子运动和精子尾部分化所必需的,annulus形成了一个蛋白质扩散屏障以建立合适的细胞区间,从而对中段-主段连接处进行调节,防止线粒体末端螺旋发生移位,确保中段正确组装[2]。Annulus的缺失主要造成精子尾部严重弯曲[3]。没有annulus的精子常出现线粒体缺陷,包括线粒体排列异常、大小不等、外观不规则和线粒体膜质减少等[4]。研究表明:精子尾部每一个部分的发育均受到相关基因的精确调控,如果发生基因缺失或突变会导致其相应的编码蛋白的改变,从而导致精子尾部结构异常或产生功能障碍。本文按照精子尾部的超微结构顺序,对近年来精子尾部发育相关蛋白(表1)的研究进展进行综述,以期为男性不育症的遗传学诊断和治疗提供理论基础和实践的可能。
图1
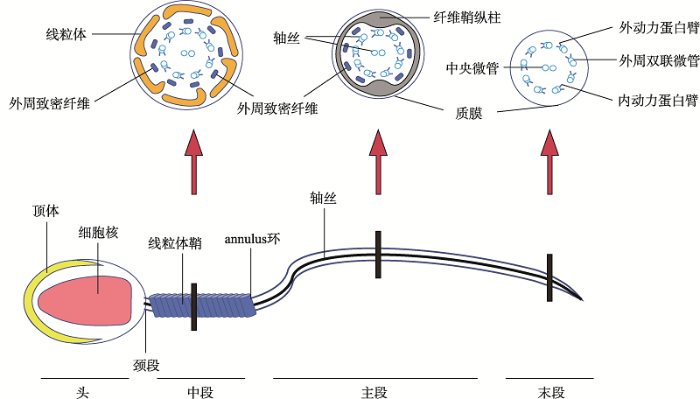 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1精子结构模式图
上方分别是精子尾部中段、主段和末段的横断面示意图。
Fig. 1Schematic of sperm structure
Table 1
表1
表1精子尾部发育相关蛋白
Table 1
| 精子尾部结构 | 发育相关蛋白 |
|---|---|
| 植入窝和基底板 | SUN5和OAZ3 |
| 小头和节柱 | SPATA6 |
| 中心体 | SPATC1L、CEP135、CFAP43和CFAP44 |
| Manchette | STK33、KIF3A、LRGUK1、SEPT12和MEIG1 |
| 轴丝 | CFAP69、SPEF2、ARMC2、TCTE1、RSPH6A、DNAH1、DNAH2、C11orf70和PIH1D3 |
| 外周致密纤维 | ODF1、ODF2、ODF3、Tssk4和MNS1 |
| 线粒体鞘 | KLC3、MFN2和CFAP251 |
| 纤维鞘 | FSIP2、AKAP4、AKAP3、ROPN1、ROPN1L、FS39、Als2cr12、Mtsga10、ENO4和CFAP157 |
新窗口打开|下载CSV
1 植入窝和基底板发育相关蛋白
哺乳动物中至少有5种SUN (Sad1 and UNC84 domain containing)蛋白,其中3种在小鼠中分别被命名为Sun1、Sun2和Sun3,另外2种SUN蛋白被命名为大鼠SPAG4 (sperm-associated antigen 4)和SPAG4L (sperm-associated antigen 4-like),又分别称为Sun4和Sun5。SUN5是SUN家族的新成员,位于精子颈段[5],负责将头尾连接体(head-tail couplingapparatus, HTCA)附着到精子的核膜上,这对精子头尾部的连接至关重要。Sun5基因敲除雄性小鼠精子头尾交界处的植入窝和基底板关键成分出现缺失,HTCA虽然可以在精子形成早期成功组装,但不能附着于核膜,随着精子细胞的伸长,HTCA连同基底板一起从植入窝分离[6]。Sun5基因敲除小鼠精子呈现出球形头部精子表型,但实际上是无头精子,所谓的“球形头部”内不含染色质,而是充满了未清除的细胞质和排列杂乱的线粒体,因此又将这种精子表型命名为假球形精子症。OAZs (ornithine decarboxylase antizymes)由TISP15编码,它属于一个保守的基因家族,在脊椎动物中至少有OAZ1、OAZ2及OAZ3三个成员,其中只有OAZ3在单倍体生殖细胞中特异性表达。OAZ3是一个影响植入窝和基底板的蛋白,它以反馈的方式控制着细胞内多胺的浓度,而多胺会影响精子头尾连接处的构建。Oaz3基因突变小鼠精子头尾容易发生分离,可观察到无植入窝和基底板的脱落头部和尾部,虽然脱落的头部和尾部具有活动能力,但大多无头的尾部会笔直地向前运动[7]。总之,在精子发生过程中,OAZ3通过调控多胺的局部浓度而在头尾连接的形成中发挥作用。
2 小头和节柱发育相关蛋白
颈段负责将精子的头部和尾部相连,不仅起着物理连接作用,还能启动和调节成熟精子的尾部波形和整体运动。小头和节柱是精子颈段的主要结构,在精子形成后期,对精子头部与鞭毛的连接至关重要。SPATA6 (spermatogenesis associated 6)是高度保守的精子发生基因之一,编码一种小头和节柱形成必需的蛋白,仅表达于精子颈段[8]。SPATA6对精子颈段的形成起着至关重要的作用。Spata6敲除会造成节柱形成畸形或缺失,颈段形成被完全破坏,导致小鼠出现无头精子。但无头的鞭毛仍具有运动性,其波形来自主段-末段连接处,而不是精子颈段,表明在主段-末段连接处存在第二波形源,其独立于颈段产生的第一波形源[8]。
3 中心体发育相关蛋白
Spatc1l (spermatogenesis and centriole associated 1 like)是一种新的生殖细胞特异性基因,位于小鼠10号染色体,大约包含一个8 kb区域,它以Spatc1 (spermatogenesis and centriole associated 1)基因命名。Spatc1基因编码精子中心体蛋白,与Spatc1l编码氨基酸具有50%左右同源性。Spatc1l编码蛋白含342个氨基酸,分子量大小为38 kDa[9],位于精子颈段。Spatc1l敲除小鼠精子头部、尾部在植入窝内的基底板与小头之间发生分离,继而产生无头和无尾的精子[10]。人类同源基因SPATC1L位于小鼠和人类之间保守的同源基因组区域(染色体21q22.3)。在精子形成过程中,SPATC1L可能通过与RIa亚基结合而增加PKA活性,而SPATC1L-PKA复合物能维持精子头尾连接的稳定性[10]。SPATC1L在植入窝中维持PKA活性可能对稳定该区域至关重要。CEP135 (the gene encoding the 135 kDa centrosomal protein)也编码一种中心体蛋白,对中心粒的发生,特别是中央微管的组装至关重要,而中心粒对中心体的形成、轴丝和微管的生长至关重要。CEP135基因突变导致常染色体原发性小头畸形[11],突变的CEP135蛋白在中心粒附近形成聚集体[12]。CEP135表达水平的改变可能导致微管结构紊乱,引起精子鞭毛多发性形态异常(multiple morphological abnormalities of the flagella, MMAF)。
此外,CFAP43 (cilia and flagella-associated protein43)和CFAP44 (cilia and flagella-associated protein44)也可能参与了中心体的形成。CFAP43和CFAP44均在睾丸中特异性表达或优先表达,CFAP43,又称WDR96,位于10号染色体上,含有38个外显子,编码蛋白含1665个氨基酸。CFAP43是一种纤毛或鞭毛相关蛋白,在精子发生中起重要作用[13]。CFAP44,又称WDR52,位于3号染色体上,含有35个外显子,其编码含1854个氨基酸。CFAP44全称纤毛和鞭毛相关蛋白44,含有1个WD40功能结构域,参与细胞骨架的组装,可能在中心体形成过程中发挥作用[13]。CFAP43和CFAP44缺失均呈现出MMAF表型,且精子活力降低。
4 Manchette发育相关蛋白
Manchette由α-微管蛋白和β-微管蛋白组成,是引导精子尾部延伸的短暂结构,其从中心体开始形成,朝着核的方向建立正端,朝着尾部方向建立负端[14],α-微管蛋白位于Manchette的负端。STK33和SEPT12能直接与Manchette作用,其中STK33通过与α-微管蛋白相互作用来影响Manchette发育,而SEPT12能同时与α-微管蛋白及β-微管蛋白相互作用。STK33 (serine/threonine kinase)是一种广泛表达的基因,位于人染色体11p15.3上,编码一种人鼠同源且高度保守的丝氨酸/苏氨酸激酶,在睾丸组织中表达量最高。Stk33表达于减数分裂I初级精母细胞及其后的生精细胞中。Stk33通过直接与α-微管蛋白相互作用来调节Manchette微管的组织结构和功能[15],Stk33缺失可导致Manchette形态异常,进而引起精子头部和尾部畸形,因而,Stk33对Manchette的形成必不可少。Kif3a、Lrguk1和Spef2基因敲除小鼠与Stk33基因敲除小鼠具有最为相似的表型。
精子尾部轴丝的发育由鞭毛内转运(intraflagellar transport, IFT)介导。IFT由驱动蛋白II和动力蛋白1B共同负责,驱动蛋白II负责顺向转运,动力蛋白1B负责逆向转运[16]。其中,驱动蛋白II是一种异源三聚体蛋白质复合物,包含KIF3A和KIF3B两个运动亚基及一个非运动亚基KAP3。KIF3A位于长形精子细胞Manchette和成熟精子基底体及尾部主段,它在轴丝延伸和转运、细胞极性和基底体定位中起着重要作用。KIF3A是精子发生的重要调节因子,对精子尾部形成和Manchette功能至关重要[17]。KIF3A缺失可导致Manchette缺陷,轴丝发育不全,进而影响精子头部成形和尾部形成。
LRGUK1 (leucine-rich repeats and guanylate kinase-domain containing isoform 1)由LRR (leucine- rich repeat)、GUK-like (guanylate kinase-like)和UN (unnamed) 3个结构域组成。LRGUK1通过LRR结构域与KLC3结合,并通过GUK-like结构域与HOOK2和RIMBP3结合[18]。实际上,LRGUK1与货物连接蛋白HOOK1、HOOK2、HOOK3及货物蛋白RIMBP3形成了一个多蛋白复合物,通过顺向转运蛋白KLC3的作用,沿着Manchette转运到HTCA,这对Manchette功能以及精子尾部从基底体延伸必不可少。LRGUK1作为多蛋白复合物关键组分,在单倍体雄性生殖细胞微管动力中发挥重要作用,LRGUK1的缺失破坏了这种复合物,造成精子头部形态异常、顶体脱离细胞核和基底体无轴丝延伸。
SEPTIN基因属于高度保守的具有GTP酶活性的蛋白家族。SEPTIN通过与各种细胞骨架蛋白相互作用来执行细胞骨架重塑、细胞极性、有丝分裂、囊泡运输和扩散屏障等功能[19]。SEPTIN家族的蛋白质已被证明定位于annulus上,是其组成成分。哺乳动物annulus是由SEPTIN 1、4、6、7和12组成的多蛋白复合体,精子尾部的形态分化和扩散屏障功能需要稳定的SEPTIN复合物[2]。SEPT12在减数分裂后雄性精子细胞中表达,在精子形成过程中,SEPT12与α-微管蛋白和β-微管蛋白相互作用,形成SEPT12-α-微管蛋白和SEPT12-β-微管蛋白复合物,这两种复合物对精子头部成形和尾部延伸起着重要作用[19]。SEPT12缺失会破坏α-微管蛋白和β-微管蛋白的组织和动力,影响α-微管蛋白和β-微管蛋白聚合,从而扰乱精子头部成形和尾部延伸。SEPT12突变后精子出现头部畸形、尾部弯曲及annulus环缺陷。
除了与α-微管蛋白、β-微管蛋白相互作用之外,还有一些基因与Manchette相关,如MEIG1 (meiosis expressed gene 1)是一种最初被认为在减数分裂中起作用的蛋白,但敲除Meig1基因,意外地发现雄性小鼠在减数分裂中没有明显异常,而出现精子核浓缩及尾部延伸缺陷而不育[20]。MEIG1是Manchette 结构和功能以及调控精子形成的关键基因,MEIG1蛋白分子量10 kDa,包含丝氨酸和苏氨酸磷酸化的多重一致序列。Meig1缺失小鼠精子细胞中Manchette被破坏,从而损害了Manchette内转运(intramanchette transport, IMT)系统,导致精子头部成形和鞭毛形成障碍[20]。此外,PACRG (the Parkin co- regulated gene)是一种影响轴丝外周双联微管形成的蛋白,MEIG1可以与PACRG直接相互作用,提示两者通过一个共同的机制调节精子形成,MEIG1可能稳定PACRG或作为PACRG作用的辅助因子。
5 轴丝发育相关蛋白
5.1 中央微管发育相关蛋白
CFAP69 (cilia and flagella-associated protein)编码蛋白在进化上高度保守,包含ARM-repeat和AH/BAR两个结构域。其在睾丸中含量较高,定位于人类精子鞭毛中段,在成年小鼠睾丸中,Cfap69开始表达于减数分裂期,并在随后阶段表达量显著增加。CFAP69对于鞭毛的装配和稳定是必需的,它的缺失会导致轴丝缺陷[21],并呈现出MMAF表型。CFAP69突变精子中轴丝的中心对复合体(central pair complex, CPC)蛋白SPAG6和SPEF2减少,表明CFAP69可能参与了CPC的装配,CFAP69可能通过参与IFT而参与精子尾部形成和CPC组装。此外,在精子形成过程中,CFAP69对于精子头部的形成也是至关重要的。SPEF2 (sperm flagellar 2)是另一种影响中央微管发育的蛋白,在精子细胞伸长阶段对精子形成至关重要[22]。SPEF2含有1822个氨基酸,其N-端有CH结构域,C-端有IFT20结合结构域。SPEF2能与IFT20相互作用,并定位于高尔基复合体和Manchette[23]。SPEF2突变精子主要的形态学缺陷是鞭毛主段的CPC完全缺失,形成“9+0”构象,表明SPEF2在正常轴丝形成中具有重要作用[22]。SPEF2在功能上与CFAP69相互作用,CFAP69突变精子中SPEF2蛋白水平显著降低或缺失,SPEF2突变精子中CFAP69也出现减少。SPEF2可能通过特定的机制与CFAP69一起参与精子鞭毛CPC的组装。
此外,ARMC2 (armadillo repeat containing 2- encoding gene)也影响中央微管的发育。ARMC2位于6号染色体上,包含18个外显子,编码蛋白含867个氨基酸[24],这是一种ARM (armadillo)蛋白,优先在睾丸中表达,属于含有ARM重复序列蛋白家族,由12个ARM重复序列组成,两侧分别是独特的C端和N端结构域。ARMC2对人和小鼠精子尾部发育至关重要,ARMC2双等位基因突变呈现出典型的MMAF表型。在AMRC2突变个体和小鼠中,CPC中SPAG6和SPEF2蛋白缺失[25],表明ARMC2参与了CPC的组装和稳定,其对精子鞭毛的结构和装配是必需的。
5.2 外周微管发育相关蛋白
动力蛋白被锚定在外周微管上,其产生的力使微管彼此滑动,而连接蛋白将微管固定在适当位置,通过防止微管滑动,将动力蛋白产生的力转化为鞭毛的弯曲运动。连接蛋白-动力蛋白调节复合物(nexin-dynein regulatory complex, N-DRC)是相邻的外周双联微管之间的细丝,由多达11种蛋白质组成,除连接相邻外周双联微管以防止微管滑动外,N-DRC还可以调节动力蛋白的运动活性[26]。TCTE1 (T-complex associated testis expressed 1)是一种进化上保守的基因,存在于含有鞭毛的所有真核生物中。TCTE1是衣藻N-DRC组分DRC5的同源物,是一种从衣藻DRC5到哺乳动物进化上保守的轴丝蛋白,定位于N-DRC。TCTE1编码蛋白含498个氨基酸,C端具有富含亮氨酸重复区(leucine rich repeat, LRR)结构域,LRR结构域可以介导蛋白质-蛋白质的相互作用。Tcte1缺失小鼠精子尾部向一侧收缩,精子形成圆形的运动路径[27]。此外,Tcte1敲除精子的ATP显著减少,前向运动减弱,精子内的能量代谢降低。
5.3 放射辐发育相关蛋白
RS为轴丝的组分,是一种与鞭毛运动调节有关的T形蛋白质复合物,具有一个细长的“茎”与外周双联微管相连,以及一个球状的“头”向中央微管延伸。在衣藻中发现了5种RS头蛋白:RSP1、RSP4、RSP6、RSP9和RSP10,其在小鼠和人类中是保守的,分别对应于RSPH1、RSPH4A、RSPH6A、RSPH9和RSPH10B。其中,RSPH6A (radial spoke head 6 homolog A)为一种进化上保守的基因,是衣藻RSP6的同源物。RSPH6A对小鼠精子鞭毛装配是必需的。RS受损,轴丝可变得不稳定并停止伸长,线粒体和纤维鞘形成随即终止。Rsph6a基因敲除小鼠精子短且不动,轴丝可以伸长,但在附属结构形成之前被破坏,并且出现Manchette移除障碍,导致核周环异常地收紧细胞核,造成精子棒状头部。此外,RSPH9在Rsph6a敲除精子鞭毛中缺失,表明RSPH6A与RSPH9相互作用对于将RSPH9整合到鞭毛中很重要[28]。Rsph1敲除小鼠表型与Rsph6a敲除小鼠相似,具有异常的轴丝结构,如RS和中央微管对缺失[29],并且具有畸形的头部和发育不良的鞭毛。
5.4 内外动力蛋白臂发育相关蛋白
DNAH1 (dynein axonemal heavy chain 1)是一个编码轴丝IDA重链的蛋白,其基因突变可显著降低蛋白表达,并导致MMAF表型,虽然DNAH1缺失不影响ODA,但IDA完全杂乱、中央微管对缺失、FS畸形[30]。与DNAH1相似,DNAH2也是一种睾丸特异性蛋白,是轴丝内动蛋白臂重链(dynein heavy chains, DHC)的主要组分,是动力蛋白-F的一个重要亚基。DNAH2突变精子中DNAH2水平显著降低,IDA缺失,MS也受到破坏,精子丧失活力[31]。DNAH2基因突变呈现出MMAF表型,表明DNAH2是与MMAF相关的一种新的候选蛋白。对DNAH1和DNAH2的研究揭示了DHC家族蛋白在维持鞭毛结构完整性方面的重要作用,并提示其他功能不明的DHC编码基因也可能参与了精子鞭毛缺陷表型。与仅影响轴丝IDA重链形成的DNAH1和DNAH2不同,C11orf70 (the chromosome 11 open- reading frame 70)缺陷不仅导致1型和2型ODAs缺失,还造成I2组IDAs的DNALI1缺失和I3组IDAs的DNAH6缺失,这表明C11orf70参与了精子鞭毛中细胞质内动力蛋白臂的组装[32],其突变引起了组装的中断,导致ODAs和IDAs缺失,造成了鞭毛不动。此外,C11orf70与细胞质ODA/IDA装配因子DNAAF2直接相互作用,表明C11orf70可能是一个细胞质预组装因子,参与了动力蛋白组分向轴丝转运。
与C11orf70相似,PIH1D3 (PIH1 domain containing3)也是一种动力蛋白臂细胞质预组装因子,并且PIH1D3缺失也会导致ODAs和IDAs同时缺失。PIH1D3含有PIH1结构域,它在生精细胞特异性表达并定位于细胞质,其mRNA在粗线期精母细胞中含量最高。作为一种具有独特功能的新型轴丝动力蛋白预组装因子(dynein axonemal assembly factor, DNAAF),PIH1D3可以促进轴丝ODAs和IDAs的HCs和ICs在小鼠精子细胞质中的稳定和组装。PIH1D3也是第一个发现的ICs细胞质预组装以及“9+2”微管结构所需的DNAAF。Pih1d3敲除小鼠精子不动并且十分脆弱,其轴丝“9+2”微管结构紊乱,ODAs和IDAs缺失[33]。由此可见,PIH1D3是通过稳定和促进ODA和IDA的形成促成了精子细胞中动力蛋白复合物在细胞质中的预组装。
6 外周致密纤维发育相关蛋白
ODF是发现的2种主要细胞骨架结构之一,每根ODF都与1个双联微管(doublets of microtubules, DMTs)对应。已知ODF1、ODF2和ODF3是现今发现的3种编码ODF的基因,并且3者之间存在着密切的联系。ODF1基因位于人染色体8q22上[34],主要编码27 kDa ODF蛋白,富含半胱氨酸和脯氨酸。ODF1既可通过N端亮氨酸拉链基序自我联合,也可通过该基序与ODF2亮氨酸拉链相互作用。单倍体精子细胞中ODF1在减数分裂后期转录,其翻译似乎紧随着转录进行。ODF2基因,又称为ODF84,位于人染色体9q34上[35],主要编码84 kDa ODF蛋白。人类和大鼠ODF2外显子在核苷酸水平上有90%相同,由该外显子编码的氨基酸序列则100%相同[35]。ODF2有两个亮氨酸拉链,在长形精子细胞ODF沿着轴丝装配过程中,ODF2通过上游C端亮氨酸拉链与ODF1 N端亮氨酸拉链发生强烈特异性相互作用,其第二个亮氨酸拉链可能与其他ODF或精子尾部结构蛋白相互作用。因此,ODF2可能是ODF形态发生的关键参与者。ODF3编码一种约110 kDa ODF卷曲螺旋蛋白[36],其中心区域几乎完全由卷曲螺旋组成,而在N端和C端,卷曲螺旋结构被非螺旋区域打断。ODF3具有3个亮氨酸拉链区域,ODF2和ODF3均可形成纤丝支架,最终形成精子尾部外周致密纤维。上述ODF1、ODF2和ODF3均是ODF的结构蛋白,Tssk4则是通过与Odf2相互作用影响ODF的形成。TSSK (testis specific serine/threonine protein kinase)家族在精子发生和精子形成中起重要作用,其由Tssk1、Tssk2、Tssk3、Tssk4/5及Tssk6 5个成员组成,除Tssk3主要在间质细胞表达外,其他成员的表达仅限于减数分裂后生殖细胞,且Tssk4与Tssk5是同一蛋白[37]。Tssk4属于TSSK家族,它是维持精子鞭毛结构完整性所必需的。Tssk4和Odf2位于精子鞭毛主段,通过磷酸化相互调节,这种相互调节可能保持一个正反馈回路,活性的Tssk4可以改变Odf2磷酸化状态以调节精子的运动和结构。反之,Odf2可以增强Tssk4自身磷酸化活性[38],而Tssk4又可以通过自身磷酸化活性维持自身的激酶活性[37]。此外,Odf2可以将Tssk4蛋白募集到ODFs上。Tssk4敲除的精子对剪切力更敏感,精子尾部超微结构发生紊乱,在中段-主段连接处出现弯曲,精子运动能力降低。
此外,MNS1 (meiosis-specific nuclear structural protein 1)缺失也会导致ODF形成障碍。MNS1是一种约60 kDa的卷曲螺旋蛋白,在晚期粗线期精母细胞、双线期精母细胞和精子细胞中大量表达[39],对精子形成至关重要。MNS1是精子鞭毛必不可少的组分,精子鞭毛的装配需要MNS1。MNS1单体彼此相互作用并且在异位表达时能够形成纤维聚合物,在鞭毛中MNS1组装成丝状结构。MNS1缺失的精子鞭毛中,特征性的“9+2”微管排列和ODF被完全破坏。此外,缺失MNS1,精子的产量显著降低,产生不动的精子,且有异常的短尾。
7 线粒体鞘发育相关蛋白
驱动蛋白是主要的正端导向微管马达,它负责将细胞器、蛋白质复合物以及mRNAs转运到细胞内特定区域[40]。驱动蛋白I马达分子由两条驱动蛋白重链(kinesin heavy chains, KHCs)和两条驱动蛋白轻链(kinesin light chain, KLCs)组成。其中,KLC3是目前唯一已知的驱动蛋白轻链,它在雄性生殖细胞减数分裂后表达并在精子尾部中段聚积。KLC3位于ODF和线粒体之间,并具有典型的KLC结构域特征,包括保守的7肽重复序列(heptad repeat, HR)和34肽重复序列(tetratricopeptide repeats, TPRs)[41],其HR区与ODF1的亮氨酸拉链结构域相互作用[42],而TPR区可能直接或通过衔接分子Caytaxin与线粒体外膜蛋白VDAC2结合[43],因此KLC3作为锚定蛋白将ODF和线粒体结合在一起。KLC3与线粒体结合正值线粒体从精子细胞边缘移动到正在发育的中段,并且KLC3能以微管依赖的方式引起线粒体聚集形成聚集体,这些表明KLC3在中段形成中起着重要作用,其可能通过协助精子中段MS的形成参与了精子发生。与KLC3不同,在线粒体中MFN2 (mitofusin 2)本身就是一种外膜蛋白。MFN2影响MS的形成,它不仅参与线粒体网络的融合、维持和运转,同时也参与调节线粒体与亚细胞细胞器之间的联系。MFN2和MNS1均是精子鞭毛的一个组分,它们在鞭毛的生物发生和功能中起作用。研究发现,在精子发生过程中,MFN2与MNS1通过相互作用形成了一种蛋白质复合物,并共定位于精子鞭毛[44]。在生精细胞中,MFN2位于线粒体内,与精子鞭毛中段的发育相关。
此外,CFAP251 (cilia and flagella-associated protein 251)也可影响MS的发育。CFAP251又称WDR66,它在睾丸中特异性表达,其编码蛋白含1149个氨基酸,有9个WD重复序列,N端有富含Glu的酸性结构域,C端有钙结合EF-hand结构域。CFAP251是钙调蛋白和RS相关复合体的组分,位于轴丝外周双联微管内表面,与DNAH1相邻。DNAH1与CFAP251可相互作用,两者相互作用受损可以破坏RS3与IDA3之间的连接[45]。尽管位于轴丝外周双联微管上,但CFAP251可以影响IFT,而IFT通常在线粒体募集之前会立即将annulus环移动并使其远离细胞核,IFT通过轴丝和辅助鞘间的一系列相互作用、通过对轴丝刚性的机械作用、或在装配过程中将特定蛋白导向轴丝的外表面来限定MS的末端。CFAP251缺失呈现出MMAF表型[45],其突变精子的线粒体被募集到中段,但不能沿轴丝扩展,造成MS发育不良,可见到线粒体密度非常低的短MS。CFAP251是MS沿着精子鞭毛中段延伸所必需的,它可能通过启用特定的IFT而参与MS-FS连接的定位。
8 纤维鞘发育相关蛋白
FSIP2 (fibrous sheath-interacting protein 2)在精子鞭毛形成过程中起着重要作用。FSIP2突变精子超微结构异常,精子中段较厚,有多余的残余体,并且DMTs和ODFs解体[46]。FSIP2突变精子的活力明显受损,并可以引起MMAF表型,FSIP2可能是MMAF相关的弱畸精子症的一个新的蛋白。FSIP2和激酶A锚定蛋白4 (A-kinase anchor protein 4, AKAP4)之间存在相互作用,而AKAP4和激酶A锚定蛋白3 (A-kinase anchor protein 3, AKAP3)是FS中最丰富的结构蛋白,因此FSIP2可能与AKAP3和AKAP4一起参与了FS的形成。PKA全酶由两个调控亚基(RIα和RIIα)和两个催化亚基(Cα和Cα2)组成。PKA的R亚基还包含1个RII二聚/对接(RII dimerization/docking, R2D2)结构域,此结构域可与激酶A锚定蛋白(A-kinase anchoring proteins, AKAPs)上的短肽区相互作用。ROPN1 (Ropporin 1)、ROPN1L (ROPN1-like)是包含R2D2结构域的R2D2蛋白质[47],两者在功能上存在相互补偿。AKAP可能具有双重信号传导功能,除与PKA相互作用外,还通过两性螺旋结构域与ROPN1和ROPN1L结合[48],以调节精子活力。R2D2蛋白ROPN1和ROPN1L通过依赖PKA的信号通路参与精子活力调控[47]。ROPN1和ROPN1L突变可导致FS完整性、精子活力和PKA依赖性信号传导通路的缺陷。ROPN1和ROPN1L对于正常的FS结构和功能是必需的。上述FSIP2、ROPN1和ROPN1L都是通过与FS中的结构蛋白相互作用而发挥作用,而FS39、Als2cr12和Mtsga10 3种蛋白则是FS的组成成分。
FS39 (fibrous sheath)是一种39 kDa的FS中间丝相关蛋白,仅表达于睾丸单倍体生殖细胞[49]。FS39 mRNA具有生殖细胞特异性,在精子形成第3~14步表达,在顶体期(第8~12步)达到高峰,FS39 mRNA受翻译调控,在成熟期(第13~14步)首次检测到该蛋白。FS39具有纤维鞘蛋白的特点:高不溶性、富含天冬氨酸和谷氨酸,并含有可能在FS组装和功能中起关键作用的特定磷酸化位点。FS39位于FS的纵柱中,其分布模式与AKAP82相同。AKAP82是将PKA锚定在FS上,在cAMP作用下,激酶的催化亚基被释放并自由磷酸化其底物。AKAP82被合成为细胞质中不活跃的前体,通过轴丝向下运输到装配位点,随后被切割为成熟蛋白,FS39在氨基酸11处含有1个特定的酰胺化位点,而酰胺化位点存在于前体蛋白的切割位点上,因此FS39可能经过AKAP82类似的处理转运到FS位点上。
Als2cr12 (amyotrophic lateral sclerosis 2 chromosome region candidate 12)是一种新的生精细胞特异性蛋白。Als2cr12产生短Als2cr12 (Als2cr12-S)和长Als2cr12 (Als2cr12-L)两种转录物[50],其中Als2cr12-S编码蛋白含245个氨基酸,分子量28 kDa,在睾丸体细胞表达或在体细胞和生殖细胞中均有表达;而Als2cr12-L编码蛋白含383个氨基酸、预计分子量为45 kDa,在雄性生殖细胞特异性表达,是精子鞭毛主段FS的组分,Als2cr12-L在FS发育中起着重要作用。
Mtsga10 (mus testis-specific gene antigen 10)位于小鼠1号染色体B带,在不同物种中高度保守,基因序列在小鼠与人之间同源性为89%,氨基酸序列同源性为94%[51]。Mtsga10含有一种特定的ERM结构域(又称为FERM结构域,其命名源于最初在该结构域发现的4种蛋白:条带4.1 (F)、Ezrin (E)、Radixin (R)和Moesin (M),即肌球蛋白、埃滋蛋白、根蛋白和膜突蛋白[52]),Mtsga10的肌球蛋白结构域是形成细丝所必需的,在FS形成中发挥作用。Mtsga10 mRNA最早在精子发生减数分裂后期检 测到,被翻译成65 kDa的精子细胞蛋白,随后在 成熟精子中被加工成27 kDa的FS结构蛋白,并保存于精子尾部主段[51]。人TSGA10 (testis-specific gene antigen 10)是小鼠Mtsga10的同源基因,位于人染色体2q11.2上。
除上述蛋白外,还发现通过其他机制影响FS形成的蛋白,如ENO4 (enolase 4)。众所周知,糖酵解是精子中ATP的主要来源,精子中的糖酵解酶主要位于精子鞭毛的主段。在糖酵解的倒数第3步,烯醇化酶催化2-磷酸甘油酸转化为磷酸烯醇式丙酮酸。随后在丙酮酸激酶的催化作用下,磷酸烯醇式丙酮酸转化为丙酮酸,并伴有ATP生成。而ENO4是小鼠精子中发现的一种新型精子特异性烯醇化酶,位于精子鞭毛的主段,也是小鼠精子中主要的烯醇化酶。ENO4在精子中提供了大部分的烯醇化酶活性,它是FS正常装配所必需的[53]。Eno4敲除小鼠精子活力、ATP水平和烯醇化酶活性显著降低,FS组分无序聚集,常出现1个或3个纵柱,且环形肋组织结构和厚度不规则[53],说明ENO4对FS的形成具有重要的影响。此外,位于中段-主段连接处的annulus环也出现缺失、退化或错位。
最后,CFAP157 (cilia and flagella-associated protein 157)是一种基底体蛋白,定位于基底体,可以与微管蛋白以及中心体蛋白CAP350相互作用[54]。CFAP157仅在男性生殖细胞中具有关键功能,它在精子运动和鞭毛形态发生中起作用。CFAP157作用于哺乳动物发育中的精子,以确保形成一个超微结构正常的轴丝以及一个具有功能性的中段[55]。Cfap157敲除精子的中段有多余的细胞质和聚集的线粒体,造成中段异常扩张和无序,并出现轴丝环[55]。Cfap157缺失精子的头部相对于鞭毛轴弯曲成较小的角度,因此,鞭毛摆动不能将精子打入卵细胞内,而是沿着卵细胞表面,远离卵。CFAP157确切的作用机制目前尚不清楚,但CFAP157对于FS的形成具有重要影响。
9 结语与展望
据统计,我国不孕不育人口已超过500万,约占育龄人口比例的12.5%,但其治愈率却不到30%。在不孕不育的育龄夫妇中,由男方因素引起的不育占了50%。男性不育是一种具有高度异质性表型的多因素复杂疾病,其中,遗传因素占了至少15%,包括染色体和单基因改变[56],其常见的临床表现之一是少、弱、畸形精子症(oligo-astheno-teratozoospermia, OAT)。目前,辅助生殖技术(assisted reproductive technologies, ART)是治疗男性不育最有效的手段之一,包括试管婴儿(in vitro fertilization, IVF)和卵胞浆内单精子注射(intracytoplasmic sperm injection, ICSI)等,但同时存在诸多的弊端,例如通过IVF和ICSI出生的婴儿遗传缺陷几率有显著增加[57]。生殖系基因治疗(germ line gene therapy)是一种十分具有前景的治疗方法,揭示生育相关基因、蛋白的功能与特性是生殖系基因治疗的前提。在导致男性不育的基因突变中,有很多是影响精子发育的基因,尤其是影响尾部发育的基因,其突变对精子的结构和功能产生了严重的影响。目前已鉴定出了很多影响精子尾部发育的蛋白,但这些蛋白缺失所引起的精子形态和功能异常仅能解释30%~60%的临床男性不育病例,还有很多遗传学病因及致病机制尚不清楚,需要更深入的研究。揭示男性不育的遗传病因十分重要,这不仅可以在分子水平上更准确地阐明不育症的发病机制,还可以为今后的基因诊断和基因治疗奠定基础。本文根据精子尾部的超微结构,对影响精子尾部各个部分发育的蛋白近年来的研究进展进行综述,希望有助于读者对影响精子尾部发育相关的蛋白有一个系统性认识。随着生殖医学的快速发展,越来越多的男性不育患者有望能够解决生育难题。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
