 ,1, 成勇
,1, 成勇 ,2
,2Expression analysis of tPA/gGH double genes in transfected goat mammary epithelial cells
Shaozheng Song1, Kangying Yu1, Ting Zhang2, Rui Lu2, Shengqiang Pan1, Mingming Zhou ,1, Yong Cheng
,1, Yong Cheng ,2
,2通讯作者: 成勇,教授,博士生导师,研究方向:转基因动物制药与胚胎工程。E-mail:chengyong12@yeah.net;
编委: 任军
收稿日期:2019-09-24修回日期:2019-11-29网络出版日期:2020-04-20
| 基金资助: |
Corresponding authors: 周鸣鸣,博士,副教授,研究方向:分子医学与遗传学、基因工程。E-mail:zmm19770@126.com
Editorial board:
Received:2019-09-24Revised:2019-11-29Online:2020-04-20
| Fund supported: |
作者简介 About authors
宋绍征,博士,讲师,研究方向:转基因与胚胎工程。E-mail:

摘要
人组织纤溶酶原激活剂(tissue-type plasminogen activator, tPA)是一种被广泛应用于临床的溶栓药物。双基因共整合入生物体内能够产生协同作用,从而提高目的基因的表达水平。但是目前,利用gGH基因与tPA基因共整合以期提高tPA表达水平的相关研究较少。为筛选获得tPA高表达的tPA/gGH双基因整合的单克隆转基因山羊乳腺上皮细胞株,本研究以β-casein基因作为调控序列,构建乳腺特异性表达载体PCL25/gGH,并通过电转染将tPA和gGH双基因共转染山羊乳腺上皮细胞;通过G418筛选获得抗性细胞株,经PCR检测获得转基因单克隆细胞株;利用催乳素诱导tPA表达,收集48 h后细胞诱导液进行ELISA()和Western blotting检测并分析其tPA表达水平。结果表明,共获得142株抗性单克隆细胞,其中有53株tPA单基因整合细胞株,34株tPA/gGH双基因整合细胞株,双基因整合率达23.9% (34/142)。共检测出29株细胞能够表达tPA,其中单基因表达细胞为12株,表达率为22.6% (12/53);双基因表达细胞为17株,表达率为50.0% (17/34);且单基因细胞表达tPA含量为7.5~52.0 μg/mL,而双基因细胞表达tPA含量为40~360 μg/mL,明显高于单基因表达水平。本研究通过电转染的方式成功获得了tPA/gGH双基因整合的单克隆山羊乳腺上皮细胞株,并证明双基因整合的细胞株表达tPA水平明显提高,为后期制备高表达转基因山羊奠定了基础。
关键词:
Abstract
tPA is a thrombolytic agent widely used in clinical settings. While double gene co-integration into organisms can produce synergistic effects and improved expression levels of the target gene, there are few reports detailing the co-integration of the tPA and gGH genes and an increased expression level of tPA. In order to study this, we obtained monoclonal goat mammary epithelial cell lines with tPA/gGH double gene integration and we analyzed the tPA expression level of single and double gene integration cells. We constructed a mammary gland-specific expression vector PCL25/gGH by using the β-casein gene as the regulatory sequence. The tPA and gGH genes were co-transfected into goat mammary epithelial cells by electrotransfection. Resistant cell lines were screened by G418, and transgenic monoclonal cell lines were obtained by PCR detection. tPA expression was induced by prolactin and subsequently, the cell induction solution was assayed after 48 hours by ELISA and Western blotting. The results show that a total of 142 resistant monoclonal cells were obtained including 53 tPA monogenic integration cell lines and 34 tPA/gGH double gene integration cell lines. The rate of double gene integration was 23.9% (34/142). A total of 29 cells were detected to be able to express tPA, of which 12 were single-gene-expressing cells and the corresponding expression rate was 22.6% (12/53). There were 17 double-gene- expressing cells with a corresponding expression rate of 50.0% (17/34). The expression level of tPA in single-gene cells was 7.5-52.0 μg/mL, while in double-gene cells was 40-360 μg/mL, which was significantly greater than that in single- gene cells. The goat mammary epithelial cell lines with tPA/gGH gene integration were successfully obtained by electrotransfection, and we proved that the expression level of tPA in the double gene integration cell lines with tPA/gGH gene integration was significantly increased. Our findings lay the foundation for the additional study of highly expressed transgenic goats and other animals with determination of scientific and clinical utility.
Keywords:
PDF (692KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
宋绍征, 于康英, 张婷, 陆睿, 潘生强, 周鸣鸣, 成勇. tPA/gGH双基因转染山羊乳腺上皮细胞表达分析. 遗传[J], 2020, 42(4): 380-387 doi:10.16288/j.yczz.19-299
Shaozheng Song.
自20世纪以来,血栓性疾病一直是危害人类健康和生命安全的头号因素,溶栓疗法是目前临床上使用最广泛而有效的一种治疗方法[1,2,3]。人组织纤溶酶原激活剂(tissue-type plasminogen activator, tPA)是由血管内皮细胞合成并分泌的一种丝氨酸蛋白酶,能够高效特异地溶解血栓,是一种较好的溶栓药物[4]。1991年,Ebert等[2]首次报道了转基因山羊乳腺表达tPA含量为3 µg/mL;2006年,徐寒梅等[5]以β乳球蛋白基因为调控序列,制备的转基因山羊乳腺表达tPA含量为8.5 µg/mL;本实验室于2015年在山羊乳腺上皮细胞水平也进行了tPA表达研究,但其tPA表达水平一直相对较低[6]。山羊生长激素(goat growth hormone, gGH)是由垂体前叶分泌的一种蛋白质,与催乳素有着类似的结构,控制αs-casein和β-casein的激活,具有促进乳腺生长发育及维持泌乳的作用[7,8]。
有研究证明,通过双基因共整合获得的转基因生物能够在体内同时表达两种不同的基因,而且双基因产生协同作用会促进其中一种基因表达水平的提高[9]。例如韩操等[10]通过慢病毒介导bFGF和BMP-2双基因转染兔骨髓间充质干细胞的研究,bFGF和BMP-2蛋白表达量明显增加,促进了细胞的增殖水平。王林楠等[11]通过慢病毒介导NEP1-40及NT-3双基因转染神经干细胞,NEP1-40和NT-3 mRNA相对表达量及蛋白表达量均显著高于单基因转染。陈宁等[12]将NGF与BMP2双基因转染大鼠BMSCs,双基因转染组的目的蛋白表达量明显高于对照组。但是,将tPA和gGH双基因共整合到生物体内以期提高tPA表达量的相关研究较少见报道,尤其是在山羊乳腺上皮细胞中的研究更少。
由于动物乳腺生物反应器的研制周期长、前期投资大、涉及技术难点多及乳蛋白特异性调控机制复杂等问题[13],因此在细胞水平对其前期表达研究至关重要。山羊乳腺上皮细胞具有诱导表达功能[6],是一种前期细胞水平验证研究的良好选择。本研究主要在前期PCL25/tPA乳腺特异性表达载体(以β-casein基因作为调控序列)的基础上,构建了PCL25/gGH乳腺特异性表达载体,tPA/gGH双基因共转染山羊乳腺上皮细胞,研究目的基因tPA的表达水平,为将来制备高表达转基因动物提供新思路、新方法,也为转基因动物乳腺生物反应器和转基因育种建立新的技术途径。
1 材料与方法
1.1 材料
萨能奶山羊常规饲养于扬州大学实验农牧场,处于泌乳中后期。PCL25/tPA乳腺特性表达载体为本实验室构建、保存(图1A),是以β-casein为调控元件、CMV为启动子的哺乳动物表达载体,已在山羊(Capra)细胞、小鼠(Mus musculus)和兔(Leporidae)等得到表达验证[6,14];gGH基因由上海生工生物工程技术服务有限公司合成(两端含Xho I酶切位点);宿主菌DH5α由本实验室保存。1.2 引物的设计与合成
PCR引物设计借助于Primer Premier 5.0软件完成,引物由上海生工生物工程技术服务有限公司合成(表1)。1.3 PCL25/gGH乳腺特异性表达载体的构建
应用常规分子生物学技术构建PCL25/gGH乳腺特异性表达载体,由上海生工生物工程技术服务有限公司合成山羊生长激素(gGH)基因,Xho I酶切PCL25/tPA载体,经T4 DNA连接酶(宝生物工程(大连)有限公司)连接基因片段,转化感受态大肠杆菌,AMP抗性筛选,提取质粒经酶切和测序鉴定,正确的菌株命名为PCL25/gGH。1.4 山羊乳腺上皮细胞的分离、纯化
无菌手术切取大约5 g左右的泌乳期山羊乳腺实质组织,D-hanks’缓冲溶液反复冲洗直至干净无血迹和乳汁,将腺泡组织剪成约1 mm3大小,添加30 mL I型胶原酶消化液(含I型胶原酶200 IU/mL,透明质酸酶100 IU/mL)振荡消化1 h,收集悬液,300目的筛网过滤,收集滤液离心后,用D-hank’s离心洗涤3次,细胞计数并用培养液(含DMEM/F12,购自美国Thermo公司;10% FBS,购自美国Hyclone公司;乙酸钠5 mmol/L,转铁蛋白5 µg/mL,乙醇胺0.5 mmol/L,胰岛素10 µg/mL,氢化可的松5 µg/mL,均购自美国Sigma公司)调整密度至5×105个/mL接种于六孔板中,置于37℃、5% CO2、饱和湿度的CO2培养箱内静置培养。待贴壁细胞汇合至80%时,用0.05%胰蛋白酶 + 0.04% EDTA消化2 min后,弃去含脱壁成纤维细胞的消化液,重新加入培养液培养,重复两次可获得较纯的乳腺上皮细胞。1.5 PCL25/tPA与PCL25/gGH双基因共转染山羊乳腺上皮细胞
PCL25/tPA与PCL25/gGH载体经Sal I和Not I双酶切而分别线性化,用QIAGEN试剂盒回收后溶于超纯水中,-20℃保存。收集对数生长期的山羊乳腺上皮细胞,用电转染液洗涤离心后重悬细胞密度至1×106个/mL,加入DNA使终浓度为20 µg/mL,以2.0 KV/cm,200 µs的条件电击一次(Multiporator电转染仪,购自德国Eppendorf公司)。48 h后加入500 µg/mL G418 (美国Amesco公司)筛选,每2 d换一次液,10~14 d后挑取克隆细胞于48孔细胞培养板,以200 µg/mL G418筛选扩增传代至12孔板,收集部分细胞用DMEM/F12 + 10% DMSO + 20% FBS的冷冻液冻存,另一部分用于后续检测。1.6 PCR检测单克隆细胞株
使用0.05%胰蛋白酶 + 0.04% EDTA消化吹打收集部分细胞悬液,2000 r/min离心5 min,弃上清,加入10 μL细胞裂解液,重悬细胞,45℃孵育45 min、96℃孵育15 min后可直接作为PCR模板,进行tPA和gGH基因整合检测,引物序列见表1。Table 1
表1
表1PCR扩增引物序列
Table 1
| 引物名称 | 引物序列(5°→3°) |
|---|---|
| gGH-F | CCGCTCGAGCGGATGATGGCTGCAGGCCCCCGGA |
| gGH-R | CCGCTCGAGCGGCTAGAAGGCACAGCTGGCCTCCCCG |
| CMV/tPA-F | CGTGGATAGCGGTTTGA |
| CMV/tPA-R | GAGCCCTCCTTTGATGC |
新窗口打开|下载CSV
1.7 ELISA表达检测
待12孔板中细胞汇集至80%左右,弃去旧培养液,添加含5 µmol/L催乳素的新鲜培养液进行诱导表达,48 h后收集细胞诱导液,进行ELISA检测,使用鼠抗tPA单克隆抗体作为一抗(sc-59721,美国Santa Cruz公司)、羊抗鼠单克隆抗体IgG-HRP作为二抗(sc-2005,美国Santa Cruz公司),显色后酶标仪测定OD450值,并绘制标准曲线、计算tPA表达量,比较tPA/gGH双基因整合和tPA单基因整合的山羊乳腺上皮细胞诱导表达水平。1.8 Western blotting检测
按照常规方法对细胞诱导液进行12% SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)[13]。使用转移缓冲液(1.93 g/L Tris, 9 g/L Glycine)将丙烯酰胺凝胶转移至PVDF膜,250 mA,转印3.5 h。超纯水冲洗后,37℃封闭(20 mmol/L Tris, 137 mmol/L NaCl, 0.1% Tween- 20, 10% Fetal bovine serum, pH 7.6),2.5 h。加入一抗稀释液(1∶2000稀释,鼠抗tPA单克隆抗体,sc-59721,美国Santa Cruz公司),37℃孵育2 h。TTBS (20 mmol/L Tris, 137 mmol/L NaCl, 1% Tween-20, pH 7.6)洗涤3次后,加入二抗-HRP稀释液(1∶2000稀释,羊抗鼠单克隆抗体IgG-HRP,sc-2005,美国Santa Cruz公司)中,37℃孵育2 h。取出PVDF膜,PBS洗净后,添加显色液(DAB 50 mg, 0.05 mol/L TB 100 mL, 30 μL 30% H2O2, pH7.6),室温15 min,晾干后拍照、记录并保存。2 结果与分析
2.1 PCL25/gGH乳腺特异性表达载体鉴定
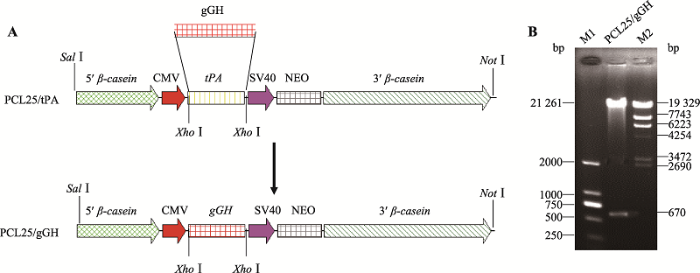
在实验室原有的PCL25/tPA乳腺特异性表达载体(图1A)基础上,通过常规分子生物学手段,以gGH基因置换tPA基因,重新构建的PCL25/gGH质粒经Xho I酶切后,分别扩增出约670 bp和21 261 bp大小的条带(图1B),与目标条带大小一致。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1乳腺特异性表达载体PCL25/gGH构建示意图
A:PCL25/tPA和PCL25/gGH载体结构示意图;B:PCL25/gGH载体XhoⅠ酶切鉴定。M1:DL2000 digest DNA Marker;M2:λ-EcoT14 digest DNA Marker。
Fig. 1Construction of PCL25/gGH vector
2.2 tPA/gGH双基因整合乳腺上皮细胞分析
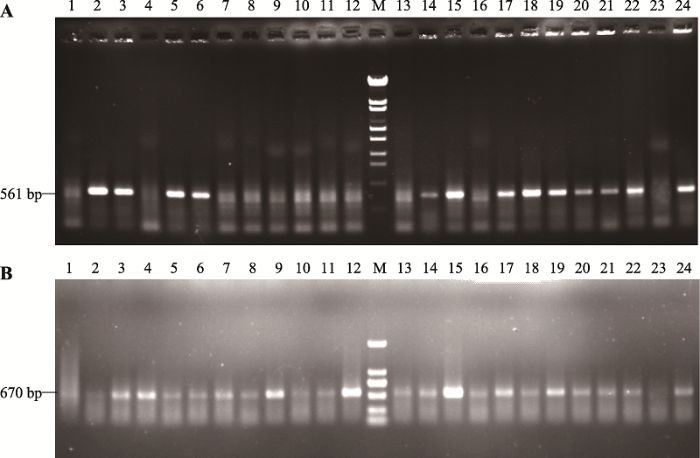
纯化后的未转染山羊乳腺上皮细胞生长旺盛、形态均一、细胞之间排列紧密,其形状呈现典型的短梭状或鹅卵石状(图2)。经筛选,本研究共获得142株单克隆抗性细胞株,进一步利用CMV/tPA-F/R引物进行PCR扩增,经检测,获得87株整合外源基因tPA细胞株,能扩增出561 bp大小的目标条带(图3A);利用gGH-F/R引物对这87株细胞进行gGH基因整合检测,共获得34株整合gGH基因的细胞株,扩增出670 bp大小的目标条带(图3B)。因此,本研究共获得53株tPA单基因整合入乳腺上皮细胞的细胞株,整合效率为37.3% (53/142);34株tPA/gGH双基因整合乳腺上皮细胞株,双基因整合效率达到23.9% (34/142),具体详见表2。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2纯化后的乳腺上皮细胞
Fig. 2Purified mammary epithelial cell clones
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3转tPA/gGH双基因山羊乳腺上皮细胞PCR检测结果
A:转tPA基因的PCR检测结果。1~22:乳腺上皮细胞单克隆;M:λ-EcoT14 digest DNA Marker;23:阴性对照(正常细胞基因组);24:阳性对照(PCL25/tPA质粒)。B:转gGH基因的PCR检测结果。1~22:乳腺上皮细胞单克隆;M:DL2000 digest DNA Marker;23:阴性对照(正常细胞基因组);24:阳性对照(PCL25/gGH质粒)。
Fig. 3Detection of transfected tPA/gGH gene in goat mammary epithelial cell clones by PCR
2.3 tPA在单克隆细胞株中的诱导表达分析
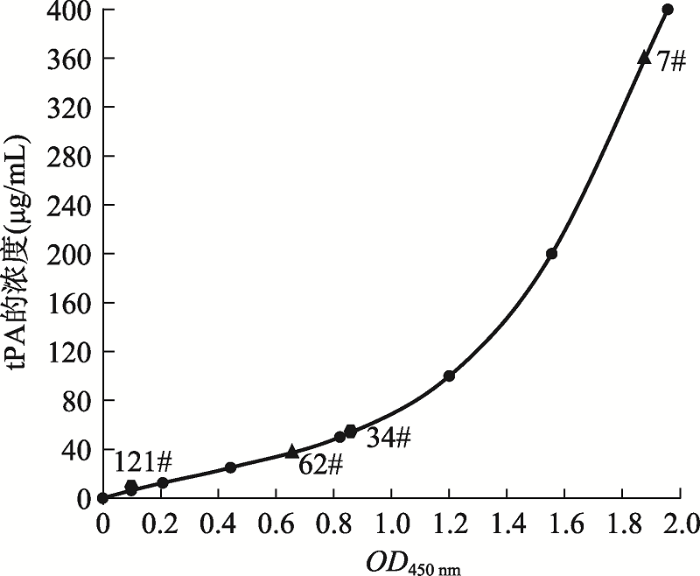
分别对整合tPA单基因、tPA/gGH双基因的山羊乳腺上皮细胞进行催乳素诱导tPA表达,收集48 h后的细胞诱导液进行ELISA检测,重复一次,取平均值。结果显示,共有29株细胞能够表达tPA,表达率为33.3% (29/87),其中单基因表达细胞有12株,表达率为22.6% (12/53),双基因表达细胞有17株,表达率为50.0% (17/34) (表2)。以tPA标准品(阿替普酶)浓度(μg/mL)作为纵坐标、OD450 nm值作为横坐标,制作相应的标准曲线(图4),计算乳腺细胞诱导表达tPA的水平,其中单基因细胞表达tPA含量为7.5~52.0 μg/mL,而双基因细胞表达tPA含量为40~360 μg/mL,明显高于单基因整合细胞株的表达量。Table 2
表2
表2tPA/gGH双基因转染山羊乳腺上皮细胞情况统计表
Table 2
| 细胞(142个) | 整合细胞数 | 整合率(%) | 表达细胞数 | 表达率(%) | 表达水平(μg/mL) |
|---|---|---|---|---|---|
| tPA 单基因整合 | 53 | 37.3 | 12 | 22.6 | 7.5~52.0 |
| tPA/gGH 双基因整合 | 34 | 23.9 | 17 | 50.0 | 40~360 |
新窗口打开|下载CSV
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4转基因单克隆乳腺上皮细胞株表达tPA的检测结果
tPA标准品的浓度分别是0、6.25、12.5、25、50、100、200和400 μg/mL;34#、121#分别是tPA单基因整合的山羊乳腺上皮细胞株诱导表达tPA的最高量和最低量;7#、62#分别是tPA/gGH双基因整合的山羊乳腺上皮细胞株诱导表达tPA的最高量和最低量。
Fig. 4Detection of tPA expression in transgenic monoclonal mammary epithelial cell lines
2.4 Western blotting对表达蛋白的鉴定
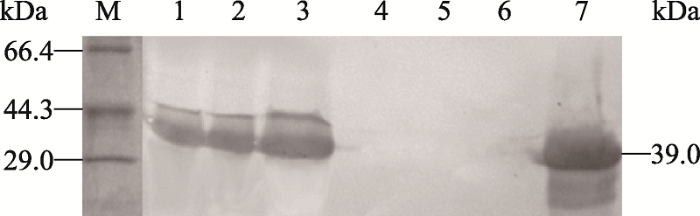
以鼠抗tPA单克隆抗体作为一抗,利用Western blotting检测收集的细胞诱导液表达tPA的,结果如图5所示。表达细胞诱导液和阳性对照(tPA标准品)均出现约39.0 kDa大小的条带,与目标蛋白tPA的大小一致,而未表达细胞诱导液和阴性对照均未出现条带,这说明与ELISA检测结果一致,初步判断整合外源基因的山羊乳腺上皮细胞经催乳素诱导表达的蛋白为tPA目标蛋白。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5转基因单克隆乳腺上皮细胞株表达tPA的western blotting检测结果
M:蛋白分子量标准;1~3:表达细胞诱导液(62#、34#、7#);4:未表达细胞诱导液;5:阴性对照(未诱导);6:空白对照(H2O);7:阳性对照(tPA标准品)。
Fig. 5Detection of tPA expression in transgenic monoclonal mammary epithelial cell lines by Western blotting
3 讨论
随着人们生活水平的不断提高,饮食结构和生活习惯的不断改变,血栓疾病在我国已呈现出明显的上升趋势,并有着向中青年人发展的趋势[3,15]。人组织纤溶酶原激活剂(tPA)作为一种溶栓药物,在临床上治疗血栓类疾病发挥着重要作用[16],但如何高效、低成本、简便地生产tPA一直困扰着科学界。自20世纪90年代,Wright等[17]在羊乳腺中成功地表达了人α-抗胰蛋白酶基因以来,乳腺生物反应器得到了长足的发展,为生产tPA类溶栓药物提供了较大的可能性。利用动物乳腺生物反应器来生产tPA等溶栓药物,具有产量高、成本低、翻译后修饰、生物活性高等优于其他表达系统的特点[6]。但哺乳动物乳腺表达tPA产量一直较低,这可能是由于tPA是一种非乳蛋白,而乳蛋白的特异性表达机制较复杂、基因网络涉及到多个基因及调控元件的相互作用等。因此,积极探索如何提高哺乳动物乳腺中表达外源基因tPA至关重要。将两个基因共同整合到动物体内会产生协同作用[9,18],其中一种基因能够促进另一种目标基因表达水平的提高,从而解决转基因动物中表达tPA较低的问题,获得较高的产量。近年来,双基因提高外源基因表达水平的研究已有报道,例如Dominggues等[19]将血红蛋白四聚体的α-Hb与β-Hb两个亚基克隆到同一启动子trc的下游,实现了多基因的共表达。陈宁等[12]将NGF与BMP2双基因转染大鼠BMSCs,使双基因转染组的目的标蛋白表达量显著地提高。韩操等[10]、王林楠等[11]分别对兔骨髓间充质干细胞和神经干细胞的研究也证明了双基因转染的目标蛋白表达水平明显高于单基因。分析原因可能是生物体内基因调控网络所致,基因表达调控具有复杂性和多层次性,有的基因表达能够激活提高另一种基因的转录和表达水平[19,20]。但是,在山羊乳腺上皮细胞中的研究较少见报道,尤其是关于tPA/gGH双基因转染山羊乳腺上皮细胞的表达分析研究尚未见报道。
有研究证明生长激素(GH)对于β-casein基因的表达具有促进作用[21,22],能够与β-casein基因的HRE序列结合,激活其受体并提高蛋白的特异性表达,同时GH还能够刺激乳腺上皮细胞的分化与增殖[23]。因此,本研究选择了山羊β-casein基因作为调控序列,以本实验室前期构建且验证表达的PCL25/tPA乳腺特异性表达载体为基础,构建了PCL25/gGH表达载体。但由于动物乳腺生物反应器存在诸如研制周期长、技术繁杂、动物成本大、风险高等问题[14],故有必要在制备转基因动物之前进行载体表达验证,而哺乳动物细胞和小鼠是最常用的表达载体验证工具[6,13]。山羊乳腺上皮细胞虽然是一种极难培养的终末分化细胞,但由于具有诱导表达功能,可使用催乳素等诱导[6],因此该细胞是目前应用最广泛的一种验证乳腺特异性表达载体的技术手段。而且,本研究选择的gGH基因能够促进乳腺上皮细胞的增殖,本研究结果成功获得的众多转基因细胞株也较好地证明了这一点。
本研究通过电转染山羊乳腺上皮细胞的双基因载体PCL25/tPA和PCL25/gGH均是以山羊β-casein基因为调控序列,共获得tPA/gGH双基因整合的转基因乳腺上皮细胞34株(整合率23.9%),tPA单基因整合细胞53株(整合率37.3%),转基因整合效率较高。催乳素诱导表达结果显示双基因整合能够明显提高转基因细胞中外源目的基因tPA的表达水平,最高表达水平达360 μg/mL,而且表达率也明显高于单基因整合细胞株(50.0%/22.6%)。分析原因可能是gGH基因能够与山羊β-casein基因调控序列发挥协同促进作用,从而提高外源基因tPA的表达水平。同时,由于单基因表达水平过低,部分细胞株表达tPA量极低而不易被ELISA检测出,当额外转入对表达具有协同促进作用的gGH基因时,使部分原先表达水平极低的细胞株表达tPA量显著提高,从而被检出来,故tPA/gGH双基因整合细胞株的表达率也明显高于tPA单基因整合细胞株。但是,基因表达涉及到整合位点、表观遗传、外源基因拷贝数、相关激素水平及基因网络等多方面的影响[13,23,24],因此,本实验室今后还会进行深入的后续研究工作,重点阐明整合位点与基因拷贝数对tPA表达水平的影响。
综上所述,本研究成功地制备了tPA/gGH双基因整合的山羊乳腺上皮细胞株,并证明了双基因整合入山羊细胞的可行性以及在细胞水平能够高效地表达外源目的基因tPA,为将来制备高表达转基因山羊及其他动物奠定了基础,也为转基因动物乳腺生物反应器和转基因育种建立新技术提供了前提保障。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 6]
[本文引用: 6]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 4]
[本文引用: 4]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
