 ,2,3, 范永斌1, 宋苗苗1, 黄韵杰1, 丁佳佳1
,2,3, 范永斌1, 宋苗苗1, 黄韵杰1, 丁佳佳1Genome-wide identification, phylogenetic analysis and expression profiling of the MKK gene family in Arabidopsis pumila
Xiaocui Li1, Kaicheng Kang1, Xianzhong Huang ,2,3, Yongbin Fan1, Miaomiao Song1, Yunjie Huang1, Jiajia Ding1
,2,3, Yongbin Fan1, Miaomiao Song1, Yunjie Huang1, Jiajia Ding1通讯作者: 黄先忠,教授,博士生导师,研究方向:植物响应逆境的分子机制。E-mail:xianzhongh106@163.com
编委: 张根发
收稿日期:2019-12-30修回日期:2020-03-15网络出版日期:2020-04-20
| 基金资助: |
Corresponding authors: $con.vcortext
Editorial board:
Received:2019-12-30Revised:2020-03-15Online:2020-04-20
| Fund supported: |
作者简介 About authors
李晓翠,硕士研究生,专业方向:遗传学。E-mail:

摘要
丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase, MAPKK或MKK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联的重要组成部分,在植物的生长发育和胁迫应答过程中发挥重要作用。目前,已在多种植物中鉴定了MKK基因家族,但在十字花科植物小拟南芥(Arabidopsis pumila)中MKK基因家族的系统鉴定与分析尚未见报道。为了探索小拟南芥MKK基因家族的进化和功能,本研究通过全基因组分析鉴定了小拟南芥中16个MKK基因,散布于小拟南芥的10条染色体上。基于系统发育分析和多重序列比对,将这些基因分为5个亚族:A亚族(5个)、B亚族(2个)、C亚族(4个)、D亚族(3个)和E亚族(2个)。分子进化和共线性分析表明小拟南芥中存在7对复制基因,分别是ApMKK1-1/1-2、ApMKK2-1/2-2、ApMKK3-1/3-2、ApMKK4-1/4-2、ApMKK5-1/5-2、ApMKK9-1/9-2和ApMKK10-1/10-2,其中ApMKK1-1/1-2在复制事件之后发生了加速进化。结合ApMKKs启动子区的顺式元件分布和ApMKKs在成熟叶片、茎、花和果实以及盐胁迫下的表达模式,结果发现复制基因的表达具有组织特异性和功能多样性。部分复制基因在组织中的表达模式存在差异,但在盐胁迫下的表达模式却基本相同。本研究结果为解析MKK介导的小拟南芥发育过程和非生物胁迫信号转导通路的复杂机制奠定了基础。
关键词:
Abstract
Mitogen-activated protein kinase kinase (MAPKK or MKK) is an important component of the MAPK cascade, which plays important roles in plant growth and development as well as in various stress responses. At present, the MKK gene family has been identified in a variety of plants, but there has been no systematic study in Cruciferous plant Arabidopsis pumila. To explore the evolution and function of the MKK gene family in Arabidopsis pumila, 16 ApMKK genes were identified from the Arabidopsis pumila genome by genome-wide analysis, and they were distributed on 10 chromosomes of Arabidopsis pumila. According to phylogenetic analysis and multiple sequence alignment, these putative genes were divided into five known subfamilies, i.e, Groups A, B, C, D, and E, which includes 5, 2, 4, 3, 2 members, respectively. Evolutionary and syntenic analysis showed that there are seven pairs of duplication genes in Arabidopsis pumila: ApMKK1-1/1-2, ApMKK2-1/2-2, ApMKK3-1/3-2, ApMKK4-1/4-2, ApMKK5-1/5-2, ApMKK9-1/9-2, and ApMKK10-1/10-2. Ka/Ks and Tajima analysis indicated that evolution of ApMKK1-1/1-2 was accelerated after the duplication event. Combining the distribution of cis-element in the promoter region of ApMKKs and the expression profile of ApMKKs in mature leaves, stems, flowers and fruits as well as under salt stress, we found that the expressions of paralogous genes (duplication genes) were tissue-specific and their functions were diversified. The expression patterns of some duplicated genes in tissues were different, but the expression patterns under salt stress were basically the same. These results lay the foundation for analyzing the complex mechanisms of MKK-mediated growth and development and abiotic stress signal transduction pathways in Arabidopsis pumila.
Keywords:
PDF (2412KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李晓翠, 康凯程, 黄先忠, 范永斌, 宋苗苗, 黄韵杰, 丁佳佳. 小拟南芥MKK基因家族全基因组鉴定及进化和表达分析. 遗传[J], 2020, 42(4): 403-421 doi:10.16288/j.yczz.19-388
Xiaocui Li.
植物在抵御外界不利环境刺激过程中已经进化出一套复杂而有效的防御机制来感知外部环境信号,并且在分子水平、细胞水平和生理水平等方面对各种胁迫作出响应,从而维持正常的生长和发育[1]。在众多抗逆机制中,丝裂原活化蛋白激酶(mitogen- activated protein kinase, MAPK)级联途径作为最重要的信号转导途径,能将细胞膜表面受体感知到的信号通过磷酸化和去磷酸化作用逐级放大并传递到细胞内,靶向激活胞质或核内的其他激酶、酶或转录因子等效应蛋白,调节特定基因的表达,从而促使细胞、组织、器官、整个生物体作出相应的生理生化反应,进而适应环境和抵御逆境胁迫[2,3,4,5]。MAPK信号级联是一个进化保守的信号转导模块,典型的MAPK级联由3种功能上连续作用的蛋白激酶组成:MAPK激酶激酶(MAPKKK或MEKK)、MAPK激酶(MAPKK、MEK或MKK)和MAPK。MAPKKK通常作用于MKK的S/T-xxxxx-S/T位点将其磷酸化并激活,随后活化的MKK磷酸化MAPK的苏氨酸和酪氨酸残基(TXY)从而激活MAPK[5,6,7]。此外,支架蛋白、共享对接域和适配器或锚定蛋白也可以介导特定MAPK级联的形成和完整性[8,9,10]。
目前,在已报道的所有植物MAPK级联组分中,MKK基因家族包含最少的成员,几乎是MAPKs的一半,可能激活不止一个MAPK蛋白;同时又远少于MAPKKK基因家族的成员数量,可能同一个MKK可以被不同的MAPKKK激活,这表明有大量的MAPKKK-MAPKK-MAPK组合可能形成特定的MAPK级联[11]。拟南芥(Arabidopsis thaliana)全基因组中有10个MKK成员,根据S/T-xxxxx-S/T保守基序的进化可分为4个亚族(Groups A-D):MKK1/2/6属于Group A;MKK3属于Group B;MKK4/5属于Group C;MKK7/8/9/10属于Group D[12]。但近期有研究表明,通过对多个植物物种中MKK基因家族的进化分析,植物MKK基因家族成员可被分为5个亚家族,分别为Group A (MKK1/2/6)、Group B (MKK3)、Group C (MKK4/5)、Group D (MKK7/8/9)和Group E (MKK10)[13]。
MAPK级联中的MKK组分在植物生长发育和响应外界胁迫过程中起着承上启下的作用[5,14]。目前,已有大量研究报道对一些植物中MKK的功能进行了详细阐明。例如,在模式植物拟南芥中,MEKK1- MKK1/MKK2-MPK4级联响应冷和盐胁迫,并介导先天的免疫应答反应[15,16,17,18]。AtMKK1可作用于AtMPK6,参与H2O2的代谢[19]。AtMKK6可激活突变酵母中的AtMPK13,从而恢复细胞溶菌作用表型,且二者在拟南芥的多个组织中共表达[20]。AtMKKK18-AtMKK3-AtMPK1/2/7是一条脱落酸(abscisic acid, ABA)依赖的信号通路,调节叶片衰老和干旱胁迫抗性[21]。AtMKK3-AtMPK6在茉莉酸(jasmonic acid, JA)介导的信号转导途径[22]和蓝光介导的信号转导途径[23]中起着关键作用。过表达AtMKK7导致拟南芥生长素极性运输缺陷和异常表型[24]。AtMKK9的缺失会造成植物对高盐极度敏感,据报道,MKK9-MPK3/MPK6级联一方面可以调控磷酸盐的吸收[25],另一方面参与乙烯信号转导通路[26,27]。在烟草(Nicotiana tabacum)中,NPK1- NQK1/NtMEK1-NRK1级联(一个MAPK级联,其中NQK1/NtMEK1是烟草NtMKK6的同源基因)参与了细胞分裂后期细胞板的形成[28]。ZmMKK4过表达可以提高拟南芥对盐胁迫和冷胁迫的耐受性[29]。在拟南芥中,过表达ZmMKK1和GhMKK1都可以调节抗氧化酶和ABA相关基因的表达,从而增强植物对高盐和干旱胁迫的耐受性;另外,酵母双杂交实验显示,ZmMKK1与ZmMEKK1互作[30,31]。GhMKK3- GhMPK7是一条ABA或干旱胁迫诱导的信号通路,GhMKK3在响应干旱胁迫的过程中主要是通过调节气孔关闭和根毛生长的方式[32]。大豆(Glycine max)中的GmMEKK1-GmMKK1/2/4/9-GmMPK3/6级联调节细胞死亡并参与免疫防御反应[33]。Kiegerl等[34]发现SIMKK介导的SIMK激活使苜蓿(Medicago sativa)积极响应盐胁迫。苹果(Malus domestica)中的MdMKK1-MdMPK1在种子萌发和幼苗生长中对ABA超敏感[35]。水稻(Oryza sativa)中的OsMKK6- OsMPK3级联在冷胁迫信号通路中扮演重要角色,增强植物的寒冷抗性[36]。OsMKKK10-OsMKK4- OsMAPK6级联参与水稻的籽粒发育,调控籽粒大小和重量[37]。
大量研究表明,MKK基因家族已经在多种植物中得到系统鉴定和分析。十字花科鼠耳芥属植物小鼠耳芥(Arabidopsis pumila),俗称小拟南芥,是生长在新疆半干旱、半盐碱化的特殊环境下的一种短命植物[38],具有耐盐碱、抗干旱、光合能力强、生长周期短及繁殖率高等特点,是研究植物抗逆性的优良材料[39,40]。然而,目前对小拟南芥MKK基因家族尚未进行系统的研究。利用本实验室前期获得的小拟南芥基因组测序数据(数据未公布),本研究对小拟南芥中MKK基因家族的成员进行了全基因组搜索和鉴定,详细介绍了小拟南芥MKK基因家族成员的染色体定位、模式植物拟南芥与小拟南芥MKK基因家族成员的多重序列比对、motif分布、外显子-内含子结构以及启动子区的顺式作用元件分布情况。此外,本研究还比较了小拟南芥、水稻和小拟南芥的近缘物种MKK基因家族的系统发育关系。Ka/Ks、Tajima相对速率测验和共线性分析表明,小拟南芥MKK基因家族中存在基因复制和加速进化事件。最后,利用RNA-seq数据,对小拟南芥MKK基因在不同组织和盐胁迫不同时间点的表达模式进行研究,初步分析了ApMKK基因的功能,为后续解析MAPK级联参与小拟南芥生长发育和响应逆境胁迫的机制提供理论基础。
1 材料与方法
1.1 材料
本研究对象是新疆短命植物小拟南芥。首先将小拟南芥种子杀菌消毒处理后播撒在1/2 MS培养基平板上,于4℃冰箱春化2~3 d,然后置于22℃光照培养箱中(16 h光照,8 h黑暗),待长出2~3片真叶后,将幼苗移栽至含有营养土和蛭石(体积比为1∶1)的盆钵中,放置在光照培养间里(16 h光照,8 h黑暗)培养[38]。本实验室前期完成了小拟南芥不同组织(茎、叶、花和果荚)转录组测序,方法如下:收集3个月大的小拟南芥不同组织(茎、叶、花和果荚),每个组织样品的收集都是选取长势相似的3株小拟南芥植株作为3个生物学重复,然后进行混合。小拟南芥盐胁迫转录组测序数据来自本实验室前期研究成果[40],具体方法:选取生长6周的小拟南芥幼苗,用含250 mmol/L NaCl的改良Hoagland营养液通过水培法进行盐胁迫,在胁迫处理0.5 h、3 h、6 h、12 h、24 h和48 h后收集叶片,用于转录组测序。未处理的小拟南芥叶片用作0 h对照。
1.2 小拟南芥MKK基因家族成员的鉴定及命名
利用小拟南芥基因组的蛋白序列文件,通过本地BLAST工具BioEdit (version 7.2.5)创建一个小拟南芥的蛋白序列数据库。分别从TAIR网站(小拟南芥中每个MKK基因的名称都以小拟南芥拉丁名Arabidopsis pumila的缩写Ap开头,然后是小拟南芥MKK基因在模式植物拟南芥中对应的直系同源基因的名称,如ApMKK1。拟南芥MKK基因家族的大部分成员在小拟南芥中具有两个直系同源基因(ortholog),少部分只有1个,极少数无直系同源基因。最终,本研究采取将小拟南芥中的旁系同源基因(paralog)按连续编号的方式进行命名(如ApMKK1-1和ApMKK1-2)。对于只有一个同源基因的情况,如AtMKK6,在小拟南芥中只有一个直系同源基因,将其编号为ApMKK6-1[42]。
1.3 系统进化树构建、motif分布和多重序列比对
分别从TAIR网站和RGAP网站下载拟南芥和水稻MKK基因家族成员的氨基酸序列。从Ensembl基因组数据库(1.4 基因结构、复制事件和共线性分析
基于每个ApMKK基因的开放阅读框(open reading frame, ORF)和基因组编码区的比较,借助基因结构显示服务器GSDS (基因复制事件通过多重序列比对和共线性分析来揭示。另外,ApMKK旁系同源基因的确定需满足两个条件:比对长度大于较长基因的90%;核苷酸一致性>90%的情况下才被视为复制基因[46,47]。借助ClustalW (https://www.genome.jp/tools-bin/clustalw)计算成对基因的蛋白编码区序列(coding sequence, CDS)相似性和蛋白相似性,参数选为默认值。使用DnaSP 6.0软件[48]计算非同义替换率(Ka)和同义替换率(Ks),通过ApMKK旁系同源基因间的Ka/Ks来评估进化过程中复制基因的选择压力(提交序列为CDS序列,编码区域设置为从序列的起始到终止)。Ka/Ks > 1、< 1或= 1分别表示正、负或中性演化[49]。获取ApMKK复制基因对的氨基酸序列,利用MEGA6.0软件进行Tajima相对速率测验,从而确定ApMKK复制基因在复制事件发生后的进化速率(提交序列为全长氨基酸序列,设定Taxon A序列,Taxon B序列和outgroup序列对应的基因名,其他参数默认)。本研究对于复制基因发生加速进化的判断根据:Tajima相对速率(P值)是否小于0.05,若复制基因对的P值< 0.05,则表明复制基因发生了加速进化[50]。使用Circos程序[51]分析小拟南芥、拟南芥和叶芽鼠耳芥中MKK同源基因的共线关系。
1.5 小拟南芥MKK基因表达模式分析
利用本实验室前期获得的组织转录组数据获取小拟南芥ApMKK基因在不同组织(成熟期的茎、叶、花和果荚)中的RPKM值,然后借助R语言的热图程序包将表达数据(RPKM的log2值)可视化为热图,进而分析ApMKK基因在小拟南芥不同组织中的表达情况。从盐胁迫转录组数据[40]中获取小拟南芥ApMKK基因在盐胁迫不同时间点(0 h、0.5 h、3 h、6 h、12 h、24 h和48 h)的FPKM值,同样借助R语言中的热图程序包将表达数据(FPKM的log2值)可视化为热图,然后分析ApMKK基因在盐胁迫不同时间点的表达情况。1.6 小拟南芥MKK基因启动子区的顺式作用元件分布
检索小拟南芥基因组数据库,截取每个ApMKK基因起始密码子上游的1500 bp区域作为启动子序列,然后将这些序列提交至PlantCARE (2 结果与分析
2.1 小拟南芥MKK基因家族成员的鉴定
将拟南芥MKK (AtMKK)氨基酸序列作为蛋白种子序列,在小拟南芥基因组数据库中进行蛋白序列检索,去除重复序列后结合Pfam分析,最终确定小拟南芥MKK基因家族有16个成员,它们都具有蛋白激酶域,具体信息见表1。另外,16个ApMKKs的ORF长度从939 bp (ApMKK9-1和ApMKK9-2)到1692 bp (ApMKK3-1)不等,其编码蛋白由312~367个氨基酸组成,蛋白质分子量为34.53~62.75 kDa,等电点为5.715~9.268。预测显示,除了ApMKK7-1定位于膜结合线粒体外,其他ApMKKs的亚细胞定位均显示位于细胞质中。Table 1
表1
表1小拟南芥MKK基因家族信息
Table 1
新窗口打开|下载CSV
2.2 小拟南芥MKK多重序列比对和motif分布
为了更好地解析小拟南芥和拟南芥MKK蛋白的序列保守性,本研究进行了多重序列比对和保守motif分析。多重序列比对结果表明,鉴定获得的16个ApMKKs基本包含已报道过的活性位点D (L/I/V) K[52,53]、S/T-xxxxx-S/T[54]和VGExxYMSPER[12] (图1)。根据拟南芥AtMKK的最新分组情况[13],ApMKK1-1/ 1-2/2-1/2-2/6-1属于Group A;ApMKK3-1/3-2属于Group B;ApMKK4-1/4-2/5-1/5-2属于Group C;ApMKK7-1/9-1/9-2属于Group D;ApMKK10-1/10-2属于Group E。特别注意的是,Group E中的AtMKK10、ApMKK10-1和ApMKK10-2无S/T-xxxxx-S/T保守结构域。图1
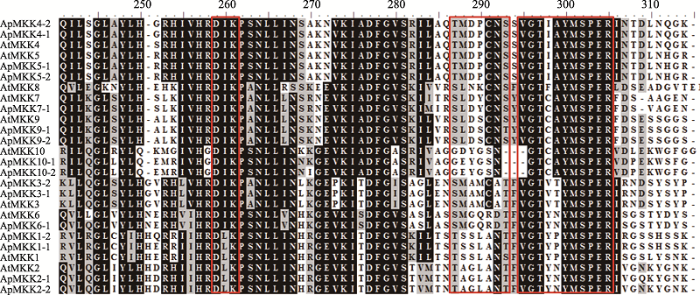 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1小拟南芥ApMKK与拟南芥AtMKK的氨基酸多重序列比对
阴影部分表示保守区域;红色方框分别表示ApMKK的3个主要保守结构域:D (L/I/V) K,S/T-xxxxx-S/T和VGExxYMSPER。
Fig. 1Multiple amino acid sequence alignment of ApMKK and AtMKK proteins
此外,通过MEME在线程序对16个ApMKKs进行保守motif分析,共预测出11个保守的motifs,这11个保守motifs的分布见图2A,详细的氨基酸序列信息见图2B。本研究发现,所有的ApMKKs皆包含motif 1/2/3/4/5/6/7,其中motif 1包含两个主要MKK保守结构域:D (L/I/V) K和S/T-xxxxx-S/T,这两个保守结构域在多重序列比对结果(图1)中也得以鉴定。每个亚族都有其特有保守motif,Group A特有的保守motif是motif 8,motif 11是Group C、Group D和Group E所特有的。Group A中的ApMKKs由10个motifs (不含motif 11)构成,Group B中的ApMKKs由8个motifs (不含motif 8/10/11)构成,Group C和Group D中的ApMKKs由10个motifs (不含motif 8)组成,Group E中的ApMKKs由9个motifs (不含motif 8/9)组成,这表明相同亚族的MKK成员具有相似的motif组成。尽管不同亚族基因的motif组成不同,但它们都具有重要的活性位点motif 1,且共有的motif以基本相同的顺序排列,但是只有Group B除外,Group B中MKK3的motif 2和motif 6的分布顺序与其他亚族相反。令人意外的是,motif 9是重要的催化位点(VGExxYMSPER),多重序列比对结果也显示所有ApMKKs都具有MKK重要的催化结构域VGExxYMSPER,但Group E中的ApMKK10-1和ApMKK10-2却不包含motif 9,这可能与MEME的motif识别程序有关。另外,ApMKK和AtMKK基因家族之间的大部分直系同源基因的motif组成相同,唯独MKK10例外,ApMKK10-1/10-2比AtMKK10多一个motif 10。
图2
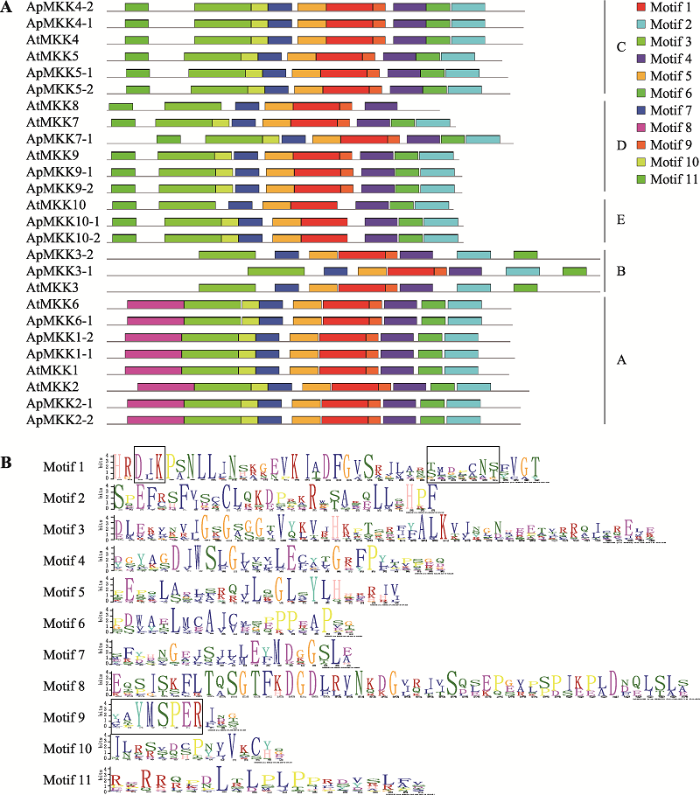 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2拟南芥和小拟南芥MKK蛋白的motif分析
A:16个ApMKKs和10个AtMKKs的motif分布(不同颜色的长方形代
Fig. 2Motif analysis of the MKK proteins in Arabidopsis thaliana and Arabidopsis pumila
2.3 小拟南芥MKK基因家族成员的进化和外显子-内含子结构
为揭示小拟南芥ApMKK和小拟南芥近缘物种MKK之间的进化关系,分别获取水稻(8个)、拟南芥(10个)、叶芽鼠耳芥(9个)、琴叶拟南芥(9个)和盐芥(10个)MKKs和小拟南芥的16个ApMKKs的氨基酸序列,构建系统发育树(图3)。根据进化树信息,MKK基因家族成员被分为5个亚家族,分别是Group A、Group B、Group C、Group D和Group E。对6个物种中MKK基因家族的各个亚族的基因个数进行统计,结果发现,小拟南芥MKK基因家族的成员数量明显多于其近缘物种和水稻,其中Group B和Group C的ApMKK基因数目是其他5种植物B、C亚族MKK基因的两倍(图4)。从进化关系来看(图3),小拟南芥中的大部分MKKs两两排布在一起,似乎小拟南芥MKK基因家族中存在一些复制关系。为了验证小拟南芥ApMKK基因家族中是否存在复制基因对,通过计算进化关系很近的两个ApMKKs的CDS相似性和蛋白相似性发现,CDS相似性大于90%的有7对基因,为此本研究鉴定到小拟南芥MKK基因家族有7对复制基因,分别是ApMKK1-1/1-2、ApMKK2-1/2-2、ApMKK3-1/3-2、ApMKK4-1/4-2、ApMKK5-1/5-2、ApMKK9-1/9-2和ApMKK10-1/10-2,具体信息见表2。而ApMKK6-1和ApMKK7-1没有旁系同源基因,即没有发生复制事件。出乎意料的是,小拟南芥中不存在AtMKK8的直系同源基因,可能在进化中发生了丢失。从近缘物种进化关系远近的角度来分析,盐芥与小拟南芥的亲缘关系最远,特别的是ApMKK3-1/3-2与近缘种MKK的关系较远。图3
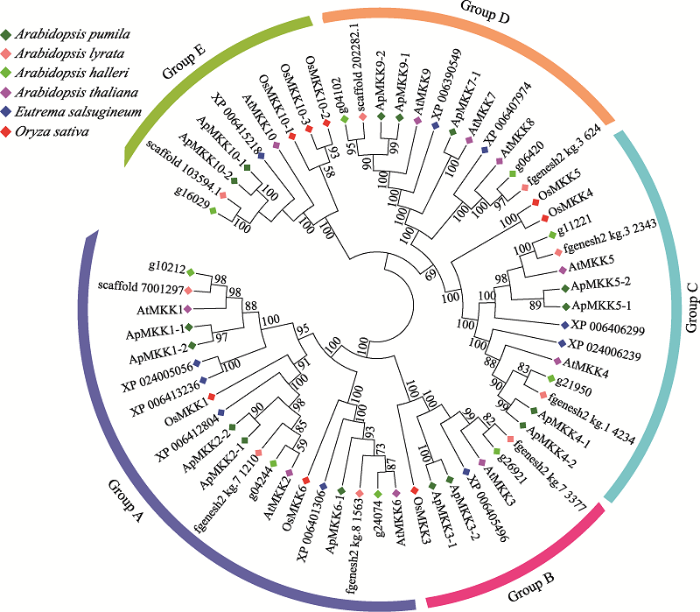 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3小拟南芥和其他物种MKK基因家族系统进化树
借助ClustalX 2.0和MEGA 6.0软件使用邻接法构建系统进化树。基因名称或基因ID前不同颜色的菱形代表不同物种的MKK基因。进化树外围5种不同颜色的弧线分别表示Group A、Group B、Group C、Group D和Group E。
Fig. 3Phylogenetic tree of the MKK gene family in Arabidopsis pumila and other species
图4
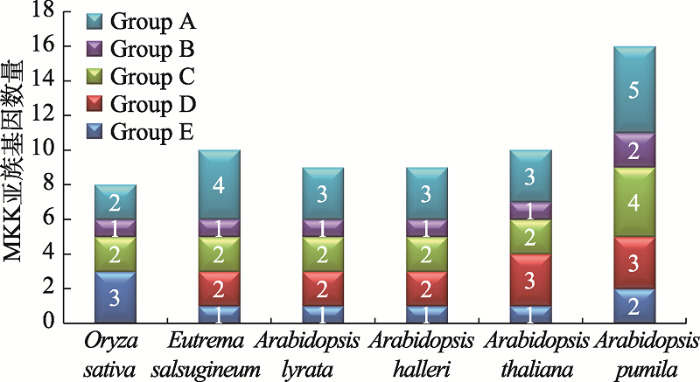 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4小拟南芥和其他物种MKK各亚族基因数量
Fig. 4Number of the MKK subfamily genes in Arabidopsis pumila and other species
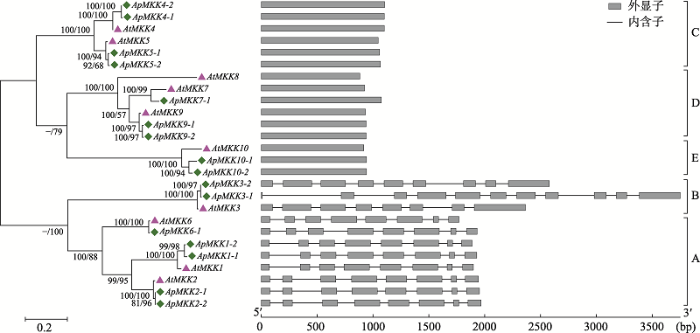
基因结构的差异在基因家族进化中起着重要的作用,可用于系统发育关系的评价[55,56]。通过分析AtMKK和ApMKK的系统发育关系和外显子-内含子分布发现,所有MKK基因被分为5个亚族(Group A、Group B、Group C、Group D和Group E),该分类结果与图3相同,同时观察到相同亚族中的大多数成员具有非常相似的外显子-内含子结构(图5),这种相似性为MKK家族的基因分类、拟南芥和小拟南芥MKK基因家族之间的进化关系提供了证据。通过比较小拟南芥和拟南芥各亚族MKK基因所含的外显子个数,发现Group C、Group D和Group E的MKKs皆只包含1个外显子;Group A的成员包含8个外显子;Group B较为特殊,其中AtMKK3、ApMKK3-1和ApMKK3-2所包含的外显子个数分别为8、11、9个,但共有的8个外显子的大小和分布是一致的,这表明ApMKK和AtMKK同源基因之间的基因结构基本是保守的。此外,不仅在旁系同源基因中观察到类似的基因结构,而且在直系同源基因中也观察到类似的基因结构,这暗示小拟南芥中MKK复制基因对和拟南芥MKK基因在进化上具有相同的起源。
Table 2
表2
表2ApMKK复制基因对CDS相似性和蛋白相似性
Table 2
| 基因1 | 基因2 | CDS相似性(%) | 蛋白相似性(%) |
|---|---|---|---|
| ApMKK1-1 | ApMKK1-2 | 97.27 | 97.46 |
| ApMKK2-1 | ApMKK2-2 | 97.07 | 98.63 |
| ApMKK3-1 | ApMKK3-2 | 97.95 | 98.66 |
| ApMKK4-1 | ApMKK4-2 | 97.83 | 98.91 |
| ApMKK5-1 | ApMKK5-2 | 97.09 | 98.03 |
| ApMKK9-1 | ApMKK9-2 | 96.59 | 99.04 |
| ApMKK10-1 | ApMKK10-2 | 96.07 | 94.90 |
新窗口打开|下载CSV
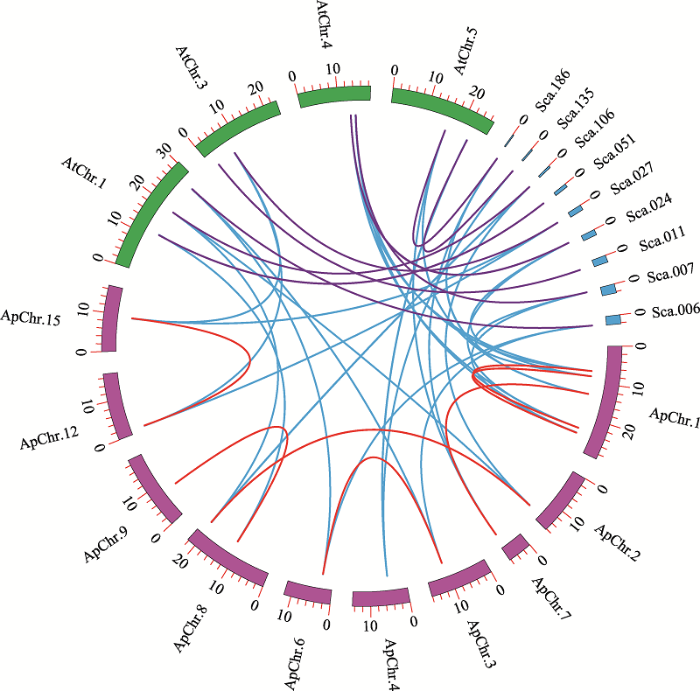
为了进一步研究小拟南芥MKK基因家族的扩张,对小拟南芥、拟南芥和叶芽鼠耳芥的MKK基因进行了共线性分析。结果表明,小拟南芥16个ApMKK基因分散分布于基因组的10条染色体上;另外,共线性分析进一步验证了小拟南芥中7个MKK复制基因对的存在(图6)。ApMKK6-1和ApMKK7-1在小拟南芥中无旁系同源基因,但这两个基因与拟南芥和叶芽鼠耳芥的MKK基因存在共线关系。仔细观察图6发现,染色体1上存在两个复制基因对(ApMKK1-1/1-2和ApMKK2-1/2-2),可能存在串联重复。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5小拟南芥和拟南芥MKK基因家族成员的系统进化树和外显子-内含子结构示意图
借助MEGA6.0构建小拟南芥和拟南芥MKK基因的最大似然树(左图),分支上的数字表示各个分支的支持率(邻接法/最大似然法);利用GSDS软件分析小拟南芥MKK基因的外显子-内含子分布(右图)。
Fig. 5Phylogenetic tree and exon-intron structures of the MKK gene family in Arabidopsis thaliana and Arabidopsis pumila
进化选择的模式可以通过Ka/Ks来估算,Ka/Ks > 1表示正选择,Ka/Ks < 1表示纯化选择,Ka/Ks = 1表示中性选择[49]。7个ApMKK复制基因对的Ka/Ks皆小于1,表明它们都经过了纯化选择(表3)。本研究进一步对MKK基因家族中的复制基因对进行Tajima相对速率测验,以评估复制事件发生后ApMKK复制基因是否加速进化。结果发现,复制基因对ApMKK1-1/1-2之间的进化速率(P < 0.05)发生了统计学意义上的增加,表明这两个复制基因可能存在潜在的功能差异(表4)。
图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6拟南芥、叶芽鼠耳芥和小拟南芥中MKK基因的共线关系
不同颜色的圆弧代表不同物种的染色体和scaffolds,曲线末端指向MKK基因在染色体上的位置。红色曲线代表小拟南芥染色体上分布的MKK复制基因对,按顺时针方向依次是ApChr.1:ApMKK1-2、ApMKK2-1、ApMKK3-2、ApMKK1-1、ApMKK2-2;ApChr.2:ApMKK4-2;ApChr.7:ApMKK3-1;ApChr.3:ApMKK9-1;ApChr.4:ApMKK6-1;ApChr.6:ApMKK9-2;ApChr.8:ApMKK10-2、ApMKK4-1;ApChr.9:ApMKK10-1;ApChr.12:ApMKK5-2;ApChr.15:ApMKK5-1。小拟南芥中的MKK复制基因对由红线连接;拟南芥与其他两种植物的同源基因以蓝色曲线连接;紫色曲线连接拟南芥和叶芽鼠耳芥之间的同源基因对。
Fig. 6Syntenic analysis of MKK genes in Arabidopsis halleri, Arabidopsis thaliana and Arabidopsis pumila
Table 3
表3
表3小拟南芥MKK复制基因对的Ka/Ks比率
Table 3
| 复制基因对 | Ka | Ks | Ka/Ks | 进化选择模式 |
|---|---|---|---|---|
| ApMKK4-2/ApMKK4-1 | 0.0036 | 0.0755 | 0.0478 | 纯化选择 |
| ApMKK5-1/ApMKK5-2 | 0.0075 | 0.0787 | 0.0955 | 纯化选择 |
| ApMKK3-2/ApMKK3-1 | 0.0058 | 0.0735 | 0.0795 | 纯化选择 |
| ApMKK1-2/ApMKK1-1 | 0.0123 | 0.0828 | 0.1485 | 纯化选择 |
| ApMKK2-1/ApMKK2-2 | 0.0084 | 0.1060 | 0.0794 | 纯化选择 |
| ApMKK10-1/ApMKK10-2 | 0.0228 | 0.0992 | 0.2298 | 纯化选择 |
| ApMKK9-1/ApMKK9-2 | 0.0042 | 0.1434 | 0.0294 | 纯化选择 |
新窗口打开|下载CSV
Table 4
表4
表4小拟南芥MKK复制基因对的Tajima相对速率测验
Table 4
| 测试组 | Mt | M1 | M2 | χ2 | P |
|---|---|---|---|---|---|
| ApMKK4-1/ApMKK4-2-AtMKK4 | 347 | 1 | 2 | 0.33 | 0.56370 |
| ApMKK5-1/ApMKK5-2-AtMKK5 | 335 | 3 | 1 | 1.00 | 0.31731 |
| ApMKK3-1/ApMKK3-2-AtMKK3 | 493 | 5 | 2 | 1.29 | 0.25684 |
| ApMKK1-1/ApMKK1-2-AtMKK1 | 325 | 7 | 1 | 4.50 | 0.03389 |
| ApMKK2-1/ApMKK2-1-AtMKK2 | 352 | 3 | 2 | 0.20 | 0.65472 |
| ApMKK9-1/ApMKK9-2-AtMKK9 | 295 | 2 | 1 | 0.33 | 0.56370 |
| ApMKK10-1/ApMKK10-1-AtMKK10 | 253 | 9 | 4 | 1.92 | 0.16552 |
新窗口打开|下载CSV
2.4 小拟南芥MKK基因在不同组织中的表达分析
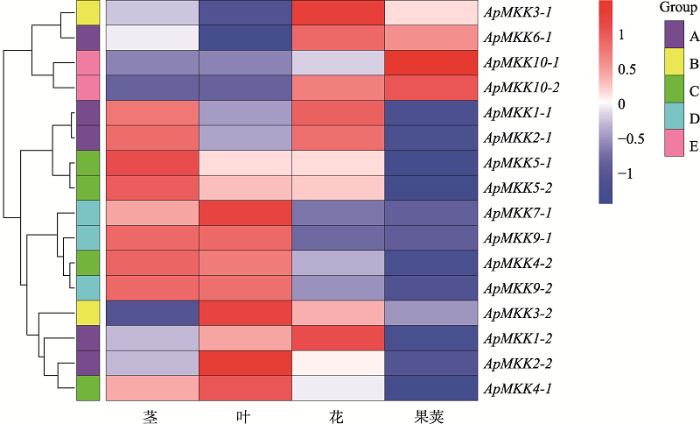
为了深入了解16个ApMKK基因在不同组织中的表达模式,通过R语言分析工具,利用本实验室前期获得的组织转录组数据,将ApMKK基因的表达模式可视化为热图,结果发现小拟南芥16个ApMKK基因在不同组织中皆差异表达且具有组织表达特异性(图7)。4个组织中都有Group A和Group B的ApMKK参与表达;Group C和Group D中ApMKK的表达模式较为特别,仅在茎和叶中高表达;Group E的MKK成员在花和果荚中的表达量较高。另外,ApMKK复制基因的表达模式并非全部一致,较为明显的如ApMKK2-1在茎和花中高表达而ApMKK2-2在叶中高表达,ApMKK3-2在叶中高表达而ApMKK3-1在花中高表达。结果表明,ApMKK既保持了固有的功能保守性,也存在功能分歧,预示小拟南芥可能存在功能进化上的保守性和多样性。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7ApMKK基因在不同组织中的表达图谱
右上角的色度条显示了所有ApMKKs在不同组织中的表达量(RPKM的log2值)变化范围。红色越深,表达量越高;蓝色越深,表达量越低。
Fig. 7Tissue expression profiles of ApMKK genes
2.5 小拟南芥MKK基因在盐胁迫下的表达分析
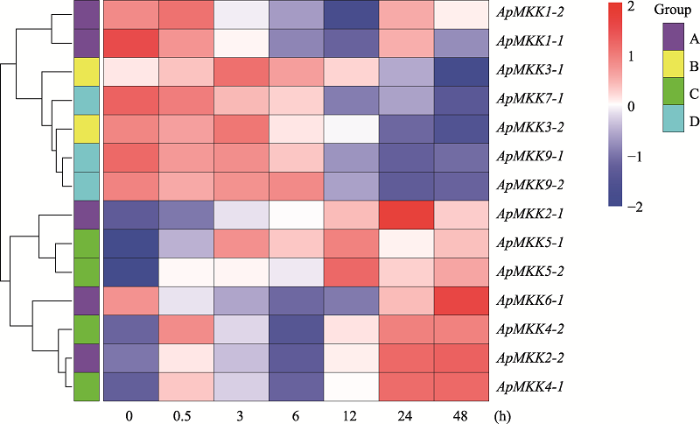
通过分析小拟南芥在盐胁迫不同时间点的转录组数据[40]发现,小拟南芥ApMKK基因家族的16个成员中有14个ApMKK基因差异表达,而Group E的ApMKK10-1和ApMKK10-2在盐胁迫各时间点皆不表达。为了深入了解差异表达的14个ApMAPK基因在250 mmol/L NaCl胁迫不同时间点的表达模式,本研究通过R语言分析工具,利用盐胁迫转录组数据的FPKM值,将ApMKK基因的表达模式可视化为热图。结果显示,Group B和Group D的所有差异表达基因在盐胁迫处理后皆呈现表达下调的趋势,而Group C的所有基因总体上表现为上调表达,较为特殊的是,Group A的部分成员(ApMAPK1-1和ApMAPK1-2)上调表达,部分基因(ApMAPK6-1、ApMAPK2-1和ApMAPK2-2)表达下调,呈现多样的表达模式(图8)。这意味着各亚族ApMKK基因在盐胁迫下具有特异的表达模式。另外,本研究还发现,ApMKK复制基因在盐胁迫不同时间点的表达模式几乎相同,这表明ApMKK复制基因具有一定的功能保守性。图8
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8ApMKK基因在盐胁迫不同时间点的表达图谱
右上角的色度条显示了所有ApMKKs在盐胁迫不同时间点的表达量(FPKM的log2值)变化范围。红色越深,表达量越高;蓝色越深,表达量越低。
Fig. 8Expression profiles of ApMKK genes at different time points under salt stress for Arabidopsis pumila
2.6 小拟南芥MKK基因启动子区的顺式作用元件分析
为了解析小拟南芥MKK基因家族成员的调控模式,本研究进一步分析了ApMKK基因启动子区域的顺式作用元件分布(图9)。结果发现,ApMKK基因家族成员的启动子区除了核心元件外,还包括胁迫和激素响应相关元件,这表明ApMKK基因可能响应多种外界胁迫,即具有功能多样性。另外本研究还观察到,各亚族内大部分复制基因启动子区的顺式作用元件种类不同。复制基因顺式元件种类的差异包含两种情况:一种情况是同源基因A的顺式元件种类包含同源基因B的顺式元件种类(ApMKK1-1/1-2、ApMKK5-1/5-2和ApMKK9-1/9-2),另一种情况是同源基因A和B除了具有共同的顺式元件,还有各自独特的顺式元件(ApMKK2-1/2-2、ApMKK3-1/3-2、ApMKK4-1/4-2和ApMKK10-1/10-2)。以上结果表明,这些旁系同源基因(复制基因对)可能存在不同的调控模式和潜在的进化命运。图9
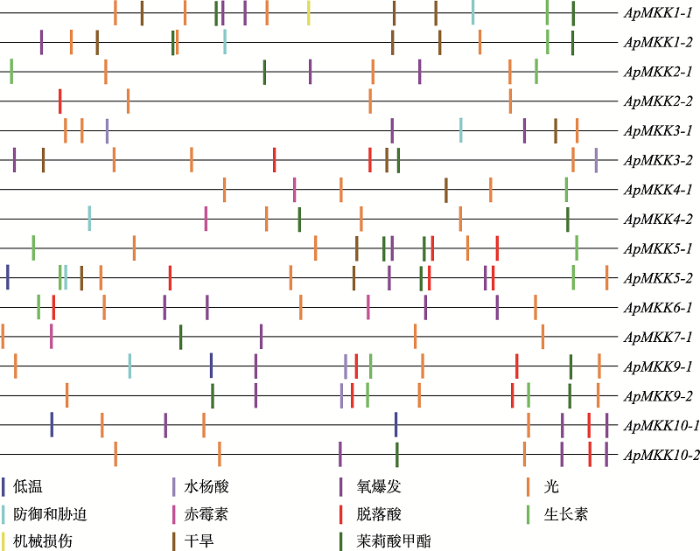 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9ApMKKs启动子区的顺式作用元件分布
Fig. 9Distribution of cis-elements in the promoter region of ApMKK genes
3 讨论
随着一系列植物基因组测序的完成,许多植物中的MAPK级联成员被注释,而且陆续开展了MAPK级联通路上3个基因家族的全基因组鉴定和功能分析。MAPK级联蛋白最初在模式植物拟南芥中发现,拟南芥中MAPKKK、MAPKK和MAPK基因家族分别包含80、10、20个成员[12]。截止目前,对MAPK级联的功能,特别是作为MAPK级联中间节点的MKK的认识还比较有限。除拟南芥外,目前对于MKK基因家族研究比较深入的还有棉花(Gossypium hirsutum) (11)[7]、油菜(Brassica napus)[53]、黄瓜(Cucumis sativus)[54]、大麦(Hordeum vulgare)[57]、番茄(Solanum lycopersicum)[58]、苹果[59]、玉米(Zea mays)[60]、二穗短柄草(Brachypodium distachyon)[61]和水稻[62]等,这些植物分别包含11、7、6、6、5、9、8、12、8个MKK基因成员。本研究从小拟南芥基因组中共鉴定出16个ApMKK基因,数量明显多于其他众多植物中的MKK基因,而且小拟南芥中Group A、B、C、D、E各亚族的ApMKK基因个数皆多于近缘物种,其中Group B、C亚族的ApMKK基因数量是近缘物种的两倍。这表明小拟南芥的MKK基因家族发生了明显的扩张。本文从小拟南芥中鉴定出7对复制基因,从Ka/Ks分析结果来看,这些复制基因都经历了纯化选择。研究表明,植物MKK基因家族的Group B,C,D,E四个亚族的MKK基因在大多数植物中是单拷贝或低拷贝,而Group A的MKK基因却发生多次复制事件,产生多拷贝基因[13]。但本文研究发现,小拟南芥各亚族的MKK都存在多拷贝基因,该结果与之前的报道不相符,可能是小拟南芥发生了大范围的全基因组复制事件(whole genome duplications, WGD)。根据Hoffmann等[63]研究结果,结合本实验室前期开展的全基因组测序和组装分析表明,小拟南芥是二倍体植物(2n=32);小拟南芥和近缘物种的系统进化分析发现,小拟南芥近期发生过一次染色体复制事件(数据未公开)。因此,小拟南芥MKK基因家族中复制基因的出现可能是小拟南芥发生基因组扩张形成的。
基因复制是进化过程中产生新基因的基本来源,为基因的成功进化提供了新的机会,而全基因组复制是进化的一个重要特征[64]。MKK基因家族在生长发育和响应逆境胁迫过程中发挥重要作用。在MKK基因家族成员数量方面,拟南芥、小拟南芥和琴叶拟南芥中分别有10、16、9个MKK基因,即小拟南芥中MKK基因的数目是琴叶拟南芥中的1.78倍,琴叶拟南芥中MKK基因的数目是拟南芥中的0.9倍,小拟南芥中MKK基因的数目是拟南芥中的1.6倍。小拟南芥的基因组约283 Mb (数据未公开),大约是琴叶拟南芥基因组(207 Mb)[65]的1.37倍,而琴叶拟南芥的基因组大约是拟南芥(125 Mb)[45]的1.66倍,小拟南芥的基因组大约是拟南芥基因组的2.26倍。这3个物种中MKK基因的数目与基因组的大小不成正比,推测可能由于进化过程中环境的改变导致小拟南芥中发生了全基因组复制或特定基因家族的扩张[66]。须弥芥(Crucihimalaya himalaica)是生长在青藏高原上一种特殊环境植物,比较基因组分析发现须弥芥基因组中抗病相关的基因家族发生了明显缩减,可能与青藏高原病原菌较少有关;另外,须弥芥中抗紫外线等的基因家族发生了扩张[67]。大多数植物中至少发生过一次WGD,然而在拟南芥中至少发生了两次WGDs:大约在60~70百万年前和23~43百万年前[68,69]。WGD的扩增结果是全基因组扩增到两倍[64,68]。自从WGD事件以来,植物在漫长的进化过程中会重新移除冗余基因拷贝(如AtMKK6和AtMKK7在小拟南芥中分别只有一个直系同源基因),但也会保留一些重复的拷贝,这取决于它们对环境的适应,这也是植物物种间特定基因家族成员数量存在差异的原因[68,70]。出人意料的是,小拟南芥中没有AtMKK8的同源基因,可能在进化过程中发生了选择性丢失。
分析小拟南芥和拟南芥MKK基因家族成员的motif分布和外显子-内含子结构发现,小拟南芥MKK基因家族的各亚族成员都具有其特有的motif组成和基因结构,即相同亚族的成员具有相似的motif组成和基因结构。另外,ApMKK基因家族和AtMKK基因家族的大部分直系同源基因的motif组成和外显子-内含子也相似。旁系同源基因和直系同源基因中类似的基因结构,暗示了小拟南芥和拟南芥中的MKK基因在进化上具有相同的起源。然而Group B中AtMKK3、ApMKK3-1和ApMKK3-2的外显子个数不尽相同,分别包含8、11、9个外显子(共有的8个外显子的大小和分布是一致的),而且Group B成员的motif 2和motif 6的分布顺序与其它亚族MKK不同。除ApMKK3-1/3-2与AtMKK3的基因结构不同外,ApMKK3-1和ApMKK3-2之间的基因结构也存在一定差异。这表明小拟南芥Group B 中MKKs的基因结构和motif分布发生了大的分歧,也预示Group B的MKK基因在功能进化上的多样性。ApMKK3-1和ApMKK3-1的组织表达模式差异正好印证了这一点。值得注意的是,Group E中ApMKK10-1/10-2和AtMKK10的S/T-xxxxx-S/T保守区都发生了突变。目前,关于MKK8和MKK10的功能信息较少,可能是由于它们的转录水平较低,或是因为MKK10活性位点的突变而没有发挥生物学功能[61]。本研究通过分析ApMKK基因在不同组织和盐胁迫下的表达情况表明,ApMKK10-1和ApMKK10-2在小拟南芥果荚中高表达,但在盐胁迫不同时间点都未检测到二者的表达,这与之前报道的结果相符。然而也有报道显示,OsMKK10-2在水杨酸(salicylic acid, SA)信号介导的防御机制中起关键作用[71],这可能与不同物种的进化差异有关。
ApMKK基因参与了小拟南芥不同组织的发育,皆显示出组织表达特异性。本研究发现,ApMKK1-1/ 1-2、ApMKK3-1、ApMKK6-1与它们的直系同源基因AtMKK1、AtMKK3和AtMKK6皆在花中高表达[61];另外,小拟南芥中的部分旁系同源基因的表达模式相同,如ApMKK4-1/4-2和ApMKK9-1/9-2在茎和叶中表达水平较高,ApMKK5-1/5-2在茎中高表达。这些发现表明,MKK旁系同源基因间和直系同源基因间皆存在一定的功能保守性。与此同时,ApMKK4-1/ 4-2在茎和叶中的表达水平较高,而它们的直系同源基因AtMKK4在花和果荚中有较高的表达量[61],这表明直系同源基因间也存在功能分歧。值得关注的是,小拟南芥MKK复制基因对的表达模式。基因复制是提高植物对新环境适应性的主要驱动因素,其引起的功能多样性可能导致基因表达水平和蛋白质性质的改变。本研究发现,部分旁系同源基因的表达模式存在很大差异,如ApMKK2-1在茎和花中高表达而ApMKK2-2在叶中高表达,ApMKK3-2在叶中高表达而ApMKK3-1在花中高表达,表明这些复制基因可能在不同的信号转导途径中发挥作用或者一些复制基因在进化过程中获得新的功能[53]。分析Tajima相对速率结果发现,小拟南芥中的一对复制基因ApMKK1-1/1-2在复制事件发生后,其中一个基因经历了加速进化,这预示着小拟南芥MKK基因的新功能化和亚功能化的产生。进而分析小拟南芥MKK基因组织表达热图和启动子区的顺式作用元件分布发现,ApMKK1-1和ApMKK1-2的表达模式不同:ApMKK1-1在叶和花中高表达,而ApMKK1-2在茎和花中高表达;且二者顺式元件的种类也有所不同:ApMKK1-1要比ApMKK1-2多一类机械损伤顺式元件(wound)。以上分析表明,尽管小拟南芥MKK复制基因间具有高的CDS和氨基酸相似性,但也存在一定的功能分歧。与组织表达模式不同的是,MKK复制基因在盐胁迫不同时间点的表达模式几乎相同,暗示着在不同的生物学过程中,小拟南芥MKK复制基因的表达模式组合可能存在一定差异。本文不足的地方在于小拟南芥的组织表达中没有涉及根的表达信息,后期会展开小拟南芥各生长发育时期的不同组织转录组测序,进而弥补本实验的不足。
MKK是MAPK级联组分中成员最少的一个基因家族,为此同一个MKK或相同MKK级联可能响应多种逆境胁迫。MEKK1-MKK4/MKK5-MPK3/MPK6级联赋予拟南芥对细菌和真菌病原体的抗性[72]。另外有研究发现,MKK4/5-MPK3/6负调控冷胁迫抗性[17,73]。近期又有研究报道MKK4/MKK5-MPK3/ MPK6在生长素促进侧根形成中是不可或缺的[74]。AtMKK5-AtMPK6级联途径也参与ABA应答[75]。小拟南芥生长在新疆干旱、高温的盐碱地环境,有大量的抗逆基因值得挖掘,而小拟南芥MAPK级联作为响应外界不利环境的信号转导途径,可帮助人们进行抗逆基因的初探。本研究对MAPK级联中的MKK基因家族进行了生物信息学和表达特征分析,后期将陆续对MAPK级联中另外两个基因家族展开研究,为解析小拟南芥的抗逆机制奠定基础。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
