 ,1,2,3,4, 刘媛媛
,1,2,3,4, 刘媛媛 ,1,2,3,41.
,1,2,3,41. 2.
3.
4.
The role of Bmal1 in neuronal radial migration and axonal projection of the embryonic mouse cerebral cortex
Fang Li1, Qingyun Huang2, Sijia Liu1,2,3,4, Zhongxin Guo1,2,3,4, Xinxin Xiong1, Lin Gui2, Huijuan Shu1, Shaoming Huang1,4, Guohe Tan ,1,2,3,4, Yuanyuan Liu
,1,2,3,4, Yuanyuan Liu ,1,2,3,41.
,1,2,3,41. 2.
3.
4.
通讯作者:
责任编辑: 王晓群
收稿日期:2019-05-5修回日期:2019-05-28网络出版日期:2019-06-20
| 基金资助: |
Received:2019-05-5Revised:2019-05-28Online:2019-06-20
| Fund supported: |
作者简介 About authors
李芳,硕士研究生,专业方向:人体解剖与组织胚胎学E-mail:1689795367@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (612KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李芳, 黄青芸, 刘斯佳, 郭忠信, 熊欣欣, 桂林, 束会娟, 黄绍明, 谭国鹤, 刘媛媛. Bmal1对小鼠胚胎期皮层神经元放射状迁移和轴突投射的影响[J]. 遗传, 2019, 41(6): 524-533 doi:10.16288/j.yczz.19-123
Fang Li, Qingyun Huang, Sijia Liu, Zhongxin Guo, Xinxin Xiong, Lin Gui, Huijuan Shu, Shaoming Huang, Guohe Tan, Yuanyuan Liu.
哺乳动物生物钟基因Bmal1编码蛋白BMAL1含有bHLH (basic helix-loop-helix)- PAS (PER-ARNT- SIM)结构域,该蛋白是生物钟转录、翻译反馈环中的核心部分,也是哺乳动物昼夜节律起搏点不可缺少的组件[1]。CLOCK是BMAL1的一个重要分子伴侣,也具有类似的bHLH 和 PAS 结构域[2]。BMAL1与CLOCK结合成异源二聚体,激活3种周期基因(Per1、Per 2和Per 3)和2种隐花色素基因 (Cry1和Cry2)的表达,PER 和CRY蛋白形成分子复合体后进入细胞核,进而抑制BMAL1/CLOCK异源二聚体的活性,构成了反馈性的负向环路[3,4]。在生物钟调节过程中,BMAL1是核心的转录因子,该基因敲除小鼠(Bmal1-/-)会丧失昼夜节律。有研究表明,BMAL1还与许多脑内损伤现象有关。例如,新生大鼠的松果体中BMAL1蛋白在缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD) 48 h后表达会显著升高[5];Bmal1缺乏会影响大脑的氧化还原稳态,与神经变性的症状产生以及学习记忆功能衰退有关[6,7];临床上帕金森病患者外周血中Bmal1和Bmal2基因的相对表达水平明显降低[4];最新研究还发现,在5周龄小鼠中敲除Bmal1后,小鼠脑内海马区的神经祖细胞增殖能力增强,这可能是由于细胞周期失调所引起的[8];在成年(10~15周龄)小鼠中敲除Bmal1基因,海马神经祖细胞池也显著减少,并且神经祖细胞向神经胶质细胞谱系的转移分化增多[9]。这些研究结果说明,Bmal1对神经祖细胞的有丝分裂活性有一定的促进作用,在早期神经元形成中可能起着重要的调节作用[9,10]。因此,Bmal1可能会在神经发育过程中发挥一定的潜在作用。本研究以小鼠大脑皮层发育为研究模型,深入探索Bmal1基因在胚胎发育期神经元放射状迁移和轴突投射中的具体作用,以期增进人们对大脑皮层发育分子调节机制的新认识。
1 材料与方法
1.1 小鼠饲养
C57BL/6小鼠和ICR小鼠均由湖南斯莱克景达实验动物有限公司提供,在广西医科大学实验动物中心SPF级屏障系统内繁育。用于实验的母鼠以见阴栓的当天记为胚胎0.5 d即E0.5,根据实验需求统计不同天数用于后续实验。新生小鼠的年龄按照出生当天记为P0,1月龄小鼠记为1 M,小鼠的饲养标准为每笼5只,遵循12 h光照与12 h黑暗循环,自由饮食,室温25±1℃。所有涉及动物的实验均在广西医科大学实验动物中心动物管理和使用委员会许可下进行,并遵循广西医科大学实验动物中心的相关伦理学规则。
1.2 质粒构建
本研究所使用的Bmal1敲减质粒和携带EGFP的Bmal1全长质粒均由上海泰儿图生物科技有限公司合成。含Bmal1全长基因序列的质粒构建:首先在GenBank中查询小鼠Bmal1全长基因(GenBank登录号:NM_001243048.1)序列,直接合成该基因。进一步通过重叠PCR扩增将Bmal1基因序列与P2A-EGFP片段连接,经NheⅠ和XhoⅠ内切酶酶切后将该片段连入pcDNA3.1(+)载体。Bmal1敲减质粒构建:针对小鼠Bmal1的靶向干扰序列构建短发夹环 RNA (shRNA),然后克隆到pSUPER-basic载体,将无意序列构建的质粒(Bmal1-shRNA-Scr)作为阴性对照。质粒构建所用引物见表1。Table 1
表1
表1 本研究所用引物信息
Table 1
| 引物 | 序列(5°→3°) | 用途 |
|---|---|---|
| Bmal1-shRNA-1# | F: GATCCCCGGAAGGATCAAGAATGCAATTCAAGAGATTGCATTCTTGATCCTTCCTTTTTA | 质粒构建 |
| R: AGCTTAAAAAGGAAGGATCAAGAATGCAATCTCTTGAATTGCATTCTTGATCCTTCCGGG | ||
| Bmal1-shRNA-2# | F: GATCCCCGCAACAGGCCTTCAGTAAATTCAAGAGATTTACTGAAGGCCTGTTGCTTTTTA | 质粒构建 |
| R: AGCTTAAAAAGCAACAGGCCTTCAGTAAATCTCTTGAATTTACTGAAGGCCTGTTGCGGG | ||
| Bmal1-shRNA-3# | F: GATCCCCGCGGAGGAAATCATGGAAATTCAAGAGATTTCCATGATTTCCTCCGCTTTTTA | 质粒构建 |
| R: AGCTTAAAAAGCGGAGGAAATCATGGAAATCTCTTGAATTTCCATGATTTCCTCCGCGGG | ||
| Bmal1引物 | F: GTGCCACCAACCCATACA | RT-PCR扩增 |
| R: TCCCTCGGTCACATCCTAC | ||
| Gapdh引物 | F: CCCCAATGTATCCGTTGTG | RT-PCR扩增 |
| R: CTCAGTGT AGCCCAGGATGC |
新窗口打开|下载CSV
针对小鼠Bmal1的靶向干扰序列信息如下:
Bmal-shRNA-1#:5′-GGAAGGATCAAGAATGCAA-3′;
Bmal1-shRNA-2#:5′-GCAACAGGCCTTCAGTAAA-3′;
Bmal1-shRNA-3#:5′-GCGGAGGAAATCATGGAAA-3′;
Bmal1-shRNA-scr:5′-CGCTGAGTACTTCGAAATGTC-3′。
1.3 细胞培养与转染
使用含10%胎牛血清(FBS)的细胞培养基DMEM (Dulbecco modified eagle’s medium)培养HEK293细胞(由中国科学院上海生物化学与细胞生物学研究所提供),并使用Lipofectamin 3000试剂盒(Thermo Fisher Scientific公司,美国)进行细胞脂质体转染。以12孔细胞培养盘中的单个孔为例,具体步骤如下:在A管中加入50 μL Opti-MEM (OMEM),混入0.5 μg携带EGFP的Bmal1全长质粒和0.5 μg Bmal1 shRNA质粒以及2 μL P3000,在B管中加入50 μL OMEM,混入1.5 μL 脂质体(Lipo3000),静置5 min,将A、B两管的溶液混合,室温静置15 min;将培养细胞的12孔培养盘从培养箱中取出,直接滴入混匀后的AB液,于37℃培养箱继续培养;24 h后用显微镜进行细胞图像采集,然后收集细胞提取细胞总蛋白。1.4 Western blot
HEK293细胞脂质体转染24 h后收集细胞总蛋白,利用Western blot验证Bmal1 RNAi的敲减效率。首先将细胞置于冰上,弃去培养液,PBS快速漂洗两次,加入200 μL的2×蛋白上样缓冲液裂解30 min,收集于1.5 mL EP管中,95℃变性15 min。取20 μL样品用10%的SDS-聚丙烯酰胺凝胶电泳(Bio-Rad)分离等效变性样品,并在PVDF膜(Millipore)上进行印迹。室温封闭1 h,进行一抗(Rabbit anti-GFP antibody,1:2000,美国Sigma公司;GAPDH Antibody (V-18) HRP,1:20000,美国Santa Cruz Biotechnology公司;)和二抗(HRP-conjugated goat anti-rabbit antibodies,1:50000,美国Santa Cruz Biotechnology公司)孵育,ECL反应液显影,全自动成像系统扫描成像。1.5 RNA提取、RT-PCR和Real-time PCR
收集不同发育期C57 BL/6小鼠的皮层脑组织 ( E12、E14、E16、E18、P0、P3、P7、P14、1M和2M)和P7时C57 BL/6小鼠的各脏器组织(大脑、小脑、脊髓、心、肝、肺、肾、胃、皮肤、肌肉、大肠和小肠),称量后立即加入Trizol,冰浴5 min后匀浆,加入氯仿震荡15 s,冰上静置10 min,4℃离心15 min。取上清,加入等体积的异丙醇,混匀,冰浴10 min,再次4℃离心15 min。离心后弃上清,75%酒精漂洗沉淀2次,室温下晾干,以30~50 μL DEPC水溶解RNA,测定浓度,-80℃保存。以提取的RNA为模板,利用M-MLV反转录试剂盒(Thermo Fisher Scientific公司,美国)反转录成cDNA。通过RT-PCR扩增,检测Bmal1在小鼠不同发育期的皮层脑组织中的表达情况和Bmal1在P7小鼠各组织器官中的表达情况。扩增引物由桑尼公司(上海)合成,引物序列信息见表1。
以Gapdh作为内参基因,经2%琼脂糖凝胶电泳,Tanon-2500凝胶成像系统进行图像采集和分析。
根据SYBR Green I Premix Ex Taq试剂盒(TaKaRa公司,日本)说明书对上述反转录合成的cDNA通过Real-time PCR扩增,检测Bmal1在小鼠不同发育期的皮层脑组织中的表达情况。PCR扩增后,进行溶解曲线分析,以判断是否存在非特异性扩增和引物二聚体。PCR扩增结果以2M为对照组进行标准化,使用Prism 6.0软件进行作图分析。
1.6 胚胎电转
小鼠子宫内胚胎电转实验参考文献[11]并有所修改。实验所用孕鼠为怀孕14.5 d (E14.5)的ICR孕鼠,质粒为CAG-GFP质粒(0.5 μg/μL,由中国科学院神经科学研究所提供)和Bmal1 shRNA质粒(1.5 μg/μL)。用于标记的0.1%固绿 FCF购自美国Sigma公司、ECM830胚胎电转仪购自美国BTX公司。程序为50 ms、30 V电脉冲,5次,间隔1 s。手术过程中不断使用预热的0.85%无菌生理盐水润洗胚胎和手术切口,以保证胚胎始终湿润。电转完成后,将胚胎重新放回母鼠腹腔内,缝合手术切口。术后孕鼠应注意保暖。为了降低致死率及流产率,整个过程须在40 min内完成。1.7 免疫荧光染色
分别取E18.5和P3时电转后的小鼠脑组织,浸泡在4%多聚甲醛中固定过夜。在恒冷式冰冻切片机上进行连续冠状冰冻切片,厚度为50 μm,在0.2% Triton X-100的封闭液中室温孵育1 h。分别用一抗(Rabbit anti-GFP antibody,1:2000,美国Sigma公司;)和二抗(Alexa Fluor?488 donkey anti-Rabbit IgG (H+L),1:2000,美国Life Technologies公司)进行孵育,用Hoechst 33342 (终浓度2 μg/mL,上海碧云天生物公司)标记细胞核,室温孵育10 min,PBS漂洗3遍 (每次10 min),贴片,90%甘油进行封片,使用Thermo Fisher EVOS FL AUTO 2荧光显微镜下观察拍照。1.8 图像采集与统计分析
经过脂转的HEK293细胞与脑片免疫荧光染色结果利用显微镜成像,使用单张扫描法采集图像数据。皮层神经元胞体数量以及胼胝体的轴突长度用ImageJ软件进行分析。收集的数据用Prism 6.0软件制图,以SPSS 20.0软件进行分析。所有统计分析都遵循随机双盲原则。数据以均数(Mean)±标准误(SEM)表示,各组间平均值差异程度用t检验(Student’s t test)或者One-way ANOVA进行检验分析,*P<0.05表示有统计学差异,**P<0.01表示统计学差异显著,***P<0.001表示统计学差异极显著。2 结果与分析
2.1 Bmal1在小鼠大脑皮层发育过程中高表达
为研究Bmal1在大脑皮层发育过程中的潜在作用,本研究首先利用RT-PCR扩增P7小鼠各组织器官Bmal1基因,分析Bmal1在P7小鼠各组织器官中的表达情况。结果显示,Bmal1在大脑、小脑、脊髓、心脏、肝脏、肺、肾、胃、皮肤、肌肉、大肠和小肠中均有不同程度的表达,其中在大脑中的表达量相对较高(图1A)。进一步通过RT-PCR扩增不同发育阶段小鼠(E12、E14、E16、E18、P0、P3、P7、P14、1M和2M)脑组织Bmal1基因,分析该基因在脑内的表达规律。结果发现,Bmal1在E12已有表达,在P3时期表达水平达到高峰,P14后Bmal1基因表达明显降低,在成年期表达相对稳定(图1B)。本研究进一步通过Real-time PCR方法检测了Bmal1在小鼠不同发育期的皮层脑组织中的表达情况,分析结果与RT-PCR结果一致(图1C)。图1
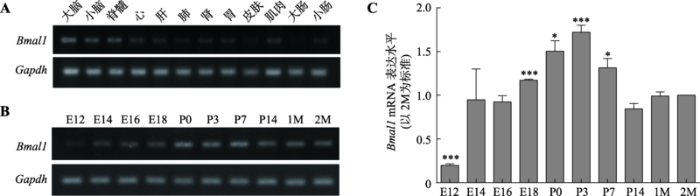 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1发育期小鼠脑内Bmal1基因表达情况
A:RT-PCR检测Bmal1 mRNA在P7小鼠各脏器组织中的表达;B:RT-PCR检测Bmal1 mRNA在不同发育阶段小鼠脑组织中的表达;C:Real-time PCR检测Bmal1 mRNA在不同发育阶段的表达水平。数据以平均值±S.E.M表示,n=3;*P<0.05 表示与对照组2M相比有统计学差异,***P<0.001 表示与对照组2M相比统计学差异极显著。
Fig. 1Expression of Bmal1 in the developing mouse brain
以上结果说明Bmal1在发育早期脑内呈现一过性高表达,提示Bmal1在脑内的功能可能存在发育相关性,并在脑发育的特定阶段中发挥潜在作用。
2.2 Bmal1 shRNAs质粒的敲减效率
为进一步探究Bmal1在发育期脑内的具体作用,本研究采用Bmal1的短发夹环 RNA (shRNA)敲减Bmal1基因,并利用HEK293细胞脂质体转染验证3条Bmal1 shRNA质粒的敲减效率。Western blot结果显示,Bmal1-shRNA-1#和Bmal1-shRNA-2#质粒的敲减效率明显,而Bmal1-shRNA-3#质粒敲减效果不明显(图2A)。与对照组相比,Bmal1-shRNA-1#和Bmal1-shRNA-2#敲减组GFP荧光强度明显降低(图2B),而Bmal1-shRNA-3#敲减组荧光亮度无明显差异,这些结果表明本研究所构建的Bmal1-shRNA- 1#和Bmal1-shRNA-2#干扰质粒能够有效地降低细胞内Bmal1基因的表达。图2
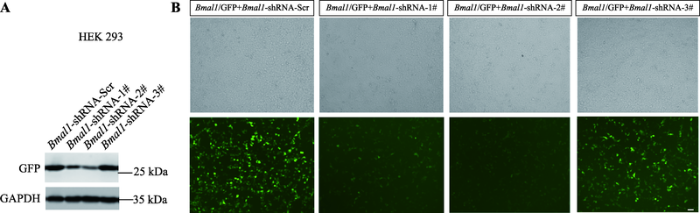 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2Bmal1 shRNAs质粒敲减效率
A:Western blot方法检测HEK293细胞脂转后Bmal1 shRNA的敲减效率;B:通过观察荧光强度检测HEK293细胞脂转后Bmal1 shRNA的敲减效率。标尺=55 μm。
Fig. 2Plasmid knockdown efficiency of Bmal1 shRNAs
2.3 降低Bmal1基因表达延缓了胚胎发育期皮层神经元的放射状迁移
为在胚胎期快速有效地干预Bmal1基因的表达,本研究采用小鼠子宫内胚胎电转技术将Bmal1基因的各个shRNA干扰质粒和GFP蛋白质粒(CAG-GFP质粒)共同注射到E14.5胎鼠的侧脑室,皮层电转位置如图3A所示。在直流电场作用下,这些质粒DNA转入胎鼠大脑皮层的室管膜周围细胞,通过观察表达GFP荧光的神经元位置及数量来评估Bmal1基因的表达变化对神经元放射状迁移的具体影响。结果显示,E18.5时对照组小鼠(电转Bmal1- shRNA-Scr)的大脑皮层内,皮质板区(CP)有大量表达GFP的细胞,说明神经元可以顺利迁移(图3,B和C);Bmal1-shRNA-1# 质粒与GFP质粒共转,结果显示小鼠脑内表达GFP荧光的细胞主要集中于大脑皮层的中间区(IZ)和脑室及脑室下区(VZ/SVZ),而在CP区只有少量神经元迁移到位(图3,B和C),说明神经元迁移发生障碍;当转入Bmal1-shRNA-2#质粒时,仍有大部分神经元停留在IZ和VZ/SVZ区;而转入Bmal1-shRNA-3#质粒对Bmal1进行干扰后,表达GFP荧光的细胞位置相比对照组没有明显差异(图3,B和C)。图3
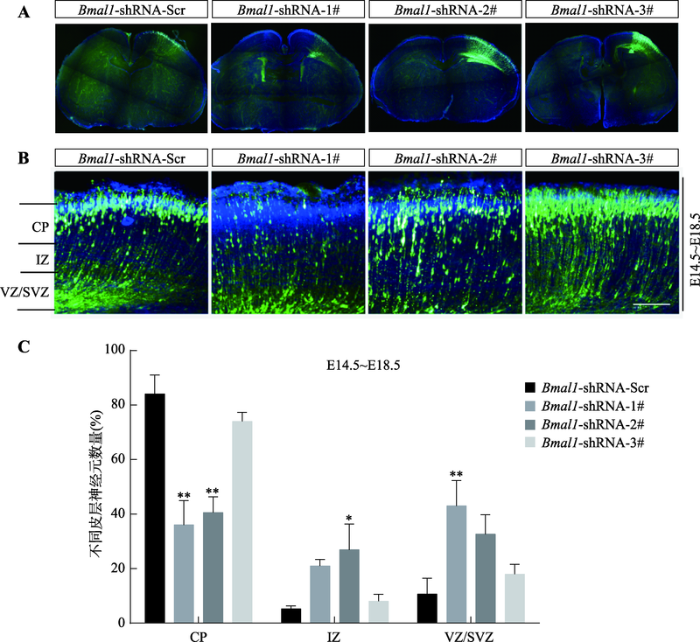 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3Bmal1基因表达下调对皮层神经元放射状迁移的影响
A:观察子宫内胚胎电转实验具体皮层电转位置。B:子宫内胚胎电转实验观察敲减Bmal1对E18.5小鼠神经元迁移的影响。切片用Hoechst 33324(蓝色)染色,标记相应皮层;CP:皮质板区;IZ:中间区;VZ:脑室;SVZ:脑室下区;标尺=125 μm。C:每个区域中 GFP 阳性细胞所占总阳性细胞百分比统计图。结果以平均值±S.E.M表示;每个发育阶段收集3只小鼠脑片;*P<0.05表示与Bmal1-shRNA-Scr组相比有统计学差异,**P<0.01表示与Bmal1-shRNA-Scr组相比统计学差异显著。
Fig. 3Effect of down-regulation of Bmal1 gene expression on radial migration of cortical neurons
为明确Bmal1对神经元放射状迁移的具体影响,本研究用Bmal1-shRNA-2#质粒与CAG-GFP质粒进行小鼠子宫内胚胎共电转实验,然后对电转后P3时期的幼鼠进行灌注切片继续观察,延长实验观察时间。结果显示:在胚胎期对Bmal1进行敲减,P3时shRNA-Scr组和shRNA-2#组的神经元大部分已迁移到Ⅱ-Ⅲ层(图4A),其中在Ⅱ-Ⅲ层中,shRNA-Scr组带有GFP荧光的细胞数目占97.7%,shRNA-2#组为88.6%,两组相比P值为0.15;在Ⅳ-Ⅵ层中,shRNA-Scr组带有GFP荧光的细胞数目占2.2%,shRNA-2#组为11.1%,两组相比P值为0.16;在VZ/SVZ中,shRNA-Scr 组带有GFP荧光的细胞数目占0.18%,sRNA-2#组为0.31%,两组相比P值为0.7 (图4B)。
图4
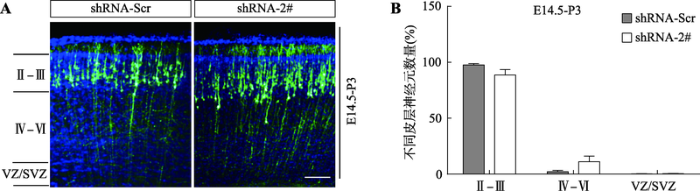 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4Bmal1基因表达下调对P3期皮层神经元放射状迁移的影响
A:子宫内胚胎电转实验观察敲减Bmal1对P3小鼠神经元迁移的影响(标尺=125 μm);B:每个区域中 GFP 阳性细胞所占总阳性细胞百分比的统计图。每组样本数量n=3,结果以平均值±S.E.M表示。
Fig. 4Effects of down-regulation of Bmal1 expression on radial migration of cortical neurons in the P3 stage
综合以上研究结果,在胚胎早期敲减Bmal1,造成了皮层神经元放射状迁移发生延缓。
2.4 Bmal1表达下调影响了对侧大脑半球胼胝体的轴突生长
在小鼠大脑胼胝体系统的正常发育模式中,Ⅱ-Ⅲ层的锥体神经元将轴突投射到中线和对侧大脑皮层,形成胼胝体,同样这些神经元的胼胝体投射也具有层和区域特异性[12,13]。为研究Bmal1与小鼠大脑胼胝体轴突投射的关系,本研究利用小鼠子宫内胚胎电转方法,将Bmal1 shRNA质粒与CAG- GFP质粒共同转入E14.5胎鼠的侧脑室,然后在P3进行灌注取脑,经冠状切片和免疫荧光染色。结果发现,Bmal1敲减后胼胝体轴突向对侧投射的长度变短(图5A),其中shRNA-Scr组平均长度为6294.76 μm,shRNA-2#组平均长度为3657.3 μm,两组相比P值为0.006 (图5B)。这些数据表明,在大脑发育过程中,Bmal1对于胼胝体内轴突的生长和投射是必需的。图5
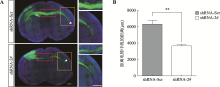 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5敲减Bmal1基因对胼胝体轴突投射的影响
A:子宫内胚胎电转实验观察敲减Bmal1对胼胝体轴突投射的影响。箭头表示轴突生长的末端,右侧是左侧方框区域的放大图,标尺= 450 μm。B:轴突末端距离电转中线的距离。数据以平均值±S.E.M表示,**P<0.01 表示与shRNA-Scr组相比统计学差异显著。
Fig. 5Effects of knockdown the Bmal1 gene on axonal projection of corpus callosum
3 讨论
大脑皮层发育是脑行使高级认知功能的基础,皮层发育异常会引起不同程度的后果,甚至导致严重的神经系统疾病以及精神类疾病发生,如大脑发育畸形、智力发育障碍、癫痫等[14,15]。作为大脑发育的关键环节,神经元放射状迁移及胼胝体轴突正常投射显得尤为重要。BMAL1是体内重要的生物钟节律因子之一,最新研究发现Bmal1基因不仅在调控生物的昼夜节律中发挥一定作用,而且还可以通过调节细胞的有丝分裂活性从而影响海马神经祖细胞增殖[16],这提示Bmal1基因与神经发育之间具有潜在的联系,但是该基因在胚胎期神经系统发育过程中的作用仍不清楚。本研究发现Bmal1在发育期小鼠的各脏器组织中都有表达,但在大脑中表达相对最为显著,提示Bmal1在大脑发育的过程中可能起着特定的作用。在大脑皮层发育过程中,首批皮质投射神经元在E11.5时开始出现,而后迁移形成新生的皮质板区,继而发展成出生后大脑新皮质的第Ⅱ-Ⅵ层[17],本研究发现,Bmal1从E12开始就已经在脑内表达,在P3时期的脑内达到表达高峰,至P7时仍有很高的表达,而此阶段也正是大脑皮层神经元放射状迁移以及胼胝体投射神经元轴突生长的关键时期。这提示,Bmal1基因可能在大脑发育过程中皮层神经元的放射状迁移以及胼胝体神经元轴突投射中发挥着重要的作用。
大脑皮层的发育是一个复杂且精细的过程,在正常情况下,这种过程受多种信号通路协同调控以及细胞骨架的动态平衡来完成[18],这对于后续神经环路以及神经系统功能的正常发挥起着重要作用。大量研究表明,在细胞分裂周期或者在细胞骨架形成过程中扮演重要角色的蛋白质分子,如参与调控细胞骨架中肌动蛋白丝状分支的N-WASP蛋白,下调或者过表达N-WASP均会造成大脑皮层神经元迁移障碍[19];与智力障碍相关的候选基因成纤维细胞生长因子13 (FGF13)及其受体在神经发育早期具有调节功能,沉默FGF13的表达可以增加啮齿动物胼胝体神经元轴突的分枝[20];SOX5 (L-SOX5)作为转录因子,对神经元迁移、分化和深层神经元的轴突投射都有着重要作用[21]。本研究利用小鼠子宫内胚胎电转的方法结合Bmal1 RNAi技术分析小鼠大脑中Bmal1基因的表达,发现Bmal1基因敲减的小鼠在E18.5时皮层大部分神经元仍位于皮层的深层IZ和VZ/SVZ区,在P3时大部分迁移到了皮质的浅层。因此,在胚胎期敲减Bmal1基因延缓了皮层神经元的放射状迁移。此外,本研究还发现在E14.5时对Bmal1基因进行敲减后,可使P3小鼠胼胝体投射神经元的轴突延长发生障碍。综合以上研究结果,降低Bmal1基因在脑内的表达,不仅会影响皮层神经元的放射状迁移而且对胼胝体投射神经元的轴突延伸也发挥着重要的作用。本研究初步阐明了Bmal1在大脑发育过程中的调节功能,揭示了皮层神经元发育调控的一个新分子机制,并为今后进一步了解Bmal1在发育期脑内的生理作用以及相关脑疾病发病机制提供了新的科学依据。BMAL1作为重要的生物钟调节因子,既可以参与小鼠昼夜节律的调节,又参与小鼠大脑神经发育系统的调控。在调节生物昼夜节律的负反馈环路中,BMAL1作为转录因子与周期基因Per启动子上的E-box相结合,启动Per基因转录。最新研究发现,在胚胎期敲除Per基因也可以影响神经元的迁移[22]。负反馈环路有多个分子参与,那么在这一环路中的其他分子是否也参与了胚胎发育期大脑皮层神经元的发育调控?仍有待进一步研究。因此,寻找BMAL1在神经系统内发挥功能的下游底物或相互作用分子将更有利于人们了解BMAL1在体内的正常功能和致病机制方面的作用。
综上所述,本研究发现Bmal1基因对胚胎期皮层神经元的放射状迁移和胼胝体投射神经元的轴突延伸是必不可少的。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
Magsci [本文引用: 1]

目的:观察缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)新生大鼠松果体中CLOCK、BMAL1蛋白表达的变化,探讨钟基因表达异常在HIBD导致的昼夜节律紊乱中的作用。方法:72只7 日龄新生Sprague-Dawley大鼠随机分为假手术组与HIBD模型组,每组36只。采用改良Levine法建立HIBD模型,用Western blot方法测定两组新生大鼠术后0、2、12、24、36、48 h松果体中CLOCK、BMAL1蛋白水平。结果:HIBD模型组松果体的CLOCK及BMAL1蛋白表达水平在HIBD后48 h高于假手术组(P<0.05),在0、2、12、24、36 h CLOCK及BMAL1蛋白表达水平与假手术组相比差异均无统计学意义(P>0.05)。结论:HIBD新生大鼠松果体中CLOCK和BMAL1蛋白在损伤48 h后有显著升高,提示两者可能共同参与缺氧缺血时昼夜节律紊乱的发生。
Magsci [本文引用: 1]

目的:观察缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)新生大鼠松果体中CLOCK、BMAL1蛋白表达的变化,探讨钟基因表达异常在HIBD导致的昼夜节律紊乱中的作用。方法:72只7 日龄新生Sprague-Dawley大鼠随机分为假手术组与HIBD模型组,每组36只。采用改良Levine法建立HIBD模型,用Western blot方法测定两组新生大鼠术后0、2、12、24、36、48 h松果体中CLOCK、BMAL1蛋白水平。结果:HIBD模型组松果体的CLOCK及BMAL1蛋白表达水平在HIBD后48 h高于假手术组(P<0.05),在0、2、12、24、36 h CLOCK及BMAL1蛋白表达水平与假手术组相比差异均无统计学意义(P>0.05)。结论:HIBD新生大鼠松果体中CLOCK和BMAL1蛋白在损伤48 h后有显著升高,提示两者可能共同参与缺氧缺血时昼夜节律紊乱的发生。
URL [本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
[本文引用: 2]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
