王姝瑶
† , 郝鑫
† , 曲悦, 陈迎迎, 沈应柏
, * 北京林业大学, 北京 100083 The Role of Trans -2-hexenal in Plant Defense Responses Shuyao Wang
† , Xin Hao
† , Yue Qu, Yingying Chen, Yingbai Shen
, * Beijing Forestry University, Beijing 100083, China 通讯作者: * E-mail:
ybshen@bjfu.edu.cn † 共同第一作者 收稿日期: 2020-07-22
接受日期: 2021-01-22
网络出版日期: 2021-03-01
Corresponding authors: * E-mail:
ybshen@bjfu.edu.cn † These authors contributed equally to this paper Received: 2020-07-22
Accepted: 2021-01-22
Online: 2021-03-01
摘要 反式-2-己烯醛是绿色植物释放的一种小分子挥发性物质, 在调节植物生长发育和抵抗各种环境胁迫中发挥重要作用。已有研究表明, 反式-2-己烯醛可抑制植物根系生长, 具有较高的抑菌和抗虫活性, 也可以作为植物间的“信使”来传递防御信号。该文系统综述了反式-2-己烯醛的生物合成、代谢途径及其在生物胁迫防御反应中的重要作用, 提出了研究中存在的问题及未来的研究方向和建议, 以期为深入揭示反式-2-己烯醛的作用机理提供参考。
关键词: 绿叶挥发物 ;
植物防御反应 ;
反式-2-己烯醛 Abstract As a small molecule volatile compound released by green plants,
trans -2-hexenal plays a vital role in regulating plant growth and resistance to various environmental stresses. Studies have shown that
trans -2-hexenal exhibits obvious inhibition on growth of plant root, and defense against bacterial infection and herbivorous feeding. Furthermore, it also displays a ‘messenger’ role in transmitting defense signals among plants. This paper reviewed
trans -2-hexenal biosynthesis, metabolism pathway and its important role in defense response to biotic stress, also discussed the current problems in this research field and suggestions for future research, which would be helpful to illustrate defense or growth mechanism in plant response to
trans -2-hexenal.
Keywords: green leaf volatiles ;
plant defense response ;
trans -2-hexenalPDF (2311KB) 元数据 多维度评价 相关文章 导出 EndNote |
Ris |
Bibtex 收藏本文 引用本文 王姝瑶, 郝鑫, 曲悦, 陈迎迎, 沈应柏 . 反式-2-己烯醛在植物防御反应中的作用. 植物学报, 2021,
56 (2): 232-240 doi:10.11983/CBB20131
Wang Shuyao, Hao Xin, Qu Yue, Chen Yingying, Shen Yingbai .
The Role of Trans -2-hexenal in Plant Defense Responses .
Bulletin of Botany , 2021,
56 (2): 232-240 doi:10.11983/CBB20131
在复杂多变的生态环境中, 植物进化出一系列防御反应机制。防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 )。植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统。其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物。健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs。植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a )。大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质。反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用。此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累。例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 )。反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色。
1 反式-2-己烯醛的结构与化学性质 反式-2-己烯醛又称青叶醛, 分子式为C
6 H
10 O, 为无色油状液体, 不溶于水, 溶于乙醇和甲醇等有机溶剂, 具有绿叶清香和淡淡的水果香气, 可用于调配苹果(
Malus pumila )和草莓(
Fragaria ×
ananassa )等食用香精。水果中天然存在反式-2-己烯醛, 在苹果汁中含量可达72.26 mg·m
-3 , 香蕉(
Musa nana )中反式-2-己烯醛的含量达305.09 mg·m
-3 (Dittberner
et al. 1997 )。与其它绿叶挥发物不同, 反式-2-己烯醛含有α,β-不饱和羰基, α,β-不饱和羰基是亲电反应物质(reactive electrophile species, RES), 其不饱和的羰基基团能够与蛋白质中普遍含有的亲电基团(如巯基或氨基)发生迈克尔加成反应(Michael Addition)形成加合物, 可在多种胁迫环境下诱导活性氧(reactive oxygen species, ROS)产生并激活下游的防御反应(Alméras
et al. 2003 ; Farmer and Davoine,
2007 ; Farmer and Mueller,
2013 )。研究发现, 采用反式-2-己烯醛处理过的植株与顺式-3-己烯醛(
cis -3-hexenal)处理过的植株相比产生的植物抗毒素(camelexin)更多, 推测与α,β-不饱和羰基有关(Kishimoto
et al. 2006 )。
2 反式-2-己烯醛的生物合成 目前, 国内外对反式-2-己烯醛的研究较少, 早期研究主要集中在合成途径方面。日本汉口大学的Hatanaka从茶树(
Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(
trans -2-hexenol)和顺式-3-己烯醇(
cis -3-hexenol), 这是早期对于C
6 挥发物合成途径较为系统的报道(Hatanaka and Harada,
1973 )。近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auria
et al. 2007; 孙海峰等,
2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(
S )- hydroperoxy 9
Z , 11
E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(
S )-hydroperoxy 9
Z , 11
E , 15
Z -octadecatrienoic acid, 13-HPOTE) (Scala
et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(
n -hexanal)和愈伤素(9
Z -traumatin) (Scala
et al. 2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b )。13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid)。12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 )。反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 )。目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点。其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 )。Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用。众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 )。
图1 新窗口打开 |
下载原图ZIP |
生成PPT 图1绿叶挥发物(GLVs)的合成途径(改自Scala et al. 2013b ) 关键组分用红色字体表示。PL: 磷脂酶; 13-LOX: 脂氧合酶; HPL: 氢过氧化物裂解酶; ADH: 乙醇脱氢酶; AAT: 醇酰基转移酶; Isomerase: 3E:2Z异构体互变酶
Figure 1Green leaf volatiles (GLVs) synthetic pathway (modified from Scala et al. 2013b ) The key components are in red letters. PL: Phospholipases; 13-LOX: Lipoxygenase; HPL: Hydroperoxide lyase; ADH: Alcohol dehydrogenase; AAT: Alcohol acyltransferase; Isomerase: 3E:2Z isomerase
3 影响反式-2-己烯醛释放的因素 反式-2-己烯醛的释放受多种因素影响。研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一。此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 )。郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加。生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 )。棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 )。Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放。此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放。另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放。例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 )。反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究。
4 反式-2-己烯醛在植物中的生理作用 4.1 反式-2-己烯醛对植物根系生长的影响 植物吸收水分和养分依赖于根系, 根系对植物地上部的生长发育和抗逆性等诸多方面具有重要作用。研究表明, 反式-2-己烯醛通过抑制植物根系生长发育而影响植物根的形态建成, 这可能与其具有α,β-不饱和羰基结构有关(Bate and Rothstein,
1998 ; Mirabella
et al. 2008 )。用0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理植株后, 拟南芥(
Arabidopsis thaliana )初生根的生长明显受抑制, 表明低浓度反式-2-己烯醛抑制根系生长, 这一作用与MeJA相似(Bate and Rothstein,
1998 )。Mirabella等(
2008 )发现反式-2-己烯醛对根系生长的影响具有浓度效应, 浓度越高对根系生长的抑制作用越明显。用外源反式-2-己烯醛熏蒸处理野生型拟南芥和突变体
her1 (
hexenal-response-1 ; 编码γ-氨基丁酸(γ-aminobutyric acid, GABA)转氨酶) 24小时, 继续培养3天后, 发现野生型拟南芥根系生长被显著抑制, 而对突变体植株根系生长的抑制作用较弱, 且在高浓度外源反式-2-己烯醛处理条件下也是如此。随后研究发现, GABA与反式-2-己烯醛抑制根系生长这一生理过程有关, 用外源反式-2-己烯醛熏蒸野生型和突变体
her1 幼苗均可诱导GABA的积累, 但突变体
her1 植株中GABA积累的水平更高, 外源施加GABA可以增强
her1 幼苗对反式-2-己烯醛抑制根系生长的抵抗能力(Mirabella
et al. 2008 )。由此推测,
her1 幼苗中积累的高水平GABA可能是植株根系不受反式-2-己烯醛抑制的主要原因。此外, Mirabella等(
2015 )还发现
wrky40 /
wrky6 双突变体根伸长不受反式-2-己烯醛抑制, 他们用0.1-0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理野生型拟南芥和双突变体幼苗24小时, 继续培养3天后测量根长, 显示其根伸长不受抑制, 这说明
AtWRKY40 和
AtWRKY6 作为关键基因参与反式-2-己烯醛对根生长的抑制过程, 且作用于反式-2-己烯醛的下游。
IAA是植物体内最重要的激素之一, 其合成和转运影响植物的生长发育和形态建成, 质外体环境pH的稳定对植物根的生长也较为重要。张婷等(
2016 )利用非损伤微测技术(NMT)实时监测了外源反式-2-己烯醛处理后拟南芥根尖IAA和H
+ 的转运过程, 发现IAA的转运方向及流速在根尖不同功能区存在较大差异。正常情况下, 根尖分生区及过渡区的IAA会外流, 用反式-2-己烯醛熏蒸处理会显著抑制其外流趋势, 使IAA的整体流速降低, 且从过渡区向伸长区的转运过程被抑制。为进一步解释该现象, 研究还测定了IAA转运相关基因的表达情况, 发现外源反式-2-己烯醛熏蒸处理后, IAA转运基因(
PIN1 、
PIN2 和
PIN3 )的表达量明显低于对照组,
PIN4 的表达量则上调, 而IAA内向转运体基因
AUX1 的转录水平并未改变。此外, 外源反式-2-己烯醛熏蒸处理还导致IAA受体基因
TIR1 下调表达, 由此表明反式-2-己烯醛能在转录水平上降低根部对IAA的极性转运和感知过程(张婷等,
2016 )。反式-2-己烯醛增强植物防御反应的同时表现出减缓生长的现象, 其中可能的原因是植物在积累防御反应物质的同时会相应减少用于生长发育的物质积累(Coley
et al. 1985 ; 张婷等,
2016 )。外源反式-2-己烯醛熏蒸处理可以抑制拟南芥根尖分生区与过渡区的H
+ 内流。一般情况下, 植物根尖各个部位H
+ 流速存在较大差异, 距根尖100-700 μm处的H
+ 呈现整体内流的趋势, 且在300 μm过渡区内流流速达最大值, 而反式-2-己烯醛处理可显著降低这2个区域的平均H
+ 流速(未发表数据)。细胞内pH环境的稳定对植物根系正常生长至关重要, 已知布雷菲德菌素A (Brefeldin A, BFA)处理能显著抑制拟南芥根尖过渡区的生长素运输(Shen
et al. 2008 ), 同时, BFA处理抑制了根尖分生区与过渡区的H
+ 内流, 这一现象与外源反式-2-己烯醛处理结果一致(未发表数据)。由此推测, 根尖分生区与过渡区的H
+ 转运可能与生长素的极性运输密切相关, 外源反式-2-己烯醛处理改变了植物根系质外体环境的pH值, 这种变化直接影响植物根系的生长发育。
上述研究表明, 反式-2-己烯醛可以对植物根尖生长起到明显调节作用。与GABA的相互作用表明其可能参与线粒体氧化还原过程。参与IAA转运说明反式-2-己烯醛作用于植物激素信号网络, 调节植物的生长发育, 但截至目前, 还未见反式-2-己烯醛与生长素直接相互作用从而调节植物生长的报道, 因此反式-2-己烯醛影响植物根长生长的具体信号途径尚不明确, 还需深入研究。此外, 反式-2-己烯醛是否与脱落酸(abscisic acid, ABA)和细胞分裂素(cytokinin, CTK)等植物激素互作从而影响植物生长发育也需进一步研究。
4.2 反式-2-己烯醛诱导的植物抗菌反应 已有研究表明, 几乎所有挥发性物质都具有抑菌活性, 反式-2-己烯醛作为天然挥发物也具有显著抗菌性能, 较低浓度就能抑制革兰氏阴性、阳性菌和部分真菌的生物活性(Gardini
et al. 1997 ; Bisignano
et al. 2001 )。研究发现, 反式-2-己烯醛可作为无公害的植物源生物活性物质, 取代紫外线辐射和超声波等物理灭菌法对水果进行灭菌。扩展青霉(
Penicillium expansum )是引起苹果和猕猴桃(
Actinidia chinensis )等水果腐烂的主要霉菌之一。Neri等(
2006 )研究表明, 外源反式-2-己烯醛处理可使扩展青霉霉菌对梨(
Pyrus spp.)和苹果的感染能力明显下降; 同样, 感染青霉菌的猕猴桃经反式-2-己烯醛处理后扩展青霉萌发分生孢子的真菌膜遭到破坏, 菌丝出现皱缩和干瘪等现象, 其孢子的繁殖和扩展青霉素的产生与积累受到抑制(段腾飞等,
2019 )。另有研究表明, 外源反式-2-己烯醛可使柑橘酸腐病菌(
Geotrichum citriaurentii )的菌丝体形态改变, 出现凹陷、干瘪以及不规则扭曲等情况, 采用卡尔科弗卢尔荧光增白剂(Calcofluor White Stain: GFW)染色后出现酸腐病菌菌丝体蓝色荧光均匀减弱, 表明反式-2-己烯醛可以破坏酸腐病菌细胞壁的完整性(杨艳琴,
2019 )。上述研究表明, 反式-2-己烯醛通过破坏菌体细胞结构抑制其生长和繁殖, 使植物避免病原菌的侵染。在与病原菌的长期协同进化过程中, 植物可快速合成并释放反式- 2-己烯醛以诱导防御反应, 明显提高了生存机会。
用外源反式-2-己烯醛处理采摘后的草莓果实可以显著降低霉菌的感染程度(Wakai
et al. 2019 )。外源反式-2-己烯醛处理后, 植物防御反应相关的脂氧合酶、苯丙氨酸转氨酶(phenylalaninammo-nialyase, PAL)、过氧化物酶(peroxidase oxidase, POD)及多酚氧化酶(polyphenol oxidase, PPO)等的活性显著增强, 并诱导酚类化合物和黄酮类化合物积累, 从而增强抗病能力(Gomi
et al. 2003 ; 苗建强,
2013 ; Guo
et al. 2015 )。用外源反式-2-己烯醛处理灰霉菌感染的番茄(
Solanum lycopersicum )幼苗后, 植株体内JA和乙烯(ethylene, ET)通路基因
LOX 、
ETR3 和
ETR4 等的表达量显著增高, 推测反式-2-己烯醛可能通过介导JA/ET通路来响应病原菌侵染(Guo
et al. 2015 )。Zeringue和McCormick (
1990 )以及Kishimoto等(2000)也认为, 反式-2-己烯醛能够诱导JA信号通路
LOX 基因的表达, 诱导防御反应。Zeringue等(
1990 )研究证实, 经过反式-2-己烯醛处理的棉花对黄曲霉毒素产生很强的拮抗作用, 并提出LOX途径可能参与该反应。Kishimoto等(2000)证实反式-2-己烯醛处理后拟南芥中
LOX2 的表达量上调。LOX是JA合成过程中的关键酶, JA在植物生长发育、成熟衰老以及逆境胁迫应答过程中起重要的调节作用。上述结果表明, 反式-2-己烯醛可以诱导防御相关基因的表达, 积累防御相关物质从而增强抗病能力。
反式-2-己烯醛增强抗菌性并非广谱性适用于全部菌株。Scala等(
2013b )用不产生GLVs的突变体
hpl1 进行研究, 发现紫丁香假单胞菌(DC3000)感染
hpl1 后, JA信号途径相关基因仅被轻微诱导或不表达, JA水平降低, 但SA水平较高, DC3000的增长明显受到抑制。使用外源反式-2-己烯醛处理后可显著恢复
HPL1 的缺失效应, 反而可以解除
HPL1 突变后植株对菌体生长的抑制作用, 这一研究结果与传统观点相悖。通过分析表明, DC3000能够合成一种冠菌素(coronatine, COR), COR的作用类似于JA的活性形式茉莉酸-异亮氨酸共轭物(JA-Ile), 在DC3000感染拟南芥后, COR与SA发生类似于JA与SA的拮抗作用, 导致SA含量降低, 对DC3000的抑制能力减弱(Scala
et al. 2013b )。Liu等(
2019 )也提出DC3000可以通过JA拮抗SA介导的植物防御反应来提高其感染能力, 反式-2-己烯醛可诱导JA的合成, 因此外源反式-2-己烯醛处理DC3000后反而解除其对生长的抑制。
综上所述, 反式-2-己烯醛作为天然杀菌剂, 推测其较高的抑菌能力与其具有较强的亲电活性相关, 可以通过破坏致病菌细胞结构、诱导防御基因表达、激活激素信号调节网络以及增强植物防御反应相关酶活性等方式对抗病原菌, 从而增强植物的抗菌能力。反式-2-己烯醛因其在植物体内诱导直接和间接防御反应的能力而备受关注, 在生物胁迫过程中形成复杂的调控网络, 但其影响抗病的具体机制以及参与这些反应的完整信号通路报道较少。
4.3 反式-2-己烯醛诱导的植物抗虫反应 在自然界中, 食草性昆虫对植物的伤害普遍存在。为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 )。反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 )。当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 )。例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 )。此外, 外源施加反式-2-己烯醛可有效防治害虫。寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一。据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元。番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫。经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 )。用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%。反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 )。除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 )。
植物释放反式-2-己烯醛能提高自身以及邻近植物的防御能力, 诱导相关抗性基因的表达。外源反式-2-己烯醛处理具有一定的抗虫性, 能够直接影响昆虫繁殖、产卵和运动等能力, 还能吸引昆虫的天敌来抵御昆虫。高浓度反式-2-己烯醛还可以直接发挥杀虫的功效, 但具体作用机理尚不清楚, 如何更好地发挥其抗虫作用也需要更多的田间试验验证, 尚待深入研究。
综上所述, 反式-2-己烯醛在植物防御反应中具有重要作用, 在食草动物侵袭、病原菌感染、机械损伤等生物和非生物胁迫下释放, 影响植物激素网络, 并参与植物间信息交流(
图2 )。
图2 新窗口打开 |
下载原图ZIP |
生成PPT 图2反式-2-己烯醛在植物防御反应中的作用 LOX: 脂氧合酶; PAL: 苯丙氨酸转氨酶; PPO: 多酚氧化酶; POD: 过氧化物酶
Figure 2The role of trans-2-hexenal in plant defense responses LOX: Lipoxygenase; PAL: Phenylalaninammo-nialyase; PPO: Polyphenol oxidase; POD: Peroxidase
5 总结与展望 反式-2-己烯醛作为一种小分子挥发性新型防御信号物质, 在调节植物生长发育、诱导植物抗菌和抗虫防御反应方面均具有重要作用, 在农作物和人工林等组成较单一的人工生态系统有害生物绿色防控方面具有重要的潜在应用价值。反式-2-己烯醛作为天然抑菌剂, 可在植物生产、运输和储存过程中发挥作用。反式-2-己烯醛是天然杀虫剂, 可在植物害虫防治方面作为无公害农药使用。对反式-2-己烯醛在植物生长发育和抗逆性方面作用机理的探讨证明, 反式-2-己烯醛可与IAA、JA和SA信号系统互作, 发挥生理效应。上述研究结果积累了大量科学数据, 推动了对反式- 2-己烯醛的研究。目前, 仍有许多问题有待深入探索: 反式-2-己烯醛除了对植物地下部分生长具有抑制作用外, 对地上部分生长发育有何影响; 反式-2-己烯醛影响植物根伸长的具体信号途径尚不明确; 反式-2-己烯醛在诱导植物防御反应中是否具有独立的信号通路, 在植物抗病、抗虫防御反应中的分子机理还报道较少; 反式-2-己烯醛如何与IAA、JA和SA等激素信号网络互作, 调节植物生长发育和抗逆性的机理仍需全面深入研究。对于这些问题的深入研究将进一步揭示反式-2-己烯醛在调节植物生长发育和抗逆性中的作用机理, 为反式-2-己烯醛的实际应用提供科学依据。
[1] 陈澄宇 (2014 ). 苯并噻唑和反式-2-己烯醛对不同虫态韭菜迟眼蕈蚊的生物活性. 硕士论文山东农业大学 . pp.1 -52 . [本文引用: 1] [2] 程乐 (2017 ). 反式-2-己烯醛对松材线虫生长、繁殖和行为的影响. 硕士论文 . 泰安: 山东农业大学. pp.1 -52 . [本文引用: 2] [3] 段腾飞 , 李昭 , 岳田利 , 夏秋霞 , 孟江洪 (2019 ). 反式-2-己烯醛对猕猴桃贮藏过程扩展青霉生长的抑制作用农业工程学报 35 ,293 -301 . URL [本文引用: 1] 为研究反式-2-己烯醛对扩展青霉生长及展青霉素产生的抑制作用。选取反式-2-己烯醛和研究报道的8种具有抑菌效果的物质对5株扩展青霉进行体外抑菌试验,研究反式-2-己烯醛的抑菌效果并测定其最小抑菌浓度,然后进行猕猴桃活体试验,通过测定硬度、可溶性固形物、可滴定酸、维生素C、pH值等指标研究反式-2-己烯醛对猕猴桃品质的影响,并采用高效液相检测抑菌试验前后猕猴桃活体中展青霉素含量,最终通过扫面电子显微镜观察反式-2-己烯醛对5株扩展青霉形态的影响。结果反式-2-己烯醛与8种抑菌物质相比,反式-2-己烯醛抑菌效果最好,能够完全抑制5株扩展青霉生长且得到对5株试验菌的最小抑菌浓度(MIC,minimum inhibitory concentration);反式-2-己烯醛能够极显著降低扩展青霉对猕猴桃果实硬度、可滴定酸、维生素C的的影响(P0.01),极显著降低了染菌猕猴桃果实的腐烂率(P<0.01),较好的保持了猕猴桃品质,经反式-2-己烯醛处理的染菌猕猴桃均没有展青霉素检出;扫面电子显微镜显示5株试验菌出现菌丝皱缩、折叠、干瘪,孢子生成减少现象。研究反式-2-己烯醛对扩展青霉生长及展青霉素产生均具有很好的抑制作用,可为开发具有抑菌作用可替代农药的天然产物提供理论基础。
[4] 郭慧媛 , 马元丹 , 王丹 , 左照江 , 高岩 , 张汝民 , 王玉魁 (2014 ). 模拟酸雨对毛竹叶片抗氧化酶活性及释放绿叶挥发物的影响植物生态学报 38 ,896 -903 . DOI:
10.3724/SP.J.1258.2014.00084 PMID:
3E30CFF0-3F2C-476D-BAC7-ED6284B526D1 [本文引用: 1] 为了探讨酸雨胁迫与毛竹(Phyllostachys pubescens)绿叶挥发物(green leaf volatiles, GLVs)释放规律以及抗氧化酶活性的关系, 通过盆栽试验, 采用不同pH值(5.6、4.0、2.5)的模拟酸雨对毛竹三年生实生苗进行处理, 研究酸雨对毛竹叶片可溶性蛋白质含量、丙二醛(MDA)含量和抗氧化酶活性的影响, 并采用热脱附/气相色谱/质谱联用技术对毛竹释放的GLVs成分和含量进行分析。结果表明: 酸雨胁迫下毛竹叶片MDA含量明显增加, pH 2.5模拟酸雨胁迫处理45天毛竹叶片MDA含量与对照相比增加了43.0% (p < 0.01); pH 4.0处理MDA含量增加缓慢, 处理75天时MDA含量比对照增加了0.36倍(p < 0.01)。pH 4.0和pH 2.5模拟酸雨胁迫处理45天时, 毛竹叶片可溶性蛋白质含量极显著增加, 与对照相比分别增加了32.0%和65.0% (p < 0.01)。在酸雨胁迫下, 毛竹叶片超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)的响应时间存在一定差异, 表现为互相协调, pH 2.5模拟酸雨胁迫处理SOD活性和POD活性分别在45天和60天时达到最大值, 分别为对照的1.67倍和1.31倍(p < 0.01), 随后降低。pH 4.0和pH 2.5模拟酸雨胁迫处理, 毛竹叶片GLVs含量比对照分别增加26.4%和132.9% (p < 0.01), 新增GLVs为 (E)-2-辛烯醛、2-乙基己醛、(E)-2-己烯醛和(E)-2-壬烯醛。研究表明: 酸雨胁迫条件下, 毛竹可以通过调节保护酶活性、可溶性蛋白质含量和释放GLVs来提高适应环境的能力。
[5] 李素霞 (2014 ). 反式-2-己烯醛对南方根结线虫的作用方式及应用技术研究. 硕士论文 . 泰安: 山东农业大学. pp.1 -46 . [本文引用: 1] [6] 苗建强 (2013 ). 反式-2-己烯醛诱导黄瓜抗灰霉病活性初步研究. 硕士论文 . 泰安: 山东农业大学. pp.1 -44 . [本文引用: 1] [7] 苗建强 , 王猛 , 李秀环 , 杨法辉 , 刘峰 (2012 ). 五种挥发性化合物对土传病原真菌及线虫的生物活性植物保护学报 39 ,561 -566 . URL [本文引用: 1] 为明确挥发性化合物反式-2-己烯醛、香茅醛、1-辛烯-3-醇、芳樟醇、1-戊烯-3-醇对土传病害及线虫病的防治潜力,采用密封盘菌丝生长速率法比较了挥发性化合物对辣椒疫霉等7种植物土传病原真菌、南方根结线虫和禾谷孢囊线虫的生物活性。反式-2-己烯醛和香茅醛的生物活性高于1-辛烯-3-醇、芳樟醇及1-戊烯-3-醇,21.0 μL/L反式-2-己烯醛处理能够完全抑制供试病原真菌菌丝的生长。10.5 μL/L反式-2-己烯醛或香茅醛处理对花生冠腐病菌孢子及棉花黄萎病菌色素的产生均有较强的抑制作用,且42.0 μL/L处理能够完全抑制黄瓜菌核病菌菌核的萌发。2.62 μL/L反式-2-己烯醛处理南方根结线虫和禾谷孢囊线虫的2龄幼虫,24 h的死亡率均为100%;2.62 μL/L香茅醛处理24 h的死亡率分别为95.4%和89.5%,而对照处理的死亡率分别为2.5%和3.0%。研究表明反式-2-己烯醛及香茅醛具有较好的熏蒸抑菌及杀线虫活性。
[8] 穆丹 (2011 ). 茶树挥发性信息素调控假眼小绿叶蝉及叶蝉三棒缨小蜂行为的功效. 博士论文 . 北京: 中国农业大学. pp.1-83 . [本文引用: 1] [9] 孙海峰 , 李震宇 , 武滨 , 秦雪梅 (2013 ). 绿叶挥发物产生特征及其生态生理作用研究进展植物生态学报 37 ,268 -275 . DOI:
10.3724/SP.J.1258.2013.00027 PMID:
26530C32-D436-4F94-983D-561221AACC66 [本文引用: 2] 该文系统综述了植物绿叶挥发物(green leaf volatiles, GLVs)的形成特征、对植物的生态生理作用及调控机制等方面的最新研究进展。GLVs是指植物经十八碳烷酸途径过氧化物酶分支途径产生的含6个碳原子的醛、醇及其酯。除叶片外, 植物的根、茎、果实、种子等部位均可以合成该类化合物, 合成调控存在转录和转录后水平的调控。在特定植物中, GLVs合成及其组分还受到植物生长发育阶段和生长季节等外源环境的影响。昆虫啃食、微生物感染以及有益真菌的定植等生物逆境与缺氮等物理逆境均具有诱导GLVs合成的作用。除了参与植物特有气味形成外, GLVs在植物直接和间接防御应答中发挥着重要的作用。GLVs不仅具有抑制微生物和多种昆虫繁殖的作用, 还具有诱导多种防御化合物合成、预置(prime)有关信号途径的作用。基于GLVs在植物界的广泛存在性和在防御应答中的多层次作用, 该文作者提出了GLVs在道地药材品质形成中的潜在作用及开展相关研究的必要性和紧迫性。
[10] 许宁 , 陈宗懋 , 游小清 (1999 ). 引诱茶尺蠖天敌寄生蜂的茶树挥发物的分离与鉴定昆虫学报 42 ,126 -131 . URL [本文引用: 1] 采用Tenax GC动态吸附法对茶树-茶尺蠖Ectropis obliqua (Prout)-单白绵绒茧蜂Apanteles sp.三重营养关系中茶树的新梢挥发性化合物进行了捕集,经GC、GC-MS鉴定结果表明,不同来源的挥发物的组成和数量是不同的,完整茶树新梢(IS)的挥发物有11种组份;机械损伤新梢(MDS)的挥发物有13种组份;茶树-茶尺蠖取食复合体(PHC)的挥发物有15种组份,而用经典的SDE法获得的新梢精油有13种组份,4种挥发物数量的大小顺序为SDE>MDS>PHC>IS。生物测定结果表明,无气味经历的雌单白绵绒茧蜂对IS和MDS的气味的选择作用无统计上的显著性,对机械损伤新梢+幼虫口腔分泌物(MDS+Reg), 幼虫取食损伤(LDS)和PHC的气味有较强的偏好选择性。
[11] 杨艳琴 (2019 ). 两种脂肪醛及其结构类似物对柑橘酸腐病菌的抑制及构效分析. 硕士论文 . 湘潭: 湘潭大学. pp.1 -37 . [本文引用: 1] [12] 张庆花 , 陈迎迎 , 张海龙 , 沈应柏 (2019 ). 1-戊烯-3-酮在植物防御反应中的作用植物生理学报 55 ,225 -231 . [本文引用: 1] [13] 张婷 , 闫素丽 , 董杉杉 , 焦春阳 , 张笑 , 沈应柏 (2016 ). 反式- 2-己烯醛抑制拟南芥根尖生长素极性运输植物生理学报 52 ,209 -215 . [本文引用: 3] [14] 左照江 , 张汝民 , 高岩 (2009 ). 植物间挥发物信号的研究进展植物学报 44 ,245 -252 . DOI:
10.3969/j.issn.1674-3466.2009.02.015 URL [本文引用: 1] 植物VOCs信号是植物间进行信息交流的“语言”, 可由多种生物和非生物因素诱导产生。非寄生植物释放的VOCs信号可影响其所在群落中其它植物的种子萌发与幼苗生长; 而寄主植物释放的VOCs信号却是诱导寄生植物种子萌发和幼苗生长的信号物质。VOCs作为植物间的伤害信息可以诱导临近的同种或异种植物做好防御准备, 从而通过主动或间接防御以减少外界的伤害。植物间通过VOCs信号进行信息交流, 从而实现其繁衍与防御。该文通过对VOCs信号的种类、诱导产生因素、传递及作用进行综述, 以期对VOCs信号的研究有所帮助。
[15] Alméras E Stolz S Vollenweider S Reymond P Mène- Saffrané L Farmer EE 2003 ). Reactive electrophile species activate defense gene expression in ArabidopsisPlant J 34 ,205 -216 . DOI:
10.1046/j.1365-313X.2003.01718.x URL [本文引用: 1] [16] Arimura GI Ozawa R Horiuchi JI Nishioka T Takabayashi J 2001 ). Plant-plant interactions mediated by volatiles emitted from plants infested by spider mitesBiochem Syst Ecol 29 ,1049 -1061 . DOI:
10.1016/S0305-1978(01)00049-7 URL [本文引用: 1] In an earlier study, we demonstrated plant–plant interactions mediated by volatiles released from lima bean leaves infested by spider mites (Tetranychus urticae) (Nature 406 (2000a) 512, Biochem. Biophys. Res. Commun. 277 (2000b) 305). In the present study, we further show that, under laboratory conditions, volatiles emitted from T. urticae-infested lima bean plants activate transcription of genes encoding pathogenesis-related proteins and phenylalanine ammonia-lyase in leaves of intact neighboring plants. This finding indicates that intact lima bean plants may be responsive to volatile signals. Further, as green leaf volatiles (GLVs) are released from green plants in response to mechanical damage caused by herbivores, we studied possible involvement of GLVs in plant–plant interaction. We found that (Z)-3-hexenol, (E)-2-hexenal, and (Z)-3-hexenyl acetate, induced the expression of defense genes in uninfested leaves. This finding suggests that GLVs may act as signal compounds in plant–plant interactions.
[17] Arimura GI Ozawa R Nishioka T Boland W Koch T Kühnemann F Takabayashi J 2002 ). Herbivore-induced volatiles induce the emission of ethylene in neighboring lima bean plantsPlant J 29 ,87 -89 . DOI:
10.1046/j.1365-313x.2002.01198.x URL [本文引用: 3] [18] Bate NJ Rothstein SJ 1998 ). C6 -volatiles derived from the lipoxygenase pathway induce a subset of defense-related genesPlant J 16 ,561 -569 . PMID:
10036774 [本文引用: 2] Six-Carbon (C6-) volatiles, including the aldehydes trans-2-hexenal, hexanal and cis-3-hexenal, as well as their corresponding alcohols, are produced from damaged or wounded plant tissue as a product of the enzymatic activity of hydroperoxide lyase (HPL), a component of the lipoxygenase (LOX) pathway. Aerial treatment of Arabidopsis seedlings with 10 microM concentrations of trans-2-hexenal induces several genes known to be involved in the plant's defense response, including phenylpropanoid-related genes as well as genes of the LOX pathway. Genes encoding the pathogenesis-related proteins PR-1 or PR-2, however, were not induced. Trans-2-hexenal induction thus closely mimics the group of genes induced by methyl jasmonate (MeJA), also a LOX-derived volatile. However, unlike MeJA, trans-2-hexenal did not induce hydroxymethylglutaryl-coenzyme A reductase (HMGR) or thionin2-1. The inductive effect seemed to be limited to C6-related volatiles, as C8-, C9- and other related volatiles did not induce LOX mRNA levels. As has been demonstrated for MeJA, trans-2-hexenal quantitatively reduced wild-type seed germination. Trans-2-hexenal also reduced the germination frequency of the MeJA resistant Arabidopsis mutant, jar1-1, supporting the notion that trans-2-hexenal and MeJA are recognized via different mechanisms. In addition, trans-2-hexenal had a moderate inhibitory effect on root length relative to similar concentrations of MeJA and was approximately 10-fold less effective than MeJA at inducing anthocyanin accumulation in Arabidopsis seedlings. These results suggest that C6-volatiles of the LOX pathway act as a wound signal in plants, but result in a moderate plant response relative to MeJA at both the physiological and molecular level.
[19] Bisignano G Laganà MG Trombetta D Arena S Nostro A Uccella N Mazzanti G Saija A 2001 ). In vitro antibacterial activity of some aliphatic aldehydes from Olea europaea LFEMS Microbiol Lett 198 ,9 -13 . PMID:
11325546 [本文引用: 1] In the present paper we report the 'in vitro' activity of eight aliphatic long-chain aldehydes from olive flavor (hexanal, nonanal, (E)-2-hexenal, (E)-2-eptenal, (E)-2-octenal, (E)-2-nonenal, (E)-2-decenal and (E,E)-2,4-decadienal) against a number of standard and freshly isolated bacterial strains that may be causal agents of human intestinal and respiratory tract infections. The saturated aldehydes characterized in the present study do not exhibit significant antibacterial activity, while the alpha,beta-unsaturated aldehydes have a broad antimicrobial spectrum and show similar activity against Gram-positive and Gram-negative microorganisms. The effectiveness of the aldehydes under investigation seems to depend not only on the presence of the alpha,beta-double bond, but also on the chain length from the enal group and on the microorganism tested.
[20] Chen CY Mu W Zhao YH Li H Zhang P Wang QH Liu F 2015 ). Biological activity of trans -2-hexenal against Bradysia odoriphaga (Diptera: Sciaridae) at different developmental stagesJ Insect Sci 15 ,iev075 . DOI:
10.1093/jisesa/iev075 URL [本文引用: 1] [21] Cheng L Xu SY Xu CM Lu HB Zhang ZQ Zhang DX Mu W Liu F 2017 ). Effects of trans -2-hexenal on reproduction, growth and behaviour and efficacy against the pinewood nematode,Bursaphelenchus xylophilusPest Manag Sci 73 ,888 -895 . DOI:
10.1002/ps.2017.73.issue-5 URL [本文引用: 1] [22] Coley PD Bryant JP Chapin III FS 1985 ). Resource availability and plant antiherbivore defenseScience 230 ,895 -899 . DOI:
10.1126/science.230.4728.895 URL [本文引用: 1] [23] Davoine C Falletti O Douki T Iacazio G Ennar N Montillet JL Triantaphylidès C 2006 ). Adducts of oxylipin electrophiles to glutathione re?ect a 13 speci?city of the downstream lipoxygenase pathway in the tobacco hypersensitive responsePlant Physiol 140 ,1484 -1493 . PMID:
16500992 [本文引用: 1] The response to reactive electrophile species (RES) is now considered as part of the plant response to pathogen and insect attacks. Thanks to a previously established high-performance liquid chromatography tandem mass spectrometry methodology, we have investigated the production of oxylipin RES adducts to glutathione (GSH) during the hypersensitive response (HR) of plants. We have observed that RES conjugation to GSH in tobacco (Nicotiana tabacum) leaves is facile and nonspecific. In cryptogein-elicited tobacco leaves, we show that the oxylipin RES adducts to GSH are produced in correlation with GSH consumption, increase in glutathione S-transferase activity, and the appearance of the cell death symptoms. In this model, the adducts arise mainly from the downstream 13 lipoxygenase (LOX) metabolism, although the induced 9 LOX pathway leads massively to the accumulation of upstream metabolites. The main adducts were obtained from 2-hexenal and 12-oxo-phytodienoic acid. They accumulate transiently as 1-hexanol-3-GSH, a reduced adduct, and 12-oxo-phytodienoic acid-GSH, respectively. RES conjugation does not initiate cell death but explains part of the GSH depletion that accompanies HR cell death. The nature of these GSH conjugates shows the key role played by the 13 LOX pathway in RES signaling in the tobacco HR.
[24] Dittberner U Schmetzer B G?lzer P Eisenbrand G Zankl H 1997 ). Genotoxic effects of 2-trans-hexenal in human buccal mucosa cells in vivoMutat Res 390 , 161 - 165 . [本文引用: 1] [25] Dürr P Schobinger U Zellweger M 1981 ). Aroma von apfelmaische bei deren verflussigung durch pektinasen und zellulasenLebensm Wiss Technol 14 ,268 -272 . [26] Farag MA Fokar M Abd H Zhang HM Allen RD Paré PW 2005 ). ( Z )-3-hexenol induces defense genes and downstream metabolites in maizePlanta 220 ,900 -909 . DOI:
10.1007/s00425-004-1404-5 URL [本文引用: 1] In response to insect feeding, corn plants (<i>Zea mays</i> cv. Delprim) release elevated levels of volatile organic compounds (VOCs), including the C<sub>6</sub>-volatile (<i>Z</i>)-3-hexenol. The level of mRNA accumulation for a series of defense genes was monitored in response to application of (<i>Z</i>)-3-hexenol (50 nmol) to undamaged plants. The induction of transcripts for<i> hpl</i> (hydroperoxide lyase),<i> fps</i> (farnesyl pyrophosphate synthase),<i> pal</i> (phenylalanine ammonia-lyase),<i> lox</i> (lipoxygenase),<i> igl</i> (indole-3-glycerol phosphate lyase) and<i> mpi</i> (maize proteinase inhibitor) were compared with metabolites generated from the respective pathways. While headspace VOC analysis showed an increase in (<i>Z</i>)-3-hexenyl acetate and methyl salicylate with<i> lox</i> and<i> pal</i> induction, respectively, MPI accumulation was not observed with an increase in<i> mpi</i> transcripts. Moreover, (Z)-3-hexenol treatment did not elevate sesquiterpene emissions or activate<i> fps</i> transcription. Chemical labeling and bioassay experiments established that exogenous (<i>Z</i>)-3-hexenol can be taken up and converted to a less active acetylated form. These data indicate that (<i>Z</i>)-3-hexenol can serve as a signaling molecule that triggers defense responses in maize and can rapidly be turned over<i> in planta</i>.
[27] Farmer EE Davoine C 2007 ). Reactive electrophile speciesCurr Opin Plant Biol 10 ,380 -386 . DOI:
10.1016/j.pbi.2007.04.019 URL [本文引用: 1] [28] Farmer EE Mueller MJ 2013 ). ROS-mediated lipid peroxidation and RES-activated signalingAnnu Rev Plant Biol 64 ,429 -450 . DOI:
10.1146/annurev-arplant-050312-120132 URL [本文引用: 1] [29] Fürstenberg-H?gg J Zagrobelny M Bak S 2013 ). Plant defense against insect herbivoresInt J Mol Sci 14 ,10242 -10297 . DOI:
10.3390/ijms140510242 URL [本文引用: 1] [30] Gardini F Lanciotti R Caccioni DRL Guerzoni ME 1997 ). Antifungal activity of hexanal as dependent on its vapor pressureJ Agric Food Chem 45 ,4297 -4302 . DOI:
10.1021/jf970347u URL [本文引用: 1] [31] Gardini F Lanciotti R Guerzoni ME 2010 ). Effect of trans -2-hexenal on the growth of Aspergillus flavus in relation to its concentration, temperature and water activityLett Appl Microbiol 33 ,50 -55 . DOI:
10.1046/j.1472-765X.2001.00956.x URL [本文引用: 1] [32] Gomi K Yamasaki Y Yamamoto H Akimitsu K 2003 ). Characterization of a hydroperoxide lyase gene and effect of C6 -volatiles on expression of genes of the oxylipin metabolism in CitrusJ Plant Physiol 160 , 1219 -1231 . DOI:
10.1078/0176-1617-01177 URL [本文引用: 1] [33] Guo MR Feng JZ Zhang PY Jia LY Chen KS 2015 ). Postharvest treatment with trans -2-hexenal induced resistance against Botrytis cinerea in tomato fruitAustralas Plant Pathol 44 ,121 -128 . DOI:
10.1007/s13313-014-0331-6 URL [本文引用: 2] [34] Hatanaka A 1993 ). The biogeneration of green odour by green leavesPhytochemistry 34 ,1201 -1218 . DOI:
10.1016/0031-9422(91)80003-J URL [本文引用: 1] [35] Hatanaka A Harada T 1973 ). Formation of cis -3-hexenal, trans -2-hexenal and cis -3-hexenol in macerated Thea sinensis leavesPhytochemistry 12 ,2341 -2346 . DOI:
10.1016/0031-9422(73)80435-2 URL [本文引用: 1] [36] Hatanaka A Kajiwara T Sekiya J 1976 ). Seasonal variations in trans -2-hexenal and linolenic acid in homogenates of Thea sinensis leavesPhytochemistry 15 ,1889 -1891 . DOI:
10.1016/S0031-9422(00)88838-X URL [本文引用: 1] [37] Hatanaka A Kajiwara T Sekiya J 1987 ). Biosynthetic pathway for C6 -aldehydes formation from linolenic acid in green leavesChem Phys Lipids 44 ,341 -361 . DOI:
10.1016/0009-3084(87)90057-0 URL [38] Hirao T Okazawa A Harada K Kobayashi A Muranaka T Hirata K 2012 ). Green leaf volatiles enhance methyl jasmonate response in ArabidopsisJ Biosci Bioeng 114 ,540 -545 . DOI:
10.1016/j.jbiosc.2012.06.010 URL [本文引用: 1] Plants emit green leaf volatiles (GLVs) in response to insect or pathogen damage. GLVs consist of C6 and C9 aldehydes, alcohols, and their acetate esters, and play important roles in the plant defense response. One of the functions of GLVs in the defense response is priming. Plants pretreated by GLVs can induce a defense response more rapidly and effectively than unpretreated plants when they are damaged by pathogens or insects. In this study, we focused on the priming effects of GLVs on jasmonic acid response involved in the defense response. When Arabidopsis was pretreated with aldehyde GLVs, especially with (E)-2-hexenal, the anthocyanin content was significantly increased by a subsequent methyl jasmonate (MeJA) treatment. On the other hand, no effect of anthocyanin accumulation was observed for plants pretreated with alcohol GLVs. These results suggest that aldehyde GLVs, especially (E)-2-hexenal, could enhance sensitivity to MeJA in Arabidopsis. (C) 2012, The Society for Biotechnology, Japan.
[39] Kishimoto K Matsui K Ozawa R Takabayashi J 2005 ). Volatile C6 -aldehydes and allo-ocimene activate defense genes and induce resistance against Botrytis cinerea in Arabidopsis thalianaPlant Cell Physiol 46 , 1093 -1102 . PMID:
15879447 [本文引用: 1] Green leafy volatiles or isoprenoids are produced after mechanical wounding or pathogen/herbivore attacks in higher plants. We monitored expression profiles of the genes involved in defense responses upon exposing Arabidopsis thaliana to the volatiles. Among the genes investigated, those known to be induced by mechanical wounding and/or jasmonate application, such as chalcone synthase (CHS), caffeic acid-O-methyltransferase (COMT), diacylglycerol kinase1 (DGK1), glutathione-S-transferase1 (GST1) and lipoxygenase2 (LOX2), were shown to be induced with (E)-2-hexenal, (Z)-3-hexenal, (Z)-3-hexenol or allo-ocimene (2,6-dimethyl-2,4,6-octatriene). A salicylic acid-responsive gene, pathogenesis-related protein2 (PR2), was not induced by the volatiles. Detailed analyses of the expression profiles showed that the manner of induction varied depending on either the gene monitored or the volatile used. A chemically inert compound, (Z)-3-hexenol, was also potent, which suggested that chemical reactivity was not the sole requisite for the inducing activity. With a jasmonate-insensitive mutant (jar1), the induction by the volatiles was mostly suppressed, however, that of LOX2 was unaltered. An ethylene-insensitive mutant (etr1) showed responses almost identical to the wild type, with minor exceptions. From these observations, it was suggested that both the jasmonate-dependent and -independent pathways were operative upon perception of the volatiles, while the ETR1-dependent pathway was not directly involved. When Botrytis cinerea was inoculated after the volatile treatment, retardation of disease development could be seen. It appears that volatile treatment could make the plants more resistant against the fungal disease.
[40] Kishimoto K Matsui K Ozawa R Takabayashi J 2006 ). ETR1-, JAR1- and PAD2-dependent signaling pathways are involved in C6 -aldehyde-induced defense responses of Arabidopsis Plant Sci 171 ,415 -423 . DOI:
10.1016/j.plantsci.2006.05.004 PMID:
22980212 [本文引用: 2] C6-aldehydes [(E)-2-hexenal and (Z)-3-hexenal] induce expression of defense genes, accumulation of antifungal substances, and resistance against Botrytis cinerea with Arabidopsis. In order to elucidate the signaling pathway mediating the defense responses induced by C6-aldehydes in Arabidopsis, we compared the responses of Arabidopsis mutants deficient in the signaling pathways; i.e., etr1-1 (ethylene resistant), jar1-1 (jasmonate resistant), npr1-1 (salicylic acid insensitive), or pad2-1 (phytoalexin-deficient) with those of wild type (WT) plants. Induction of some, but not all of the defense genes in response to C6-aldehydes was significantly repressed in jar1-1, etr1-1, and pad2-1, but not at all in npr1-1. C6-aldehyde-treatment enhanced accumulation of camalexin with WT and npr1-1, but only partially with etr1-1 and jar1-1. pad2-1 showed little accumulation of camalexin. npr1-1 accumulated the antifungal substances as WT did, however, etr1-1, jar1-1 and pad2-1 exhibited only partial accumulation. The treatment enhanced resistance of etr1-1, jar1-1 and npr1-1 against B. cinerea, but failed to enhance the resistance of pad2-1. Taken together, it was suggested that ETR1-, JAR1-, and PAD2-dependent signaling pathways were simultaneously activated by C6-aldehyde-treatment. Among these, PAD2-dependent signaling appeared to be most important. In contrast, involvement of NPR1-dependent signaling was minimal.Copyright ? 2006 Elsevier Ireland Ltd. All rights reserved.
[41] Kuzma J Fall R 1993 ). Leaf Isoprene emission rate is dependent on leaf development and the level of isoprene synthasePlant Physiol 101 ,435 -440 . DOI:
10.1104/pp.101.2.435 URL [本文引用: 3] [42] Liu YY Du MM Deng L Shen JF Fang MM Chen Q Lu YH Wang QM Li CY Zhai QZ 2019 ). MYC2 regulates the termination of jasmonate signaling via an autoregulatory negative feedback loopPlant Cell 31 ,106 -127 . DOI:
10.1105/tpc.18.00405 URL [本文引用: 1] [43] Loreto F Barta C Brilli F Noguest I 2006 ). On the induction of volatile organic compound emissions by plants as consequence of wounding or fluctuations of light and temperaturePlant Cell Environ 29 ,1820 -1828 . DOI:
10.1111/pce.2006.29.issue-9 URL [本文引用: 1] [44] Lu HB Xu SY Zhang WJ Xu CM Li BX Zhang DX Mu W Liu F 2017 ). Nematicidal activity of trans -2-hexenal against Southern Root-Knot Nematode ( Meloidogyne incognita ) on tomato plantsJ Agric Food Chem 65 ,544 - 550 . DOI:
10.1021/acs.jafc.6b04091 URL [本文引用: 1] [45] Matsui K 2006 ). Green leaf volatiles: hydroperoxide lyase pathway of oxylipin metabolismCurr Opin Plant Biol 9 ,274 -280 . DOI:
10.1016/j.pbi.2006.03.002 URL [本文引用: 1] [46] Matsui K Kurishita S Hisamitsu A Kajiwara T 2000 ). A lipid-hydrolysing activity involved in hexenal formationBiochem Soc Trans 28 ,857 -860 . DOI:
10.1042/bst0280857 URL [本文引用: 2] [47] Mirabella R Rauwerda H Allmann S Scala A Spyropoulou EA de Vries M Boersma MR Breit TM Haring MA Schuurink RC 2015 ). WRKY40 and WRKY6 act downstream of the green leaf volatile E -2-hexenal in ArabidopsisPlant J 83 , 1082 -1096 . DOI:
10.1111/tpj.12953 URL [本文引用: 2] [48] Mirabella R Rauwerda H Struys EA Jakobs C Triantaphylidès C Haring MA Schuurink RC 2008 ). The Arabidopsis her1 mutant implicates GABA in E -2-hexenal responsivenessPlant J 53 ,197 -213 . PMID:
17971036 [本文引用: 5] When wounded or attacked by herbivores or pathogens, plants produce a blend of six-carbon alcohols, aldehydes and esters, known as C6-volatiles. Undamaged plants, when exposed to C6-volatiles, respond by inducing defense-related genes and secondary metabolites, suggesting that C6-volatiles can act as signaling molecules regulating plant defense responses. However, to date, the molecular mechanisms by which plants perceive and respond to these volatiles are unknown. To elucidate such mechanisms, we decided to isolate Arabidopsis thaliana mutants in which responses to C6-volatiles were altered. We observed that treatment of Arabidopsis seedlings with the C6-volatile E-2-hexenal inhibits root elongation. Among C6-volatiles this response is specific to E-2-hexenal, and is not dependent on ethylene, jasmonic and salicylic acid. Using this bioassay, we isolated 18 E-2-hexenal-response (her) mutants that showed sustained root growth after E-2-hexenal treatment. Here, we focused on the molecular characterization of one of these mutants, her1. Microarray and map-based cloning revealed that her1 encodes a gamma-amino butyric acid transaminase (GABA-TP), an enzyme that degrades GABA. As a consequence of the mutation, her1 plants accumulate high GABA levels in all their organs. Based on the observation that E-2-hexenal treatment induces GABA accumulation, and that high GABA levels confer resistance to E-2-hexenal, we propose a role for GABA in mediating E-2-hexenal responses.
[49] Neri F Mari M Menniti AM Brigati S Bertolini P 2006 ). Control of Penicillium expansum in pears and apples by trans -2-hexenal vapoursPostharvest Biol Technol 41 ,101 -108 . DOI:
10.1016/j.postharvbio.2006.02.005 URL [本文引用: 1] [50] Noordermeer MA Veldink GA Vliegenthart JFG 2001 ). Fatty acid hydroperoxide lyase: a plant cytochrome P450 enzyme involved in wound healing and pest resistanceChemBioChem 2 ,494 -504 . DOI:
10.1002/1439-7633(20010803)2:7/8<>1.0.CO;2-B URL [本文引用: 1] [51] R?se USR Manukian A Heath RR Tumlinson JH 1996 ). Volatile semiochemicals released from undamaged cotton leaves (a systemic response of living plants to caterpillar damage)Plant Physiol 111 ,487 -495 . DOI:
10.1104/pp.111.2.487 URL [本文引用: 3] [52] Scala A Allmann S Mirabella R Haring MA Schuurink RC 2013a ). Green leaf volatiles: a plant’s multifunctional weapon against herbivores and pathogensInt J Mol Sci 14 ,17781 -17811 . DOI:
10.3390/ijms140917781 URL [本文引用: 3] [53] Scala A Mirabella R Goedhart J de Vries M Haring MA Schuurink RC 2017 ). Forward genetic screens identify a role for the mitochondrial HER2 in E -2-hexenal responsivenessPlant Mol Biol 95 ,399 -409 . DOI:
10.1007/s11103-017-0659-8 URL [本文引用: 1] [54] Scala A Mirabella R Mugo C Matsui K Haring MA Schuurink RC 2013b ). E-2-hexenal promotes susceptibility to Pseudomonas syringae by activating jasmonic acid pathways in ArabidopsisFront Plant Sci 4 , 74 . [本文引用: 8] [55] Shen H Hou NY Schlicht M Wan YL Mancuso S Baluska F 2008 ). Aluminium toxicity targets PIN2 in Arabidopsis root apices: effects on PIN2 endocytosis, vesicular recycling, and polar auxin transportChin Sci Bull 53 ,2480 -2487 . [本文引用: 1] [56] Wakai J Kusama S Nakajima K Kawai S Okumura Y Shiojiri K 2019 ). Effects of trans -2-hexenal and cis -3- hexenal on post-harvest strawberrySci Rep 9 ,10112 . DOI:
10.1038/s41598-019-46307-4 URL [本文引用: 1] [57] Yan ZG Wang CZ 2006 ). Wound-induced green leaf volatiles cause the release of acetylated derivatives and a terpenoid in maizePhytochemistry 67 ,34 -42 . DOI:
10.1016/j.phytochem.2005.10.005 URL [本文引用: 1] [58] Zeringue HJ Jr McCormick SP 1990 ). Aflatoxin production in cultures of Aspergillus flavus incubated in atmospheres containing selected cotton leaf-derived volatilesToxicon 28 ,445 -448 . DOI:
10.1016/0041-0101(90)90083-J URL [本文引用: 2] [59] Zhang PY Chen KS 2009 ). Age-dependent variations of volatile emissions and inhibitory activity toward Botrytis cinerea and Fusarium oxysporum in tomato leaves treated with chitosan oligosaccharideJ Plant Biol 52 ,332 - 339 . DOI:
10.1007/s12374-009-9043-9 URL [本文引用: 1] We investigated variations in the level and composition of volatiles emitted by tomato leaves at different ages. Our focus also included their antifungal properties and responses to chitosan oligosaccharide. Based on leaf position, the release of volatiles decreased over time. Young leaves produced high levels of C6-aldehyde, which is mainly composed of hexenal, while the volatiles emitted by more mature leaves largely comprised terpenes, particularly β-phellandrene and caryophyllane. In young upper leaves, the main components (up to 86% of the total) were hexenal, β-phellandrene, and caryophyllane. Their levels decreased steadily over time, from 386.3 μg g<sup>−1</sup> fresh weight (FW) in young leaves to 113.2 μg g<sup>−1</sup> FW in old tissues. Volatiles emitted from young leaves exhibited the best antifungal activity against spore germination and hyphal growth by <i>Botrytis cinerea</i> and <i>Fusarium oxysporum</i>. Leaves became more susceptible to oligosaccharide treatment with increasing age. When young tissues were exposed to chitosan, we found declines in both the quantity of volatiles and their ability to inhibit fungal growth. Compared with the control, the amount of volatiles from young tissues was 88.4% lower after such treatment. In contrast, contents of volatiles from old and adult leaves were dramatically increased by chitosan oligosaccharide. Likewise, their inhibitory effect was significantly enhanced. Therefore, our results suggest that these volatiles are responsible for antifungal activity and may play a role in age-related resistance by tomato.
[60] Zhuang H Hamilton-Kemp TR Andersen RA Hildebrand DF 1992 ). Developmental change in C6 -aldehyde formation by soybean leavesPlant Physiol 100 ,80 -87 . PMID:
16653005 [本文引用: 1] Damage to plant leaves by wounding or freezing induces the production of large amounts of C(6)-compounds. However, the control of formation of these compounds in leaves is not yet clear. In the current study, C(6)-aldehyde formation by freeze-injured soybean leaves of different ages (based on the leaf positions on the plant) at stage R1 of plant development was investigated. The results demonstrate that C(6)-aldehyde formation by the soybean (Glycine max L.) leaves changes as leaves develop. Younger leaves produce high levels of C(6)-aldehydes, mainly composed of hexanal. Subsequently, as the leaves develop, the level of C(6)-aldehyde formation decreases markedly, followed by an increase with a large shift from hexanal to hexenals. Lipoxygenase and lipolytic acyl hydrolase activity was reduced, and, in contrast, hydroperoxide lyase activity increased. There was little difference in lipoxygenase substrate specificity for linoleic acid and linolenic acid, but hydroperoxide lyase preferentially utilized 13-hydroperoxy-9,11,15-octadecatrienoic acid. In the in vivo lipoxygenase substrate pool, the linoleic acid level declined and the relative level of linolenic acid increased. The change in ratios of linolenic acid to linoleic acid showed a similar trend during soybean leaf development to that of hexenals to hexanal.
苯并噻唑和反式-2-己烯醛对不同虫态韭菜迟眼蕈蚊的生物活性. 硕士论文
1
2014
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
2
2017
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
反式-2-己烯醛对猕猴桃贮藏过程扩展青霉生长的抑制作用
1
2019
... 已有研究表明, 几乎所有挥发性物质都具有抑菌活性, 反式-2-己烯醛作为天然挥发物也具有显著抗菌性能, 较低浓度就能抑制革兰氏阴性、阳性菌和部分真菌的生物活性(Gardini
et al. 1997 ; Bisignano
et al. 2001 ).研究发现, 反式-2-己烯醛可作为无公害的植物源生物活性物质, 取代紫外线辐射和超声波等物理灭菌法对水果进行灭菌.扩展青霉(
Penicillium expansum )是引起苹果和猕猴桃(
Actinidia chinensis )等水果腐烂的主要霉菌之一.Neri等(
2006 )研究表明, 外源反式-2-己烯醛处理可使扩展青霉霉菌对梨(
Pyrus spp.)和苹果的感染能力明显下降; 同样, 感染青霉菌的猕猴桃经反式-2-己烯醛处理后扩展青霉萌发分生孢子的真菌膜遭到破坏, 菌丝出现皱缩和干瘪等现象, 其孢子的繁殖和扩展青霉素的产生与积累受到抑制(段腾飞等,
2019 ).另有研究表明, 外源反式-2-己烯醛可使柑橘酸腐病菌(
Geotrichum citriaurentii )的菌丝体形态改变, 出现凹陷、干瘪以及不规则扭曲等情况, 采用卡尔科弗卢尔荧光增白剂(Calcofluor White Stain: GFW)染色后出现酸腐病菌菌丝体蓝色荧光均匀减弱, 表明反式-2-己烯醛可以破坏酸腐病菌细胞壁的完整性(杨艳琴,
2019 ).上述研究表明, 反式-2-己烯醛通过破坏菌体细胞结构抑制其生长和繁殖, 使植物避免病原菌的侵染.在与病原菌的长期协同进化过程中, 植物可快速合成并释放反式- 2-己烯醛以诱导防御反应, 明显提高了生存机会. ...
模拟酸雨对毛竹叶片抗氧化酶活性及释放绿叶挥发物的影响
1
2014
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
1
2014
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
1
2013
... 用外源反式-2-己烯醛处理采摘后的草莓果实可以显著降低霉菌的感染程度(Wakai
et al. 2019 ).外源反式-2-己烯醛处理后, 植物防御反应相关的脂氧合酶、苯丙氨酸转氨酶(phenylalaninammo-nialyase, PAL)、过氧化物酶(peroxidase oxidase, POD)及多酚氧化酶(polyphenol oxidase, PPO)等的活性显著增强, 并诱导酚类化合物和黄酮类化合物积累, 从而增强抗病能力(Gomi
et al. 2003 ; 苗建强,
2013 ; Guo
et al. 2015 ).用外源反式-2-己烯醛处理灰霉菌感染的番茄(
Solanum lycopersicum )幼苗后, 植株体内JA和乙烯(ethylene, ET)通路基因
LOX 、
ETR3 和
ETR4 等的表达量显著增高, 推测反式-2-己烯醛可能通过介导JA/ET通路来响应病原菌侵染(Guo
et al. 2015 ).Zeringue和McCormick (
1990 )以及Kishimoto等(2000)也认为, 反式-2-己烯醛能够诱导JA信号通路
LOX 基因的表达, 诱导防御反应.Zeringue等(
1990 )研究证实, 经过反式-2-己烯醛处理的棉花对黄曲霉毒素产生很强的拮抗作用, 并提出LOX途径可能参与该反应.Kishimoto等(2000)证实反式-2-己烯醛处理后拟南芥中
LOX2 的表达量上调.LOX是JA合成过程中的关键酶, JA在植物生长发育、成熟衰老以及逆境胁迫应答过程中起重要的调节作用.上述结果表明, 反式-2-己烯醛可以诱导防御相关基因的表达, 积累防御相关物质从而增强抗病能力. ...
五种挥发性化合物对土传病原真菌及线虫的生物活性
1
2012
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
1
2011
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
绿叶挥发物产生特征及其生态生理作用研究进展
2
2013
... 目前, 国内外对反式-2-己烯醛的研究较少, 早期研究主要集中在合成途径方面.日本汉口大学的Hatanaka从茶树(
Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(
trans -2-hexenol)和顺式-3-己烯醇(
cis -3-hexenol), 这是早期对于C
6 挥发物合成途径较为系统的报道(Hatanaka and Harada,
1973 ).近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auria
et al. 2007; 孙海峰等,
2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(
S )- hydroperoxy 9
Z , 11
E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(
S )-hydroperoxy 9
Z , 11
E , 15
Z -octadecatrienoic acid, 13-HPOTE) (Scala
et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(
n -hexanal)和愈伤素(9
Z -traumatin) (Scala
et al. 2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
... ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
引诱茶尺蠖天敌寄生蜂的茶树挥发物的分离与鉴定
1
1999
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
1
2019
... 已有研究表明, 几乎所有挥发性物质都具有抑菌活性, 反式-2-己烯醛作为天然挥发物也具有显著抗菌性能, 较低浓度就能抑制革兰氏阴性、阳性菌和部分真菌的生物活性(Gardini
et al. 1997 ; Bisignano
et al. 2001 ).研究发现, 反式-2-己烯醛可作为无公害的植物源生物活性物质, 取代紫外线辐射和超声波等物理灭菌法对水果进行灭菌.扩展青霉(
Penicillium expansum )是引起苹果和猕猴桃(
Actinidia chinensis )等水果腐烂的主要霉菌之一.Neri等(
2006 )研究表明, 外源反式-2-己烯醛处理可使扩展青霉霉菌对梨(
Pyrus spp.)和苹果的感染能力明显下降; 同样, 感染青霉菌的猕猴桃经反式-2-己烯醛处理后扩展青霉萌发分生孢子的真菌膜遭到破坏, 菌丝出现皱缩和干瘪等现象, 其孢子的繁殖和扩展青霉素的产生与积累受到抑制(段腾飞等,
2019 ).另有研究表明, 外源反式-2-己烯醛可使柑橘酸腐病菌(
Geotrichum citriaurentii )的菌丝体形态改变, 出现凹陷、干瘪以及不规则扭曲等情况, 采用卡尔科弗卢尔荧光增白剂(Calcofluor White Stain: GFW)染色后出现酸腐病菌菌丝体蓝色荧光均匀减弱, 表明反式-2-己烯醛可以破坏酸腐病菌细胞壁的完整性(杨艳琴,
2019 ).上述研究表明, 反式-2-己烯醛通过破坏菌体细胞结构抑制其生长和繁殖, 使植物避免病原菌的侵染.在与病原菌的长期协同进化过程中, 植物可快速合成并释放反式- 2-己烯醛以诱导防御反应, 明显提高了生存机会. ...
1-戊烯-3-酮在植物防御反应中的作用
1
2019
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
反式- 2-己烯醛抑制拟南芥根尖生长素极性运输
3
2016
... IAA是植物体内最重要的激素之一, 其合成和转运影响植物的生长发育和形态建成, 质外体环境pH的稳定对植物根的生长也较为重要.张婷等(
2016 )利用非损伤微测技术(NMT)实时监测了外源反式-2-己烯醛处理后拟南芥根尖IAA和H
+ 的转运过程, 发现IAA的转运方向及流速在根尖不同功能区存在较大差异.正常情况下, 根尖分生区及过渡区的IAA会外流, 用反式-2-己烯醛熏蒸处理会显著抑制其外流趋势, 使IAA的整体流速降低, 且从过渡区向伸长区的转运过程被抑制.为进一步解释该现象, 研究还测定了IAA转运相关基因的表达情况, 发现外源反式-2-己烯醛熏蒸处理后, IAA转运基因(
PIN1 、
PIN2 和
PIN3 )的表达量明显低于对照组,
PIN4 的表达量则上调, 而IAA内向转运体基因
AUX1 的转录水平并未改变.此外, 外源反式-2-己烯醛熏蒸处理还导致IAA受体基因
TIR1 下调表达, 由此表明反式-2-己烯醛能在转录水平上降低根部对IAA的极性转运和感知过程(张婷等,
2016 ).反式-2-己烯醛增强植物防御反应的同时表现出减缓生长的现象, 其中可能的原因是植物在积累防御反应物质的同时会相应减少用于生长发育的物质积累(Coley
et al. 1985 ; 张婷等,
2016 ).外源反式-2-己烯醛熏蒸处理可以抑制拟南芥根尖分生区与过渡区的H
+ 内流.一般情况下, 植物根尖各个部位H
+ 流速存在较大差异, 距根尖100-700 μm处的H
+ 呈现整体内流的趋势, 且在300 μm过渡区内流流速达最大值, 而反式-2-己烯醛处理可显著降低这2个区域的平均H
+ 流速(未发表数据).细胞内pH环境的稳定对植物根系正常生长至关重要, 已知布雷菲德菌素A (Brefeldin A, BFA)处理能显著抑制拟南芥根尖过渡区的生长素运输(Shen
et al. 2008 ), 同时, BFA处理抑制了根尖分生区与过渡区的H
+ 内流, 这一现象与外源反式-2-己烯醛处理结果一致(未发表数据).由此推测, 根尖分生区与过渡区的H
+ 转运可能与生长素的极性运输密切相关, 外源反式-2-己烯醛处理改变了植物根系质外体环境的pH值, 这种变化直接影响植物根系的生长发育. ...
... 下调表达, 由此表明反式-2-己烯醛能在转录水平上降低根部对IAA的极性转运和感知过程(张婷等,
2016 ).反式-2-己烯醛增强植物防御反应的同时表现出减缓生长的现象, 其中可能的原因是植物在积累防御反应物质的同时会相应减少用于生长发育的物质积累(Coley
et al. 1985 ; 张婷等,
2016 ).外源反式-2-己烯醛熏蒸处理可以抑制拟南芥根尖分生区与过渡区的H
+ 内流.一般情况下, 植物根尖各个部位H
+ 流速存在较大差异, 距根尖100-700 μm处的H
+ 呈现整体内流的趋势, 且在300 μm过渡区内流流速达最大值, 而反式-2-己烯醛处理可显著降低这2个区域的平均H
+ 流速(未发表数据).细胞内pH环境的稳定对植物根系正常生长至关重要, 已知布雷菲德菌素A (Brefeldin A, BFA)处理能显著抑制拟南芥根尖过渡区的生长素运输(Shen
et al. 2008 ), 同时, BFA处理抑制了根尖分生区与过渡区的H
+ 内流, 这一现象与外源反式-2-己烯醛处理结果一致(未发表数据).由此推测, 根尖分生区与过渡区的H
+ 转运可能与生长素的极性运输密切相关, 外源反式-2-己烯醛处理改变了植物根系质外体环境的pH值, 这种变化直接影响植物根系的生长发育. ...
... ; 张婷等,
2016 ).外源反式-2-己烯醛熏蒸处理可以抑制拟南芥根尖分生区与过渡区的H
+ 内流.一般情况下, 植物根尖各个部位H
+ 流速存在较大差异, 距根尖100-700 μm处的H
+ 呈现整体内流的趋势, 且在300 μm过渡区内流流速达最大值, 而反式-2-己烯醛处理可显著降低这2个区域的平均H
+ 流速(未发表数据).细胞内pH环境的稳定对植物根系正常生长至关重要, 已知布雷菲德菌素A (Brefeldin A, BFA)处理能显著抑制拟南芥根尖过渡区的生长素运输(Shen
et al. 2008 ), 同时, BFA处理抑制了根尖分生区与过渡区的H
+ 内流, 这一现象与外源反式-2-己烯醛处理结果一致(未发表数据).由此推测, 根尖分生区与过渡区的H
+ 转运可能与生长素的极性运输密切相关, 外源反式-2-己烯醛处理改变了植物根系质外体环境的pH值, 这种变化直接影响植物根系的生长发育. ...
植物间挥发物信号的研究进展
1
2009
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
Reactive electrophile species activate defense gene expression in Arabidopsis
1
2003
... 反式-2-己烯醛又称青叶醛, 分子式为C
6 H
10 O, 为无色油状液体, 不溶于水, 溶于乙醇和甲醇等有机溶剂, 具有绿叶清香和淡淡的水果香气, 可用于调配苹果(
Malus pumila )和草莓(
Fragaria ×
ananassa )等食用香精.水果中天然存在反式-2-己烯醛, 在苹果汁中含量可达72.26 mg·m
-3 , 香蕉(
Musa nana )中反式-2-己烯醛的含量达305.09 mg·m
-3 (Dittberner
et al. 1997 ).与其它绿叶挥发物不同, 反式-2-己烯醛含有α,β-不饱和羰基, α,β-不饱和羰基是亲电反应物质(reactive electrophile species, RES), 其不饱和的羰基基团能够与蛋白质中普遍含有的亲电基团(如巯基或氨基)发生迈克尔加成反应(Michael Addition)形成加合物, 可在多种胁迫环境下诱导活性氧(reactive oxygen species, ROS)产生并激活下游的防御反应(Alméras
et al. 2003 ; Farmer and Davoine,
2007 ; Farmer and Mueller,
2013 ).研究发现, 采用反式-2-己烯醛处理过的植株与顺式-3-己烯醛(
cis -3-hexenal)处理过的植株相比产生的植物抗毒素(camelexin)更多, 推测与α,β-不饱和羰基有关(Kishimoto
et al. 2006 ). ...
Plant-plant interactions mediated by volatiles emitted from plants infested by spider mites
1
2001
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
Herbivore-induced volatiles induce the emission of ethylene in neighboring lima bean plants
3
2002
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
... 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
C
6 -volatiles derived from the lipoxygenase pathway induce a subset of defense-related genes
2
1998
... 植物吸收水分和养分依赖于根系, 根系对植物地上部的生长发育和抗逆性等诸多方面具有重要作用.研究表明, 反式-2-己烯醛通过抑制植物根系生长发育而影响植物根的形态建成, 这可能与其具有α,β-不饱和羰基结构有关(Bate and Rothstein,
1998 ; Mirabella
et al. 2008 ).用0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理植株后, 拟南芥(
Arabidopsis thaliana )初生根的生长明显受抑制, 表明低浓度反式-2-己烯醛抑制根系生长, 这一作用与MeJA相似(Bate and Rothstein,
1998 ).Mirabella等(
2008 )发现反式-2-己烯醛对根系生长的影响具有浓度效应, 浓度越高对根系生长的抑制作用越明显.用外源反式-2-己烯醛熏蒸处理野生型拟南芥和突变体
her1 (
hexenal-response-1 ; 编码γ-氨基丁酸(γ-aminobutyric acid, GABA)转氨酶) 24小时, 继续培养3天后, 发现野生型拟南芥根系生长被显著抑制, 而对突变体植株根系生长的抑制作用较弱, 且在高浓度外源反式-2-己烯醛处理条件下也是如此.随后研究发现, GABA与反式-2-己烯醛抑制根系生长这一生理过程有关, 用外源反式-2-己烯醛熏蒸野生型和突变体
her1 幼苗均可诱导GABA的积累, 但突变体
her1 植株中GABA积累的水平更高, 外源施加GABA可以增强
her1 幼苗对反式-2-己烯醛抑制根系生长的抵抗能力(Mirabella
et al. 2008 ).由此推测,
her1 幼苗中积累的高水平GABA可能是植株根系不受反式-2-己烯醛抑制的主要原因.此外, Mirabella等(
2015 )还发现
wrky40 /
wrky6 双突变体根伸长不受反式-2-己烯醛抑制, 他们用0.1-0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理野生型拟南芥和双突变体幼苗24小时, 继续培养3天后测量根长, 显示其根伸长不受抑制, 这说明
AtWRKY40 和
AtWRKY6 作为关键基因参与反式-2-己烯醛对根生长的抑制过程, 且作用于反式-2-己烯醛的下游. ...
... )初生根的生长明显受抑制, 表明低浓度反式-2-己烯醛抑制根系生长, 这一作用与MeJA相似(Bate and Rothstein,
1998 ).Mirabella等(
2008 )发现反式-2-己烯醛对根系生长的影响具有浓度效应, 浓度越高对根系生长的抑制作用越明显.用外源反式-2-己烯醛熏蒸处理野生型拟南芥和突变体
her1 (
hexenal-response-1 ; 编码γ-氨基丁酸(γ-aminobutyric acid, GABA)转氨酶) 24小时, 继续培养3天后, 发现野生型拟南芥根系生长被显著抑制, 而对突变体植株根系生长的抑制作用较弱, 且在高浓度外源反式-2-己烯醛处理条件下也是如此.随后研究发现, GABA与反式-2-己烯醛抑制根系生长这一生理过程有关, 用外源反式-2-己烯醛熏蒸野生型和突变体
her1 幼苗均可诱导GABA的积累, 但突变体
her1 植株中GABA积累的水平更高, 外源施加GABA可以增强
her1 幼苗对反式-2-己烯醛抑制根系生长的抵抗能力(Mirabella
et al. 2008 ).由此推测,
her1 幼苗中积累的高水平GABA可能是植株根系不受反式-2-己烯醛抑制的主要原因.此外, Mirabella等(
2015 )还发现
wrky40 /
wrky6 双突变体根伸长不受反式-2-己烯醛抑制, 他们用0.1-0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理野生型拟南芥和双突变体幼苗24小时, 继续培养3天后测量根长, 显示其根伸长不受抑制, 这说明
AtWRKY40 和
AtWRKY6 作为关键基因参与反式-2-己烯醛对根生长的抑制过程, 且作用于反式-2-己烯醛的下游. ...
In vitro antibacterial activity of some aliphatic aldehydes from
Olea europaea L
1
2001
... 已有研究表明, 几乎所有挥发性物质都具有抑菌活性, 反式-2-己烯醛作为天然挥发物也具有显著抗菌性能, 较低浓度就能抑制革兰氏阴性、阳性菌和部分真菌的生物活性(Gardini
et al. 1997 ; Bisignano
et al. 2001 ).研究发现, 反式-2-己烯醛可作为无公害的植物源生物活性物质, 取代紫外线辐射和超声波等物理灭菌法对水果进行灭菌.扩展青霉(
Penicillium expansum )是引起苹果和猕猴桃(
Actinidia chinensis )等水果腐烂的主要霉菌之一.Neri等(
2006 )研究表明, 外源反式-2-己烯醛处理可使扩展青霉霉菌对梨(
Pyrus spp.)和苹果的感染能力明显下降; 同样, 感染青霉菌的猕猴桃经反式-2-己烯醛处理后扩展青霉萌发分生孢子的真菌膜遭到破坏, 菌丝出现皱缩和干瘪等现象, 其孢子的繁殖和扩展青霉素的产生与积累受到抑制(段腾飞等,
2019 ).另有研究表明, 外源反式-2-己烯醛可使柑橘酸腐病菌(
Geotrichum citriaurentii )的菌丝体形态改变, 出现凹陷、干瘪以及不规则扭曲等情况, 采用卡尔科弗卢尔荧光增白剂(Calcofluor White Stain: GFW)染色后出现酸腐病菌菌丝体蓝色荧光均匀减弱, 表明反式-2-己烯醛可以破坏酸腐病菌细胞壁的完整性(杨艳琴,
2019 ).上述研究表明, 反式-2-己烯醛通过破坏菌体细胞结构抑制其生长和繁殖, 使植物避免病原菌的侵染.在与病原菌的长期协同进化过程中, 植物可快速合成并释放反式- 2-己烯醛以诱导防御反应, 明显提高了生存机会. ...
Biological activity of
trans -2-hexenal against
Bradysia odoriphaga (Diptera: Sciaridae) at different developmental stages
1
2015
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
Effects of
trans -2-hexenal on reproduction, growth and behaviour and efficacy against the pinewood nematode,Bursaphelenchus xylophilus
1
2017
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
Resource availability and plant antiherbivore defense
1
1985
... IAA是植物体内最重要的激素之一, 其合成和转运影响植物的生长发育和形态建成, 质外体环境pH的稳定对植物根的生长也较为重要.张婷等(
2016 )利用非损伤微测技术(NMT)实时监测了外源反式-2-己烯醛处理后拟南芥根尖IAA和H
+ 的转运过程, 发现IAA的转运方向及流速在根尖不同功能区存在较大差异.正常情况下, 根尖分生区及过渡区的IAA会外流, 用反式-2-己烯醛熏蒸处理会显著抑制其外流趋势, 使IAA的整体流速降低, 且从过渡区向伸长区的转运过程被抑制.为进一步解释该现象, 研究还测定了IAA转运相关基因的表达情况, 发现外源反式-2-己烯醛熏蒸处理后, IAA转运基因(
PIN1 、
PIN2 和
PIN3 )的表达量明显低于对照组,
PIN4 的表达量则上调, 而IAA内向转运体基因
AUX1 的转录水平并未改变.此外, 外源反式-2-己烯醛熏蒸处理还导致IAA受体基因
TIR1 下调表达, 由此表明反式-2-己烯醛能在转录水平上降低根部对IAA的极性转运和感知过程(张婷等,
2016 ).反式-2-己烯醛增强植物防御反应的同时表现出减缓生长的现象, 其中可能的原因是植物在积累防御反应物质的同时会相应减少用于生长发育的物质积累(Coley
et al. 1985 ; 张婷等,
2016 ).外源反式-2-己烯醛熏蒸处理可以抑制拟南芥根尖分生区与过渡区的H
+ 内流.一般情况下, 植物根尖各个部位H
+ 流速存在较大差异, 距根尖100-700 μm处的H
+ 呈现整体内流的趋势, 且在300 μm过渡区内流流速达最大值, 而反式-2-己烯醛处理可显著降低这2个区域的平均H
+ 流速(未发表数据).细胞内pH环境的稳定对植物根系正常生长至关重要, 已知布雷菲德菌素A (Brefeldin A, BFA)处理能显著抑制拟南芥根尖过渡区的生长素运输(Shen
et al. 2008 ), 同时, BFA处理抑制了根尖分生区与过渡区的H
+ 内流, 这一现象与外源反式-2-己烯醛处理结果一致(未发表数据).由此推测, 根尖分生区与过渡区的H
+ 转运可能与生长素的极性运输密切相关, 外源反式-2-己烯醛处理改变了植物根系质外体环境的pH值, 这种变化直接影响植物根系的生长发育. ...
Adducts of oxylipin electrophiles to glutathione re?ect a 13 speci?city of the downstream lipoxygenase pathway in the tobacco hypersensitive response
1
2006
... 目前, 国内外对反式-2-己烯醛的研究较少, 早期研究主要集中在合成途径方面.日本汉口大学的Hatanaka从茶树(
Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(
trans -2-hexenol)和顺式-3-己烯醇(
cis -3-hexenol), 这是早期对于C
6 挥发物合成途径较为系统的报道(Hatanaka and Harada,
1973 ).近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auria
et al. 2007; 孙海峰等,
2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(
S )- hydroperoxy 9
Z , 11
E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(
S )-hydroperoxy 9
Z , 11
E , 15
Z -octadecatrienoic acid, 13-HPOTE) (Scala
et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(
n -hexanal)和愈伤素(9
Z -traumatin) (Scala
et al. 2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
Genotoxic effects of 2-trans-hexenal in human buccal mucosa cells in vivo
1
1997
... 反式-2-己烯醛又称青叶醛, 分子式为C
6 H
10 O, 为无色油状液体, 不溶于水, 溶于乙醇和甲醇等有机溶剂, 具有绿叶清香和淡淡的水果香气, 可用于调配苹果(
Malus pumila )和草莓(
Fragaria ×
ananassa )等食用香精.水果中天然存在反式-2-己烯醛, 在苹果汁中含量可达72.26 mg·m
-3 , 香蕉(
Musa nana )中反式-2-己烯醛的含量达305.09 mg·m
-3 (Dittberner
et al. 1997 ).与其它绿叶挥发物不同, 反式-2-己烯醛含有α,β-不饱和羰基, α,β-不饱和羰基是亲电反应物质(reactive electrophile species, RES), 其不饱和的羰基基团能够与蛋白质中普遍含有的亲电基团(如巯基或氨基)发生迈克尔加成反应(Michael Addition)形成加合物, 可在多种胁迫环境下诱导活性氧(reactive oxygen species, ROS)产生并激活下游的防御反应(Alméras
et al. 2003 ; Farmer and Davoine,
2007 ; Farmer and Mueller,
2013 ).研究发现, 采用反式-2-己烯醛处理过的植株与顺式-3-己烯醛(
cis -3-hexenal)处理过的植株相比产生的植物抗毒素(camelexin)更多, 推测与α,β-不饱和羰基有关(Kishimoto
et al. 2006 ). ...
Aroma von apfelmaische bei deren verflussigung durch pektinasen und zellulasen
0
1981
(
Z )-3-hexenol induces defense genes and downstream metabolites in maize
1
2005
... 目前, 国内外对反式-2-己烯醛的研究较少, 早期研究主要集中在合成途径方面.日本汉口大学的Hatanaka从茶树(
Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(
trans -2-hexenol)和顺式-3-己烯醇(
cis -3-hexenol), 这是早期对于C
6 挥发物合成途径较为系统的报道(Hatanaka and Harada,
1973 ).近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auria
et al. 2007; 孙海峰等,
2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(
S )- hydroperoxy 9
Z , 11
E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(
S )-hydroperoxy 9
Z , 11
E , 15
Z -octadecatrienoic acid, 13-HPOTE) (Scala
et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(
n -hexanal)和愈伤素(9
Z -traumatin) (Scala
et al. 2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
Reactive electrophile species
1
2007
... 反式-2-己烯醛又称青叶醛, 分子式为C
6 H
10 O, 为无色油状液体, 不溶于水, 溶于乙醇和甲醇等有机溶剂, 具有绿叶清香和淡淡的水果香气, 可用于调配苹果(
Malus pumila )和草莓(
Fragaria ×
ananassa )等食用香精.水果中天然存在反式-2-己烯醛, 在苹果汁中含量可达72.26 mg·m
-3 , 香蕉(
Musa nana )中反式-2-己烯醛的含量达305.09 mg·m
-3 (Dittberner
et al. 1997 ).与其它绿叶挥发物不同, 反式-2-己烯醛含有α,β-不饱和羰基, α,β-不饱和羰基是亲电反应物质(reactive electrophile species, RES), 其不饱和的羰基基团能够与蛋白质中普遍含有的亲电基团(如巯基或氨基)发生迈克尔加成反应(Michael Addition)形成加合物, 可在多种胁迫环境下诱导活性氧(reactive oxygen species, ROS)产生并激活下游的防御反应(Alméras
et al. 2003 ; Farmer and Davoine,
2007 ; Farmer and Mueller,
2013 ).研究发现, 采用反式-2-己烯醛处理过的植株与顺式-3-己烯醛(
cis -3-hexenal)处理过的植株相比产生的植物抗毒素(camelexin)更多, 推测与α,β-不饱和羰基有关(Kishimoto
et al. 2006 ). ...
ROS-mediated lipid peroxidation and RES-activated signaling
1
2013
... 反式-2-己烯醛又称青叶醛, 分子式为C
6 H
10 O, 为无色油状液体, 不溶于水, 溶于乙醇和甲醇等有机溶剂, 具有绿叶清香和淡淡的水果香气, 可用于调配苹果(
Malus pumila )和草莓(
Fragaria ×
ananassa )等食用香精.水果中天然存在反式-2-己烯醛, 在苹果汁中含量可达72.26 mg·m
-3 , 香蕉(
Musa nana )中反式-2-己烯醛的含量达305.09 mg·m
-3 (Dittberner
et al. 1997 ).与其它绿叶挥发物不同, 反式-2-己烯醛含有α,β-不饱和羰基, α,β-不饱和羰基是亲电反应物质(reactive electrophile species, RES), 其不饱和的羰基基团能够与蛋白质中普遍含有的亲电基团(如巯基或氨基)发生迈克尔加成反应(Michael Addition)形成加合物, 可在多种胁迫环境下诱导活性氧(reactive oxygen species, ROS)产生并激活下游的防御反应(Alméras
et al. 2003 ; Farmer and Davoine,
2007 ; Farmer and Mueller,
2013 ).研究发现, 采用反式-2-己烯醛处理过的植株与顺式-3-己烯醛(
cis -3-hexenal)处理过的植株相比产生的植物抗毒素(camelexin)更多, 推测与α,β-不饱和羰基有关(Kishimoto
et al. 2006 ). ...
Plant defense against insect herbivores
1
2013
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
Antifungal activity of hexanal as dependent on its vapor pressure
1
1997
... 已有研究表明, 几乎所有挥发性物质都具有抑菌活性, 反式-2-己烯醛作为天然挥发物也具有显著抗菌性能, 较低浓度就能抑制革兰氏阴性、阳性菌和部分真菌的生物活性(Gardini
et al. 1997 ; Bisignano
et al. 2001 ).研究发现, 反式-2-己烯醛可作为无公害的植物源生物活性物质, 取代紫外线辐射和超声波等物理灭菌法对水果进行灭菌.扩展青霉(
Penicillium expansum )是引起苹果和猕猴桃(
Actinidia chinensis )等水果腐烂的主要霉菌之一.Neri等(
2006 )研究表明, 外源反式-2-己烯醛处理可使扩展青霉霉菌对梨(
Pyrus spp.)和苹果的感染能力明显下降; 同样, 感染青霉菌的猕猴桃经反式-2-己烯醛处理后扩展青霉萌发分生孢子的真菌膜遭到破坏, 菌丝出现皱缩和干瘪等现象, 其孢子的繁殖和扩展青霉素的产生与积累受到抑制(段腾飞等,
2019 ).另有研究表明, 外源反式-2-己烯醛可使柑橘酸腐病菌(
Geotrichum citriaurentii )的菌丝体形态改变, 出现凹陷、干瘪以及不规则扭曲等情况, 采用卡尔科弗卢尔荧光增白剂(Calcofluor White Stain: GFW)染色后出现酸腐病菌菌丝体蓝色荧光均匀减弱, 表明反式-2-己烯醛可以破坏酸腐病菌细胞壁的完整性(杨艳琴,
2019 ).上述研究表明, 反式-2-己烯醛通过破坏菌体细胞结构抑制其生长和繁殖, 使植物避免病原菌的侵染.在与病原菌的长期协同进化过程中, 植物可快速合成并释放反式- 2-己烯醛以诱导防御反应, 明显提高了生存机会. ...
Effect of
trans -2-hexenal on the growth of
Aspergillus flavus in relation to its concentration, temperature and water activity
1
2010
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
Characterization of a hydroperoxide lyase gene and effect of C
6 -volatiles on expression of genes of the oxylipin metabolism in Citrus
1
2003
... 用外源反式-2-己烯醛处理采摘后的草莓果实可以显著降低霉菌的感染程度(Wakai
et al. 2019 ).外源反式-2-己烯醛处理后, 植物防御反应相关的脂氧合酶、苯丙氨酸转氨酶(phenylalaninammo-nialyase, PAL)、过氧化物酶(peroxidase oxidase, POD)及多酚氧化酶(polyphenol oxidase, PPO)等的活性显著增强, 并诱导酚类化合物和黄酮类化合物积累, 从而增强抗病能力(Gomi
et al. 2003 ; 苗建强,
2013 ; Guo
et al. 2015 ).用外源反式-2-己烯醛处理灰霉菌感染的番茄(
Solanum lycopersicum )幼苗后, 植株体内JA和乙烯(ethylene, ET)通路基因
LOX 、
ETR3 和
ETR4 等的表达量显著增高, 推测反式-2-己烯醛可能通过介导JA/ET通路来响应病原菌侵染(Guo
et al. 2015 ).Zeringue和McCormick (
1990 )以及Kishimoto等(2000)也认为, 反式-2-己烯醛能够诱导JA信号通路
LOX 基因的表达, 诱导防御反应.Zeringue等(
1990 )研究证实, 经过反式-2-己烯醛处理的棉花对黄曲霉毒素产生很强的拮抗作用, 并提出LOX途径可能参与该反应.Kishimoto等(2000)证实反式-2-己烯醛处理后拟南芥中
LOX2 的表达量上调.LOX是JA合成过程中的关键酶, JA在植物生长发育、成熟衰老以及逆境胁迫应答过程中起重要的调节作用.上述结果表明, 反式-2-己烯醛可以诱导防御相关基因的表达, 积累防御相关物质从而增强抗病能力. ...
Postharvest treatment with
trans -2-hexenal induced resistance against
Botrytis cinerea in tomato fruit
2
2015
... 用外源反式-2-己烯醛处理采摘后的草莓果实可以显著降低霉菌的感染程度(Wakai
et al. 2019 ).外源反式-2-己烯醛处理后, 植物防御反应相关的脂氧合酶、苯丙氨酸转氨酶(phenylalaninammo-nialyase, PAL)、过氧化物酶(peroxidase oxidase, POD)及多酚氧化酶(polyphenol oxidase, PPO)等的活性显著增强, 并诱导酚类化合物和黄酮类化合物积累, 从而增强抗病能力(Gomi
et al. 2003 ; 苗建强,
2013 ; Guo
et al. 2015 ).用外源反式-2-己烯醛处理灰霉菌感染的番茄(
Solanum lycopersicum )幼苗后, 植株体内JA和乙烯(ethylene, ET)通路基因
LOX 、
ETR3 和
ETR4 等的表达量显著增高, 推测反式-2-己烯醛可能通过介导JA/ET通路来响应病原菌侵染(Guo
et al. 2015 ).Zeringue和McCormick (
1990 )以及Kishimoto等(2000)也认为, 反式-2-己烯醛能够诱导JA信号通路
LOX 基因的表达, 诱导防御反应.Zeringue等(
1990 )研究证实, 经过反式-2-己烯醛处理的棉花对黄曲霉毒素产生很强的拮抗作用, 并提出LOX途径可能参与该反应.Kishimoto等(2000)证实反式-2-己烯醛处理后拟南芥中
LOX2 的表达量上调.LOX是JA合成过程中的关键酶, JA在植物生长发育、成熟衰老以及逆境胁迫应答过程中起重要的调节作用.上述结果表明, 反式-2-己烯醛可以诱导防御相关基因的表达, 积累防御相关物质从而增强抗病能力. ...
...
2015 ).Zeringue和McCormick (
1990 )以及Kishimoto等(2000)也认为, 反式-2-己烯醛能够诱导JA信号通路
LOX 基因的表达, 诱导防御反应.Zeringue等(
1990 )研究证实, 经过反式-2-己烯醛处理的棉花对黄曲霉毒素产生很强的拮抗作用, 并提出LOX途径可能参与该反应.Kishimoto等(2000)证实反式-2-己烯醛处理后拟南芥中
LOX2 的表达量上调.LOX是JA合成过程中的关键酶, JA在植物生长发育、成熟衰老以及逆境胁迫应答过程中起重要的调节作用.上述结果表明, 反式-2-己烯醛可以诱导防御相关基因的表达, 积累防御相关物质从而增强抗病能力. ...
The biogeneration of green odour by green leaves
1
1993
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
Formation of
cis -3-hexenal,
trans -2-hexenal and
cis -3-hexenol in macerated
Thea sinensis leaves
1
1973
... 目前, 国内外对反式-2-己烯醛的研究较少, 早期研究主要集中在合成途径方面.日本汉口大学的Hatanaka从茶树(
Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(
trans -2-hexenol)和顺式-3-己烯醇(
cis -3-hexenol), 这是早期对于C
6 挥发物合成途径较为系统的报道(Hatanaka and Harada,
1973 ).近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auria
et al. 2007; 孙海峰等,
2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(
S )- hydroperoxy 9
Z , 11
E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(
S )-hydroperoxy 9
Z , 11
E , 15
Z -octadecatrienoic acid, 13-HPOTE) (Scala
et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(
n -hexanal)和愈伤素(9
Z -traumatin) (Scala
et al. 2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
Seasonal variations in
trans -2-hexenal and linolenic acid in homogenates of
Thea sinensis leaves
1
1976
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
Biosynthetic pathway for C
6 -aldehydes formation from linolenic acid in green leaves
0
1987
Green leaf volatiles enhance methyl jasmonate response in Arabidopsis
1
2012
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
Volatile C
6 -aldehydes and allo-ocimene activate defense genes and induce resistance against Botrytis cinerea in Arabidopsis thaliana
1
2005
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
ETR1-, JAR1- and PAD2-dependent signaling pathways are involved in C
6 -aldehyde-induced defense responses of
Arabidopsis 2
2006
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
... 反式-2-己烯醛又称青叶醛, 分子式为C
6 H
10 O, 为无色油状液体, 不溶于水, 溶于乙醇和甲醇等有机溶剂, 具有绿叶清香和淡淡的水果香气, 可用于调配苹果(
Malus pumila )和草莓(
Fragaria ×
ananassa )等食用香精.水果中天然存在反式-2-己烯醛, 在苹果汁中含量可达72.26 mg·m
-3 , 香蕉(
Musa nana )中反式-2-己烯醛的含量达305.09 mg·m
-3 (Dittberner
et al. 1997 ).与其它绿叶挥发物不同, 反式-2-己烯醛含有α,β-不饱和羰基, α,β-不饱和羰基是亲电反应物质(reactive electrophile species, RES), 其不饱和的羰基基团能够与蛋白质中普遍含有的亲电基团(如巯基或氨基)发生迈克尔加成反应(Michael Addition)形成加合物, 可在多种胁迫环境下诱导活性氧(reactive oxygen species, ROS)产生并激活下游的防御反应(Alméras
et al. 2003 ; Farmer and Davoine,
2007 ; Farmer and Mueller,
2013 ).研究发现, 采用反式-2-己烯醛处理过的植株与顺式-3-己烯醛(
cis -3-hexenal)处理过的植株相比产生的植物抗毒素(camelexin)更多, 推测与α,β-不饱和羰基有关(Kishimoto
et al. 2006 ). ...
Leaf Isoprene emission rate is dependent on leaf development and the level of isoprene synthase
3
1993
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
... 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
... ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
MYC2 regulates the termination of jasmonate signaling via an autoregulatory negative feedback loop
1
2019
... 反式-2-己烯醛增强抗菌性并非广谱性适用于全部菌株.Scala等(
2013b )用不产生GLVs的突变体
hpl1 进行研究, 发现紫丁香假单胞菌(DC3000)感染
hpl1 后, JA信号途径相关基因仅被轻微诱导或不表达, JA水平降低, 但SA水平较高, DC3000的增长明显受到抑制.使用外源反式-2-己烯醛处理后可显著恢复
HPL1 的缺失效应, 反而可以解除
HPL1 突变后植株对菌体生长的抑制作用, 这一研究结果与传统观点相悖.通过分析表明, DC3000能够合成一种冠菌素(coronatine, COR), COR的作用类似于JA的活性形式茉莉酸-异亮氨酸共轭物(JA-Ile), 在DC3000感染拟南芥后, COR与SA发生类似于JA与SA的拮抗作用, 导致SA含量降低, 对DC3000的抑制能力减弱(Scala
et al. 2013b ).Liu等(
2019 )也提出DC3000可以通过JA拮抗SA介导的植物防御反应来提高其感染能力, 反式-2-己烯醛可诱导JA的合成, 因此外源反式-2-己烯醛处理DC3000后反而解除其对生长的抑制. ...
On the induction of volatile organic compound emissions by plants as consequence of wounding or fluctuations of light and temperature
1
2006
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
Nematicidal activity of
trans -2-hexenal against Southern Root-Knot Nematode (
Meloidogyne incognita ) on tomato plants
1
2017
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
Green leaf volatiles: hydroperoxide lyase pathway of oxylipin metabolism
1
2006
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
A lipid-hydrolysing activity involved in hexenal formation
2
2000
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
... ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
WRKY40 and WRKY6 act downstream of the green leaf volatile
E -2-hexenal in Arabidopsis
2
2015
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
... 植物吸收水分和养分依赖于根系, 根系对植物地上部的生长发育和抗逆性等诸多方面具有重要作用.研究表明, 反式-2-己烯醛通过抑制植物根系生长发育而影响植物根的形态建成, 这可能与其具有α,β-不饱和羰基结构有关(Bate and Rothstein,
1998 ; Mirabella
et al. 2008 ).用0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理植株后, 拟南芥(
Arabidopsis thaliana )初生根的生长明显受抑制, 表明低浓度反式-2-己烯醛抑制根系生长, 这一作用与MeJA相似(Bate and Rothstein,
1998 ).Mirabella等(
2008 )发现反式-2-己烯醛对根系生长的影响具有浓度效应, 浓度越高对根系生长的抑制作用越明显.用外源反式-2-己烯醛熏蒸处理野生型拟南芥和突变体
her1 (
hexenal-response-1 ; 编码γ-氨基丁酸(γ-aminobutyric acid, GABA)转氨酶) 24小时, 继续培养3天后, 发现野生型拟南芥根系生长被显著抑制, 而对突变体植株根系生长的抑制作用较弱, 且在高浓度外源反式-2-己烯醛处理条件下也是如此.随后研究发现, GABA与反式-2-己烯醛抑制根系生长这一生理过程有关, 用外源反式-2-己烯醛熏蒸野生型和突变体
her1 幼苗均可诱导GABA的积累, 但突变体
her1 植株中GABA积累的水平更高, 外源施加GABA可以增强
her1 幼苗对反式-2-己烯醛抑制根系生长的抵抗能力(Mirabella
et al. 2008 ).由此推测,
her1 幼苗中积累的高水平GABA可能是植株根系不受反式-2-己烯醛抑制的主要原因.此外, Mirabella等(
2015 )还发现
wrky40 /
wrky6 双突变体根伸长不受反式-2-己烯醛抑制, 他们用0.1-0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理野生型拟南芥和双突变体幼苗24小时, 继续培养3天后测量根长, 显示其根伸长不受抑制, 这说明
AtWRKY40 和
AtWRKY6 作为关键基因参与反式-2-己烯醛对根生长的抑制过程, 且作用于反式-2-己烯醛的下游. ...
The
Arabidopsis her1 mutant implicates GABA in
E -2-hexenal responsiveness
5
2008
... 目前, 国内外对反式-2-己烯醛的研究较少, 早期研究主要集中在合成途径方面.日本汉口大学的Hatanaka从茶树(
Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(
trans -2-hexenol)和顺式-3-己烯醇(
cis -3-hexenol), 这是早期对于C
6 挥发物合成途径较为系统的报道(Hatanaka and Harada,
1973 ).近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auria
et al. 2007; 孙海峰等,
2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(
S )- hydroperoxy 9
Z , 11
E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(
S )-hydroperoxy 9
Z , 11
E , 15
Z -octadecatrienoic acid, 13-HPOTE) (Scala
et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(
n -hexanal)和愈伤素(9
Z -traumatin) (Scala
et al. 2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
...
2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
... 植物吸收水分和养分依赖于根系, 根系对植物地上部的生长发育和抗逆性等诸多方面具有重要作用.研究表明, 反式-2-己烯醛通过抑制植物根系生长发育而影响植物根的形态建成, 这可能与其具有α,β-不饱和羰基结构有关(Bate and Rothstein,
1998 ; Mirabella
et al. 2008 ).用0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理植株后, 拟南芥(
Arabidopsis thaliana )初生根的生长明显受抑制, 表明低浓度反式-2-己烯醛抑制根系生长, 这一作用与MeJA相似(Bate and Rothstein,
1998 ).Mirabella等(
2008 )发现反式-2-己烯醛对根系生长的影响具有浓度效应, 浓度越高对根系生长的抑制作用越明显.用外源反式-2-己烯醛熏蒸处理野生型拟南芥和突变体
her1 (
hexenal-response-1 ; 编码γ-氨基丁酸(γ-aminobutyric acid, GABA)转氨酶) 24小时, 继续培养3天后, 发现野生型拟南芥根系生长被显著抑制, 而对突变体植株根系生长的抑制作用较弱, 且在高浓度外源反式-2-己烯醛处理条件下也是如此.随后研究发现, GABA与反式-2-己烯醛抑制根系生长这一生理过程有关, 用外源反式-2-己烯醛熏蒸野生型和突变体
her1 幼苗均可诱导GABA的积累, 但突变体
her1 植株中GABA积累的水平更高, 外源施加GABA可以增强
her1 幼苗对反式-2-己烯醛抑制根系生长的抵抗能力(Mirabella
et al. 2008 ).由此推测,
her1 幼苗中积累的高水平GABA可能是植株根系不受反式-2-己烯醛抑制的主要原因.此外, Mirabella等(
2015 )还发现
wrky40 /
wrky6 双突变体根伸长不受反式-2-己烯醛抑制, 他们用0.1-0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理野生型拟南芥和双突变体幼苗24小时, 继续培养3天后测量根长, 显示其根伸长不受抑制, 这说明
AtWRKY40 和
AtWRKY6 作为关键基因参与反式-2-己烯醛对根生长的抑制过程, 且作用于反式-2-己烯醛的下游. ...
... ).Mirabella等(
2008 )发现反式-2-己烯醛对根系生长的影响具有浓度效应, 浓度越高对根系生长的抑制作用越明显.用外源反式-2-己烯醛熏蒸处理野生型拟南芥和突变体
her1 (
hexenal-response-1 ; 编码γ-氨基丁酸(γ-aminobutyric acid, GABA)转氨酶) 24小时, 继续培养3天后, 发现野生型拟南芥根系生长被显著抑制, 而对突变体植株根系生长的抑制作用较弱, 且在高浓度外源反式-2-己烯醛处理条件下也是如此.随后研究发现, GABA与反式-2-己烯醛抑制根系生长这一生理过程有关, 用外源反式-2-己烯醛熏蒸野生型和突变体
her1 幼苗均可诱导GABA的积累, 但突变体
her1 植株中GABA积累的水平更高, 外源施加GABA可以增强
her1 幼苗对反式-2-己烯醛抑制根系生长的抵抗能力(Mirabella
et al. 2008 ).由此推测,
her1 幼苗中积累的高水平GABA可能是植株根系不受反式-2-己烯醛抑制的主要原因.此外, Mirabella等(
2015 )还发现
wrky40 /
wrky6 双突变体根伸长不受反式-2-己烯醛抑制, 他们用0.1-0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理野生型拟南芥和双突变体幼苗24小时, 继续培养3天后测量根长, 显示其根伸长不受抑制, 这说明
AtWRKY40 和
AtWRKY6 作为关键基因参与反式-2-己烯醛对根生长的抑制过程, 且作用于反式-2-己烯醛的下游. ...
...
2008 ).由此推测,
her1 幼苗中积累的高水平GABA可能是植株根系不受反式-2-己烯醛抑制的主要原因.此外, Mirabella等(
2015 )还发现
wrky40 /
wrky6 双突变体根伸长不受反式-2-己烯醛抑制, 他们用0.1-0.3 μmol·L
-1 反式-2-己烯醛熏蒸处理野生型拟南芥和双突变体幼苗24小时, 继续培养3天后测量根长, 显示其根伸长不受抑制, 这说明
AtWRKY40 和
AtWRKY6 作为关键基因参与反式-2-己烯醛对根生长的抑制过程, 且作用于反式-2-己烯醛的下游. ...
Control of
Penicillium expansum in pears and apples by
trans -2-hexenal vapours
1
2006
... 已有研究表明, 几乎所有挥发性物质都具有抑菌活性, 反式-2-己烯醛作为天然挥发物也具有显著抗菌性能, 较低浓度就能抑制革兰氏阴性、阳性菌和部分真菌的生物活性(Gardini
et al. 1997 ; Bisignano
et al. 2001 ).研究发现, 反式-2-己烯醛可作为无公害的植物源生物活性物质, 取代紫外线辐射和超声波等物理灭菌法对水果进行灭菌.扩展青霉(
Penicillium expansum )是引起苹果和猕猴桃(
Actinidia chinensis )等水果腐烂的主要霉菌之一.Neri等(
2006 )研究表明, 外源反式-2-己烯醛处理可使扩展青霉霉菌对梨(
Pyrus spp.)和苹果的感染能力明显下降; 同样, 感染青霉菌的猕猴桃经反式-2-己烯醛处理后扩展青霉萌发分生孢子的真菌膜遭到破坏, 菌丝出现皱缩和干瘪等现象, 其孢子的繁殖和扩展青霉素的产生与积累受到抑制(段腾飞等,
2019 ).另有研究表明, 外源反式-2-己烯醛可使柑橘酸腐病菌(
Geotrichum citriaurentii )的菌丝体形态改变, 出现凹陷、干瘪以及不规则扭曲等情况, 采用卡尔科弗卢尔荧光增白剂(Calcofluor White Stain: GFW)染色后出现酸腐病菌菌丝体蓝色荧光均匀减弱, 表明反式-2-己烯醛可以破坏酸腐病菌细胞壁的完整性(杨艳琴,
2019 ).上述研究表明, 反式-2-己烯醛通过破坏菌体细胞结构抑制其生长和繁殖, 使植物避免病原菌的侵染.在与病原菌的长期协同进化过程中, 植物可快速合成并释放反式- 2-己烯醛以诱导防御反应, 明显提高了生存机会. ...
Fatty acid hydroperoxide lyase: a plant cytochrome P450 enzyme involved in wound healing and pest resistance
1
2001
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
Volatile semiochemicals released from undamaged cotton leaves (a systemic response of living plants to caterpillar damage)
3
1996
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
... 在自然界中, 食草性昆虫对植物的伤害普遍存在.为了抵抗昆虫的袭击, 植物能释放1 000多种挥发性物质(volatile organic compounds, VOCs), 其中大多数是醛类和短链醇类(Noordermeer
et al. 2001 ; Fürstenberg-H?gg
et al. 2013 ).反式-2-己烯醛作为抵御昆虫取食的防御物质, 影响植食性昆虫的取食、交配和产卵等行为, 这种防御机制被称为植物的抗生性(苗建强等,
2012 ; Chen
et al. 2015 ; Cheng
et al. 2017 ).当植食性昆虫取食植株后, 挥发性物质不仅在植物体自身传递信号, 引起体内JA和SA等防御途径基因表达, 还可以作为一种植物间的“信使”, 将害虫的天敌吸引过来, 或者传递信号帮助其它植株间接抵御昆虫的侵袭(Arimura
et al. 2001 ).例如, 当植食性昆虫取食棉花植株下部叶片后, 上部并未被取食的完整叶片会立即释放更多的反式-2-己烯醛; 西双版纳茶园的主要害虫茶尺蠖(
Ectropis oblique )取食茶梢后其口腔反分泌物和茶树释放的醛类挥发性物质能够吸引茶尺蠖的天敌寄生蜂, 其中反式-2-己烯醛的释放量可达平时的6.72倍; 穆丹(
2011 )鉴定了假眼小绿叶蝉(
Empoasca vitis )取食茶梢后茶树释放挥发物的成分, 其中反式-2-己烯醛含量最高, 用反式-2-己烯醛与其它挥发性物质配成天然互利素制成的诱集器可以诱集假眼小绿叶蝉的天敌缨小蜂(
Anagrus nilaparvatae ), 从而防治假眼小绿叶蝉(R?se
et al. 1996 ; 许宁等,
1999 ).此外, 外源施加反式-2-己烯醛可有效防治害虫.寄生线虫是现阶段导致作物产量下降、造成直接经济损失的主要虫害之一.据统计, 全球每年因植物寄生线虫造成的农业损失达1 250亿美元.番茄是我国重要的经济作物, 南方根结线虫(
Meloidogyne incognita )可导致番茄产量严重减少, 用浓度为0.5 μmol·L
-1 的外源反式-2-己烯醛熏蒸处理, 根结线虫的致死率为100%, 且适用于不同发育时期的南方根结线虫.经外源反式-2-己烯醛处理后, 番茄产量高于对照组45% (李素霞,
2014 ; Lu
et al. 2017 ).用浓度为139.8 g·m
-3 的反式-2-己烯醛处理400 g黑松(
Pinus thunbergii )原木, 对照组存活松材线虫(
Bursaphelenchus xylophilus ) (110 148±7 717)条, 熏蒸组仅存活(41 593±3 420)条, 死亡率为(63.6± 4.61)%; 当反式-2-己烯醛浓度上升到699 g·m
-3 后, 松材线虫无存活, 死亡率达100%.反式-2-己烯醛对虫卵的孵化也具有强烈的抑制作用, 对松材线虫的繁殖、产卵和运动能力等均有影响(程乐,
2017 ).除线虫外, 反式-2-己烯醛熏蒸处理对韭菜迟眼蕈蚊(
Bradysia odoriphaga )的存活率、繁殖能力、产卵能力和羽化率等均有显著性影响, 高浓度熏蒸处理后韭菜迟眼蕈4龄幼虫基本不再取食(陈澄宇,
2014 ). ...
Green leaf volatiles: a plant’s multifunctional weapon against herbivores and pathogens
3
2013a
... 在复杂多变的生态环境中, 植物进化出一系列防御反应机制.防御反应指植物对昆虫和病原菌侵袭表现出的一系列特异性内部代谢变化和外部结构改变以提高自身生存能力的应变过程, 包括外界刺激识别、刺激信号转导、防御基因表达调控、生物活性物的合成积累和防御效应实现等生物过程(张庆花等,
2019 ).植物防御反应由复杂的信号调节网络组成, 包括生长素(indole-3-acetic acid, IAA)、茉莉酸(jasmonic acid, JA)、水杨酸(salicylic acid, SA)和绿叶挥发物(green leaf volatiles, GLVs)等防御信号系统.其中, 绿叶挥发物是植物在遭受昆虫取食、病原菌侵染以及机械损伤等生物和非生物胁迫时释放出的一种六碳小分子挥发物, 包含醛类、醇类和酯类化合物.健康植物释放的GLVs很少, 当受到侵害时, 立即合成并大量释放GLVs.植物不仅从受损伤部位释放GLVs, 还可以从未损伤的部位释放GLVs (Hatanaka
et al. 1993 ; R?se
et al. 1996 ; Arimura
et al. 2002 ; Matsui
et al. 2006 ; Scala
et al. 2013a ).大部分GLVs具有抑菌和抗虫活性, 是植物进行防御反应的基础物质.反式-2-己烯醛(
trans -2-hexenal)属于GLVs的一种, 不仅影响植物根尖生长素的转运和分配, 而且对细菌、真菌类病原菌也具有很强的抑制作用.此外, 在植物抵御昆虫取食过程中, 反式-2-己烯醛迅速合成并作为特殊的“报警信号”诱导植物自身或邻近植株的防御基因表达和抗虫次生代谢物质积累.例如, 诱导JA的合成及转运, 启动防御反应(Kishimoto
et al. 2005 ,
2006 ; Hirao
et al. 2012 ; Scala
et al. 2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
...
2013a ; Mirabella
et al. 2015 ).反式-2-己烯醛作为具有较强活性的绿叶挥发物, 在植物防御反应中扮演重要角色. ...
... 目前, 国内外对反式-2-己烯醛的研究较少, 早期研究主要集中在合成途径方面.日本汉口大学的Hatanaka从茶树(
Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(
trans -2-hexenol)和顺式-3-己烯醇(
cis -3-hexenol), 这是早期对于C
6 挥发物合成途径较为系统的报道(Hatanaka and Harada,
1973 ).近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auria
et al. 2007; 孙海峰等,
2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(
S )- hydroperoxy 9
Z , 11
E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(
S )-hydroperoxy 9
Z , 11
E , 15
Z -octadecatrienoic acid, 13-HPOTE) (Scala
et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(
n -hexanal)和愈伤素(9
Z -traumatin) (Scala
et al. 2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
Forward genetic screens identify a role for the mitochondrial HER2 in
E -2-hexenal responsiveness
1
2017
... 反式-2-己烯醛的释放受多种因素影响.研究发现, 机械损伤(Matsui
et al. 2000 )、高温(Loreto
et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall,
1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen,
2009 )处理均可诱导植物产生大量的C
6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO
2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall,
1993 ; 左照江等,
2009 ; Scala
et al. 2017 ).郭慧媛等(
2014 )模拟酸雨对毛竹(
Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka
et al. 1976 ; Gardini
et al. 2010 ).棉花(
Gossypium hirsutum )和利马豆(
Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C
6 挥发物(R?se
et al. 1996 ; Arimura
et al. 2002 ).Matsui等(
2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C
6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(
2002 )还证实昼夜交替和季节变化同样影响C
6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(
Vicia faba )叶片发育程度影响反式-2-己烯醛等C
6 挥发性物质的释放量(Zhuang
et al. 1992 ; Kuzma and Fall,
1993 ; 程乐,
2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...
E-2-hexenal promotes susceptibility to Pseudomonas syringae by activating jasmonic acid pathways in Arabidopsis
8
2013b
... 目前, 国内外对反式-2-己烯醛的研究较少, 早期研究主要集中在合成途径方面.日本汉口大学的Hatanaka从茶树(
Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(
trans -2-hexenol)和顺式-3-己烯醇(
cis -3-hexenol), 这是早期对于C
6 挥发物合成途径较为系统的报道(Hatanaka and Harada,
1973 ).近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auria
et al. 2007; 孙海峰等,
2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(
S )- hydroperoxy 9
Z , 11
E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(
S )-hydroperoxy 9
Z , 11
E , 15
Z -octadecatrienoic acid, 13-HPOTE) (Scala
et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(
n -hexanal)和愈伤素(9
Z -traumatin) (Scala
et al. 2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
...
2013b ), 正己醛再由ADH还原生成正己醇(
n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(
n -hexenyl acetate)等(Mirabella
et al. 2008 ; Scala
et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
...
2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(
9Z )-dodecenoic acid).12-oxo-(
9Z )-dodecenoic acid合成愈伤素(Scala
et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
...
2013b ), 而顺式-3-己烯醛极不稳定, 在3
E :2
Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella
et al. 2008 ; 孙海峰等,
2013 ; Scala
et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(
trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(
trans -2-hexenyl acetate)和顺式- 3-己烯酯(
cis -3-hexenyl acetate) (
图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang,
2006 ).Farag等(
2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine
et al. 2006 ). ...
...
2013b ) 关键组分用红色字体表示.PL: 磷脂酶; 13-LOX: 脂氧合酶; HPL: 氢过氧化物裂解酶; ADH: 乙醇脱氢酶; AAT: 醇酰基转移酶; Isomerase: 3E:2Z异构体互变酶 ...
... 关键组分用红色字体表示.PL: 磷脂酶; 13-LOX: 脂氧合酶; HPL: 氢过氧化物裂解酶; ADH: 乙醇脱氢酶; AAT: 醇酰基转移酶; Isomerase: 3E:2Z异构体互变酶
Green leaf volatiles (GLVs) synthetic pathway (modified from Scala <i>et al.</i> <xref ref-type="bibr" rid="b54">2013b</xref>) The key components are in red letters. PL: Phospholipases; 13-LOX: Lipoxygenase; HPL: Hydroperoxide lyase; ADH: Alcohol dehydrogenase; AAT: Alcohol acyltransferase; Isomerase: 3E:2Z isomerase ...2013b )用不产生GLVs的突变体hpl1 进行研究, 发现紫丁香假单胞菌(DC3000)感染hpl1 后, JA信号途径相关基因仅被轻微诱导或不表达, JA水平降低, 但SA水平较高, DC3000的增长明显受到抑制.使用外源反式-2-己烯醛处理后可显著恢复HPL1 的缺失效应, 反而可以解除HPL1 突变后植株对菌体生长的抑制作用, 这一研究结果与传统观点相悖.通过分析表明, DC3000能够合成一种冠菌素(coronatine, COR), COR的作用类似于JA的活性形式茉莉酸-异亮氨酸共轭物(JA-Ile), 在DC3000感染拟南芥后, COR与SA发生类似于JA与SA的拮抗作用, 导致SA含量降低, 对DC3000的抑制能力减弱(Scala et al. 2013b ).Liu等(2019 )也提出DC3000可以通过JA拮抗SA介导的植物防御反应来提高其感染能力, 反式-2-己烯醛可诱导JA的合成, 因此外源反式-2-己烯醛处理DC3000后反而解除其对生长的抑制. ...2013b ).Liu等(2019 )也提出DC3000可以通过JA拮抗SA介导的植物防御反应来提高其感染能力, 反式-2-己烯醛可诱导JA的合成, 因此外源反式-2-己烯醛处理DC3000后反而解除其对生长的抑制. ...Arabidopsis root apices: effects on PIN2 endocytosis, vesicular recycling, and polar auxin transport2016 )利用非损伤微测技术(NMT)实时监测了外源反式-2-己烯醛处理后拟南芥根尖IAA和H+ 的转运过程, 发现IAA的转运方向及流速在根尖不同功能区存在较大差异.正常情况下, 根尖分生区及过渡区的IAA会外流, 用反式-2-己烯醛熏蒸处理会显著抑制其外流趋势, 使IAA的整体流速降低, 且从过渡区向伸长区的转运过程被抑制.为进一步解释该现象, 研究还测定了IAA转运相关基因的表达情况, 发现外源反式-2-己烯醛熏蒸处理后, IAA转运基因(PIN1 、PIN2 和PIN3 )的表达量明显低于对照组, PIN4 的表达量则上调, 而IAA内向转运体基因AUX1 的转录水平并未改变.此外, 外源反式-2-己烯醛熏蒸处理还导致IAA受体基因TIR1 下调表达, 由此表明反式-2-己烯醛能在转录水平上降低根部对IAA的极性转运和感知过程(张婷等, 2016 ).反式-2-己烯醛增强植物防御反应的同时表现出减缓生长的现象, 其中可能的原因是植物在积累防御反应物质的同时会相应减少用于生长发育的物质积累(Coley et al. 1985 ; 张婷等, 2016 ).外源反式-2-己烯醛熏蒸处理可以抑制拟南芥根尖分生区与过渡区的H+ 内流.一般情况下, 植物根尖各个部位H+ 流速存在较大差异, 距根尖100-700 μm处的H + 呈现整体内流的趋势, 且在300 μm过渡区内流流速达最大值, 而反式-2-己烯醛处理可显著降低这2个区域的平均H + 流速(未发表数据).细胞内pH环境的稳定对植物根系正常生长至关重要, 已知布雷菲德菌素A (Brefeldin A, BFA)处理能显著抑制拟南芥根尖过渡区的生长素运输(Shen et al. 2008 ), 同时, BFA处理抑制了根尖分生区与过渡区的H+ 内流, 这一现象与外源反式-2-己烯醛处理结果一致(未发表数据).由此推测, 根尖分生区与过渡区的H+ 转运可能与生长素的极性运输密切相关, 外源反式-2-己烯醛处理改变了植物根系质外体环境的pH值, 这种变化直接影响植物根系的生长发育. ...trans -2-hexenal and cis -3- hexenal on post-harvest strawberryet al. 2019 ).外源反式-2-己烯醛处理后, 植物防御反应相关的脂氧合酶、苯丙氨酸转氨酶(phenylalaninammo-nialyase, PAL)、过氧化物酶(peroxidase oxidase, POD)及多酚氧化酶(polyphenol oxidase, PPO)等的活性显著增强, 并诱导酚类化合物和黄酮类化合物积累, 从而增强抗病能力(Gomi et al. 2003 ; 苗建强, 2013 ; Guo et al. 2015 ).用外源反式-2-己烯醛处理灰霉菌感染的番茄(Solanum lycopersicum )幼苗后, 植株体内JA和乙烯(ethylene, ET)通路基因LOX 、ETR3 和ETR4 等的表达量显著增高, 推测反式-2-己烯醛可能通过介导JA/ET通路来响应病原菌侵染(Guo et al. 2015 ).Zeringue和McCormick (1990 )以及Kishimoto等(2000)也认为, 反式-2-己烯醛能够诱导JA信号通路LOX 基因的表达, 诱导防御反应.Zeringue等(1990 )研究证实, 经过反式-2-己烯醛处理的棉花对黄曲霉毒素产生很强的拮抗作用, 并提出LOX途径可能参与该反应.Kishimoto等(2000)证实反式-2-己烯醛处理后拟南芥中LOX2 的表达量上调.LOX是JA合成过程中的关键酶, JA在植物生长发育、成熟衰老以及逆境胁迫应答过程中起重要的调节作用.上述结果表明, 反式-2-己烯醛可以诱导防御相关基因的表达, 积累防御相关物质从而增强抗病能力. ...Thea sinensis )叶片中提取到亚麻酸, 进一步研究证实亚麻酸经过脂氧合酶(lipoxygenase, LOX)加氧反应形成顺式-3-己烯醛, 顺式-3-己烯醛异构化为反式-2-己烯醛, 二者在乙醇脱氢酶(alcohol dehydrogenase, ADH)的作用下分别形成反式-2-己烯醇(trans -2-hexenol)和顺式-3-己烯醇(cis -3-hexenol), 这是早期对于C6 挥发物合成途径较为系统的报道(Hatanaka and Harada, 1973 ).近期研究发现, 当植物遭受非生物或生物胁迫时, 细胞膜上的半乳糖脂(galactolipid)在磷脂酶(phospholipases)的作用下裂解, 产生游离的十八碳化合物亚油酸(linoleic acid, LA)和α-亚麻酸(α-linolenic acid, ALA) (Auriaet al. 2007; 孙海峰等, 2013 ), LA和ALA在LOX的作用下发生加氧反应, 分别生成亚油酸氢过氧化物(13(S )- hydroperoxy 9Z , 11E -octadecatrienoic, 13-HPODE)和亚麻酸氢过氧化物(13(S )-hydroperoxy 9Z , 11E , 15Z -octadecatrienoic acid, 13-HPOTE) (Scala et al. 2013b ), 13-HPODE经JA合成途径的氢过氧化物裂解酶(hydroperoxide lyase, HPL)裂解后合成正己醛(n -hexanal)和愈伤素(9Z -traumatin) (Scala et al. 2013b ), 正己醛再由ADH还原生成正己醇(n -hexanol), 最终在醇酰基转移酶(alcohol acyltransferase, AAT)的乙酰化作用下生成乙酸己酯(n -hexenyl acetate)等(Mirabella et al. 2008 ; Scala et al. 2013b ).13-HPOTE在HPL的作用下裂解为顺式-3-己烯醛和十二-氧代-9-顺式-十二烯酸(12-oxo-(9Z )-dodecenoic acid).12-oxo-(9Z )-dodecenoic acid合成愈伤素(Scala et al. 2013b ), 而顺式-3-己烯醛极不稳定, 在3E :2Z 异构体互变酶(isomerase)的异构化作用下极易生成反式-2-己烯醛, 也可以异构化为反式-3-己烯醛(Mirabella et al. 2008 ; 孙海峰等, 2013 ; Scala et al. 2013 ).反式- 2-己烯醛、反式-3-己烯醛和顺式-3-己烯醛在ADH的脱氢作用下分别形成反式-2-己烯醇、反式-3-己烯醇(trans -3-hexenol)和顺式-3-己烯醇, 最终反式-2-己烯醇和顺式-3-己烯醇由AAT催化形成反式-2-己烯酯(trans -2-hexenyl acetate)和顺式- 3-己烯酯(cis -3-hexenyl acetate) (图1 ).目前, 有关反式-2-己烯醛降解途径的报道较少, 主要倾向于2种观点.其一是外源反式-2-己烯醛被植物迅速吸收后, 转化为相应的酯(Yan and Wang, 2006 ).Farag等(2005 )推测这一过程在醛类绿叶挥发物的失活过程中起重要作用.众所周知, 与谷胱甘肽(GSH)结合是常见的活性分子灭活机制, 第二种观点认为, 外源反式- 2-己烯醛可与GSH偶联, 形成1-hexanol-3-GSH形式的反式-2-己烯醛GSH加合物(Davoine et al. 2006 ). ...Aspergillus flavus incubated in atmospheres containing selected cotton leaf-derived volatileset al. 2019 ).外源反式-2-己烯醛处理后, 植物防御反应相关的脂氧合酶、苯丙氨酸转氨酶(phenylalaninammo-nialyase, PAL)、过氧化物酶(peroxidase oxidase, POD)及多酚氧化酶(polyphenol oxidase, PPO)等的活性显著增强, 并诱导酚类化合物和黄酮类化合物积累, 从而增强抗病能力(Gomi et al. 2003 ; 苗建强, 2013 ; Guo et al. 2015 ).用外源反式-2-己烯醛处理灰霉菌感染的番茄(Solanum lycopersicum )幼苗后, 植株体内JA和乙烯(ethylene, ET)通路基因LOX 、ETR3 和ETR4 等的表达量显著增高, 推测反式-2-己烯醛可能通过介导JA/ET通路来响应病原菌侵染(Guo et al. 2015 ).Zeringue和McCormick (1990 )以及Kishimoto等(2000)也认为, 反式-2-己烯醛能够诱导JA信号通路LOX 基因的表达, 诱导防御反应.Zeringue等(1990 )研究证实, 经过反式-2-己烯醛处理的棉花对黄曲霉毒素产生很强的拮抗作用, 并提出LOX途径可能参与该反应.Kishimoto等(2000)证实反式-2-己烯醛处理后拟南芥中LOX2 的表达量上调.LOX是JA合成过程中的关键酶, JA在植物生长发育、成熟衰老以及逆境胁迫应答过程中起重要的调节作用.上述结果表明, 反式-2-己烯醛可以诱导防御相关基因的表达, 积累防御相关物质从而增强抗病能力. ...1990 )研究证实, 经过反式-2-己烯醛处理的棉花对黄曲霉毒素产生很强的拮抗作用, 并提出LOX途径可能参与该反应.Kishimoto等(2000)证实反式-2-己烯醛处理后拟南芥中LOX2 的表达量上调.LOX是JA合成过程中的关键酶, JA在植物生长发育、成熟衰老以及逆境胁迫应答过程中起重要的调节作用.上述结果表明, 反式-2-己烯醛可以诱导防御相关基因的表达, 积累防御相关物质从而增强抗病能力. ...Botrytis cinerea and Fusarium oxysporum in tomato leaves treated with chitosan oligosaccharideet al. 2000 )、高温(Loreto et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall, 1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen, 2009 )处理均可诱导植物产生大量的C6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall, 1993 ; 左照江等, 2009 ; Scala et al. 2017 ).郭慧媛等(2014 )模拟酸雨对毛竹(Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka et al. 1976 ; Gardini et al. 2010 ).棉花(Gossypium hirsutum )和利马豆(Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C6 挥发物(R?seet al. 1996 ; Arimura et al. 2002 ).Matsui等(2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(2002 )还证实昼夜交替和季节变化同样影响C6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(Vicia faba )叶片发育程度影响反式-2-己烯醛等C6 挥发性物质的释放量(Zhuang et al. 1992 ; Kuzma and Fall, 1993 ; 程乐, 2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...6 -aldehyde formation by soybean leaveset al. 2000 )、高温(Loreto et al. 2006 )以及外源茉莉酸甲酯(MeJA) (Kuzma and Fall, 1993 )和寡聚糖(chitosan oligosaccharide) (Zhang and Chen, 2009 )处理均可诱导植物产生大量的C6 挥发物, 反式-2-己烯醛是其中最主要的成分之一.此外, 光照、水分、湿度、营养及CO2 浓度等非生物因素也会影响反式-2-己烯醛的释放量(Kuzma and Fall, 1993 ; 左照江等, 2009 ; Scala et al. 2017 ).郭慧媛等(2014 )模拟酸雨对毛竹(Phyllostachys pubescens )叶片进行处理, 发现反式-2-己烯醛的释放量显著增加.生物因素(如病原菌侵染、昆虫取食和发育程度)亦影响反式-2-己烯醛的释放(Hatanaka et al. 1976 ; Gardini et al. 2010 ).棉花(Gossypium hirsutum )和利马豆(Phaseolus lunatus )等植株的下部叶片被昆虫取食后, 植株上部未被取食的完整叶片会迅速合成并释放反式-2-己烯醛等C6 挥发物(R?seet al. 1996 ; Arimura et al. 2002 ).Matsui等(2000 )将被昆虫取食的植物组织匀浆处理后, 检测到组织中的半乳糖脂含量大幅降低, 确定C6 挥发物由组织内游离的脂肪酸合成, 表明反式-2-己烯醛可被虫害诱导合成和释放.此外, Arimura等(2002 )还证实昼夜交替和季节变化同样影响C6 挥发物的释放.另外, 有研究显示, 植物的发育阶段也会影响醛类挥发物的释放.例如, 蚕豆(Vicia faba )叶片发育程度影响反式-2-己烯醛等C6 挥发性物质的释放量(Zhuang et al. 1992 ; Kuzma and Fall, 1993 ; 程乐, 2017 ).反式-2-己烯醛作为重要的植物防御反应物质, 能够在多种生物和非生物因子诱导下被迅速合成并释放, 这一特殊的“报警信号”可进一步诱导植物自身或邻近植株防御基因的表达, 响应环境压力, 并且其作用发挥也受环境等因素的影响, 因此对其合成释放以及代谢机制仍需深入探究. ...  ,*
,* ,*
,*
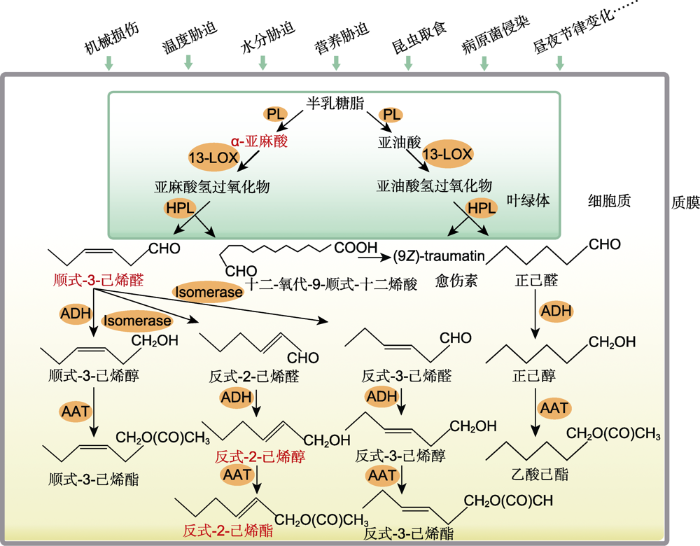 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT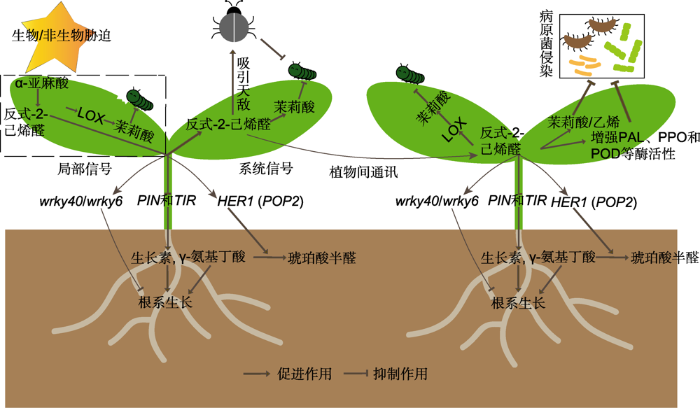 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT
















