周乃富 1 ,
张俊佩 1 , * , ,
刘昊 2 ,
查巍巍 1 ,
裴东 1 1 中国林业科学研究院林业研究所, 林木遗传育种国家重点实验室, 国家林业局林木培育重点实验室, 北京 1000912 天津市林业果树研究所, 天津 300112Zhou Naifu 1 ,
Zhang Junpei 1 , * , ,
Liu Hao 2 ,
Zha Weiwei 1 ,
Pei Dong 1 1 Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration, State Key Laboratory of Tree Genetics and Breeding, Research Institute of Forestry Chinese Academy of Forestry, Beijing 100091, China2 Tianjin Research Institute of Forestry and Pomology, Tianjin 300112, China引用本文 周乃富 ,
张俊佩 ,
刘昊 ,
查巍巍 ,
裴东 . 木本植物非均质化组织石蜡切片制作方法. 植物学报, 2018, 53(5): 653-660
贡献者
* 通讯作者。E-mail: 1054122493@qq.com 基金资助
燕山特色坚果新品种耐旱丰产技术研究集成与科技示范(No.Z161100000916011)和中国核桃优异种质遗传信息评价(No.RIF- 2013-01) ;
接受日期:2018-03-2网络出版日期:2018-09-10
-->Copyright
2018《植物学报》编辑部
Contributors
* Author for correspondence. E-mail: 1054122493@qq.com History
Received :
Online :
摘要: 在常规石蜡切片技术的基础上, 针对木本植物茎段木质化程度高、硬度大以及各部分组织硬度不均匀等特点, 选取核桃(Juglans regia )茎段以及芽接愈合区域组织为实验材料, 对固定、软化和脱水等关键步骤进行改进, 获得结构完整且染色清晰的茎段组织和嫁接愈合区域组织切片, 可清晰地观察到各部分组织的形态特征和愈合过程中的发育特征, 且缩短了制片周期。采用改良后的实验流程成功获得了苹果(Malus pumila )、桃(Amygdalus persica )、杏(Armeniaca vulgaris )、李(Prunus salicina )和杨(Populus tomentosa )的茎段横截面切片。该方法为从解剖学上研究林木茎段生长机制和形态发育变化提供技术基础, 为非均质化植物材料的石蜡切片制作提供参考。 关键词 :
非均质化组织 ;
改良方案 ;
核桃 ;
石蜡切片 Abstract :
In view of the characteristics of highly lignified, large hardness and heterogeneous of various parts of woody plants, the stem segments and healing areas of bud grafting of Juglans regia were used as materials with the conventional method of paraffin sectioning. The aspects of fixation, softening, dehydration and other critical steps were modified to obtain cross-section slices with complete organizational structure and clear staining. The morphological and developmental characteristics of the healing period could be observed clearly and shortened the experimental period. The paraffin sections of stem segments of apple, peach, apricot, plum and poplar were obtained by the improved experimental process. The study provides a technical basis for studying the growth mechanism and morphological development of stem segments of woody plants and provides a reference for making paraffin sections of heterogeneous plant materials. Key words :
heterogeneous plant tissue ;
improved protocol ;
Juglans regia ;
paraffin section 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 )。由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 )。但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 )。随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究。然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性。本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法。
核桃(
Juglans regia )茎段组织木质化程度较高, 材料硬度大, 且各部分组织硬度不均, 属于典型的非均质化材料, 尤其是芽接愈合区域组织, 按照传统的石蜡切片方法很难获得完整且清晰的显微切片, 在一定程度上阻碍了对核桃生理解剖结构及嫁接愈合机理的研究。本研究以核桃节间茎段和芽接愈合区域组织为材料, 对传统石蜡切片中的关键步骤进行改良, 以期建立适合核桃茎段组织的石蜡切片制作方法, 为进一步从解剖学上研究核桃的生长机制以及探究芽接愈合过程中砧木和接穗组织的微观形态结构提供技术基础。进一步选取苹果(
Malus pumila )、桃(
Amyg- dalus persica )、杏(
Armeniaca vulgaris )、李(
Prunus salicina )和杨(
Populus tomentosa )的茎段进行试验, 为非均质化植物材料的石蜡切片制作提供参考。
1 材料与方法1.1 材料采样地位于河北省保定市易县润源林果种植有限公司基地。在6月分别采集核桃(
Juglans regia L.)、苹果(
Malus pumila Mill.)、桃(
Amygdalus persica L.)和杨(
Populus tomentosa Carr)当年生的半木质化新梢以及杏(
Armeniaca vulgaris Lam.)和李(
Prunus salicina Lindl.) 1-2年生枝条。以2年生的清香核桃实生苗为砧木, 香玲核桃品种为接穗, 于6月中旬进行芽接。
1.2 方法
1.2.1 取材与固定 2016年6月下旬, 取当年生核桃半木质化枝条, 剪取相邻节间直径在6.5-9.5 mm的茎段, 将其切成厚2-3 mm的圆柱形小块; 取芽接后6天和12天的核桃砧穗愈合区域茎段, 再横切成5 mm厚的小段。将材料分别用2种不同的固定液进行处理: (1) 将材料快速置于传统的FAA固定液(70%乙醇:35%-40%甲醛:乙酸=90:5:5, v/v/v)中, 抽气至材料下沉且无气泡出现, 4°C下保存48小时; (2) 将材料放入改进后的固定液(70%叔丁醇:35%-40%甲醛:丙酸:丙三醇=85:5:5:5, v/v/v/v)中, 抽真空至没有气体产生且材料完全下沉, 4°C下保存48小时以上。
1.2.2 软化 将茎段从固定液中取出, 用蒸馏水冲洗3分钟, 然后置于2种不同的软化剂中分别进行软化处理。方法1: 将茎段放入70%乙醇-丙三醇混合溶液(1:1, v/v), 抽真空30分钟, 保存12天。方法2: 将茎段置于过氧化氢-冰醋酸混合溶液(1:1, v/v), 抽真空30分钟, 处理3小时, 再将材料转入装有70%叔丁醇-丙三醇混合溶液(1:1, v/v)的带盖玻璃瓶中, 置于50°C恒温培养箱中处理2天。以不做任何软化处理的材料为对照, 每个处理设3次重复。
1.2.3 脱水与透明 将软化后的材料用蒸馏水冲洗, 去除材料表面的软化剂。然后参照
李和平(2009) 的乙醇梯度脱水法对材料进行脱水处理。方法1: 50%乙醇2小时→70%乙醇2小时→85%乙醇2小时→95%乙醇1小时→无水乙醇45分钟→无水乙醇45分钟; 将材料转入无水乙醇与二甲苯的混合溶液(1:1, v/v)中处理1小时, 然后转入纯二甲苯溶液中, 每次1小时, 更换2次。方法2: 采用叔丁醇梯度脱水法, 即50%叔丁醇1.5小时→70%叔丁醇1.5小时→85%叔丁醇1.5小时→95%叔丁醇1小时→纯叔丁醇30分钟→纯叔丁醇30分钟。更换脱水剂后均进行抽真空处理。由于叔丁醇有脱水和透明的双重作用, 采用叔丁醇梯度脱水后不需要再进行透明步骤。
1.2.4 浸蜡与包埋 常规的石蜡渗透是将透明后的茎段从二甲苯中过渡到纯石蜡中, 改进后的浸蜡步骤与常规方法相近, 只是用叔丁醇替换二甲苯, 即将茎段浸在50%石蜡(叔丁醇:石蜡=1:1, v/v)溶液中处理6小时, 温度54- 56°C; 然后转移到75%石蜡(叔丁醇:石蜡=1:3, v/v)溶液中处理6小时, 温度56-58°C; 最后转入预先熔化好的纯石蜡溶液中, 温度58-60°C, 每隔4小时更换1次石蜡溶液, 更换3次, 整个过程在恒温箱中进行。本研究中采用的切片石蜡为Leica鳞片状石蜡, 熔点56-58°C。将熔好的石蜡倒入规格为21 mm×21 mm×5 mm不锈钢包埋底模, 迅速取出浸蜡后的材料, 根据切片的需要用解剖针调整材料的位置, 贴上塑料包埋盒, 常温下冷却, 使石蜡由溶液凝固成石蜡块。将材料置于-20°C下处理2分钟, 退掉不锈钢底模, 得到与塑料包埋盒紧密连接的石蜡块。
1.2.5 切片、粘片和烤片 修块后, 用切片机(Leica RM2245)切片, 厚度8-12 μm。将切好的蜡片平整地贴于经正电荷处理的黏附载玻片上(世泰, 188105W), 在蜡带上滴加蒸馏水, 确保蜡带完全浸过后, 倾斜载玻片倒掉多余的蒸馏水。将载玻片置于45°C烤片机上, 烤片50-80分钟。烤片结束后, 将载玻片置于室温下备用。
1.2.6 脱蜡与染色 参照李和平(2009) 的方法进行脱蜡处理, 即用0.5% (w/v)甲苯胺蓝O浸染2分钟, 取出后用蒸馏水清洗2次, 0.5% (v/v)醋酸水溶液分化处理1分钟。
1.2.7 封片与拍照 将染色后的切片进行乙醇梯度脱水, 二甲苯透明。然后在切片材料中央滴加1滴中性树胶, 用干净盖玻片从一侧压下, 使树胶均匀分布, 置于通风橱散发残留的二甲苯。在Olympus BX51显微镜下观察并拍照。
2 结果与讨论2.1 固定液和软化方法的改进采用2种不同的固定液和2种不同的软化方法进行组合试验(
表1 ), 切片效果从优到劣依次为: 组合4>组合3>组合2>组合1。通过对比4种组合的石蜡切片, 发现改良后的固定液处理(
图1B , D)效果优于传统的FAA固定液(
图1A , C), 能有效降低材料的脆度, 很好地解决了固定过程中材料变脆导致的材料破裂和部分组织分离的问题。软化方法2 (
图1C , D)的软化效果要优于软化方法1 (
图1A , B), 有效解决了软化不均匀造成的材料卷曲和折叠问题(
表1 ), 且软化时间由288小时缩短到48小时, 提高了软化效率(
表2 )。
图1 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-5-653/img_1.png <b>图1</b> 核桃茎段完整横截面切片<br/>(A) 采用传统的FAA固定, 软化方法1处理; (B) 采用改良后的固定液, 软化方法1处理; (C) 采用传统的FAA固定, 软化方法2处理; (D) 采用改良后的固定液, 软化方法2处理。Bars=1 mm<br/><b>Figure 1</b> The intact cross-section slice of walnut stem segment tissue<br/>(A) Traditional FAA fixative, according to softening method 1 treatment; (B) Improve fixative, according to softening method 1 treatment; (C) Traditional FAA fixative, according to softening method 2 treatment; (D) Improve fixative, according to softening method 2 treatment. Bars=1 mm Figure 1 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-5-653/img_1.png <b>图1</b> 核桃茎段完整横截面切片<br/>(A) 采用传统的FAA固定, 软化方法1处理; (B) 采用改良后的固定液, 软化方法1处理; (C) 采用传统的FAA固定, 软化方法2处理; (D) 采用改良后的固定液, 软化方法2处理。Bars=1 mm<br/><b>Figure 1</b> The intact cross-section slice of walnut stem segment tissue<br/>(A) Traditional FAA fixative, according to softening method 1 treatment; (B) Improve fixative, according to softening method 1 treatment; (C) Traditional FAA fixative, according to softening method 2 treatment; (D) Improve fixative, according to softening method 2 treatment. Bars=1 mm 在新窗口打开 下载 下载原图ZIP 生成PPT 图1
核桃茎段完整横截面切片
(A) 采用传统的FAA固定, 软化方法1处理; (B) 采用改良后的固定液, 软化方法1处理; (C) 采用传统的FAA固定, 软化方法2处理; (D) 采用改良后的固定液, 软化方法2处理。Bars=1 mm
Figure 1
The intact cross-section slice of walnut stem segment tissue
(A) Traditional FAA fixative, according to softening method 1 treatment; (B) Improve fixative, according to softening method 1 treatment; (C) Traditional FAA fixative, according to softening method 2 treatment; (D) Improve fixative, according to softening method 2 treatment. Bars=1 mm
表1 Table 1 表1 表1 不同固定液和软化方法对核桃切片效果的影响
Table 1 Effect of different types of fixation and softening on paraffin section of
Juglans regia Combination 1 Combination 2 Combination 3 Combination 4 FAA fixative solution Improved fixative solution FAA fixative solution Improved fixative solution Softening method 2 Paraffin Partial cavity, divided and ripples Continuous and ripples Continuous and tidy Continuous and tidy Cortex Brokenness and incomplete Rupture and incomplete Partial rupture and complete Complete Pith Partial cavity and removed Partly dehiscent, not detached Complete Complete Transverse Fragmentary and incomplete with unclear outline Shrinkage deformation, unclear outline Partly complete with clear outline Complete and smooth with clear outline
表1
不同固定液和软化方法对核桃切片效果的影响
Table 1
Effect of different types of fixation and softening on paraffin section of
Juglans regia 表2 Table 2 表2 表2 两种不同制片方法关键步骤对比
Table 2 Comparison of key steps of two different slicing methods
Key steps of slicing Traditional slicing method (method 1) Improved slicing method (method 2) Reagent Time (h) Reagent Time (h) Fixation FAA fixative 48 Improved fixative 48 Softening 70% ethanol-glycerol 288 Hydrogen peroxide-glacial acetic acid, 70% ethanol-glycerol 48 Dehydration Different concentrations of ethanol 8.5 Different concentrations of tert butanol solution 6.5 Transparency Ethanol, xylene 3 - -
表2
两种不同制片方法关键步骤对比
Table 2
Comparison of key steps of two different slicing methods
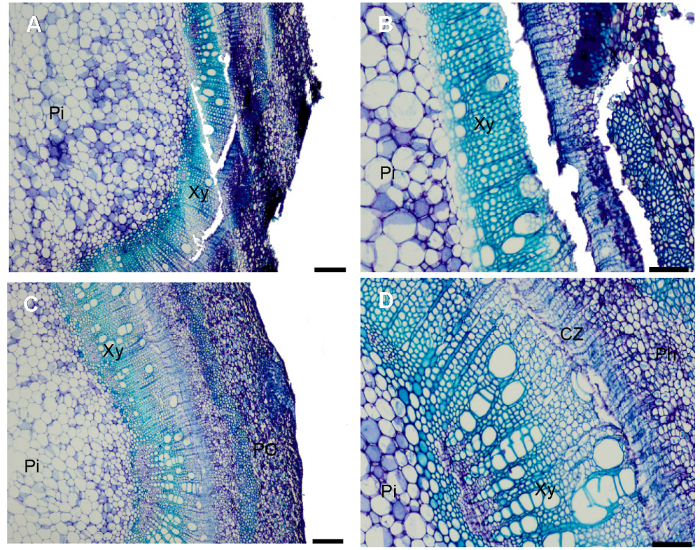
同时, 对最劣组合(组合1)和最优组合(组合4)获得的石蜡切片进行局部的细节对比分析, 发现组合1中切片(
图2A , B)呈现较明显的切痕, 皮层部分破裂, 边缘部分组织分离、脱落; 而组合4中切片(
图2C , D)茎段横切面平整、光滑, 无切痕。可见, 组合4更适合制作核桃半木质化茎段材料的石蜡切片。
图2 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-5-653/img_2.png <b>图2</b> 不同处理方法得到的核桃茎段切片<br/>(A), (B) 采用传统的FAA固定, 软化方法1处理; (C), (D) 采用改良的固定液, 软化方法2处理。(B), (D)分别是(A), (C)的局部放大。(A), (C) Bars=200 μm; (B), (D) Bars=100 μm。CZ: 形成层带; Ph: 韧皮部; Xy: 木质部; Pi: 髓; PC: 薄壁细胞<br/><b>Figure 2</b> The stem segment tissue slice of walnut with different treatment methods<br/>(A), (B) Traditional FAA fixative, according to softening method 1 treatment; (C), (D) Improve fixative, according to softening method 2 treatment. (B) and (D) are local amplification of (A) and (C). (A), (C) Bars=200 μm; (B), (D) Bars=100 μm. CZ: Cambium zone; Ph: Phloem; Xy: Xylem; Pi: Pith; PC: Parenchyma cell Figure 2 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-5-653/img_2.png <b>图2</b> 不同处理方法得到的核桃茎段切片<br/>(A), (B) 采用传统的FAA固定, 软化方法1处理; (C), (D) 采用改良的固定液, 软化方法2处理。(B), (D)分别是(A), (C)的局部放大。(A), (C) Bars=200 μm; (B), (D) Bars=100 μm。CZ: 形成层带; Ph: 韧皮部; Xy: 木质部; Pi: 髓; PC: 薄壁细胞<br/><b>Figure 2</b> The stem segment tissue slice of walnut with different treatment methods<br/>(A), (B) Traditional FAA fixative, according to softening method 1 treatment; (C), (D) Improve fixative, according to softening method 2 treatment. (B) and (D) are local amplification of (A) and (C). (A), (C) Bars=200 μm; (B), (D) Bars=100 μm. CZ: Cambium zone; Ph: Phloem; Xy: Xylem; Pi: Pith; PC: Parenchyma cell 在新窗口打开 下载 下载原图ZIP 生成PPT 图2
不同处理方法得到的核桃茎段切片
(A), (B) 采用传统的FAA固定, 软化方法1处理; (C), (D) 采用改良的固定液, 软化方法2处理。(B), (D)分别是(A), (C)的局部放大。(A), (C) Bars=200 μm; (B), (D) Bars=100 μm。CZ: 形成层带; Ph: 韧皮部; Xy: 木质部; Pi: 髓; PC: 薄壁细胞
Figure 2
The stem segment tissue slice of walnut with different treatment methods
(A), (B) Traditional FAA fixative, according to softening method 1 treatment; (C), (D) Improve fixative, according to softening method 2 treatment. (B) and (D) are local amplification of (A) and (C). (A), (C) Bars=200 μm; (B), (D) Bars=100 μm. CZ: Cambium zone; Ph: Phloem; Xy: Xylem; Pi: Pith; PC: Parenchyma cell
2.2 样品脱水和透明流程的改良相比传统的乙醇梯度脱水方法, 方法2中采用叔丁醇梯度脱水, 在更换不同浓度叔丁醇后增加抽真空处理, 从而使各梯度脱水时间由原来的2小时缩短到1.5小时, 其中纯叔丁醇更换2次, 每次30分钟。乙醇作为最常规的脱水剂可以有效去除材料中的水分, 由于核桃茎段组织密度较大, 需要较长的脱水时间, 而长时间浸泡在乙醇溶液中也会引起组织块的收缩和硬化, 严重影响后期的切片质量。因此选用叔丁醇来替代乙醇, 同时在不同脱水阶段都进行抽真空处理, 可以有效地缩短脱水时间, 完全脱去组织内的水分, 为后期的透明和浸蜡创造条件。
叔丁醇能与水、二甲苯和乙醇等溶剂混合, 而且是石蜡的溶媒, 兼有脱水和透明的作用(
贺兵等, 2014 )。因此, 在采用叔丁醇梯度脱水后, 不需再进行透明步骤, 可以直接进入浸蜡环节。
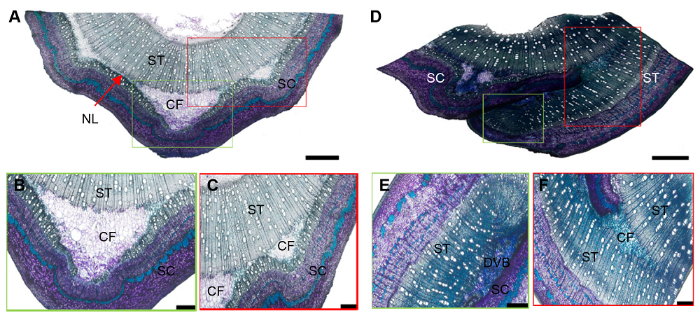
2.3 核桃芽接愈合区域组织切片效果分析接穗主要包括皮层和韧皮部、形成层以及小部分初生木质部组织, 砧木主要包括木质部和髓, 而砧木和接穗间形成的愈伤组织, 主要是由不规则的薄壁细胞组成。各部分组织在细胞结构、密度和硬度上都存在很大差异, 属于典型的非均质化材料。采用改进后的石蜡切片方法获得了核桃芽接后6天(
图3A -C)和12天(
图3D -F)的愈合区域组织切片, 能清楚地观察到愈伤组织的增殖和发育过程, 且砧木和接穗各部分组织清晰可见。
图3 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-5-653/img_3.png <b>图3</b> 改进石蜡切片法的核桃方块芽接嫁接部位发育图<br/>(A)-(C) 嫁接后6天; (D)-(F) 嫁接后12天。(B), (C)和(E), (F)分别是(A)和(D)的局部放大。(A), (D) Bars=1 mm; (B), (C), (E), (F) Bars=500 μm。CF: 愈伤组织细胞形成; SC: 接穗; ST: 砧木; NL: 坏死细胞层; DVB: 发育中的维管组织<br/><b>Figure 3</b> The sliced section of walnut bud healing area using the improved paraffin section method<br/>(A)-(C) 6 days after grafted; (D)-(F) 12 days after grafted. (B), (C) and (E), (F) are local amplification of (A) and (D). (A), (D) Bars=1 mm; (B), (C), (E), (F) Bars=500 μm. CF: Callus formation; SC: Scion; ST: Stock; NL: Necrotic layer; DVB: Developing vascular bundles Figure 3 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-5-653/img_3.png <b>图3</b> 改进石蜡切片法的核桃方块芽接嫁接部位发育图<br/>(A)-(C) 嫁接后6天; (D)-(F) 嫁接后12天。(B), (C)和(E), (F)分别是(A)和(D)的局部放大。(A), (D) Bars=1 mm; (B), (C), (E), (F) Bars=500 μm。CF: 愈伤组织细胞形成; SC: 接穗; ST: 砧木; NL: 坏死细胞层; DVB: 发育中的维管组织<br/><b>Figure 3</b> The sliced section of walnut bud healing area using the improved paraffin section method<br/>(A)-(C) 6 days after grafted; (D)-(F) 12 days after grafted. (B), (C) and (E), (F) are local amplification of (A) and (D). (A), (D) Bars=1 mm; (B), (C), (E), (F) Bars=500 μm. CF: Callus formation; SC: Scion; ST: Stock; NL: Necrotic layer; DVB: Developing vascular bundles 在新窗口打开 下载 下载原图ZIP 生成PPT 图3
改进石蜡切片法的核桃方块芽接嫁接部位发育图
(A)-(C) 嫁接后6天; (D)-(F) 嫁接后12天。(B), (C)和(E), (F)分别是(A)和(D)的局部放大。(A), (D) Bars=1 mm; (B), (C), (E), (F) Bars=500 μm。CF: 愈伤组织细胞形成; SC: 接穗; ST: 砧木; NL: 坏死细胞层; DVB: 发育中的维管组织
Figure 3
The sliced section of walnut bud healing area using the improved paraffin section method
(A)-(C) 6 days after grafted; (D)-(F) 12 days after grafted. (B), (C) and (E), (F) are local amplification of (A) and (D). (A), (D) Bars=1 mm; (B), (C), (E), (F) Bars=500 μm. CF: Callus formation; SC: Scion; ST: Stock; NL: Necrotic layer; DVB: Developing vascular bundles
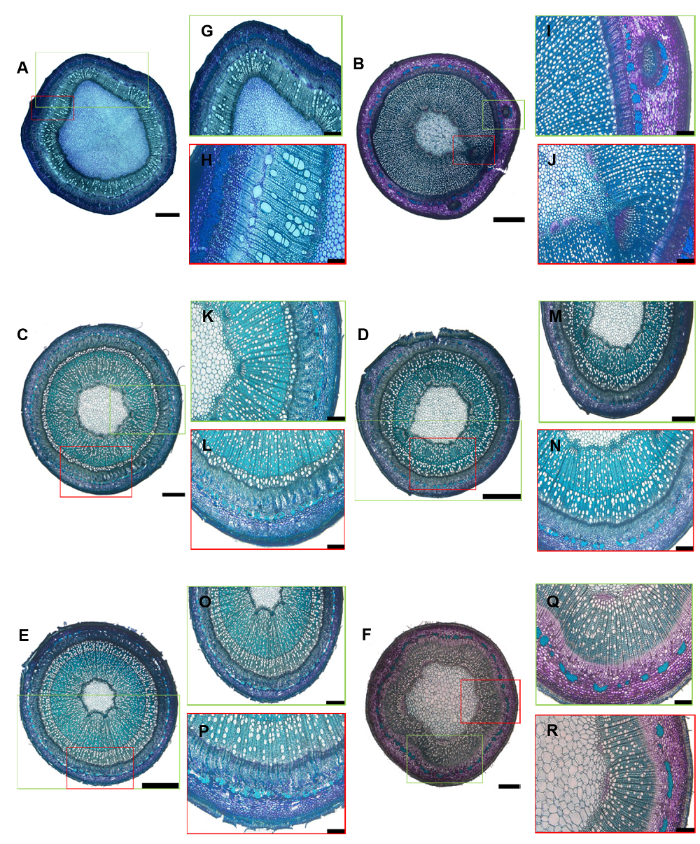
2.4 讨论通过对传统石蜡切片中固定、软化和脱水等主要步骤进行改良, 制得核桃茎段组织和芽接愈合区域组织不同发育时期的石蜡切片, 建立了适用于非均质化木本植物材料的石蜡切片方法。采用改良后的切片方法获得了苹果、桃和杨半木质化茎段切片以及杏和李1-2年生木质化茎段切片(
图4 ), 其表皮、皮层、韧皮部、木质部和髓等各部分组织结构清晰, 横截面切片完整, 为从解剖学上研究林木茎段生长机制和形态发育变化提供技术基础。
图4 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-5-653/img_4.png <b>图4</b> 改进石蜡切片法获得的核桃、苹果、桃、杏、李和杨的茎段切片<br/>(A)-(F) 分别为核桃、苹果、桃、杏、李和杨的茎段切片; (G)和(H)、(I)和(J)、(K)和(L)、(M)和(N)、(O)和(P)、(Q)和(R)分别为(A)-(F)的局部放大。(A), (D), (E) Bars=1 mm; (G), (M), (O) Bars=500 μm; (H)-(L), (N), (P)-(R) Bars=200 μm<br/><b>Figure 4</b> The sliced sections of walnut, apple, peach, apricot, plum and poplar were obtained by improved paraffin section method<br/>(A)-(F) Paraffin sections of stems of walnut, apple, peach, apricot, plum and poplar; (G) and (H), (I) and (J), (K) and (L), (M) and (N), (O) and (P), (Q) and (R) are local amplification of (A)-(F). (A), (D), (E) Bars=1 mm; (G), (M), (O) Bars=500 μm; (H)-(L), (N), (P)-(R) Bars= 200 μm Figure 4 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-5-653/img_4.png <b>图4</b> 改进石蜡切片法获得的核桃、苹果、桃、杏、李和杨的茎段切片<br/>(A)-(F) 分别为核桃、苹果、桃、杏、李和杨的茎段切片; (G)和(H)、(I)和(J)、(K)和(L)、(M)和(N)、(O)和(P)、(Q)和(R)分别为(A)-(F)的局部放大。(A), (D), (E) Bars=1 mm; (G), (M), (O) Bars=500 μm; (H)-(L), (N), (P)-(R) Bars=200 μm<br/><b>Figure 4</b> The sliced sections of walnut, apple, peach, apricot, plum and poplar were obtained by improved paraffin section method<br/>(A)-(F) Paraffin sections of stems of walnut, apple, peach, apricot, plum and poplar; (G) and (H), (I) and (J), (K) and (L), (M) and (N), (O) and (P), (Q) and (R) are local amplification of (A)-(F). (A), (D), (E) Bars=1 mm; (G), (M), (O) Bars=500 μm; (H)-(L), (N), (P)-(R) Bars= 200 μm 在新窗口打开 下载 下载原图ZIP 生成PPT 图4
改进石蜡切片法获得的核桃、苹果、桃、杏、李和杨的茎段切片
(A)-(F) 分别为核桃、苹果、桃、杏、李和杨的茎段切片; (G)和(H)、(I)和(J)、(K)和(L)、(M)和(N)、(O)和(P)、(Q)和(R)分别为(A)-(F)的局部放大。(A), (D), (E) Bars=1 mm; (G), (M), (O) Bars=500 μm; (H)-(L), (N), (P)-(R) Bars=200 μm
Figure 4
The sliced sections of walnut, apple, peach, apricot, plum and poplar were obtained by improved paraffin section method
(A)-(F) Paraffin sections of stems of walnut, apple, peach, apricot, plum and poplar; (G) and (H), (I) and (J), (K) and (L), (M) and (N), (O) and (P), (Q) and (R) are local amplification of (A)-(F). (A), (D), (E) Bars=1 mm; (G), (M), (O) Bars=500 μm; (H)-(L), (N), (P)-(R) Bars= 200 μm
材料各部分组织在硬度和密度上的不均匀是增加石蜡切片难度的主要原因, 改良后的切片方法不仅能有效降低茎段组织的硬度, 还可防止材料在制片过程中变硬、变脆, 使材料达到适中的硬度, 从而获得高质量的石蜡切片。
在固定样品后, 采用过氧化氢-冰醋酸混合溶液(1:1, v/v)软化处理2小时, 能起到快速软化的作用, 主要是软化茎段中木质化加厚的部分, 再转入70%叔丁醇-丙三醇(1:1, v/v)混合溶液中, 50°C条件下处理2天, 是一个缓慢软化的过程, 在进一步软化材料的同时, 能使材料各部分更均匀地软化, 可以有效预防由于软化不均匀在脱水过程中造成整个材料的分散(
王欣等, 2015 ), 能有效降低茎段组织硬度, 从而达到切片要求。软化过程中进行抽真空处理, 使软化剂迅速渗入, 可提高软化效率(
吴华等, 2011 )。但是需要严格控制过氧化氢-冰醋酸的软化时间, 浸泡时间过长, 会导致材料离解, 不能进行制片(
权金娥等, 2014 )。
固定是为了保持组织原有的形态和结构在石蜡切片过程中不发生变形(
侯春春和徐水, 2009 )。改进的固定液是在FPA固定液的基础上, 用70%叔丁醇替代70%乙醇, 且增加了丙三醇, 能有效提升材料的固定效果。其原因可能是由于70%叔丁醇比70%乙醇更能维持材料的完整性, 不易发生收缩, 同时, 丙三醇能起到预软化作用。采用传统的乙醇梯度法脱水, 需要准确把握好各步骤的脱水时间, 以避免出现过度硬化和脱水不彻底的问题(
杨捷频, 2006 )。脱水时间过长, 材料长时间浸泡在乙醇溶液中, 其硬度会增加(
曾月星, 1991 ), 导致后期切片时发生分裂和脱落; 脱水时间太短, 组织脱水不彻底, 会导致透明和浸蜡过程中透明剂和石蜡无法完全渗入组织, 切片不完整。改进后的方法在脱水过程中, 采用叔丁醇梯度脱水法, 且在更换脱水剂时立即抽真空5-8分钟, 时间不宜过长, 以免组织结构变形(
Takahashi et al., 2010 )。在保证材料完全脱水的前提下有效缩短了脱水时间。叔丁醇脱水后可以直接进入浸蜡过程, 与传统石蜡切片流程相比, 省略了在二甲苯溶液中透明的过程, 不仅缩短了切片流程, 而且有效防止了材料在透明过程中变脆, 有助于石蜡渗入组织, 同时避免了二甲苯的毒害(
杨虎彪等, 2009 )。
改良的石蜡切片方法解决了传统石蜡切片技术中材料软化不均匀、制片过程中组织收缩和变形等问题, 且缩短了制片时间, 提高了制片效率。该方法适用于木本植物非均质化组织的切片, 但要制得更高质量的石蜡切片, 需结合材料的结构特征, 不断改进和完善石蜡切片的各个步骤, 探索出适宜的切片方法。
The authors have declared that no competing interests exist. 参考文献 文献选项 原文顺序 文献年度倒序 文中引用次数倒序 被引期刊影响因子 [1] 邓传远 , 郑俊鸣 , 张万超 , 郭素枝 , 薛秋华 , 叶露莹 , 孙建文 (2015 ). 红海榄木材结构的生态解剖. 植物生态学报 39, 604 -615 .[2] 丁平海 , 郗荣庭 , 李金空 (1989 ). 核桃愈伤组织形成条件及形成部位的解剖观察. 河北农业大学学报 12(1 ), 27 -33 .[3] 冯金玲 (2011 ). 油茶芽苗砧嫁接体愈合机理研究. 博士论文. 福州: 福建农林大学 . pp. 22 -28 .[4] 贺冰 , 李志岗 , 郝晓娟 , 贺运春 (2014 ). 植物材料快速石蜡制片方法. 植物学报 49, 203 -208 .[5] 侯春春 , 徐水 (2009 ). 浅析影响石蜡切片质量的关键因素. 中国农学通报 25(23 ), 94 -98 .[6] 黄坚钦 , 章滨森 , 陆建伟 , 付敢伟 (2001 ). 山核桃嫁接愈合过程的解剖学观察. 浙江林学院学报 18(2 ), 111 -114 .[7] 李和平 (2009 ). 植物显微技术(第2版) . 北京: 科学出版社. pp. 9 -34 .[8] 李正理 (1987 ). 植物制片技术(第2版) . 北京: 科学出版社. pp. 138 -148 .[9] 林月惠 , 李寒冰 , 贺新强 (2001 ). 高度木质化材料的冰冻切片技术. 植物学通报 18, 118 -120 .[10] 刘昊 , 宋晓波 , 周乃富 , 马庆国 , 裴东 (2017 ). 吲哚丁酸对核桃嫩枝扦插生根及内源激素变化的影响. 浙江农林大学学报 34, 1038 -1043 .[11] 刘杏娥 , 汪佑宏 , 江泽慧 , 费本华 , 任海青 , 田根林 , 徐鑫 (2010 ). 黄藤材发育过程中维管束的变化. 西北林学院学报 25(2 ), 152 -155 .[12] 鲁丹 , 张瑞 , 彭方仁 , 任莺 , 华宏 (2013 ). 红桤木扦插繁殖技术及生根过程的解剖学观察. 西南林业大学学报 33(2 ), 24 -28 .[13] 牛田 , 王厚新 , 李承秀 , 张林 , 于永畅 , 孙芳 , 王长宪 (2012 ). 华北五角枫嫩枝扦插生根形态解剖学分析. 山东林业科技 42(5 ), 19 -21 .[14] 权金娥 , 朱海兰 , 张春霞 , 张胜 , 赵忠 (2014 ). 四倍体刺槐茎段组织石蜡切片的制作方法. 西北林学院学报 29(3 ), 140 -144 .[15] 王欣 , 隋方功 , 初庆刚 (2015 ). 成熟玉米秆组织结构切片方法的比较研究. 西北植物学报 35, 1052 -1056 .[16] 吴华 , 陈娉婷 , 袁玲 , 徐永荣 , 陈龙清 (2011 ). 蕨类植物石蜡切片制作技术探讨. 湖北农业科学 50, 3767 -3769, 3774 .[17] 吴清韩 , 赵庆芳 , 朱慧 , 马瑞君 (2012 ). 植物高度木质化叶片表皮细胞制备方法. 植物学报 47, 422 -426 .[18] 闫绍鹏 (2011 ). 欧美山杨杂种扦插生根的理化与分子机理研究. 博士论文. 哈尔滨: 东北林业大学 . pp. 23 -26 .[19] 杨虎彪 , 李晓霞 , 罗丽娟 (2009 ). 植物石蜡制片中透明和脱蜡技术的改良. 植物学报 44, 230 -235 .[20] 杨捷频 (2006 ). 常规石蜡切片方法的改良. 生物学杂志 23, 45 -46 .[21] 曾月星 (1991 ). 硬重木材的软化方法. 木材工业 5(2 ), 45 -46, 32 .[22] Coates PJ 1991 ). Paraffin section molecular biology: review of current techniques.J Histotechnol 14, 263 -269 .[23] Day RC 2010 ). Laser microdissection of paraffin-embedded plant tissues for transcript profiling. In: Hennig L, Köhler C, eds. Plant Developmental Biology: Methods and Protocols. Totowa: Humana Press. pp. 321 -346 .[24] Takahashi H Kamakura H Sato Y Shiono K Abiko T Tsutsumi N Nagamura Y Nishizawa NK Nakazono M 2010 ). A method for obtaining high quality RNA from paraffin sections of plant tissues by laser microdissection.J Plant Res 123, 807 -813 .
红海榄木材结构的生态解剖
1
2015
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
核桃愈伤组织形成条件及形成部位的解剖观察
1
1989
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
油茶芽苗砧嫁接体愈合机理研究
1
2011
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
植物材料快速石蜡制片方法
1
2014
... 叔丁醇能与水、二甲苯和乙醇等溶剂混合, 而且是石蜡的溶媒, 兼有脱水和透明的作用(
贺兵等, 2014 ).因此, 在采用叔丁醇梯度脱水后, 不需再进行透明步骤, 可以直接进入浸蜡环节. ...
浅析影响石蜡切片质量的关键因素
1
2009
... 固定是为了保持组织原有的形态和结构在石蜡切片过程中不发生变形(
侯春春和徐水, 2009 ).改进的固定液是在FPA固定液的基础上, 用70%叔丁醇替代70%乙醇, 且增加了丙三醇, 能有效提升材料的固定效果.其原因可能是由于70%叔丁醇比70%乙醇更能维持材料的完整性, 不易发生收缩, 同时, 丙三醇能起到预软化作用.采用传统的乙醇梯度法脱水, 需要准确把握好各步骤的脱水时间, 以避免出现过度硬化和脱水不彻底的问题(
杨捷频, 2006 ).脱水时间过长, 材料长时间浸泡在乙醇溶液中, 其硬度会增加(
曾月星, 1991 ), 导致后期切片时发生分裂和脱落; 脱水时间太短, 组织脱水不彻底, 会导致透明和浸蜡过程中透明剂和石蜡无法完全渗入组织, 切片不完整.改进后的方法在脱水过程中, 采用叔丁醇梯度脱水法, 且在更换脱水剂时立即抽真空5-8分钟, 时间不宜过长, 以免组织结构变形(
Takahashi et al., 2010 ).在保证材料完全脱水的前提下有效缩短了脱水时间.叔丁醇脱水后可以直接进入浸蜡过程, 与传统石蜡切片流程相比, 省略了在二甲苯溶液中透明的过程, 不仅缩短了切片流程, 而且有效防止了材料在透明过程中变脆, 有助于石蜡渗入组织, 同时避免了二甲苯的毒害(
杨虎彪等, 2009 ). ...
山核桃嫁接愈合过程的解剖学观察
1
2001
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
3
2009
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
... 将软化后的材料用蒸馏水冲洗, 去除材料表面的软化剂.然后参照
李和平(2009) 的乙醇梯度脱水法对材料进行脱水处理.方法1: 50%乙醇2小时→70%乙醇2小时→85%乙醇2小时→95%乙醇1小时→无水乙醇45分钟→无水乙醇45分钟; 将材料转入无水乙醇与二甲苯的混合溶液(1:1, v/v)中处理1小时, 然后转入纯二甲苯溶液中, 每次1小时, 更换2次.方法2: 采用叔丁醇梯度脱水法, 即50%叔丁醇1.5小时→70%叔丁醇1.5小时→85%叔丁醇1.5小时→95%叔丁醇1小时→纯叔丁醇30分钟→纯叔丁醇30分钟.更换脱水剂后均进行抽真空处理.由于叔丁醇有脱水和透明的双重作用, 采用叔丁醇梯度脱水后不需要再进行透明步骤. ...
...
参照李和平(2009) 的方法进行脱蜡处理, 即用0.5% (w/v)甲苯胺蓝O浸染2分钟, 取出后用蒸馏水清洗2次, 0.5% (v/v)醋酸水溶液分化处理1分钟. ...
1
1987
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
高度木质化材料的冰冻切片技术
1
2001
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
吲哚丁酸对核桃嫩枝扦插生根及内源激素变化的影响
1
2017
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
黄藤材发育过程中维管束的变化
1
2010
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
红桤木扦插繁殖技术及生根过程的解剖学观察
1
2013
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
华北五角枫嫩枝扦插生根形态解剖学分析
1
2012
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
四倍体刺槐茎段组织石蜡切片的制作方法
1
2014
... 在固定样品后, 采用过氧化氢-冰醋酸混合溶液(1:1, v/v)软化处理2小时, 能起到快速软化的作用, 主要是软化茎段中木质化加厚的部分, 再转入70%叔丁醇-丙三醇(1:1, v/v)混合溶液中, 50°C条件下处理2天, 是一个缓慢软化的过程, 在进一步软化材料的同时, 能使材料各部分更均匀地软化, 可以有效预防由于软化不均匀在脱水过程中造成整个材料的分散(
王欣等, 2015 ), 能有效降低茎段组织硬度, 从而达到切片要求.软化过程中进行抽真空处理, 使软化剂迅速渗入, 可提高软化效率(
吴华等, 2011 ).但是需要严格控制过氧化氢-冰醋酸的软化时间, 浸泡时间过长, 会导致材料离解, 不能进行制片(
权金娥等, 2014 ). ...
成熟玉米秆组织结构切片方法的比较研究
1
2015
... 在固定样品后, 采用过氧化氢-冰醋酸混合溶液(1:1, v/v)软化处理2小时, 能起到快速软化的作用, 主要是软化茎段中木质化加厚的部分, 再转入70%叔丁醇-丙三醇(1:1, v/v)混合溶液中, 50°C条件下处理2天, 是一个缓慢软化的过程, 在进一步软化材料的同时, 能使材料各部分更均匀地软化, 可以有效预防由于软化不均匀在脱水过程中造成整个材料的分散(
王欣等, 2015 ), 能有效降低茎段组织硬度, 从而达到切片要求.软化过程中进行抽真空处理, 使软化剂迅速渗入, 可提高软化效率(
吴华等, 2011 ).但是需要严格控制过氧化氢-冰醋酸的软化时间, 浸泡时间过长, 会导致材料离解, 不能进行制片(
权金娥等, 2014 ). ...
蕨类植物石蜡切片制作技术探讨
1
2011
... 在固定样品后, 采用过氧化氢-冰醋酸混合溶液(1:1, v/v)软化处理2小时, 能起到快速软化的作用, 主要是软化茎段中木质化加厚的部分, 再转入70%叔丁醇-丙三醇(1:1, v/v)混合溶液中, 50°C条件下处理2天, 是一个缓慢软化的过程, 在进一步软化材料的同时, 能使材料各部分更均匀地软化, 可以有效预防由于软化不均匀在脱水过程中造成整个材料的分散(
王欣等, 2015 ), 能有效降低茎段组织硬度, 从而达到切片要求.软化过程中进行抽真空处理, 使软化剂迅速渗入, 可提高软化效率(
吴华等, 2011 ).但是需要严格控制过氧化氢-冰醋酸的软化时间, 浸泡时间过长, 会导致材料离解, 不能进行制片(
权金娥等, 2014 ). ...
植物高度木质化叶片表皮细胞制备方法
1
2012
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
欧美山杨杂种扦插生根的理化与分子机理研究
1
2011
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
植物石蜡制片中透明和脱蜡技术的改良
1
2009
... 固定是为了保持组织原有的形态和结构在石蜡切片过程中不发生变形(
侯春春和徐水, 2009 ).改进的固定液是在FPA固定液的基础上, 用70%叔丁醇替代70%乙醇, 且增加了丙三醇, 能有效提升材料的固定效果.其原因可能是由于70%叔丁醇比70%乙醇更能维持材料的完整性, 不易发生收缩, 同时, 丙三醇能起到预软化作用.采用传统的乙醇梯度法脱水, 需要准确把握好各步骤的脱水时间, 以避免出现过度硬化和脱水不彻底的问题(
杨捷频, 2006 ).脱水时间过长, 材料长时间浸泡在乙醇溶液中, 其硬度会增加(
曾月星, 1991 ), 导致后期切片时发生分裂和脱落; 脱水时间太短, 组织脱水不彻底, 会导致透明和浸蜡过程中透明剂和石蜡无法完全渗入组织, 切片不完整.改进后的方法在脱水过程中, 采用叔丁醇梯度脱水法, 且在更换脱水剂时立即抽真空5-8分钟, 时间不宜过长, 以免组织结构变形(
Takahashi et al., 2010 ).在保证材料完全脱水的前提下有效缩短了脱水时间.叔丁醇脱水后可以直接进入浸蜡过程, 与传统石蜡切片流程相比, 省略了在二甲苯溶液中透明的过程, 不仅缩短了切片流程, 而且有效防止了材料在透明过程中变脆, 有助于石蜡渗入组织, 同时避免了二甲苯的毒害(
杨虎彪等, 2009 ). ...
常规石蜡切片方法的改良
1
2006
... 固定是为了保持组织原有的形态和结构在石蜡切片过程中不发生变形(
侯春春和徐水, 2009 ).改进的固定液是在FPA固定液的基础上, 用70%叔丁醇替代70%乙醇, 且增加了丙三醇, 能有效提升材料的固定效果.其原因可能是由于70%叔丁醇比70%乙醇更能维持材料的完整性, 不易发生收缩, 同时, 丙三醇能起到预软化作用.采用传统的乙醇梯度法脱水, 需要准确把握好各步骤的脱水时间, 以避免出现过度硬化和脱水不彻底的问题(
杨捷频, 2006 ).脱水时间过长, 材料长时间浸泡在乙醇溶液中, 其硬度会增加(
曾月星, 1991 ), 导致后期切片时发生分裂和脱落; 脱水时间太短, 组织脱水不彻底, 会导致透明和浸蜡过程中透明剂和石蜡无法完全渗入组织, 切片不完整.改进后的方法在脱水过程中, 采用叔丁醇梯度脱水法, 且在更换脱水剂时立即抽真空5-8分钟, 时间不宜过长, 以免组织结构变形(
Takahashi et al., 2010 ).在保证材料完全脱水的前提下有效缩短了脱水时间.叔丁醇脱水后可以直接进入浸蜡过程, 与传统石蜡切片流程相比, 省略了在二甲苯溶液中透明的过程, 不仅缩短了切片流程, 而且有效防止了材料在透明过程中变脆, 有助于石蜡渗入组织, 同时避免了二甲苯的毒害(
杨虎彪等, 2009 ). ...
硬重木材的软化方法
1
1991
... 固定是为了保持组织原有的形态和结构在石蜡切片过程中不发生变形(
侯春春和徐水, 2009 ).改进的固定液是在FPA固定液的基础上, 用70%叔丁醇替代70%乙醇, 且增加了丙三醇, 能有效提升材料的固定效果.其原因可能是由于70%叔丁醇比70%乙醇更能维持材料的完整性, 不易发生收缩, 同时, 丙三醇能起到预软化作用.采用传统的乙醇梯度法脱水, 需要准确把握好各步骤的脱水时间, 以避免出现过度硬化和脱水不彻底的问题(
杨捷频, 2006 ).脱水时间过长, 材料长时间浸泡在乙醇溶液中, 其硬度会增加(
曾月星, 1991 ), 导致后期切片时发生分裂和脱落; 脱水时间太短, 组织脱水不彻底, 会导致透明和浸蜡过程中透明剂和石蜡无法完全渗入组织, 切片不完整.改进后的方法在脱水过程中, 采用叔丁醇梯度脱水法, 且在更换脱水剂时立即抽真空5-8分钟, 时间不宜过长, 以免组织结构变形(
Takahashi et al., 2010 ).在保证材料完全脱水的前提下有效缩短了脱水时间.叔丁醇脱水后可以直接进入浸蜡过程, 与传统石蜡切片流程相比, 省略了在二甲苯溶液中透明的过程, 不仅缩短了切片流程, 而且有效防止了材料在透明过程中变脆, 有助于石蜡渗入组织, 同时避免了二甲苯的毒害(
杨虎彪等, 2009 ). ...
1
1991
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
1
2010
... 石蜡切片技术是组织解剖学研究中最为经典的实验技术之一, 也是观察和研究植物器官、组织及细胞的有效手段(
李正理, 1987 ).由于石蜡切片具有成本低、易操作、可连续切片及能永久保存等优点, 被广泛应用于发育生物学、植物解剖学及分子生物学等研究领域(
Coates, 1991 ;
Day, 2010 ;
闫绍鹏, 2011 ;
吴清韩等, 2012 ).但是, 传统的石蜡切片制作方法耗时较长, 对于密度大、硬度高的材料则需要进行更长时间的软化处理, 且制片质量不稳定(
林月慧等, 2001 ;
李和平, 2009 ).随着石蜡制片技术的日臻完善, 植物材料的石蜡制片质量和效率有了显著提高, 石蜡切片技术已广泛应用于林木结构组织发育(
刘杏娥等, 2010 ;
邓传远等, 2015 )、嫁接愈合过程(
丁平海等, 1989 ;
黄坚钦等, 2001 ;
冯金玲, 2011 )和扦插不定根发生过程(
牛田等, 2012 ;
鲁丹等, 2013 ;
刘昊等, 2017 )的解剖学研究.然而, 这些石蜡切片技术的改进均是针对特定的植物材料, 缺乏广适性.本研究在传统石蜡切片的基础上进行创新和尝试, 以期建立适合非均质化植物材料的切片方法. ...
1
2010
... 固定是为了保持组织原有的形态和结构在石蜡切片过程中不发生变形(
侯春春和徐水, 2009 ).改进的固定液是在FPA固定液的基础上, 用70%叔丁醇替代70%乙醇, 且增加了丙三醇, 能有效提升材料的固定效果.其原因可能是由于70%叔丁醇比70%乙醇更能维持材料的完整性, 不易发生收缩, 同时, 丙三醇能起到预软化作用.采用传统的乙醇梯度法脱水, 需要准确把握好各步骤的脱水时间, 以避免出现过度硬化和脱水不彻底的问题(
杨捷频, 2006 ).脱水时间过长, 材料长时间浸泡在乙醇溶液中, 其硬度会增加(
曾月星, 1991 ), 导致后期切片时发生分裂和脱落; 脱水时间太短, 组织脱水不彻底, 会导致透明和浸蜡过程中透明剂和石蜡无法完全渗入组织, 切片不完整.改进后的方法在脱水过程中, 采用叔丁醇梯度脱水法, 且在更换脱水剂时立即抽真空5-8分钟, 时间不宜过长, 以免组织结构变形(
Takahashi et al., 2010 ).在保证材料完全脱水的前提下有效缩短了脱水时间.叔丁醇脱水后可以直接进入浸蜡过程, 与传统石蜡切片流程相比, 省略了在二甲苯溶液中透明的过程, 不仅缩短了切片流程, 而且有效防止了材料在透明过程中变脆, 有助于石蜡渗入组织, 同时避免了二甲苯的毒害(
杨虎彪等, 2009 ). ...
 ,
,  ,
,