马骊 1 ,
孙万仓 1 , * , ,
袁金海 1 ,
刘自刚 1 ,
武军艳 1 ,
方彦 1 ,
许耀照 2 ,
蒲媛媛 1 ,
白静 1 ,
董小云 1 ,
何辉立 1 1 甘肃农业大学农学院, 甘肃省油菜工程技术研究中心, 甘肃省作物遗传改良与种质创新重点实验室, 兰州 7300702 河西学院农业与生物技术学院, 张掖 734000Ma Li 1 ,
Sun Wancang 1 , * , ,
Yuan Jinhai 1 ,
Liu Zigang 1 ,
Wu Junyan 1 ,
Fang Yan 1 ,
Xu Yaozhao 2 ,
Pu Yuanyuan 1 ,
Bai Jing 1 ,
Dong Xiaoyun 1 ,
He Huili 1 1 Gansu Key Laboratory of Crop Improvement and Germplasm Enhancement, Rapeseed Engineering Research Center of Gansu Province, College of Agronomy, Gansu Agricultural University, Lanzhou 730070, China2 College of Agronomy and Biotechnology, Hexi University, Zhangye 734000, China引用本文 马骊 ,
孙万仓 ,
袁金海 ,
刘自刚 ,
武军艳 ,
方彦 ,
许耀照 ,
蒲媛媛 ,
白静 ,
董小云 ,
何辉立 . 白菜型冬油菜【-逻*辑*与-】#x003b2;-1,3-葡聚糖酶基因在低温胁迫下的表达. , 2017, 52(5): 568-578
贡献者
* 通讯作者。E-mail: 18293121851@163.com 基金资助
国家现代农业产业技术体系(No.CARS-13)、国家自然科学基金(No.31460356, No.31560397, No.3166040, No.31660404)、国家重点基础研究发展计划(No.2015CB150206)、科技部油菜杂种优势利用技术与强优势杂交种创制(No.2016YFD0101300)和甘肃省教育厅科研专项(No.2015A-077) ;
接受日期:2016-11-23接受日期:2017-03-24网络出版日期:2017-09-1
-->Copyright
2017《植物学报》编辑部
Contributors
* Author for correspondence. E-mail: 18293121851@163.com History
Received :
Accepted :
Online :
摘要: 为探明β-1,3-葡聚糖酶基因(β-1,3-glucanase )对油菜(Brassica campestris )抵御低温胁迫能力的作用, 通过蛋白质谱分析得到β-1,3-葡聚糖酶蛋白, 采用RT-PCR技术克隆白菜型冬油菜(B. rapa )陇油6号和天油4号β-1,3-葡聚糖酶的cDNA序列; 并对该序列进行生物信息学分析; 进而采用实时荧光定量PCR及半定量PCR检测β-1,3-葡聚糖酶基因在低温胁迫下的表达模式。结果获得长度为1 032 bp的陇油6号β-1,3-葡聚糖酶基因开放阅读框, 编码343个氨基酸, 相对分子量为38.102 kDa, 理论等电点为6.63, 其与菜心(B. rapa subsp. chinensis )和甘蓝型油菜(B. napus )的蛋白质氨基酸序列同源性高达93.94%。该基因编码的酶是一个主要由α-螺旋组成的亲水性稳定蛋白, 含有1个信号肽, 存在2个跨膜结构域。该基因在进化上高度保守, 其保守序列属于植物的糖基水解酶家族17特有的保守结构域。β-1,3-葡聚糖酶基因表达模式分析显示, 4°C时该基因上调表达, 继续低温(-4°C)胁迫处理, 该基因上调表达至峰值, 至-8°C时其表达下调。研究表明从白菜型冬油菜中克隆的β-1,3-glucanase 在冬油菜品种陇油6号抗寒过程中发挥作用。 关键词 :
β-1 ;
3-葡聚糖酶基因 ;
低温 ;
分子克隆 ;
表达分析 Abstract :
This study examined the function of β-1,3-glucanase in Brassica rapa with low temperature stress, whose encoding protein was identified by protein mass spectrometry analysis. The cDNA sequence of β-1,3-glucanase was cloned by RT-PCR of winter rapeseed from Longyou6 and Tianyou4 cultivars. Semi-quantitative PCR and real-time fluorescence quantitative PCR were used to study the expression pattern of β-1,3-glucanase in response to low temperature stress. The open reading frame of the β-1,3-glucanase gene was obtained at a length of 1 032 bp, and encoded 343 amino acid. The molecular weight was 38.102 kDa and the isoelectric point 6.63, with 93.94% amino sequence similarity to B. rapa subsp. chinensis and B. napus. The protein encoded by this gene is a hydrophilic protein with one signal peptide and two transmembrane domains. The prediction of the secondary structures indicated that β-1,3-glucanase is a protein with more α-helices. The predicted β-1,3-glucanase contains a conserved amino acid sequence corresponding to the plant Glycol-Hydro 17 superfamily. RT-PCR and semi-quantitative RT-PCR results showed that β-1,3-glucanase was upregulated in response to 4°C, and the gene was upregulated to peak in expression at -4°C; However, the expression was inhibited at lower temperature (-8°C). The β-1,3-glucanase gene cloned from the winter B. rapa cv. ‘Longyou6’ might play a role in cold tolerance. Key words :
β-1 ;
3-glucanase gene ;
low temperature ;
molecular cloning ;
expression analysis 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型。自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 )。由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下。因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益。植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等。此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 )。β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 )。PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关。研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 )。β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 )。迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 )。目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少。研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 )。
陈芳兰等(2015) 研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变。
Griffith等(1992) 已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性。
Hon等(1994) 也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性。通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关。本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据。
1 材料与方法1.1 实验材料本研究以白菜型冬油菜(
Brassica rapa L.)陇油6号和天油4号为实验材料。陇油6号为超强抗寒品种, 在-30°C下越冬率达90%, 由甘肃农业大学选育。天油4号为弱抗寒品种, 在-30°C下越冬率为60%, 由天水农业科学研究所选育。选取籽粒饱满且大小一致的油菜种子, 用10%过氧化氢处理30分钟, 再用无菌水冲洗2-3次, 置于铺有2层滤纸的培养皿内进行催芽(光照14小时, 30°C; 黑暗10小时, 28°C)。待种子露白后, 播种于装有育苗基质的花盆(14 cm×13 cm)中, 每盆4株, 在人工培养箱中培养(光照14小时, 25°C; 黑暗10小时, 20°C)。待生长至七叶期时取样(对照)。随后将培养箱温度设置为4°C, 并于培养4天后取样; 继而-4°C培养4天后取样; 最后将植株置于-8°C继续培养4天后取样。
1.2 蛋白质筛选与分析1.2.1 质外体蛋白的提取
质外体蛋白的提取参考
龚束芳等(2010) 的方法, 并稍作改进。先用流水将叶片冲洗干净, 用ddH
2 O冲洗2遍, 再用滤纸吸干表面水分后, 切成1.0 cm长条, 用提取缓冲液(50 mmol∙L
-1 Tris-HCl, 10 mmol∙L
-1 EDTA, 20 mmol∙L
-1 Vc, pH8.0)浸洗去掉渗出物。将叶片浸入上述缓冲液中, 室温抽真空30分钟, 再用滤纸吸去叶片表面液体, 放入50 mL注射器中。将注射器放入离心管中, 平衡后4°C 7 000 ×
g 离心20分钟, 收集离心管底部溶液, 即为质外体粗提物。
1.2.2 蛋白质含量的测定
使用Bradford法(
Bradford, 1976 )测定蛋白质含量。用牛血清蛋白作标准曲线, 用分光光度计在595 nm处测定标准溶液和样品蛋白的吸光值, 根据标准曲线计算样品蛋白浓度。实验重复3次。
1.2.3 SDS-PAGE凝胶电泳
SDS-PAGE凝胶电泳参考
郭尧君(2005) 的方法。样品上样量为35 μg, 采用4%浓缩胶和12%分离胶。
1.3 RNA提取及反转录参考天根公司生物试剂使用说明书提取油菜总RNA。电泳检测后按PrimeScript™ RT reagent Kit with gDNA Eraser试剂盒(大连TaKaRa公司)说明书进行反转录, 得到单链cDNA, 测定其浓度后, 置于-20°C冰箱中保存备用。
1.4 引物设计与β-1,3-葡聚糖酶基因克隆通过蛋白质谱分析得到β-1,3-葡聚糖酶蛋白(gi|623- 61691)及对应的mRNA序列。利用NCBI数据库对该序列进行Blast, 获得同源性为99%的白菜型油菜β-1,3-葡聚糖酶基因的核苷酸序列。利用Primer Pre- mier 5.0软件设计引物。引物序列为BG-F, 5ʹ-GGCA- CGAGGGTTAGGATGTTA-3ʹ; BG-R, 5ʹ-GAAGTG- CAACGGTTAAGGCTC-3ʹ。
以陇油6号(CK)叶片cDNA为模板进行RT-PCR扩增。扩增程序为: 94°C 5分钟; 94°C 30秒, 50°C 30秒, 72°C 78秒, 35个循环; 72°C 10分钟; 16°C保存。PCR反应结束后, 对扩增产物进行电泳检测(1%)。参照天根生物普通琼脂糖凝胶DNA纯化回收试剂盒说明书对目的片段进行回收; 采用pMD-19T载体连接回收产物; 连接成功后转化至DH5α大肠杆菌感受态细胞并培养10-12小时。然后进行蓝白斑检测筛选, 挑选白斑进行菌液培养, 然后经PCR检测选取3个阳性菌落送华大基因(北京)股份有限公司进行测序。
1.5 β-1,3-葡聚糖酶预测蛋白的生物信息学分析利用Protparam工具进行蛋白质基本理化性质分析。氨基酸疏水性分析采用Protscale。跨膜结构预测采用TMpred Server软件。利用SignalP4.1 Server预测蛋白信号肽。利用SOPMA工具预测蛋白质二级结构。保守结构域分析用SMART工具。利用SWISS- MODEL软件进行蛋白质三级结构分析。
利用BLAST程序软件从GenBank中挑选8个来源于十字花科植物的β-1,3-葡聚糖酶基因编码的蛋白质氨基酸序列, 即白菜型油菜(CAA54952.1)、菜心(
B. rapa subsp.
chinensis ) (AAX76839.1)、甘蓝型油菜(
B. napus ) (XP_013742178.1)、甘蓝(
B. oleracea ) (ABO87659.1)、野甘蓝(
B. oleracea var.
oleracea ) (XP_013636025.1)、芥菜(
B. juncea ) (ABC94639.1)、萝卜(
Raphanus sativus ) (XP_ 018458782.1)和拟南芥(
Arabidopsis thaliana ) (NP_ 001325845.1)。利用DNAMAN软件进行多重序列比较和氨基酸同源性分析。应用ClustalX 2和MEGA 5.1软件构建系统发生树。
1.6 β-1,3-葡聚糖酶在低温胁迫下的表达量依据引物设计原则设计白菜型油菜β-1,3-葡聚糖酶定量表达引物BG-S (5'-TCTTCTCAGCCTTCTAATGG- 3')和BG-A (5'-CTTCCGATGGATTTGGTAT-3')。以相同浓度陇油6号和天油4号cDNA为模板, 以
β-actin (Act-F, 5'-GTGTCATGGTTGGGATGGGT-3'; Act- R, 5'-AAGAACCGGGTGCTCTTCAG-3')作为内参, 分别对其进行实时荧光定量和半定量PCR分析。半定量PCR程序同上, 温度为60°C。实时荧光定量PCR参考SYBR
® Premix Ex
Taq TMI (TliRNase H Plus)试剂盒说明书(大连TaKaRa公司), 采用两步法。扩增程序为: 95°C30秒; 95°C5秒, 60°C34秒, 40个循环; 95°C15秒, 60°C1分钟, 95°C15秒。用96孔上样板, 目的基因与内参基因对应, 操作时避免强光照射。设3次重复。采用2
-ΔΔCt 方法计算: ΔCT(目的基因)= CT(目的基因)-CT(内参基因); ΔΔCT(目的基因)=处理组(ΔCT目的基因)-对照组(ΔCT目的基因); 相对表达量(relative quantification)=2
-ΔΔCt (目的基因) (
邓文星和张映, 2007 )。
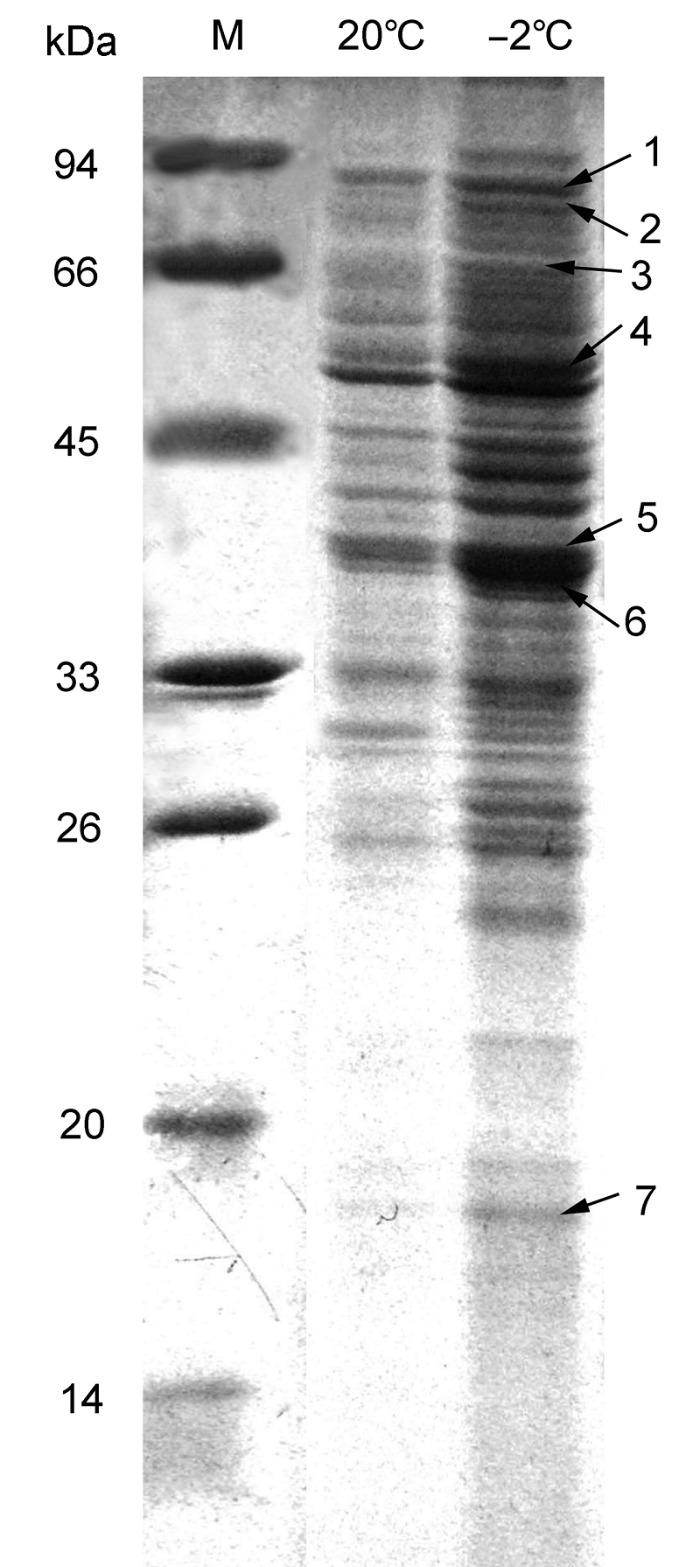
2 结果与讨论2.1 低温胁迫后陇油6号质外体蛋白标记及质谱鉴定低温胁迫后, 植株体内原有蛋白质的含量发生明显变化, 以适应逆境, 表现为其SDS-PAGE谱带与对照不同, 这意味着低温胁迫影响油菜叶片质外体蛋白的结构与组分变化。当植物受低温胁迫时, 相关基因就会表现出明显的累积效应, 从而使相关蛋白质不断富集。这些结果表明, 在正常条件下, 某些蛋白质的表达丰度较低或不表达。但是, 在低温胁迫下, 这些蛋白质被诱导表达并发挥功能, 导致植物体内一系列生化反应, 从而抵御低温胁迫。依据本课题组白菜型冬油菜质外体蛋白质谱数据, 白菜型冬油菜陇油6号叶片在低温(-2°C)下较常温(20°C)出现表达较强的条带(
图1 ,条带5)。对该条带多肽取样进行串联质谱(MALDI- TOF-TOF-MS)鉴定, 结果显示该增强表达的条带为β-1,3-葡聚糖酶蛋白(
表1 )。
图1 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_1.png <b>图1</b> 白菜型冬油菜陇油6号叶片质外体蛋白图谱<br/>M: 标准蛋白; 1: 类枯草菌素蛋白酶; 2: 叶绿体热休克蛋白70-1; 3: 黑芥子酶; 4: S-腺苷-L-同半胱氨酸水解酶; 5: 基本葡聚糖酶; 6: β-1,3-葡聚糖酶; 7: 病程相关蛋白1<br/><b>Figure 1</b> Apoplast protein map of <i>Brassica rapa </i>cv. ‘Long- you6’ leaves<br/>M: Protein marker; 1: Subtilisin-like protease; 2: Chloroplast heat shock protein 70-1; 3: Myrosinase; 4: S-adenosyl-L- homocystein hydrolase; 5: Basic glucanase; 6: β-1,3-gluca- nase; 7: Pathogenesis- related protein-1 Figure 1 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_1.png <b>图1</b> 白菜型冬油菜陇油6号叶片质外体蛋白图谱<br/>M: 标准蛋白; 1: 类枯草菌素蛋白酶; 2: 叶绿体热休克蛋白70-1; 3: 黑芥子酶; 4: S-腺苷-L-同半胱氨酸水解酶; 5: 基本葡聚糖酶; 6: β-1,3-葡聚糖酶; 7: 病程相关蛋白1<br/><b>Figure 1</b> Apoplast protein map of <i>Brassica rapa </i>cv. ‘Long- you6’ leaves<br/>M: Protein marker; 1: Subtilisin-like protease; 2: Chloroplast heat shock protein 70-1; 3: Myrosinase; 4: S-adenosyl-L- homocystein hydrolase; 5: Basic glucanase; 6: β-1,3-gluca- nase; 7: Pathogenesis- related protein-1 在新窗口打开 下载 下载原图ZIP 生成PPT 图1
白菜型冬油菜陇油6号叶片质外体蛋白图谱
M: 标准蛋白; 1: 类枯草菌素蛋白酶; 2: 叶绿体热休克蛋白70-1; 3: 黑芥子酶; 4: S-腺苷-L-同半胱氨酸水解酶; 5: 基本葡聚糖酶; 6: β-1,3-葡聚糖酶; 7: 病程相关蛋白1
Figure 1
Apoplast protein map of
Brassica rapa cv. ‘Long- you6’ leaves
M: Protein marker; 1: Subtilisin-like protease; 2: Chloroplast heat shock protein 70-1; 3: Myrosinase; 4: S-adenosyl-L- homocystein hydrolase; 5: Basic glucanase; 6: β-1,3-gluca- nase; 7: Pathogenesis- related protein-1
表1 Table 1 表1 表1 白菜型冬油菜陇油6号叶片质外体蛋白质谱鉴定
Table 1 Mass spectrometry results of apoplast proteins in
Brassica rapa cv. ‘Longyou6’ leaves
Spot NCBI accession Protein name Organism Score Sequence coverage 1 gi|757534 Subtilisin-like protease Arabidopsis thaliana 146 3 2 gi|166919370 Chloroplast heat shock protein 70-1 Ipomoea nil 291 6 3 gi|11034734 Myrosinase Raphanus sativus 98 6 4 gi|32967699 S-adenosyl-L-homocystein hydrolase A. thaliana 290 29 5 gi|118763538 Basic glucanase Brassica juncea 315 53 6 gi|62361691 β-1,3-glucanase B. rapa subsp. 348 48 7 gi|722274 Pathogenesis-related protein-1 B. juncea 78 41
表1
白菜型冬油菜陇油6号叶片质外体蛋白质谱鉴定
Table 1
Mass spectrometry results of apoplast proteins in
Brassica rapa cv. ‘Longyou6’ leaves
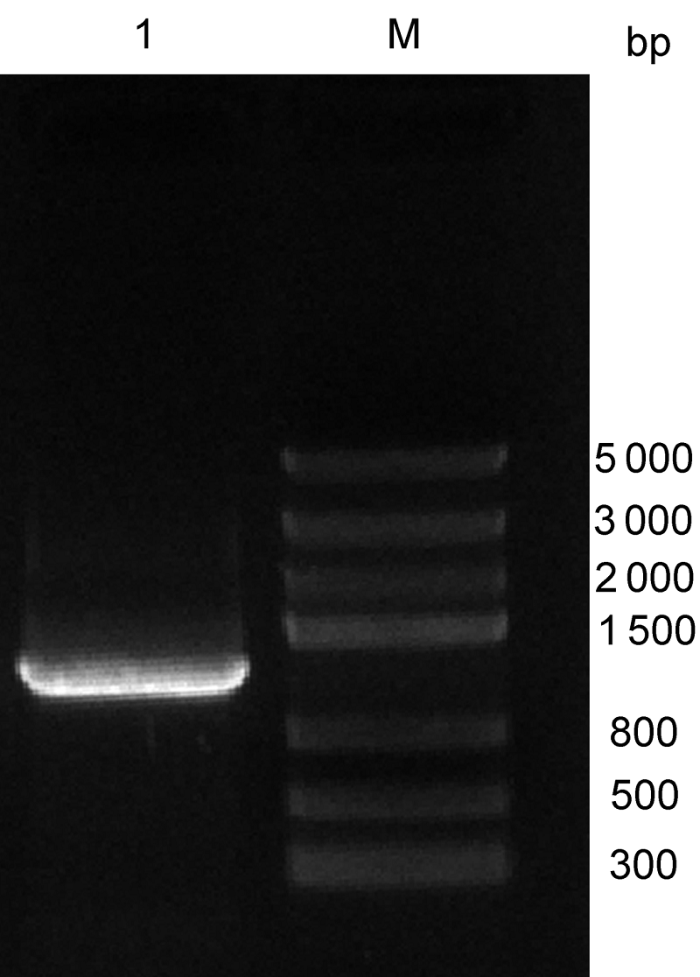
2.2 β-1,3-葡聚糖酶基因克隆为进一步验证该蛋白的功能, 我们对陇油6号进行RT- PCR扩增。结果获得长度为1 200 bp的扩增产物, 纯化回收目的片段, 连接T载体后转化大肠杆菌, 利用菌液PCR筛选阳性克隆, 得到1条1 200 bp的目的片段(
图2 ), 说明克隆β-1,3-葡聚糖酶基因已插入载体中。对挑选的阳性克隆进行测序得到碱基序列, 测序结果显示该基因全长为1 249 bp。
图2 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_2.png <b>图2</b> 菌液PCR电泳产物<br/>M: 分子量标准; 1: 菌液PCR产物<br/><b>Figure 2</b> Electrophoresis results of bacterial PCR<br/>M: DNA marker III; 1: Bacterial PCR product Figure 2 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_2.png <b>图2</b> 菌液PCR电泳产物<br/>M: 分子量标准; 1: 菌液PCR产物<br/><b>Figure 2</b> Electrophoresis results of bacterial PCR<br/>M: DNA marker III; 1: Bacterial PCR product 在新窗口打开 下载 下载原图ZIP 生成PPT 图2
菌液PCR电泳产物
M: 分子量标准; 1: 菌液PCR产物
Figure 2
Electrophoresis results of bacterial PCR
M: DNA marker III; 1: Bacterial PCR product
2.3 β-1,3-葡聚糖酶基因编码蛋白质的特性利用DNAMAN软件查找陇油6号β-1,3-葡聚糖酶序列开放阅读框, 结果显示该序列含有1个长度为1 032 bp的完整开放阅读框, 编码含343个氨基酸的蛋白质,与其它十字花科植物基因组数据库β-1,3-葡聚糖酶基因编码区序列一致, 起始密码子为ATG, 终止密码子为TAA (
图3 )。采用Protparam在线预测β-1,3-葡聚糖酶基因编码蛋白质的理化性质, 结果(
表2 )表明, 陇油6号β-1,3-glucanase蛋白的相对分子量为38.102 kDa, 由20种氨基酸组成, 其中以Asn和Leu所占比例最高, 分别为9.6%和8.7%; 理论等电点为6.63; 预测不稳定指数为39.58 (不稳定指数>40时不稳定); 总平均疏水指数(grand average of hydropathicity, GRAVY)为-0.334, 表明该蛋白为亲水性蛋白(
图4A )。其蛋白质理化性质与天油4号和白菜型油菜几乎一致, 而与甘蓝、拟南芥和芥菜差异较大。该蛋白与质谱获得的β-1,3-葡聚糖酶蛋白同源性高达93.94%, 证明前期质谱所绘的蛋白与克隆的β-1,3-葡聚糖酶基因编码蛋白一致。
图3 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_3.png <b>图3</b> <i>β-1,3-glucanase</i>基因编码区核酸序列及编码氨基酸序列<br/>上游的起始密码子ATG用方框表示; * 为终止密码子TAA的位置。<br/><b>Figure 3</b> Nucleotide sequence and deduced amino acid sequence of <i>β-1,3-glucanase </i>cDNA<br/>An upstream in-flame start codon ATG is boxed; * indicates the positions of termination codon TAA. Figure 3 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_3.png <b>图3</b> <i>β-1,3-glucanase</i>基因编码区核酸序列及编码氨基酸序列<br/>上游的起始密码子ATG用方框表示; * 为终止密码子TAA的位置。<br/><b>Figure 3</b> Nucleotide sequence and deduced amino acid sequence of <i>β-1,3-glucanase </i>cDNA<br/>An upstream in-flame start codon ATG is boxed; * indicates the positions of termination codon TAA. 在新窗口打开 下载 下载原图ZIP 生成PPT 图3
β-1,3-glucanase 基因编码区核酸序列及编码氨基酸序列
上游的起始密码子ATG用方框表示; * 为终止密码子TAA的位置。
Figure 3
Nucleotide sequence and deduced amino acid sequence of
β-1,3-glucanase cDNA
An upstream in-flame start codon ATG is boxed; * indicates the positions of termination codon TAA.
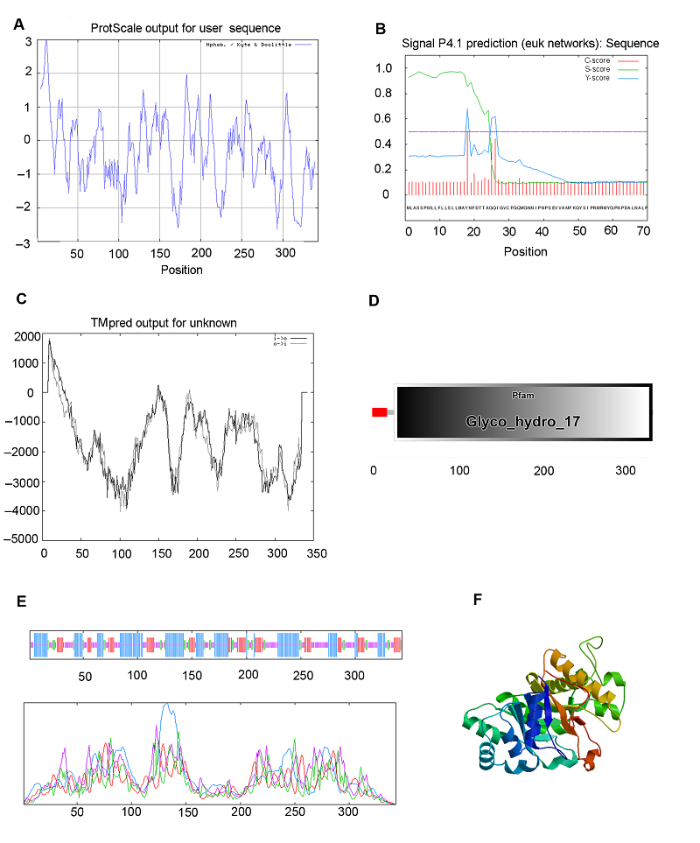
图4 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_4.png <b>图4</b> 白菜型冬油菜陇油6号β-1,3-葡聚糖酶蛋白生物信息学分析<br/>(A) 用ProtScale程序预测蛋白质疏水性; (B) 用Signal P4程序预测信号肽; (C) 用TMpred程序预测β-1,3-葡聚糖酶的跨膜区段; (D) 结构域预测; (E) 二级结构预测; (F) 三级结构预测<br/><b>Figure 4</b> Bioinformatic analysis of β-1,3-glucanase protein in <i>Brassica rapa</i> cv. ‘Longyou6’<br/>(A) Predicted protein hydrophobicity by ProtScale; (B) Predicted signal peptide by Signal P4; (C) Transmembrane helical segments predicted by TMpred; (D) Predication of domains; (E) Predicted secondary structure; (F) Predicted 3-D structure Figure 4 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_4.png <b>图4</b> 白菜型冬油菜陇油6号β-1,3-葡聚糖酶蛋白生物信息学分析<br/>(A) 用ProtScale程序预测蛋白质疏水性; (B) 用Signal P4程序预测信号肽; (C) 用TMpred程序预测β-1,3-葡聚糖酶的跨膜区段; (D) 结构域预测; (E) 二级结构预测; (F) 三级结构预测<br/><b>Figure 4</b> Bioinformatic analysis of β-1,3-glucanase protein in <i>Brassica rapa</i> cv. ‘Longyou6’<br/>(A) Predicted protein hydrophobicity by ProtScale; (B) Predicted signal peptide by Signal P4; (C) Transmembrane helical segments predicted by TMpred; (D) Predication of domains; (E) Predicted secondary structure; (F) Predicted 3-D structure 在新窗口打开 下载 下载原图ZIP 生成PPT 图4
白菜型冬油菜陇油6号β-1,3-葡聚糖酶蛋白生物信息学分析
(A) 用ProtScale程序预测蛋白质疏水性; (B) 用Signal P4程序预测信号肽; (C) 用TMpred程序预测β-1,3-葡聚糖酶的跨膜区段; (D) 结构域预测; (E) 二级结构预测; (F) 三级结构预测
Figure 4
Bioinformatic analysis of β-1,3-glucanase protein in
Brassica rapa cv. ‘Longyou6’
(A) Predicted protein hydrophobicity by ProtScale; (B) Predicted signal peptide by Signal P4; (C) Transmembrane helical segments predicted by TMpred; (D) Predication of domains; (E) Predicted secondary structure; (F) Predicted 3-D structure
表2 Table 2 表2 表2 十字花科植物
β-1,3-glucanase 基因编码蛋白的理化性质预测
Table 2 Predicted physicochemical properties of
β-1,3-glucanase gene encoding proteins in cruciferae plants
Cruciferous plants No. of Molecular Theoretical Protein instability Grand average of Composition of amino The main amino acid (%) Longyou6 343 38.102 6.63 39.58 -0.334 20 Asn (9.6), Leu (8.7) Tianyou4 343 38.130 7.68 39.02 -0.337 20 Asn (9.6), Leu (8.7) Brassica rapa 342 38.180 7.69 42.99 -0.370 20 Asn (9.6), Leu (8.8) B. rapa subsp. chinensis 363 40.659 9.27 39.84 -0.335 20 Asn (8.8), Leu (8.3) B. napus 363 40.599 9.22 39.96 -0.325 20 Asn (9.1), Leu (8.3) B. oleracea 351 38.925 6.85 40.48 -0.304 20 Asn (8.8), Ser (8.5) B. oleracea var. oleracea 365 41.075 9.27 37.84 -0.390 20 Asn (8.8), Leu (7.7) B. juncea 346 38.087 9.13 38.03 -0.188 20 Gly (9.5), Leu (9.0) Raphanus sativus 345 38.243 6.20 40.33 -0.326 20 Leu (10.1), Asn (8.4) Arabidopsis thaliana 355 39.380 5.47 47.15 -0.318 20 Ser (9.3), Leu (8.7)
表2
十字花科植物
β-1,3-glucanase 基因编码蛋白的理化性质预测
Table 2
Predicted physicochemical properties of
β-1,3-glucanase gene encoding proteins in cruciferae plants
白菜型冬油菜陇油6号β-1,3-葡聚糖酶蛋白的N-末端信号肽序列预测结果表明(
图4B ), 该蛋白为一个信号多肽, 第17-18个氨基酸为最可能的信号肽断裂点。跨膜区段预测结果显示, 白菜型油菜β-1,3-葡聚糖酶蛋白存在2个跨膜结构域(
图4C ), 分别为2-20位氨基酸和1-18位氨基酸。采用在线工具S0PMA预测陇油6号β-1,3-葡聚糖酶蛋白的二级结构(
图4E ), 结果显示, 该蛋白包含37.03% α-螺旋(α helix)、33.530%无规则卷曲(random coil)、19.53%延伸链(extended strand)和9.913% β-转角(β turn)。采用SWISS-MODEL对陇油6号β-1,3-葡聚糖酶蛋白的三级结构进行分析, 结果表明, 该蛋白主要由α-螺旋和无规则卷曲组成(
图4F )。采用SMART软件对陇油6号β-1,3-葡聚糖酶保守序列进行预测, 结果显示, 该蛋白含有1个糖基水解酶家族17特有的保守结构域(
图4D ), 在第27-342位氨基酸之间存在保守结构域, 涉及碳水化合物的化学反应和途径。
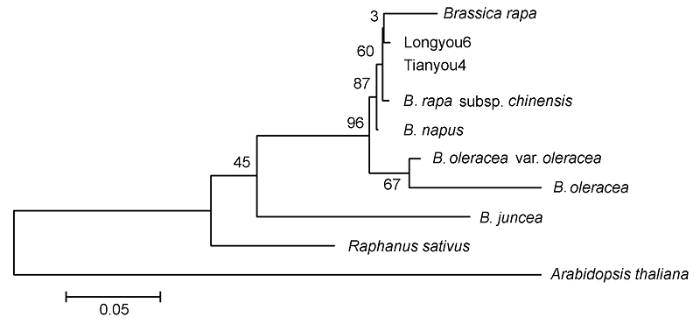
2.4 陇油6号β-1,3-葡聚糖酶蛋白的同源性和系统亲缘关系利用ClustalX 2和MEGA软件对β-1,3-glucanase蛋白的亲缘关系(
图5 )进行分析, 结果表明陇油6号与其它十字花科植物β-1,3-葡聚糖酶蛋白的系统进化亲缘关系分为3类。陇油6号(Longyou6)、天油4号(Tian- you4)、白菜型油菜、菜心、甘蓝型油菜、甘蓝、野甘蓝和芥菜为同一亚族, 属于芸薹属; 萝卜属于萝卜属; 拟南芥属于鼠耳芥属。其中白菜型油菜(陇油6号和天油4号)与菜心和甘蓝型油菜亲缘关系较近。
图5 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_5.png <b>图5</b> 陇油6号β-1,3-葡聚糖酶蛋白的系统进化树<br/><b>Figure 5</b> Phylogenetic analysis of Longyou6 β-1,3-glucanase protein Figure 5 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_5.png <b>图5</b> 陇油6号β-1,3-葡聚糖酶蛋白的系统进化树<br/><b>Figure 5</b> Phylogenetic analysis of Longyou6 β-1,3-glucanase protein 在新窗口打开 下载 下载原图ZIP 生成PPT 图5
陇油6号β-1,3-葡聚糖酶蛋白的系统进化树
Figure 5
Phylogenetic analysis of Longyou6 β-1,3-glucanase protein
利用DNAMAN软件对陇油6号β-1,3-葡聚糖酶蛋白与其它十字花科植物蛋白同源性进行比较, 结果显示(
图6 ), 陇油6号与NCBI数据库公布的白菜型油菜的β-1,3-葡聚糖酶蛋白相似性达96.79%, 而与天油4号β-1,3-葡聚糖酶蛋白相似性高达99.71%, 它们只有第100位氨基酸不同。陇油6号的β-1,3-葡聚糖酶蛋白与菜心、甘蓝型油菜、甘蓝、野甘蓝、芥菜、萝卜以及拟南芥β-1,3-glucanase蛋白的同源性分别为93.94%、93.94%、87.78%、90.41%、80.68%、83.43%和58.04%。
图6 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_6.png <b>图6</b> β-1,3-葡聚糖酶蛋白的多序列比对<br/><b>Figure 6</b> Sequence comparison of the β-1,3-glucanase proteins Figure 6 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_6.png <b>图6</b> β-1,3-葡聚糖酶蛋白的多序列比对<br/><b>Figure 6</b> Sequence comparison of the β-1,3-glucanase proteins 在新窗口打开 下载 下载原图ZIP 生成PPT 图6
β-1,3-葡聚糖酶蛋白的多序列比对
Figure 6
Sequence comparison of the β-1,3-glucanase proteins
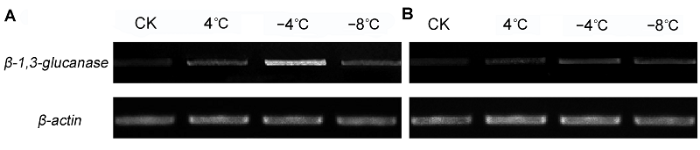
2.5 低温胁迫下β-1,3-葡聚糖酶基因的表达利用半定量RT-PCR检测β-1,3-葡聚糖酶基因在白菜型冬油菜低温胁迫下的表达特征。结果表明, -4°C时, β-1,3-葡聚糖酶基因表达最强, 随着温度的降低, 该基因表达量逐渐下降(
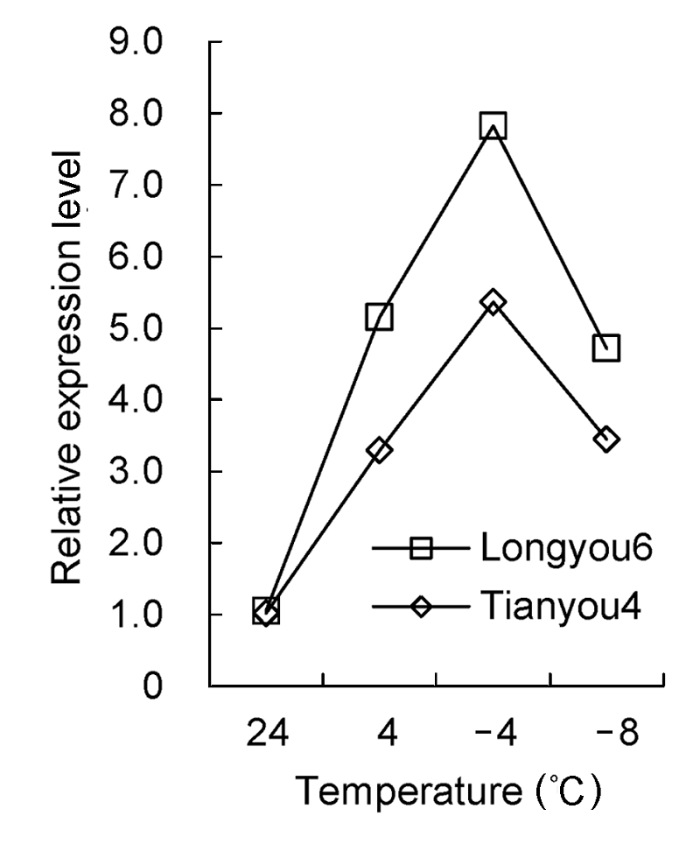
图7 )。实时荧光定量PCR分析结果表明, 温度降到4°C时, 陇油6号和天油4号β- 1,3-葡聚糖酶基因表达量均上调, 陇油6号β-1,3-葡聚糖酶基因表达量比天油4号高56.54%; -4°C时该基因在2个品种中继续上调表达至峰值, 且陇油6号表达量为天油4号的1.46倍; -8°C时, 两品种的β-1,3-葡聚糖酶基因明显下调表达。在同一处理温度下, 抗寒性弱的天油4号β-1,3-葡聚糖酶基因相对表达量低于抗寒性强的陇油6号(
图8 )。
图7 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_7.png <b>图7</b> 低温胁迫下白菜型冬油菜<i>β-1,3-glucanase</i>基因的半定量RT-PCR分析<br/>(A) 陇油6号; (B) 天油4号<br/><b>Figure 7</b> Semi-quantitative RT-PCR analysis of <i>β-1,3-glucanase </i>gene in winter <i>Brassica rapa </i>under low temperature stress<br/>(A) Longyou6; (B) Tianyou4 Figure 7 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_7.png <b>图7</b> 低温胁迫下白菜型冬油菜<i>β-1,3-glucanase</i>基因的半定量RT-PCR分析<br/>(A) 陇油6号; (B) 天油4号<br/><b>Figure 7</b> Semi-quantitative RT-PCR analysis of <i>β-1,3-glucanase </i>gene in winter <i>Brassica rapa </i>under low temperature stress<br/>(A) Longyou6; (B) Tianyou4 在新窗口打开 下载 下载原图ZIP 生成PPT 图7
低温胁迫下白菜型冬油菜
β-1,3-glucanase 基因的半定量RT-PCR分析
(A) 陇油6号; (B) 天油4号
Figure 7
Semi-quantitative RT-PCR analysis of
β-1,3-glucanase gene in winter
Brassica rapa under low temperature stress
(A) Longyou6; (B) Tianyou4
图8 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_8.png <b>图8</b> 低温胁迫下白菜型冬油菜叶片<i>β-1,3-glucanase</i>基因的相对表达量<br/><b>Figure 8</b> The relative expression level of<i> β-1,3-glucanase </i>gene in leaves of winter <i>Brassica rapa</i> under low temperature stress Figure 8 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-5-568/img_8.png <b>图8</b> 低温胁迫下白菜型冬油菜叶片<i>β-1,3-glucanase</i>基因的相对表达量<br/><b>Figure 8</b> The relative expression level of<i> β-1,3-glucanase </i>gene in leaves of winter <i>Brassica rapa</i> under low temperature stress 在新窗口打开 下载 下载原图ZIP 生成PPT 图8
低温胁迫下白菜型冬油菜叶片
β-1,3-glucanase 基因的相对表达量
Figure 8
The relative expression level of
β-1,3-glucanase gene in leaves of winter
Brassica rapa under low temperature stress
2.6 讨论β-1,3-葡聚糖酶是植物体不同生长发育阶段不可或缺的一类水解酶(
欧阳波等, 2002 ;
何江峰等, 2007 ); 同时, 该酶基因也是一类重要的逆境胁迫响应基因(
陈芳兰等, 2015 )。研究表明, 几丁质酶和β-1,3-葡聚糖酶能够相互作用, 增强植物体的防御能力(
程红梅等, 2005 )。低温胁迫下, 植株通过自身的遗传和生理生化等反应, 激发体内应激信号系统的表达, 从而诱导机体自身产生一些与抗寒相关的蛋白来抵御寒害的胁迫(
Mezabasso et al., 1986 )。有关β-1,3-葡聚糖酶基因的抗冻活性最早是从冷诱导下的冬黑麦中发现的(
Griffith et al., 1992 )。
赵娟和兰海燕(2011) 研究表明, 在4°C低温胁迫下, β-1,3-葡聚糖酶基因在拟南芥的花和薹中均上调表达, 证明该基因在低温下发挥一定作用。
杨刚等(2016) 证明低温处理后冬油菜叶片质外体蛋白中葡聚糖酶蛋白含量明显增加, 且在低温诱导下其有明显的积累, 室温恢复后其含量会下降, 回收并检测该蛋白发现其具有冰晶修饰辅助作用。本研究从超强抗寒品种白菜型冬油菜陇油6号中分离、克隆得到β-1,3-葡聚糖酶基因, 实时荧光定量表达再次验证了低温胁迫下植物体内β-1,3-葡聚糖酶抗寒基因的存在, 且荧光定量表达的特点与
张妙霞(2010) 对三明野生蕉β-1,3-葡聚糖酶基因的研究结果相似。同时, 本实验中得到的β-1,3-葡聚糖酶蛋白相对分子量为38 kDa, 与
Hon等(1994) 发现的β-1,3-葡聚糖酶抗冻蛋白分子量相近。实时荧光定量分析表明, 在-4-24°C区间, 不同温度下β-1,3-葡聚糖酶基因的表达量有明显变化。其中, -4°C时表达量最高, 之后降低温度, 该基因表达量下降; -8°C时, 表达量与4°C时基本处于同一水平。 由此推测, 最初的降温导致冬油菜叶片对低温作出应激反应, 诱导β-1,3-葡聚糖酶基因的表达与积累, 表现出明显的累积效应, 在一定程度上足以抵御寒害对机体的损伤; 而后继续进行低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降。这也与目前本研究组得出的冬油菜抗寒机理相似。而在低温胁迫后, β-1,3-葡聚糖酶基因在2个抗寒等级不同的品种中表达量有所不同, 在抗寒性强的陇油6号中的表达量明显高于抗寒性弱的天油4号, 这可能是品种自身的抗寒性所决定的。以上结果表明, β-1,3-葡聚糖酶基因在冬油菜响应低温胁迫中发挥一定的作用, 其表达具有累积效应。目前对β-1,3-葡聚糖酶的研究主要集中在增强植物的抗病性方面(
翟国会等, 2011 ), 而在提高植物抗寒性方面报道较少。
本研究从超强抗寒品种白菜型冬油菜陇油6号分离并经质谱分析为β-1,3-葡聚糖酶蛋白, 进而从陇油6号克隆获得了1个长度为1 032 bp的β-1,3-葡聚糖酶基因cDNA序列。该基因编码含343个氨基酸的蛋白质, 分子量为38.102 kDa, 与质谱得到的β-1,3-葡聚糖酶蛋白同源性达93.94%。在低温胁迫下, β-1,3-葡聚糖酶基因表达具有累积效应, 且抗寒等级不同的品种中其表达量不同, 推测其具有与抗冻蛋白相似的活性。以上结果表明, 白菜型冬油菜β-1,3-葡聚糖酶基因表达受低温胁迫诱导, 且有利于增强白菜型冬油菜的抗寒性。
The authors have declared that no competing interests exist. 参考文献 文献选项 原文顺序 文献年度倒序 文中引用次数倒序 被引期刊影响因子 [1] 陈芳兰 , 林玉玲 , 陈裕坤 , 冯新 , 张梓浩 , 赖钟雄 (2015 ). 三明野生蕉β-1,3-葡聚糖酶基因克隆及其低温下SA处理后的表达分析. 西北植物学报 35, 1709 -1721 .10.7606/j.issn.1000-4025.2015.09.1709 URL [2] 程红梅 , 简桂良 , 倪万潮 , 杨红华 , 王志兴 , 孙文姬 , 张保龙 , 王晓峰 , 马存 , 贾士荣 (2005 ). 转几丁质酶和β-1,3-葡聚糖酶基因提高棉花对枯萎病和黄萎病的抗性. 中国农业科学 38, 1160 -1166 .10.3321/j.issn:0578-1752.2005.06.014 URL [3] 邓文星 , 张映 (2007 ). 实时荧光定量PCR技术综述. 生物技术通报 (5), 93- 95, 103 .10.3969/j.issn.1002-5464.2007.05.022 URL [4] 高玉龙 , 郭旺珍 , 王磊 , 张天真 (2007 ). 一个棉花β-1,3-葡聚糖酶基因全长cDNA的克隆与特征分析. 作物学报 33, 1310 -1315 .URL [5] 龚束芳 , 杨涛 , 车代弟 (2010 ). 抗冻蛋白溶液中冰晶生长行为的研究. 上海交通大学学报(农业科学版) 28, 265 -268, 279 .URL [6] 郭尧君 (2005 ). 蛋白质电泳实验技术(第2版) . 北京: 科学出版社. pp. 123 -156 .[7] 何江峰 , 韩冰 , 郭慧琴 , 张占雄 , 赵雅丽 (2007 ). 燕麦β-1,3-葡聚糖酶II基因3′端cDNA的克隆及分析. 生物技术 17(1 ), 5 -8 .URL [8] 何江峰 , 韩冰 , 赵宏鑫 (2006 ). 植物β-1,3-葡聚糖酶的研究进展. 内蒙古农业科技 5, 21 -25 .URL [9] 蒋选利 , 李振岐 , 康振生 (2005 ). β-1,3-葡聚糖酶与植物的抗病性. 西北农业学报 14, 135 -139 .10.3969/j.issn.1004-1389.2005.04.035 URL [10] 蓝海燕 , 王长海 , 张丽华 , 刘桂珍 , 王岚兰 , 陈正华 , 田颖川 (2000 ). 导入β-1,3-葡聚糖酶及几丁质酶基因的转基因可育油菜及其抗菌核病的研究. 生物工程学报 16, 142 -146 .10.3321/j.issn:1000-3061.2000.02.006 URL [11] 林植芳 , 刘楠 (2012 ). 活性氧调控植物生长发育的研究进展. 植物学报 47, 74 -86 .10.3724/SP.J.1259.2012.00074 URL [12] 马文月 (2004 ). 植物冷害和抗冷性的研究进展. 安徽农业科学 32, 1003 -1006 .10.3969/j.issn.0517-6611.2004.05.081 URL [13] 欧阳波 , 李汉霞 , 叶志彪 (2002 ). 植物β-1,3-葡聚糖酶及其基因. 中国生物工程杂志 22, 18 -23 .10.3969/j.issn.1671-8135.2002.06.005 URL [14] 孙万仓 , 马卫国 , 雷建民 , 刘秦 , 杨仁义 , 武军艳 , 王学芳 , 叶剑 , 曾军 , 张亚宏 , 康艳丽 , 郭秀娟 , 魏文惠 , 杨杰 , 蒲媛媛 , 曾潮武 , 刘红霞 (2007 ). 冬油菜在西北旱寒区的适应性和北移的可行性研究. 中国农业科学 40, 2716 -2726 .10.3321/j.issn:0578-1752.2007.12.008 URL [15] 孙万仓 , 刘自刚 , 周冬梅 , 张仁陟 (2016 ). 北方冬油菜北移与区划 . 北京: 科学出版社. pp. 45 -47 .[16] 杨刚 , 史鹏辉 , 孙万仓 , 刘自刚 , 曾秀存 , 武军艳 , 方彦 , 李学才 , 陈奇 , 刘林波 , 杨建胜 , 方园 , 张娟 (2016 ). 白菜型冬油菜质外体抗冻蛋白研究. 中国生态农业学报 24, 210 -217 .10.13930/j.cnki.cjea.151113 URL [17] 翟国会 , 阮小蕾 , 吴丽婷 , 谭小勇 , 李华平 (2011 ). 指天蕉β-1,3-葡聚糖酶基因全长cDNA的克隆及序列分析. 中国农业科学 44, 3134 -3141 .URL [18] 张妙霞 (2010 ). 野生香蕉(Musa spp., AB group)抗寒相关基因的克隆与表达分析. 博士论文. 福州: 福建农林大学 . pp. 134 -140 .10.7666/d.y1815726 URL [19] 赵娟 , 兰海燕 (2011 ). 拟南芥β-1,3-葡聚糖酶基因(BG1)在不同组织及非生物胁迫下的表达研究. 新疆农业科学 48, 712 -718 .URL [20] 周丽英 , 杨丽涛 , 郑坚瑜 (2001 ). 植物抗寒冻基因工程研究进展. 植物学通报 18, 325 -331 .10.3969/j.issn.1674-3466.2001.03.010 URL [21] Beffa R Meins Jr FM 1996 ). Pathogenesis-related function of plant β-1,3-glucanae investigated by antisense transformation—a review.Gene 179, 97 -103 .10.1016/S0378-1119(96)00421-0 PMID:8955634 URL [22] Bradford MM 1976 ). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical Biochem 72, 248 -254 .10.1016/0003-2697(76)90527-3 URL [23] Griffith M Ala P Yang DSC Hon WC Moffatt BA 1992 ). Antifreeze protein produced endogenously in winter rye leaves.Plant Physiol 100, 593 -596 .10.1104/pp.100.2.593 URL [24] Hon WC Griffith M Chong P Yang DSC 1994 ). Extraction and isolation of antifreeze proteins from winter rye (Secale cereale L.) leaves.Plant Physiol 104, 971 -980 .10.1104/pp.104.3.961 PMID:12232141 URL [25] Masoud SA Zhu Q Lamb C Dixon RA 1996 ). Constitutive expression of an inducible β-1,3-glucanase in alfalfa reduces disease severity caused by the oomycete patho- gen Phytophthora megasperma f. spmedicaginis, but does not reduce disease severity of chitin-containing fungi.Transgenic Res 5, 313 -323 .10.1007/BF01968941 URL [26] Mezabasso L Alberdi M Raynal M Ferrerocadinanos ML Delseny M 1986 ). Changes in protein synthesis in rapeseed (Brassica napus) seedlings during a low temperature treatment.Plant Physiol 82, 733 -738 .10.1104/pp.82.3.733 PMID:16665102 URL [27] Nakamura Y Sawada H Kobayashi S Nakajima I Yoshikawa M 1999 ). Expression of soybean β-1,3-endo- glucanase cDNA and effect on disease tolerance in kiwifruit plants.Plant Cell Rep 18, 527 -532 .10.1007/s002990050616 URL [28] Xiong LM Zhu JK 2001 ). Abiotic stress signal transduction in plants: molecular and genetic perspectives.Physiol Plant 112, 152 -166 .10.1034/j.1399-3054.2001.1120202.x PMID:11454221 URL [29] Zhu Q Maher EA Masoud S Dixon RA Lamb CJ 1994 ). Enhanced protection against fungal attack by constitutive co-expression of chitinase and glucanase genes in trans- genic tobacco.Biol Technol 12, 807 -812 .10.1038/nbt0894-807 URL
三明野生蕉β-1,3-葡聚糖酶基因克隆及其低温下SA处理后的表达分析
1
2015
... β-1,3-葡聚糖酶是植物体不同生长发育阶段不可或缺的一类水解酶(
欧阳波等, 2002 ;
何江峰等, 2007 ); 同时, 该酶基因也是一类重要的逆境胁迫响应基因(
陈芳兰等, 2015 ).研究表明, 几丁质酶和β-1,3-葡聚糖酶能够相互作用, 增强植物体的防御能力(
程红梅等, 2005 ).低温胁迫下, 植株通过自身的遗传和生理生化等反应, 激发体内应激信号系统的表达, 从而诱导机体自身产生一些与抗寒相关的蛋白来抵御寒害的胁迫(
Mezabasso et al., 1986 ).有关β-1,3-葡聚糖酶基因的抗冻活性最早是从冷诱导下的冬黑麦中发现的(
Griffith et al., 1992 ).赵娟和兰海燕(2011)研究表明, 在4°C低温胁迫下, β-1,3-葡聚糖酶基因在拟南芥的花和薹中均上调表达, 证明该基因在低温下发挥一定作用.杨刚等(2016)证明低温处理后冬油菜叶片质外体蛋白中葡聚糖酶蛋白含量明显增加, 且在低温诱导下其有明显的积累, 室温恢复后其含量会下降, 回收并检测该蛋白发现其具有冰晶修饰辅助作用.本研究从超强抗寒品种白菜型冬油菜陇油6号中分离、克隆得到β-1,3-葡聚糖酶基因, 实时荧光定量表达再次验证了低温胁迫下植物体内β-1,3-葡聚糖酶抗寒基因的存在, 且荧光定量表达的特点与张妙霞(2010)对三明野生蕉β-1,3-葡聚糖酶基因的研究结果相似.同时, 本实验中得到的β-1,3-葡聚糖酶蛋白相对分子量为38 kDa, 与Hon等(1994)发现的β-1,3-葡聚糖酶抗冻蛋白分子量相近.实时荧光定量分析表明, 在-4-24°C区间, 不同温度下β-1,3-葡聚糖酶基因的表达量有明显变化.其中, -4°C时表达量最高, 之后降低温度, 该基因表达量下降; -8°C时, 表达量与4°C时基本处于同一水平. 由此推测, 最初的降温导致冬油菜叶片对低温作出应激反应, 诱导β-1,3-葡聚糖酶基因的表达与积累, 表现出明显的累积效应, 在一定程度上足以抵御寒害对机体的损伤; 而后继续进行低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降.这也与目前本研究组得出的冬油菜抗寒机理相似.而在低温胁迫后, β-1,3-葡聚糖酶基因在2个抗寒等级不同的品种中表达量有所不同, 在抗寒性强的陇油6号中的表达量明显高于抗寒性弱的天油4号, 这可能是品种自身的抗寒性所决定的.以上结果表明, β-1,3-葡聚糖酶基因在冬油菜响应低温胁迫中发挥一定的作用, 其表达具有累积效应.目前对β-1,3-葡聚糖酶的研究主要集中在增强植物的抗病性方面(
翟国会等, 2011 ), 而在提高植物抗寒性方面报道较少. ...
转几丁质酶和β-1,3-葡聚糖酶基因提高棉花对枯萎病和黄萎病的抗性
1
2005
... β-1,3-葡聚糖酶是植物体不同生长发育阶段不可或缺的一类水解酶(
欧阳波等, 2002 ;
何江峰等, 2007 ); 同时, 该酶基因也是一类重要的逆境胁迫响应基因(
陈芳兰等, 2015 ).研究表明, 几丁质酶和β-1,3-葡聚糖酶能够相互作用, 增强植物体的防御能力(
程红梅等, 2005 ).低温胁迫下, 植株通过自身的遗传和生理生化等反应, 激发体内应激信号系统的表达, 从而诱导机体自身产生一些与抗寒相关的蛋白来抵御寒害的胁迫(
Mezabasso et al., 1986 ).有关β-1,3-葡聚糖酶基因的抗冻活性最早是从冷诱导下的冬黑麦中发现的(
Griffith et al., 1992 ).赵娟和兰海燕(2011)研究表明, 在4°C低温胁迫下, β-1,3-葡聚糖酶基因在拟南芥的花和薹中均上调表达, 证明该基因在低温下发挥一定作用.杨刚等(2016)证明低温处理后冬油菜叶片质外体蛋白中葡聚糖酶蛋白含量明显增加, 且在低温诱导下其有明显的积累, 室温恢复后其含量会下降, 回收并检测该蛋白发现其具有冰晶修饰辅助作用.本研究从超强抗寒品种白菜型冬油菜陇油6号中分离、克隆得到β-1,3-葡聚糖酶基因, 实时荧光定量表达再次验证了低温胁迫下植物体内β-1,3-葡聚糖酶抗寒基因的存在, 且荧光定量表达的特点与张妙霞(2010)对三明野生蕉β-1,3-葡聚糖酶基因的研究结果相似.同时, 本实验中得到的β-1,3-葡聚糖酶蛋白相对分子量为38 kDa, 与Hon等(1994)发现的β-1,3-葡聚糖酶抗冻蛋白分子量相近.实时荧光定量分析表明, 在-4-24°C区间, 不同温度下β-1,3-葡聚糖酶基因的表达量有明显变化.其中, -4°C时表达量最高, 之后降低温度, 该基因表达量下降; -8°C时, 表达量与4°C时基本处于同一水平. 由此推测, 最初的降温导致冬油菜叶片对低温作出应激反应, 诱导β-1,3-葡聚糖酶基因的表达与积累, 表现出明显的累积效应, 在一定程度上足以抵御寒害对机体的损伤; 而后继续进行低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降.这也与目前本研究组得出的冬油菜抗寒机理相似.而在低温胁迫后, β-1,3-葡聚糖酶基因在2个抗寒等级不同的品种中表达量有所不同, 在抗寒性强的陇油6号中的表达量明显高于抗寒性弱的天油4号, 这可能是品种自身的抗寒性所决定的.以上结果表明, β-1,3-葡聚糖酶基因在冬油菜响应低温胁迫中发挥一定的作用, 其表达具有累积效应.目前对β-1,3-葡聚糖酶的研究主要集中在增强植物的抗病性方面(
翟国会等, 2011 ), 而在提高植物抗寒性方面报道较少. ...
实时荧光定量PCR技术综述
1
2007
... 依据引物设计原则设计白菜型油菜β-1,3-葡聚糖酶定量表达引物BG-S (5'-TCTTCTCAGCCTTCTAATGG- 3')和BG-A (5'-CTTCCGATGGATTTGGTAT-3').以相同浓度陇油6号和天油4号cDNA为模板, 以
β-actin (Act-F, 5'-GTGTCATGGTTGGGATGGGT-3'; Act- R, 5'-AAGAACCGGGTGCTCTTCAG-3')作为内参, 分别对其进行实时荧光定量和半定量PCR分析.半定量PCR程序同上, 温度为60°C.实时荧光定量PCR参考SYBR
? Premix Ex
Taq TMI (TliRNase H Plus)试剂盒说明书(大连TaKaRa公司), 采用两步法.扩增程序为: 95°C30秒; 95°C5秒, 60°C34秒, 40个循环; 95°C15秒, 60°C1分钟, 95°C15秒.用96孔上样板, 目的基因与内参基因对应, 操作时避免强光照射.设3次重复.采用2
-ΔΔCt 方法计算: ΔCT(目的基因)= CT(目的基因)-CT(内参基因); ΔΔCT(目的基因)=处理组(ΔCT目的基因)-对照组(ΔCT目的基因); 相对表达量(relative quantification)=2
-ΔΔCt (目的基因) (
邓文星和张映, 2007 ). ...
一个棉花β-1,3-葡聚糖酶基因全长cDNA的克隆与特征分析
1
2007
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
抗冻蛋白溶液中冰晶生长行为的研究
1
2010
...
质外体蛋白的提取参考龚束芳等(2010) 的方法, 并稍作改进.先用流水将叶片冲洗干净, 用ddH
2 O冲洗2遍, 再用滤纸吸干表面水分后, 切成1.0 cm长条, 用提取缓冲液(50 mmol?L
-1 Tris-HCl, 10 mmol?L
-1 EDTA, 20 mmol?L
-1 Vc, pH8.0)浸洗去掉渗出物.将叶片浸入上述缓冲液中, 室温抽真空30分钟, 再用滤纸吸去叶片表面液体, 放入50 mL注射器中.将注射器放入离心管中, 平衡后4°C 7 000 ×
g 离心20分钟, 收集离心管底部溶液, 即为质外体粗提物. ...
2005
燕麦β-1,3-葡聚糖酶II基因3′端cDNA的克隆及分析
1
2007
... β-1,3-葡聚糖酶是植物体不同生长发育阶段不可或缺的一类水解酶(
欧阳波等, 2002 ;
何江峰等, 2007 ); 同时, 该酶基因也是一类重要的逆境胁迫响应基因(
陈芳兰等, 2015 ).研究表明, 几丁质酶和β-1,3-葡聚糖酶能够相互作用, 增强植物体的防御能力(
程红梅等, 2005 ).低温胁迫下, 植株通过自身的遗传和生理生化等反应, 激发体内应激信号系统的表达, 从而诱导机体自身产生一些与抗寒相关的蛋白来抵御寒害的胁迫(
Mezabasso et al., 1986 ).有关β-1,3-葡聚糖酶基因的抗冻活性最早是从冷诱导下的冬黑麦中发现的(
Griffith et al., 1992 ).赵娟和兰海燕(2011)研究表明, 在4°C低温胁迫下, β-1,3-葡聚糖酶基因在拟南芥的花和薹中均上调表达, 证明该基因在低温下发挥一定作用.杨刚等(2016)证明低温处理后冬油菜叶片质外体蛋白中葡聚糖酶蛋白含量明显增加, 且在低温诱导下其有明显的积累, 室温恢复后其含量会下降, 回收并检测该蛋白发现其具有冰晶修饰辅助作用.本研究从超强抗寒品种白菜型冬油菜陇油6号中分离、克隆得到β-1,3-葡聚糖酶基因, 实时荧光定量表达再次验证了低温胁迫下植物体内β-1,3-葡聚糖酶抗寒基因的存在, 且荧光定量表达的特点与张妙霞(2010)对三明野生蕉β-1,3-葡聚糖酶基因的研究结果相似.同时, 本实验中得到的β-1,3-葡聚糖酶蛋白相对分子量为38 kDa, 与Hon等(1994)发现的β-1,3-葡聚糖酶抗冻蛋白分子量相近.实时荧光定量分析表明, 在-4-24°C区间, 不同温度下β-1,3-葡聚糖酶基因的表达量有明显变化.其中, -4°C时表达量最高, 之后降低温度, 该基因表达量下降; -8°C时, 表达量与4°C时基本处于同一水平. 由此推测, 最初的降温导致冬油菜叶片对低温作出应激反应, 诱导β-1,3-葡聚糖酶基因的表达与积累, 表现出明显的累积效应, 在一定程度上足以抵御寒害对机体的损伤; 而后继续进行低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降.这也与目前本研究组得出的冬油菜抗寒机理相似.而在低温胁迫后, β-1,3-葡聚糖酶基因在2个抗寒等级不同的品种中表达量有所不同, 在抗寒性强的陇油6号中的表达量明显高于抗寒性弱的天油4号, 这可能是品种自身的抗寒性所决定的.以上结果表明, β-1,3-葡聚糖酶基因在冬油菜响应低温胁迫中发挥一定的作用, 其表达具有累积效应.目前对β-1,3-葡聚糖酶的研究主要集中在增强植物的抗病性方面(
翟国会等, 2011 ), 而在提高植物抗寒性方面报道较少. ...
植物β-1,3-葡聚糖酶的研究进展
1
2006
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
β-1,3-葡聚糖酶与植物的抗病性
1
2005
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
导入β-1,3-葡聚糖酶及几丁质酶基因的转基因可育油菜及其抗菌核病的研究
1
2000
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
活性氧调控植物生长发育的研究进展
1
2012
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
植物冷害和抗冷性的研究进展
1
2004
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
植物β-1,3-葡聚糖酶及其基因
1
2002
... β-1,3-葡聚糖酶是植物体不同生长发育阶段不可或缺的一类水解酶(
欧阳波等, 2002 ;
何江峰等, 2007 ); 同时, 该酶基因也是一类重要的逆境胁迫响应基因(
陈芳兰等, 2015 ).研究表明, 几丁质酶和β-1,3-葡聚糖酶能够相互作用, 增强植物体的防御能力(
程红梅等, 2005 ).低温胁迫下, 植株通过自身的遗传和生理生化等反应, 激发体内应激信号系统的表达, 从而诱导机体自身产生一些与抗寒相关的蛋白来抵御寒害的胁迫(
Mezabasso et al., 1986 ).有关β-1,3-葡聚糖酶基因的抗冻活性最早是从冷诱导下的冬黑麦中发现的(
Griffith et al., 1992 ).赵娟和兰海燕(2011)研究表明, 在4°C低温胁迫下, β-1,3-葡聚糖酶基因在拟南芥的花和薹中均上调表达, 证明该基因在低温下发挥一定作用.杨刚等(2016)证明低温处理后冬油菜叶片质外体蛋白中葡聚糖酶蛋白含量明显增加, 且在低温诱导下其有明显的积累, 室温恢复后其含量会下降, 回收并检测该蛋白发现其具有冰晶修饰辅助作用.本研究从超强抗寒品种白菜型冬油菜陇油6号中分离、克隆得到β-1,3-葡聚糖酶基因, 实时荧光定量表达再次验证了低温胁迫下植物体内β-1,3-葡聚糖酶抗寒基因的存在, 且荧光定量表达的特点与张妙霞(2010)对三明野生蕉β-1,3-葡聚糖酶基因的研究结果相似.同时, 本实验中得到的β-1,3-葡聚糖酶蛋白相对分子量为38 kDa, 与Hon等(1994)发现的β-1,3-葡聚糖酶抗冻蛋白分子量相近.实时荧光定量分析表明, 在-4-24°C区间, 不同温度下β-1,3-葡聚糖酶基因的表达量有明显变化.其中, -4°C时表达量最高, 之后降低温度, 该基因表达量下降; -8°C时, 表达量与4°C时基本处于同一水平. 由此推测, 最初的降温导致冬油菜叶片对低温作出应激反应, 诱导β-1,3-葡聚糖酶基因的表达与积累, 表现出明显的累积效应, 在一定程度上足以抵御寒害对机体的损伤; 而后继续进行低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降.这也与目前本研究组得出的冬油菜抗寒机理相似.而在低温胁迫后, β-1,3-葡聚糖酶基因在2个抗寒等级不同的品种中表达量有所不同, 在抗寒性强的陇油6号中的表达量明显高于抗寒性弱的天油4号, 这可能是品种自身的抗寒性所决定的.以上结果表明, β-1,3-葡聚糖酶基因在冬油菜响应低温胁迫中发挥一定的作用, 其表达具有累积效应.目前对β-1,3-葡聚糖酶的研究主要集中在增强植物的抗病性方面(
翟国会等, 2011 ), 而在提高植物抗寒性方面报道较少. ...
冬油菜在西北旱寒区的适应性和北移的可行性研究
1
2007
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
1
2016
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
白菜型冬油菜质外体抗冻蛋白研究
2016
指天蕉β-1,3-葡聚糖酶基因全长cDNA的克隆及序列分析
1
2011
... β-1,3-葡聚糖酶是植物体不同生长发育阶段不可或缺的一类水解酶(
欧阳波等, 2002 ;
何江峰等, 2007 ); 同时, 该酶基因也是一类重要的逆境胁迫响应基因(
陈芳兰等, 2015 ).研究表明, 几丁质酶和β-1,3-葡聚糖酶能够相互作用, 增强植物体的防御能力(
程红梅等, 2005 ).低温胁迫下, 植株通过自身的遗传和生理生化等反应, 激发体内应激信号系统的表达, 从而诱导机体自身产生一些与抗寒相关的蛋白来抵御寒害的胁迫(
Mezabasso et al., 1986 ).有关β-1,3-葡聚糖酶基因的抗冻活性最早是从冷诱导下的冬黑麦中发现的(
Griffith et al., 1992 ).赵娟和兰海燕(2011)研究表明, 在4°C低温胁迫下, β-1,3-葡聚糖酶基因在拟南芥的花和薹中均上调表达, 证明该基因在低温下发挥一定作用.杨刚等(2016)证明低温处理后冬油菜叶片质外体蛋白中葡聚糖酶蛋白含量明显增加, 且在低温诱导下其有明显的积累, 室温恢复后其含量会下降, 回收并检测该蛋白发现其具有冰晶修饰辅助作用.本研究从超强抗寒品种白菜型冬油菜陇油6号中分离、克隆得到β-1,3-葡聚糖酶基因, 实时荧光定量表达再次验证了低温胁迫下植物体内β-1,3-葡聚糖酶抗寒基因的存在, 且荧光定量表达的特点与张妙霞(2010)对三明野生蕉β-1,3-葡聚糖酶基因的研究结果相似.同时, 本实验中得到的β-1,3-葡聚糖酶蛋白相对分子量为38 kDa, 与Hon等(1994)发现的β-1,3-葡聚糖酶抗冻蛋白分子量相近.实时荧光定量分析表明, 在-4-24°C区间, 不同温度下β-1,3-葡聚糖酶基因的表达量有明显变化.其中, -4°C时表达量最高, 之后降低温度, 该基因表达量下降; -8°C时, 表达量与4°C时基本处于同一水平. 由此推测, 最初的降温导致冬油菜叶片对低温作出应激反应, 诱导β-1,3-葡聚糖酶基因的表达与积累, 表现出明显的累积效应, 在一定程度上足以抵御寒害对机体的损伤; 而后继续进行低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降.这也与目前本研究组得出的冬油菜抗寒机理相似.而在低温胁迫后, β-1,3-葡聚糖酶基因在2个抗寒等级不同的品种中表达量有所不同, 在抗寒性强的陇油6号中的表达量明显高于抗寒性弱的天油4号, 这可能是品种自身的抗寒性所决定的.以上结果表明, β-1,3-葡聚糖酶基因在冬油菜响应低温胁迫中发挥一定的作用, 其表达具有累积效应.目前对β-1,3-葡聚糖酶的研究主要集中在增强植物的抗病性方面(
翟国会等, 2011 ), 而在提高植物抗寒性方面报道较少. ...
野生香蕉(Musa spp., AB group)抗寒相关基因的克隆与表达分析
1
2010
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
拟南芥β-1,3-葡聚糖酶基因(BG1)在不同组织及非生物胁迫下的表达研究
2011
植物抗寒冻基因工程研究进展
1
2001
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
1
1996
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
1
1976
... 使用Bradford法(
Bradford, 1976 )测定蛋白质含量.用牛血清蛋白作标准曲线, 用分光光度计在595 nm处测定标准溶液和样品蛋白的吸光值, 根据标准曲线计算样品蛋白浓度.实验重复3次. ...
2
1992
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
... β-1,3-葡聚糖酶是植物体不同生长发育阶段不可或缺的一类水解酶(
欧阳波等, 2002 ;
何江峰等, 2007 ); 同时, 该酶基因也是一类重要的逆境胁迫响应基因(
陈芳兰等, 2015 ).研究表明, 几丁质酶和β-1,3-葡聚糖酶能够相互作用, 增强植物体的防御能力(
程红梅等, 2005 ).低温胁迫下, 植株通过自身的遗传和生理生化等反应, 激发体内应激信号系统的表达, 从而诱导机体自身产生一些与抗寒相关的蛋白来抵御寒害的胁迫(
Mezabasso et al., 1986 ).有关β-1,3-葡聚糖酶基因的抗冻活性最早是从冷诱导下的冬黑麦中发现的(
Griffith et al., 1992 ).赵娟和兰海燕(2011)研究表明, 在4°C低温胁迫下, β-1,3-葡聚糖酶基因在拟南芥的花和薹中均上调表达, 证明该基因在低温下发挥一定作用.杨刚等(2016)证明低温处理后冬油菜叶片质外体蛋白中葡聚糖酶蛋白含量明显增加, 且在低温诱导下其有明显的积累, 室温恢复后其含量会下降, 回收并检测该蛋白发现其具有冰晶修饰辅助作用.本研究从超强抗寒品种白菜型冬油菜陇油6号中分离、克隆得到β-1,3-葡聚糖酶基因, 实时荧光定量表达再次验证了低温胁迫下植物体内β-1,3-葡聚糖酶抗寒基因的存在, 且荧光定量表达的特点与张妙霞(2010)对三明野生蕉β-1,3-葡聚糖酶基因的研究结果相似.同时, 本实验中得到的β-1,3-葡聚糖酶蛋白相对分子量为38 kDa, 与Hon等(1994)发现的β-1,3-葡聚糖酶抗冻蛋白分子量相近.实时荧光定量分析表明, 在-4-24°C区间, 不同温度下β-1,3-葡聚糖酶基因的表达量有明显变化.其中, -4°C时表达量最高, 之后降低温度, 该基因表达量下降; -8°C时, 表达量与4°C时基本处于同一水平. 由此推测, 最初的降温导致冬油菜叶片对低温作出应激反应, 诱导β-1,3-葡聚糖酶基因的表达与积累, 表现出明显的累积效应, 在一定程度上足以抵御寒害对机体的损伤; 而后继续进行低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降.这也与目前本研究组得出的冬油菜抗寒机理相似.而在低温胁迫后, β-1,3-葡聚糖酶基因在2个抗寒等级不同的品种中表达量有所不同, 在抗寒性强的陇油6号中的表达量明显高于抗寒性弱的天油4号, 这可能是品种自身的抗寒性所决定的.以上结果表明, β-1,3-葡聚糖酶基因在冬油菜响应低温胁迫中发挥一定的作用, 其表达具有累积效应.目前对β-1,3-葡聚糖酶的研究主要集中在增强植物的抗病性方面(
翟国会等, 2011 ), 而在提高植物抗寒性方面报道较少. ...
1994
1
1996
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
1
1986
... β-1,3-葡聚糖酶是植物体不同生长发育阶段不可或缺的一类水解酶(
欧阳波等, 2002 ;
何江峰等, 2007 ); 同时, 该酶基因也是一类重要的逆境胁迫响应基因(
陈芳兰等, 2015 ).研究表明, 几丁质酶和β-1,3-葡聚糖酶能够相互作用, 增强植物体的防御能力(
程红梅等, 2005 ).低温胁迫下, 植株通过自身的遗传和生理生化等反应, 激发体内应激信号系统的表达, 从而诱导机体自身产生一些与抗寒相关的蛋白来抵御寒害的胁迫(
Mezabasso et al., 1986 ).有关β-1,3-葡聚糖酶基因的抗冻活性最早是从冷诱导下的冬黑麦中发现的(
Griffith et al., 1992 ).赵娟和兰海燕(2011)研究表明, 在4°C低温胁迫下, β-1,3-葡聚糖酶基因在拟南芥的花和薹中均上调表达, 证明该基因在低温下发挥一定作用.杨刚等(2016)证明低温处理后冬油菜叶片质外体蛋白中葡聚糖酶蛋白含量明显增加, 且在低温诱导下其有明显的积累, 室温恢复后其含量会下降, 回收并检测该蛋白发现其具有冰晶修饰辅助作用.本研究从超强抗寒品种白菜型冬油菜陇油6号中分离、克隆得到β-1,3-葡聚糖酶基因, 实时荧光定量表达再次验证了低温胁迫下植物体内β-1,3-葡聚糖酶抗寒基因的存在, 且荧光定量表达的特点与张妙霞(2010)对三明野生蕉β-1,3-葡聚糖酶基因的研究结果相似.同时, 本实验中得到的β-1,3-葡聚糖酶蛋白相对分子量为38 kDa, 与Hon等(1994)发现的β-1,3-葡聚糖酶抗冻蛋白分子量相近.实时荧光定量分析表明, 在-4-24°C区间, 不同温度下β-1,3-葡聚糖酶基因的表达量有明显变化.其中, -4°C时表达量最高, 之后降低温度, 该基因表达量下降; -8°C时, 表达量与4°C时基本处于同一水平. 由此推测, 最初的降温导致冬油菜叶片对低温作出应激反应, 诱导β-1,3-葡聚糖酶基因的表达与积累, 表现出明显的累积效应, 在一定程度上足以抵御寒害对机体的损伤; 而后继续进行低温胁迫, 使得叶片细胞结构受到不可逆的损伤, 抗寒能力下降.这也与目前本研究组得出的冬油菜抗寒机理相似.而在低温胁迫后, β-1,3-葡聚糖酶基因在2个抗寒等级不同的品种中表达量有所不同, 在抗寒性强的陇油6号中的表达量明显高于抗寒性弱的天油4号, 这可能是品种自身的抗寒性所决定的.以上结果表明, β-1,3-葡聚糖酶基因在冬油菜响应低温胁迫中发挥一定的作用, 其表达具有累积效应.目前对β-1,3-葡聚糖酶的研究主要集中在增强植物的抗病性方面(
翟国会等, 2011 ), 而在提高植物抗寒性方面报道较少. ...
1
1999
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
1
2001
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
1
1994
... 白菜型冬油菜(
Brassica rapa )是我国北方旱寒区唯一能够安全越冬的冬油菜类型.自冬油菜成功北移(
孙万仓等, 2007 ), 种植面积迅速扩大, 生态和经济效益十分显著(
孙万仓等, 2016 ).由于我国北方冬季气候寒冷, 最冷月平均气温为-14- -8°C, 极端气温可达-30°C以下.因此, 北方旱寒区冬油菜品种具有非常优异的抗寒性, 研究这些品种的抗寒机理对指导作物的抗寒性改良十分有益.植物在低温胁迫下自身会通过生理生化反应来抵御冷害(
林植芳和刘楠, 2012 ), 如酶系统活性变化、激素调节和蛋白质表达变化等.此外, 还会诱导体内响应逆境通路的连锁反应, 使一系列抗逆相关蛋白表达积累(
Griffith et al., 1992 ;
周丽英等, 2001 ;
马文月, 2004 ;
高玉龙等, 2007 ).β-1,3-葡聚糖酶是一类能够水解且以β-1,3-葡聚糖键连接的葡聚糖酶系, 属于PR类蛋白(
Xiong and Zhu, 2001 ).PR类蛋白是由植物在病理或逆境条件下诱导产生的蛋白质, 与植物系统诱导性抗性密切相关.研究表明, 该类蛋白在植物的生长发育、抗病性及抵御逆境胁迫等方面具有重要作用(
Beffa and Meins, 1996 ;
蒋选利等, 2005 ;
何江峰等, 2006 ).β-1,3-葡聚糖酶依其蛋白特性可分为4类: I类葡聚糖酶为碱性, 主要存在于液泡中, 体外具有较强的抑菌活性; II-IV类为酸性蛋白, 存在于细胞外, 逆境下其受诱导表达(
Zhu et al., 1994 ).迄今为止, 在逆境胁迫下, 烟草(
Nicotiana tabacum )、猕猴桃(
Actinidia chinensis )、油菜(
B. campestris )及苜蓿(
Medicago falcata )等转β-1,3-葡聚糖酶基因植株均表现出良好的抗性(
Masoud et al., 1996 ;
Nakamura et al., 1999 ;
蓝海燕等, 2000 ).目前, 有关β-1,3-葡聚糖酶基因的研究主要集中在植物的抗病方面, 而关于植物的抗寒研究相对较少.研究表明, 不同低温条件下的三明野生蕉(
Musa spp.)碱性β-1,3-葡聚糖酶基因
Mugsp 和
Mug- sp 1表达呈降-升-降-升的趋势, 推测该基因对抗寒有影响(
张妙霞, 2010 ).陈芳兰等(2015)研究表明, 三明野生蕉抗寒性的增加源于低温诱导β-1,3-葡聚糖酶蛋白Mugsp1.2、Mugsp2和Mugsp4亚细胞定位的改变.Griffith等(1992)已证明在冬黑麦(
Secale cereale )中β-1,3-葡聚糖酶为抗冻蛋白, 具有冰晶修饰活性.Hon等(1994)也从冬黑麦中发现了与β-1,3-内切葡聚糖酶分子量非常相似的2种抗冻蛋白(分子量分别为32和37 kDa), 并推测是低温诱导了β-1,3-葡聚糖酶的同工酶表达, 为抗冻蛋白的同源蛋白, 其具有抗冻活性.通过对获得的质外体蛋白质谱数据进行分析, 我们推测β-1,3-葡聚糖酶在北方白菜型冬油菜越冬过程中发挥作用, 与白菜型冬油菜抗寒性相关.本研究在克隆获得白菜型冬油菜β-1,3-葡聚糖酶基因的基础上, 探讨不同温度处理下β-1,3-葡聚糖酶基因的表达规律, 进而揭示β-1,3-葡聚糖酶蛋白的生物学功能, 以期为抗寒冬油菜的分子研究提供科学依据. ...
 ,
,  ,
,