0 引言
【研究意义】我国是西瓜(Citrullus lanatus)产业大国,种植面积183万公顷,占世界西瓜种植面积的60%,总产量的73%[1]。由于近年来我国西瓜种植产业的调整,温室及大棚栽培的面积不断增加,农户的种植方式单一化,西瓜重茬栽培比较普遍,导致西瓜枯萎病的发病情况有逐年加重趋势,尤其在西瓜主产区发病更为严重。西瓜枯萎病是由尖镰孢西瓜专化型(Fusarium oxysporum f. sp. niveum,Fon)侵染植株根部维管束引起的一类土传病害,该病菌可以在土壤中存活十年以上,而且小种也会不断发生变异,防治比较困难,西瓜枯萎病已严重影响西瓜产业的发展。因此选育抗枯萎病的西瓜品种对于西瓜产业的发展具有重要意义,特别是多倍体西瓜抗病育种为解决西瓜枯萎病的难题提供了新思路。【前人研究进展】多倍体化是植物物种形成及基因组进化的一种重要的机制[2],几乎所有的植物在进化过程中都至少有一次或伴随着多次基因组的加倍[3];前人研究发现多倍体与它们的同源二倍体祖先相比具有更高的抗病能力,刘文革等[4]对不同染色体倍性的西瓜枯萎病抗病性进行了研究,结果显示同源四倍体及同源三倍体对枯萎病的抗病能力均优于其同源二倍体,可连种多茬;二倍体猕猴桃(Actinidia chinensis)植株在接种溃疡病菌(Pseudomonas syringae pv. actinidia)后3 d内感病,四倍体植株在接种病菌后5 d感病,四倍体植株中过氧化物酶(POD)及超氧化物歧化酶(SOD)活性均高于同源二倍体,一定程度上说明同源四倍体的抗病性强于二倍体[5];WEI等[6]研究发现,至少有44%的同源加倍区域的基因参与了四倍体甘蓝型油菜(Brassica napus)对茎部溃疡病的抗性;接着FOMEJU等[7]发现甘蓝型油菜四倍体对茎部溃疡病的抗性强于其二倍体。染色体加倍后,四倍体大蕉(Musa spp.)比二倍体表现出更高的叶斑病抗性[8];上述研究表明,与二倍体相比多倍体在抗病方面表现出一定的优势。徐锦华等[9]对51份四倍体西瓜材料进行了枯萎病抗病性评价,通过对二倍体和四倍体杂交配制的三倍体无籽西瓜研究发现,三倍体西瓜枯萎病抗性主要源于四倍体母本的加性遗传而非二倍体父本的加性遗传;焦荻等[10]将枯萎病菌基因Fon-1紧密连锁的Caps标记应用到了四倍体西瓜抗病育种筛选中,得到了纯合的抗枯萎病四倍体材料,同时发现抗病基因杂合位点对应的枯萎病抗性顺序依次为:三显体>二显体>单显体。枯萎病菌侵染寄主后,寄主可对枯萎病菌的侵染产生一定的生理反应,并通过表皮角质层等组织结构抵御病原菌的进一步入侵,程玉瑾等[11]发现西瓜接种枯萎病菌后,感病品种根系薄壁细胞间菌丝比抗病品种的多、侵染速度相对较快。通过绿色荧光蛋白(GFP)标记枯萎病菌的方法,可以直观、便捷的观察病菌在植物体内的侵染动态,ZVIRIN等[12,13]分别用GFP标记技术观察了枯萎病菌在甜瓜上的侵染过程;LÜ等[14]首次将GFP标记导入西瓜枯萎病菌,通过荧光观察其在根系的侵染过程,结果显示抗病品种的主根中再生孢子不再萌发,表现为抗定殖,而不抗侵染;寄主对枯萎病菌的侵染过程反应是多方面的,植物在胁迫条件下的反应首先是初级代谢的改变,植物感病后能产生一些对病菌有抑制作用的物质,例如酚类化合物、木质素、类黄酮和抗病相关蛋白等,病原菌侵染后会自动开启和增加体内抗病相关基因的表达,并生成与抗病相关的产物,进而表现出不同程度的植物免疫性和抗病性反应[15];LÜ等[16]初步利用自定义基因芯片,分析了西瓜与枯萎病菌非亲和互作的基因表达情况,发现接种病菌后不同时间内西瓜根系基因差异表达显著;YANG等[17]对接种枯萎病菌后的西瓜幼苗进行荧光定量检测,结果显示基因ClWRKY1在接种12 h后表达量达到最大;李猷等[18]以卡红为抗病实验材料进行了表达谱分析,结果显示抗枯萎病菌生理小种1的相关基因主要涉及抗病信号传导、转录因子、抗病防卫、细胞保护和次生代谢合成等方面。总之,寄主植物的抗病反应是个十分复杂的系统,其中包含了各种信号传递及寄主植物在外观形态、细胞组织、生理生化、分子等水平变化的过程,仅研究某一水平、某一时期的互作机理是不够的,应该综合运用各种手段进行系统研究,从不同层面揭示西瓜与枯萎病菌相互作用的机理。【本研究切入点】对西瓜抗枯萎病的研究主要集中于二倍体西瓜细胞组织结构、生理生化变化和分子标记,但针对于多倍体西瓜抗枯萎病的研究并不多,关于四倍体西瓜抗枯萎病机理的研究还未见报道。【拟解决的关键问题】以二倍体及人工诱导的同基因型四倍体西瓜为材料,通过鉴定不同倍性西瓜材料的枯萎病抗性,比较枯萎病菌在不同倍性材料中侵染过程的变化、接种病菌前后不同时期与抗病有关的代谢物质含量变化以及基因表达差异,寻找与抗病有关的差异变化,从生理结构、代谢物含量和抗病基因表达等多层面阐明四倍体西瓜枯萎病抗性的机理,为多倍体西瓜抗病育种提供新的理论依据。1 材料与方法
试验于2017年在中国农业科学院郑州果树研究所完成。1.1 试验材料
本研究所用的试验材料为郑州3号二倍体及同源四倍体西瓜,抗病对照品种为Sugarlee。带GFP标记的枯萎病菌生理小种1(Fon 1)由北京市农林科学院蔬菜研究中心许勇研究员惠赠。郑州3号二倍体西瓜是中国农业科学院郑州果树研究所选育的中果型西瓜品种,该品种中熟,果实圆形具浅绿网纹,果肉红色,种子黄色具浅褐斑。郑州3号四倍体于2006年由多倍体西瓜遗传育种课题组在中牟试验基地用0.2%的秋水仙素诱导幼苗生长点获得,之后连续自交6代,孕性恢复,性状稳定。
1.2 西瓜幼苗的培养
挑选均匀一致的西瓜种子进行人工破壳,于55℃温汤浸种2 h后,用湿毛巾包好,放置在30℃培养箱中培养24 h,取出发芽整齐的种子播种至已经浇透水的育苗专用基质中,覆土并覆膜保湿,待80%幼苗破土后,去膜适当通风,并及时进行脱帽。西瓜幼苗的培养在中国农业科学院郑州果树研究所智能型温室中进行,幼苗生长环境为相对湿度50%、温度28℃、16 h/8 h光暗交替。1.3 伤根法接种
西瓜苗生长至一叶一心时,选取生长一致的幼苗,用伤根法接种枯萎病菌[19]。将幼苗轻轻从基质中拔出并用清水洗净根表,此过程尽量不要伤害植物根系;用消毒过的剪刀剪去根长的1/3;置于浓度为106个/mL分生孢子悬液中浸根15 min;移栽至新的培养基质中,继续用不少于40 mL的分生孢子悬液灌根处理;覆膜保湿3 d,之后放置在28℃的环境中生长。1.4 枯萎病发病统计
自发病之日起记录发病情况,并统计发病等级。等级的划分参照ELMSTROM等[20]的标准并稍作改动,具体如下:0级,无明显发病症状,与对照幼苗无差异;1级,植株叶片出现黄化,子叶和叶片轻微萎蔫;2级,一片真叶萎蔫或子叶严重萎蔫;3级,子叶及60%以上真叶萎蔫,不能恢复正常;4级,整株萎蔫,60%以上枯死,但心叶仍成活;5级,整株枯死。病情指数=(∑(病情等级×该病情等级下幼苗株数)×100)/(5×调查总株数)
试验以Sugarlee为抗病对照品种,对郑州3号二倍体及同源四倍体进行苗期枯萎病接种鉴定,每一组材料重复鉴定3次,每重复鉴定设置30株。
1.5 侵染过程观察
选取接种枯萎病菌后不同时期(0.25、1、2、4、7、10 d)的西瓜幼苗,将植株轻轻从营养钵中取出,冲洗干净根系的基质,此过程尽量要保证根系的完整。将清洗好的西瓜根系及茎叶部分放置在操作台上,选取要观察的部分经过制片处理后,倒置放在显微镜下观察枯萎病菌在西瓜植株内部的侵染情况及幼苗组织结构变化。激光共聚焦显微镜的型号为Leica TCS SP5,激发光波长为488 nm,在发射光谱505—525 nm范围内,绿色荧光条件下观察病菌的侵染过程,保存激光和明场的实验照片,并存档。定殖率是指枯萎病菌在西瓜幼苗根茎及叶柄维管束中的定殖比例。每个时期的二倍体、四倍体幼苗分别取6株重复观察,根、茎、叶等每个部位5个样品,共30个重复,设每次观察的定殖率的值为a%。病菌在幼苗不同部位维管束中最终的定殖率=(a1%+a2%+…+a30%)×100/30。
1.6 与抗病相关代谢物含量的测定
接种后分别取0、1、4、7、10 d的西瓜根系样品,用清水将幼苗的整个根系清洗干净,吸干表面水分。用消过毒的剪刀将全部的根系剪成根段,在天平上称取0.1 g新鲜组织,装入2 mL的离心管中,液氮速冻,之后放入-80℃冰箱保存,用于丙二醛(MDA)、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)含量/活性的测定;总酚和类黄酮的样品预处理,是将清洗干净的西瓜根系放入80℃烘箱,烘干至质量不再发生变化,在研钵中研成粉末状,过40目筛子后,放在干燥的环境中待用。样品均由6株幼苗的全部根系混合后得到,每个样品3次重复。MDA、POD、PAL、总酚、类黄酮含量/活性的测定方法均按照试剂盒说明书进行,试剂盒购自苏州科铭生物技术有限公司。POD以每克组织在每毫升反应体系中每分钟使470 nm下吸光值变化0.01为一个酶活力单位;PAL以每克组织每毫升反应体系中每分钟使290 nm下吸光值变化0.1为一个酶活力单位。
1.7 基因表达量的测定
接种后分别取0、1、4、7、10 d的西瓜根系样品,用于基因表达量的测定。RNA提取及反转录的步骤均按照试剂盒(EasyPure Plant RNA Kit,TRANS;PrimeScriptTM Reagent Kit with gDNA Eraser(Perfect Real Time),TaKaRa)的说明书进行。实时荧光定量反应在Roche LightCycler 480Ⅱ荧光定量PCR仪上进行,以基因AP-2为内参[21],对接种病菌后不同倍性西瓜PR3、MYB、MPK7、PAL的表达量进行测定。每次测定样品和内参均做3次重复,基因的表达量按照2-ΔΔCT法进行分析[22]。以每个基因中最低的表达量数值为1,计算基因的相对表达量。引物序列见表1。
Table 1
表1
表1实时荧光定量引物
Table 1Primers of real-time fluorescence quantitative RT-PCR
| 基因 Gene | 基因ID Gene ID | 上游引物 Forward primer | 下游引物 Reverse primer |
|---|---|---|---|
| PR3 | Cla014338 | ATGACGTTATTGTCGGGCGATGGC | CCGCACTCGAGTCCACCGTTAAT |
| MPK7 | Cla014573 | TTCTCGAGAGGAATACGCCTT | GGTTGAATCTCGGGTCGTAT |
| MYB | Cla021520 | GCTTGGCAATAGATGGT | ATGGCTTTGTTTGTTCACG |
| PAL | Cla012779 | GTGCCACTTCCCATAGAAGAAC | GGAGTGTGTTGATTCTCACCAA |
| AP-2 | Cla016178 | GAACTTGGCACCTGTCCTGT | GAACAGTGCAACAGCCTCAA |
新窗口打开
2 结果
2.1 不同倍性西瓜枯萎病苗期鉴定
依据划分的抗病等级,统计接种生理小种1后不同时期西瓜苗的发病情况,计算不同品种的病情指数,结果如表2所示。接种枯萎病菌前3 d是覆膜保湿阶段,未见有明显的萎蔫情况。接种后4 d:郑州3号二倍体开始发病,大部分子叶和真叶萎蔫,发病等级集中在2—3级,病情指数为53.3;四倍体子叶或真叶轻微萎蔫,早晚尚可恢复,发病症状集中在0—2级,病情指数为17.1。接种后7 d:二倍体整株严重萎蔫(图1右),发病等级集中在4级,病情指数75.2;四倍体子叶萎蔫黄化,部分真叶萎蔫(图1左),发病等级集中在2—3级,病情指数为49.5。接种后10 d:二倍体80%以上枯死,发病等级4—5级,病情指数为91.4;四倍体60%以上真叶萎蔫,部分植株萎蔫严重,发病等级3—4级,病情指数为66.7。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1郑州3号二倍体及其同源四倍体接种枯萎病菌生理小种1后第7天发病情况对比
-->Fig. 1Comparison of the diploid and tetraploid watermelon seedlings on the 7th day post inoculation with Fon 1
-->
Table 2
表2
表2接种枯萎病菌生理小种1后二倍体及其同源四倍体病情指数
Table 2Disease index of diploid and tetraploid watermelon seedlings after inoculated with Fon 1
| 品种 Cultivar | 接种后的天数 Days post inoculation | ||||
|---|---|---|---|---|---|
| 4 d | 7 d | 10 d | 13 d | 16 d | |
| Sugarlee(R) | 0 | 2.9±0.7 | 4.8±1.3 | 7.6±2.1 | 13.3±4.2 |
| 郑州3号二倍体 Diploid Zhengzhou No. 3 | 53.3±4.5 | 75.2±4.1 | 91.4±3.0 | 98.1±1.4 | 100 |
| 郑州3号四倍体 Tetraploid Zhengzhou No. 3 | 17.1±3.2 | 49.5±2.8 | 66.7±5.5 | 97.1±1.7 | 99±1.0 |
新窗口打开
鉴定结果显示,与枯萎病抗性鉴定对照Sugarlee相比,郑州3号二倍体和同源四倍体西瓜感病,但与二倍体相比,四倍体幼苗枯萎病的发病症状明显延迟。二倍体西瓜幼苗接种后4 d发病,10 d时大部分枯死;四倍体西瓜幼苗接种后7 d开始发病,13 d时大部分枯死;四倍体比二倍体延迟3 d感病;在一定程度上说明四倍体相对于其同源二倍体抗枯萎病。
2.2 枯萎病菌在不同倍性西瓜中侵染过程的观察
2.2.1 枯萎病菌在二倍体西瓜根系中的侵染过程观察 接种后0.25 d,分生孢子附着在根系表面,部分孢子已经萌发形成芽管,并开始侵入植物根系角质层;大量的观察发现,根毛部位的荧光较强,可能是因为根毛部位凸起的结构,更有利于真菌的黏附(图2-A)。接种后1 d,芽管不断地生长分化形成纤细的菌丝;菌丝穿过根部角质层及表皮细胞的保护,并沿着皮层薄壁细胞间隙不断的扩展延伸(图2-B);少量的菌丝已经到达维管束周围的薄壁细胞及部分侧根的维管束,图2-C可以观察到枯萎病菌在少部分根系维管束中扩展,其中主根和侧根的交汇处是比较易入侵的部位。接种后2 d,菌丝在根系大量繁殖,并在根系细胞间隙不断的生长,将整个细胞团团围住,逐渐形成了大量的空间网状结构(图2-D);到达维管束的病原菌菌丝沿着导管内部管壁快速生长,并不断形成新的分枝,根系维管束可以观察到明显的分生菌丝(图2-E,箭头所示为分生的菌丝)。接种后4 d,维管束中定殖的菌丝除了沿管壁生长外,还可以通过导管间的纹孔在根系维管束细胞间传递横向传递;螺纹、网纹等不同分化程度的导管间均可以观察到菌丝的存在(图2-F);此时约半数的根系维管束已经被病菌侵染,有的二级、三级侧根已经开始褐化变软;在茎中下部的导管中也可以观察到少量的侵染性菌丝(图2-G)。接种后7 d,几乎所有的根系已被菌丝入侵,根系严重褐化,组织结构开始瓦解;茎叶部横切发现,茎部被大量菌丝侵染,病原菌大量入侵茎部的薄壁细胞、导管细胞壁荧光明显增强(图2-H);叶柄部位也可以观察到菌丝存在(图2-I);此时二倍体西瓜幼苗叶片已经严重萎蔫并逐渐枯萎。接种后10 d,二倍体80%以上幼苗已经枯死;根部侵染的菌丝产生了大量的厚垣孢子(图2-J);根系严重褐化变软,已经看不清根系的组织结构;茎部维管束内的菌丝已经严重堵塞了导管的管腔(图2-K),薄壁细胞中的分生菌丝清晰可见(图2-L)。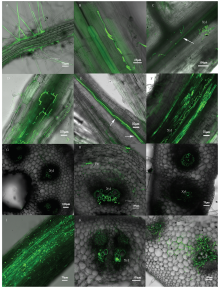 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2枯萎病菌在二倍体西瓜根系中的侵染过程 Xyl:植物的木质部The xylem of the plant;Par:薄壁细胞Parenchyma cells
-->Fig. 2The colonization process of Fon 1 in diploid watermelon roots
-->
2.2.2 枯萎病菌在四倍体西瓜根系中的侵染过程观察 接种后0.25 d,大部分的孢子已经萌发形成芽管,在根系周围大量富集,并附着在根系表面(图3-A),与二倍体无明显差异。接种后1 d,孢子萌发后通过不同的方式入侵西瓜根部,穿过角质层及表皮细胞,分化形成的菌丝体在表皮细胞间扩展延伸;与二倍体相比此时病菌仅侵染了四倍体西瓜根系1—3层表皮细胞(图3-B),且维管束中尚未观察到枯萎病菌的定殖现象。接种后2 d,在显微镜下可以观察到根系表皮被绿色荧光的菌所覆盖;菌丝入侵表皮细胞后,继续向皮层薄壁组织细胞间隙延伸,在部分区域的细胞周围形成网状结构(图3-C);根系木质部观察到有少量的病菌侵染(图3-D);此时与二倍体相比根系细胞间隙的菌丝更少。接种后4 d,菌丝体已经大量侵染表皮细胞;深入根系维管束组织,并在导管中迅速延伸(图3-E);茎部导管还未观察到有枯萎病菌的定殖现象。接种后7 d,四倍体西瓜幼苗子叶萎蔫黄化,部分真叶萎蔫;显微镜观察发现主根和大部分侧根的维管束均已经被菌丝入侵;菌丝随液流向上运输到达茎部维管束(图3-F);且叶柄部横切后,维管束内也观察到少量的菌丝存在(图3-G);虽然根茎叶维管束中均有病菌的侵染,但茎叶部病菌侵染定殖的程度较轻,除此之外新萌发的侧根并未被侵染。接种后10 d,四倍体大部分真叶已经萎蔫;菌丝已经占满了整个根系,导管细胞已经被菌丝填满(图3-H),组织结构开始瓦解,此时四倍体西瓜根系未观察到厚垣孢子的产生;茎部虽受维管束侵染,菌丝仅沿着导管壁生长,但并未完全堵塞导管(图3-I)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3枯萎病菌在四倍体西瓜根系中的侵染过程 Xyl:植物的木质部
-->Fig. 3The colonization process of Fon 1 in tetraploid watermelon roots The xylem of the plant
-->
2.2.3 枯萎病菌在二倍体与四倍体维管束中定殖率的比较 比较枯萎病菌在二倍体及其同源四倍体西瓜中的侵染过程发现,枯萎病菌在不同倍性西瓜中的侵染路径相同,但病原菌在四倍体中的侵染速度相比于二倍体明显延后。二倍体西瓜幼苗根系接种枯萎病菌后1 d,在维管束周围的薄壁细胞及部分侧根的维管束就已经观察到少量的病菌入侵,2 d根系维管束可以观察到明显的分生菌丝。而四倍体西瓜在2 d后才观察到木质部有少量的病菌侵染,并且细胞间隙的菌丝明显比二倍体少;图4是接种枯萎病菌4—10 d内二倍体及四倍体幼苗维管束中枯萎病菌定殖率的比较结果。接种枯萎病菌4 d后,二倍体西瓜幼苗根系及茎的维管束均被枯萎病菌定殖,根部、下茎部、上茎部的定殖率分别为43%、30%、8%;但在四倍体中病菌的侵染只到达下部茎,上部茎维管束没有观察到明显的荧光存在,定殖率为0,根部及下茎部的病菌定殖率分别为23%、9%;此时枯萎病菌在二倍体与四倍体根部维管束中的定殖率差异显著,在下茎部差异极显著。接种7 d后,二倍体幼苗植株大部分枯萎(图1右),几乎所有的根系被菌丝入侵,定殖率为100%,根系褐化,结构开始瓦解,茎叶部维管束中病菌的定殖率也已达到50%以上;而四倍体主根和大部分侧根虽被菌丝入侵,但有部分新生侧根未被侵染,根系维管束中病菌定殖率80%。接种后10 d,二倍体根部侵染的菌丝产生了大量的厚垣孢子,根系严重变褐变软,已经看不清组织结构,茎部明显可以观察到分生菌丝网络及维管束堵死现象,除叶柄部位维管束病菌的定殖率为68%外,叶柄以下部位均已达到100%;四倍体幼苗茎部虽受维管束侵染,但与二倍体同时期相比病菌仅沿导管壁生长并未完全堵塞导管,此时枯萎病菌在二倍体及四倍体下茎部维管束定殖率差异显著,在上茎部及叶柄差异极显著。总的来说,枯萎病菌在四倍体西瓜幼苗中的定殖率相对于其同源二倍体较低,在不同倍性幼苗根部定殖率差异显著,在叶柄部差异极显著,枯萎病菌在四倍体西瓜幼苗维管束中的定殖时间明显延迟。
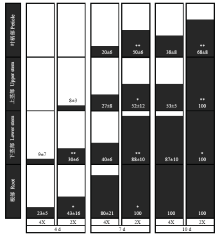 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4枯萎病菌在二倍体及其同源四倍体西瓜中定殖率的比较横坐标表示二倍体及其同源四倍体接种后的不同时期,纵坐标表示枯萎病菌在西瓜幼苗不同部位维管束中的定殖率。*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
-->Fig. 4The comparison of colonization rate of Fon 1 between diploid and tetraploid watermelon seedlings (%)The abscissa shows different days post inoculation in diploid and its autotetraploid, and the ordinate shows the colonization rate of Fon 1 in vascular at different tissues of watermelon seedlings. * indicates significantly different at P<0.05 level; ** indicates significantly different at P<0.01 level
-->
2.3 不同倍性西瓜幼苗接种枯萎病菌后POD、PAL的活性及MDA、总酚、类黄酮含量变化
MDA含量与细胞受逆境胁迫的损伤程度呈正相关。接种枯萎病菌后二倍体根系MDA含量在1 d时有所降低,之后随着时间的推移根系MDA含量不断增加;四倍体西瓜根系中MDA含量也呈不断增加的趋势。总体来看,二倍体西瓜幼苗根系MDA含量明显比同时期的四倍体高(图5-A),表明枯萎病菌侵染后,二倍体西瓜根系细胞膜损伤程度更大。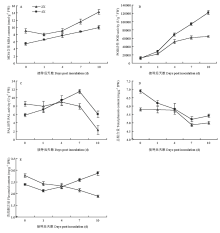 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同倍性西瓜幼苗接种枯萎病菌后POD、PAL的活性及MDA、总酚、类黄酮含量变化
-->Fig. 5The activities (contents) change of POD, PAL, MDA, total phenols and flavonoids in different polyploid watermelon roots after inoculated with Fon 1
-->
接种枯萎病菌前二倍体和四倍体西瓜根系POD活性差异较小;接种病菌后二倍体及四倍体西瓜根系POD活性均呈增加的趋势,但四倍体幼苗根系POD活性增加的幅度比二倍体大,接种枯萎病后10 d二倍体和四倍体根系POD活性分别为接种前的5.0、9.9倍(图5-B);四倍体根系POD活性整体高于其同源二倍体,并且在10 d时差异最为明显。
接种处理前二倍体植物根系的PAL活性明显比四倍体高,随着病菌的入侵,二倍体PAL活性总体呈下降的趋势;接种枯萎病菌后四倍体PAL活性逐渐增加在7 d时达到最高,7 d后也开始下降;与接种前相比,接种后1 d二倍体根系PAL活性降低6.2%、四倍体增加22.5%,接种后7 d二倍体根系PAL活性降低6.6%、四倍体增加95.2%,接种后10 d二倍体根系PAL活性降低73.3%、四倍体增加3.2%;病菌侵染后四倍体PAL活性的增加量明显高于其同源二倍体(图5-C)。
接种枯萎病菌后西瓜幼苗根系总酚的含量呈降低的趋势,在二倍体和四倍体中变化相似;但四倍体西瓜根系中总酚含量高于其同源二倍体,在接种0、1、4、7、10 d的根系总酚含量分别比二倍体高18.6%、6.7%、1.4%、7.0%、8.4%(图5-D)。
接种处理前,四倍体类黄酮的含量稍低于同源二倍体;随着枯萎病菌的侵染,二倍体幼苗根系黄酮含量逐渐降低;四倍体在接种1 d后根系类黄酮含量不断增加;与接种前相比,接种后1 d二倍体和四倍体根系类黄酮含量分别降低12.6%、11.7%,接种后4 d二倍体和四倍体根系类黄酮含量分别降低15.9%、4.2%,接种后7 d二倍体根系类黄酮含量降低22.7%、四倍体增加7.5%,接种后10 d二倍体根系类黄酮含量降低31.8%、四倍体增加19.6%;病菌侵染后四倍体类黄酮含量的增加量明显高于其同源二倍体(图5-E)。
2.4 不同倍性西瓜接种枯萎病菌后抗枯萎病基因PR3、MPK7、PAL、MYB的表达
以基因AP-2(Cla016178)为内参,分析了接种病菌后不同倍性西瓜PR3、MPK7、PAL、MYB相对表达量的变化(图6)。接种枯萎病菌后二倍体西瓜根系PR3的相对表达量一直处于较低水平,差异小;四倍体西瓜根系PR3表达量随接种后时间的推移不断增加,在接种后10 d表达量最高,是0 d表达量的6倍;二倍体与四倍体相比,0—4 d时表达量无明显差异;接种枯萎病菌7、10 d后四倍体西瓜根系PR3的表达量分别是二倍体的2、10倍。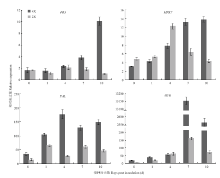 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6不同倍性西瓜接种枯萎病菌后抗枯萎病基因PR3、MPK7、PAL、MYB的表达量
-->Fig. 6The gene expression level of PR3, MPK7, PAL, MYB in different polyploid watermelon seedling roots after inoculated with Fon 1
-->
二倍体和四倍体西瓜根系MPK7呈现不同的表达趋势,二倍体根系MPK7表达量在4 d达到最大值,为0 d对照的3倍;四倍体MPK7的表达量随着接种后时间的推移不断增加,10 d时的表达量为0 d对照的4倍;枯萎病菌侵染前期四倍体根系MPK7的表达量略低,在侵染后期四倍体MPK7的表达量明显高于二倍体,接种7 d后是二倍体表达量的2倍、10 d后是二倍体表达量的3倍。
二倍体西瓜PAL的表达量一直在14—65间波动,变化幅度不大;四倍体西瓜PAL的表达量呈现先增高后降低的趋势,与PAL酶活性的变化相一致;不同倍性西瓜比较发现,接种前后各时期内四倍体幼苗根系PAL的表达量均高于二倍体,接种后4 d差别最大,是二倍体PAL表达量的6倍,接种后7 d和10 d分别是二倍体PAL表达量的2倍和3倍。
与四倍体相比二倍体根系MYB表达量一直处于极低的水平,接种后7 d时表达量达到最大值仅为160;四倍体根系MYB的表达量同样呈现先增高后降低的趋势,且高于同源二倍体,接种7 d时四倍体MYB的表达量是二倍体的80倍,接种10 d后MYB的表达量开始下降,是二倍体同时期的35倍;接种后7 d和10 d,MYB在四倍体西瓜根系明显上调表达。
3 讨论
3.1 不同倍性西瓜抗枯萎病苗期鉴定
多倍体化在植物的进化中具有重要的地位,正因为多倍化的频率高及多倍体的抗逆性,使得遗传稳定的多倍体能在植物中普遍存在。前人的研究发现多倍体与它们的同源二倍体祖先相比具有更高的抗病能力。刘文革等[4]对不同染色体倍性的西瓜枯萎病抗病性进行了研究,结果显示同源四倍体及同源三倍体对枯萎病的抗病能力均优于其同源二倍体,可连种多茬;四倍体甘蓝型油菜、香蕉等表现出更高的溃疡病、叶斑病抗性[6,7,8]。本试验也证明了以上观点,四倍体比二倍体西瓜抗枯萎病,且发病时间明显延迟。二倍体西瓜幼苗接种后4 d发病,10 d时大部分死亡,四倍体7 d发病,13 d时大部分死亡,四倍体比二倍体延迟3 d感病。张弛[5]在猕猴桃上的研究发现,二倍体植株在接种溃疡病菌后3 d内感病,四倍体植株在接种病菌后5 d感病,与本文的观点一致,均表明四倍体的抗病性强于同源二倍体。3.2 枯萎病菌在不同倍性西瓜中的侵染过程差异
四倍体西瓜幼苗枯萎病发病症状明显较轻,在表型鉴定的基础上,笔者通过观察病菌在植物体内的侵染动态,从生理结构方面深入探究四倍体的抗逆优势机理。HERMAN等[13]利用GFP标记技术观察了枯萎病菌在甜瓜中的侵染过程,发现病菌沿根毛、表皮和皮层侵入木质部。本试验发现枯萎病菌主要是从西瓜断根伤口、主根侧根间的自然缝隙、根毛等部位侵染西瓜根系,与甜瓜上的观察结果相似,说明枯萎病菌在不同瓜类作物上入侵方式及过程存在一定的相似性。病菌侵染植物后寄主会产生一系列抗病反应来抵抗病原菌的侵染和定殖,尤其是抗病品种,程玉瑾等[11]研究发现,西瓜接种枯萎病菌后感病品种根系细胞间菌丝多、侵染速度快,而抗病品种菌丝少、侵染速度较慢。在番茄与白粉病菌的互作研究中发现,抗病品种中分生孢子的萌发率更低。抗病西瓜根系会分泌更多的抗菌物质从而抑制枯萎病菌的生长,相反感病品种则含有更多的酚酸以促进病菌的生长[23]。本试验观察对比发现,不同倍性西瓜根系分生孢子的萌发率无明显差别,但是随着病菌的侵染,枯萎病菌在四倍体中的侵染速度明显较慢,细胞间菌丝较少,接种后1 d在二倍体根系就已经零星地观察到了病菌在维管束中的定殖,而四倍体仅侵染了1—3层表皮细胞,且维管束中尚未观察到枯萎病菌的定殖现象,推测四倍体可能分泌了更多的抗菌物质以抑制病原菌在植物体内的生长,进而延缓了病害的进一步扩展。
BECKMAN[24]研究发现,与感病的番茄品种相比抗病番茄茎基部侵填体的形成速度明显较快,在感病品种中几乎所有的维管束都逐渐被病菌侵染,而在抗病品种中侵染受到限制。黄萎病菌与抗病番茄的互作研究显示,病原菌仅停留在根系中,不能向茎叶等地上部分扩展[25]。对黄萎病菌在抗病莴苣中的侵染过程观察发现,病菌被限制在侧根中,从而阻止其向主根中大量的扩散[26]。本试验也观察到了类似现象,二倍体根系维管束被菌丝大量侵染时,四倍体西瓜根系维管束中的菌丝明显比二倍体少,病菌在四倍体西瓜幼苗中的定殖率相对于其同源二倍体较低,枯萎病菌在西瓜幼苗根部定殖率差异显著,在叶柄部差异极显著,说明在四倍体西瓜中,枯萎病菌向植株茎部及叶部的扩展得到了一定的限制。枯萎病菌在四倍体西瓜中的侵染过程明显滞后,与枯萎病的发病症状相吻合,进一步说明了四倍体相对于二倍体具有更强的抗枯萎病菌侵染能力。
3.3 不同倍性西瓜幼苗接种枯萎病菌后POD、PAL活性及总酚、类黄酮、丙二醛含量差异
植物根系在感染枯萎病菌后往往会发生一系列的生理生化变化,主要表现为保护酶活性的增强和呼吸作用的上升,并产生一些对病菌有抑制作用的物质,如酚类化合物、类黄酮等来抵抗病原菌的侵染。许勇等[27]研究表明,随着枯萎病菌对西瓜的侵染,羟脯氨酸糖蛋白与木质素的含量以及该物质形成过程中相关酶如POD、PAL活性在抗感病品种体内均有提高,但是抗病品种的增幅显著高于感病品种;邹芳斌等[28]对6个不同抗性等级的黄瓜品种对比发现,感染枯萎病后叶片组织内POD活性与抗性呈显著正相关;徐敬华等[29]研究表明,枯萎病菌处理后的西瓜苗PAL活性增加并呈周期性变化,不同部位的区别较大,叶片中表达量最高,PAL活性与抗病性呈正相关。本研究发现,接种枯萎病菌后四倍体西瓜PAL活性逐渐增加,在7 d时达到最高,说明接种枯萎病菌后四倍体幼苗根系产生了大量的PAL来抵御病菌的侵染,在接种7 d后有所下降,可能与选用品种相对感病有关;二倍体PAL活性总体呈下降的趋势,病菌侵染后四倍体PAL活性的增加量明显高于其同源二倍体。接种病菌后二倍体及四倍体西瓜根系POD活性均呈增加的趋势,但四倍体幼苗根系POD活性增加的幅度比二倍体大。总之,病菌侵染后四倍体根系生成了更多的PAL和POD酶以增强植物抗病能力,保护细胞免受伤害。
MDA常被判定植物细胞膜的损伤程度,并作为判定植物抗逆能力的间接指标[30]。赵秀娟等[31]研究发现,苦瓜对枯萎病的抗性与MDA含量呈负相关,感病品种MDA含量均高于抗病品种。本研究对接种枯萎病菌前后不同倍性西瓜根系的MDA含量进行了测定,结果显示接种后二倍体西瓜幼苗根系MDA含量明显高于同时期的四倍体,说明在相同的病菌处理下,四倍体西瓜根系细胞膜损伤程度更小,具有更强的抗枯萎病能力。
大量研究显示,酚类物质含量与植株的抗病性密切相关。对甘薯块根抗黑斑病研究发现,与感病品种相比,高抗品种总酚的含量增加更多,持续时间更长[32]。在香蕉与枯萎病菌的互作中发现,抗病品种根系酚类物质的增加量比感病品种大[33]。唐永萍等[34]研究表明,抗病的苹果品种通过调控果实内酚类物质等次生代谢物质含量来增强植物的抗病能力,其中类黄酮和木质素含量的提高增强了植物的抗病反应,提高了对灰霉病的抗性。受黑斑病菌侵染后高抗品种叶片内类黄酮、酚类等抑菌物质的含量高于感病品种,从而提高了甘薯的抗病能力[35]。本试验也得到了类似的结果,接种枯萎病菌后四倍体西瓜根系中总酚、类黄酮含量的增加量明显高于同源二倍体,总酚、类黄酮等次生代谢物质含量的优势使得四倍体植株更能抵御枯萎病菌的入侵。
3.4 不同倍性西瓜抗枯萎病基因PR3、MPK7、PAL、MYB的表达差异
寄主对枯萎病菌的侵染过程反应是多方面的,当病原菌侵染后会自动开启和增加体内抗病相关(PR)基因、转录因子、信号调控基因等的表达,并生成与抗病相关的产物,影响初级代谢的改变,进而表现出不同程度的植物免疫性和抗病性反应。病程相关蛋白的诱导表达,特别是几丁质酶(Chitinase,PR3)的上调表达在西瓜与枯萎病菌抗病互作中可能起到一定作用[36]。PR3一直被认为是一种重要的植物防卫基因。西瓜与枯萎病菌非亲和互作中,接种处理后8 d PR3上调表达超过20倍[14]。本研究发现,接种枯萎病菌后,二倍体根系PR3表达量变化不明显;四倍体PR3表达量不断增加,在接种后10 d表达量达到最大值,是二倍体同时期表达量的10倍。推测PR3在四倍体西瓜抗病中起到了一定的作用,但作用方式还有待进一步研究。
MAPK是一种蛋白激酶,其广泛存在于真菌、植物及动物等真核生物中,逆境下条件下MAPK级联反应在抗病抗逆信号传递中发挥着十分重要作用[37,38]。SONG等[39]对西瓜MAPK家族基因的功能分析研究发现西瓜枯萎病菌侵染后MPK7上调表达,接种后9 d时的表达量是对照的13倍,MPK7可能同时参与了多条信号转导途径,在干旱、高温、病菌侵染等多个逆境胁迫中都扮演着重要的角色;同时在本氏烟上的研究结果显示MPK7表达后可以诱导活性氧的积累及防卫基因的表达,从而减少灰霉病对植物的伤害。本研究也同样检测了MPK7在不同倍性西瓜根系的表达量,结果显示枯萎病菌侵染的前期四倍体西瓜根系MPK7表达量稍低,在侵染后期四倍体MPK7表达量明显高于二倍体,说明在接种的后期四倍体根系能表达更多的MPK7,传递抗病信号,促进抗病基因的表达,从而降低枯萎病菌对西瓜幼苗的伤害。
大蕉植物体内PAL的克隆、鉴定和表达分析结果显示M-PAL的表达可能与香蕉枯萎病抗性相关[40]。张曼等[41]的研究结果显示,与自根西瓜相比,嫁接西瓜PAL等防卫基因的表达水平较高。本研究发现,接种枯萎病菌后,四倍体西瓜PAL表达量呈先增高后降低的趋势,在同时期表达量均高于二倍体,最大表达量是二倍体PAL表达量的6倍,说明四倍体根系的抗病防御能力较强。PAL表达量与PAL酶活性变化趋势一致且在时间上有所提前,推测四倍体植物体内PAL的表达导致了PAL酶活性的变化,从而增加了四倍体植物根系类黄酮及总酚等次生代谢物质的含量,以抑制病原菌在植物体内的生长和定殖。
MYB转录因子与茉莉酸(JA)之间具有密切的联系,已经被证明在抗病中起作用。LEE等[42]研究证明JAmyb与病害引起的细胞死亡密切相关,并参与了水稻中茉莉酸介导的信号传导途径;SUGIMOTO等[37]研究发现,AtMYB15与烟草NtMYB2高度相似,它能被调控PR上调表达的激发子所诱导;韩金桓等[43]研究发现,枯萎病菌诱导后ClMYB在高抗品种根部的表达量峰值出现得早,且表达量高,与感病品种差异显著。在本试验中,接种枯萎病菌后二倍体西瓜根系ClMYB表达量一直处于较低的水平,四倍体根系ClMYB表达量明显高于同源二倍体,接种后7、10 d四倍体根系的表达量分别是二倍体同时期表达量的80、35倍。而四倍体西瓜幼苗在7 d时已经开始发病,由于此时MYB表达显著上调,笔者推测MYB在四倍体幼苗初期的抗病反应中起重要作用。它可能通过调节四倍体类黄酮的合成,参与抗病信号的传导等方式来参与四倍体的抗病反应,具体的调节方式还有待后续研究验证。
4 结论
接种枯萎病菌后,与二倍体相比,枯萎病菌在同源四倍体幼苗中的定殖率较低,侵染过程明显滞后,四倍体西瓜发病症状延迟;POD、PAL、总酚及类黄酮的活性/含量整体较高,根系细胞膜受损伤程度小;MYB、MPK7、PAL、PR3等抗病基因上调表达。研究结果从不同层面表明四倍体西瓜在抗枯萎病方面存在着一定的优势,为西瓜多倍体育种和抗病育种提供了理论依据。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
