0 引言
【研究意义】禽流感是由禽流感病毒(avian influenza virus,AIV)引起的一种严重危害家禽和人类健康的人畜共患病,其基因组是由8个单股负链RNA组成,病毒在其复制过程中突变、重组频繁,容易产生威胁动物和人类健康的新型流感病毒。低致病性H7N9亚型禽流禽感病毒(注:本文中若不特殊说明,低致病性H7N9病毒和高致病性H7N9病毒均指的是对鸡的致病性)自2013年在我国首次出现以来,不仅造成我国养殖业的巨大损失,而且已经导致大量的人类感染及死亡[1]。2017年初,对家禽呈现低致病力的H7N9病毒进一步发生变异,在其病毒HA基因裂解位点区域增加了4个氨基酸,致使该类型病毒由对鸡只的低致病性突变为高致病性[2]。流行病学研究发现,人类的感染源自接触了H7N9病毒感染的家禽以及被污染的环境[3,4,5,6,7,8]。生物学特性研究发现,H7N9病毒之所以能够感染并导致人死亡,与其病毒基因位点的突变以及获得了一些致病力相关基因位点有关[8,9,10,11,12]。因此,开展H7N9病毒对哺乳动物的致病力研究及其致病机制研究,将起到预警和评估跨物种感染和对哺乳动物的致病能力变化,充实科学防控流感的重要科学依据,具有重要的现实意义和公共卫生学意义。【前人研究进展】对2013年的H7N9病毒的研究表明,人源H7N9病毒与禽源H7N9病毒高度同源,从家禽中分离的H7N9病毒对家禽和哺乳动物并无致病力。但H7N9病毒在感染人后,很容易获得PB2蛋白E627K,D701N的突变,进而能够增强流感病毒在哺乳动物上的致病力和传播能力,导致哺乳动物的感染和死亡[10,13-19]。2017年新发高致病性H7N9病毒在其碱性裂解位点区域获得了4个氨基酸的插入,表现为对鸡的高致病性,但裂解位点区域氨基酸的增加并不一定影响病毒对哺乳动物的致病性,试验证明,早期的高致病性H7N9病毒对哺乳动物并无致病力,但高致病性病毒在获得PB2蛋白 627K或者701N的突变后,可以获得比2013年人源病毒更强的致病力,并可在雪貂之间经呼吸道飞沫传播[2,20]。另外,在H5亚型流感病毒的致病力、传播能力研究中,受体结合位点以及PB2蛋白627位点的改变或者是与人源流感病毒发生重组也不同程度的影响流感病毒对哺乳动物的致病力和传播能力[21,22,23,24,25,26,27,28,29,30]。【本研究切入点】在之前的研究中发现,对家禽呈现低致病力的H7N9病毒同样对哺乳动物模型小鼠不表现任何的致病力[19]。但是,2015年,我们在湖南省的鸡样品中分离到一株低致病性H7N9病毒,A/chicken/Hunan/S40726/2015(H7N9) (简称HuN/S40726),却对哺乳动物小鼠表现为高致病力,其小鼠半数致死量(MLD50)为3.38 log10EID50/0.1mL。对比分析其影响病毒致病力的关键分子特征,发现其PB2蛋白627位点为V,有别于大多数禽源H7N9病毒627E和人源H7N9病毒627E/K。为了了解该病毒致病力的变化及其分子机制,我们开展了本研究。【拟解决的关键问题】利用反向遗传学技术,救获HuN/S40726重组病毒验证其致病力差异,通过定点突变技术,突变病毒PB2 蛋白的627位氨基酸,从而通过动物实验验证PB2蛋白的627V是否影响HuN/S40726毒株的致病力,并研究其致病力差异的分子机制。1 材料与方法
试验于2016年在中国农业科学院哈尔滨兽医研究所完成。1.1 病毒株与质粒
低致病性H7N9病毒(注:本文中若不特殊说明,低致病性H7N9病毒和高致病性H7N9病毒均指的是对鸡的致病性)A/Chicken/Hunan/S40726/2015(H7N9)(简称HuN/S40726),A/chicken/Shanghai/S1053/2013 (H7N9)(简称SH/S1053)由兽医生物技术国家重点实验室分离鉴定并保存。其他用于PB2蛋白627位氨基酸分析比较的H5、H7亚型流感病毒序列均来自GISAID数据库。双向表达载体pBD以及真核表达载体pCAGGS由兽医生物技术国家重点实验室保存。1.2 主要试剂与材料
RNA提取试剂盒购自北京天根生化有限公司; RNA反转录酶购自日本TOYOBO公司;EasyTaqDNA聚合酶购自北京全式金生物公司;PCR产物纯化试剂盒,胶回收试剂盒购自美国OMEGA公司;测序反应试剂盒BigDye Terminator 3.1购自美国ABI公司;同源重组试剂盒购自南京诺唯赞生物科技有限公司;质粒小提试剂盒购自康宁生命科学有限公司;质粒中提试剂盒购自QIAGEN公司;转染试剂(LipofectamineTM 3000)购自Invitrogen 公司;Primer STAR 购自TaKaRa公司;双荧光素酶试剂盒购自Promega;6周龄BALB/c雌性小鼠(14—16 g)购自北京维通立华实验动物有限公司;所用9—10日龄SPF鸡胚购自哈尔滨兽医研究所实验动物中心。1.3 引物设计
依据HuN/S40726和SH/S1053病毒的基因全长序列分别设计PB2、PB1、PA、HA、NP、NA、M和NS的8个基因克隆扩增引物和定点突变引物, 以及用于构建HuN/S40726和SH/S1053聚合酶复合表达质粒的克隆引物(表1)。Table 1
表1
表1本研究中用到的引物
Table 1Primers used in this study
| 基因片段 Gene segment | 引物 (5′-3′) 1) | |
|---|---|---|
| 正向引物 Forward | 反向引物Reverse | |
| HuN/S40726-PB2 clone | 5′ TGCCGGCCAGCAAAAGCAGGTCAATTATATTC 3′ | 5′ CGGGTTATTAGTAGAAACAAGGTCGTTTTTAAACAATTC 3′ |
| HuN/S40726-PB1 clone | 5′ TGCCGGCCAGCGAAAGCAGGCAAACCATTTG 3′ | 5′ CGGGTTATTAGTAGAAACAAGGCATTTTTTCATG 3′ |
| HuN/S40726-PA clone | 5′ TGCCGGCCAGCGAAAGCAGGTACTGATCC 3′ | 5′ CGGGTTATTAGTAGAAACAAGGTACTTTTTTGG 3′ |
| HuN/S40726-HA clone | 5′ TGCCGGCCAGCAAAAGCAGGGGATAC3′ | 5′ CGGGTTATTAGTAGAAACAAGGGTG 3′ |
| HuN/S40726-NP clone | 5′ TGCCGGCCAGCAAAAGCAGGGTAGATAATCACTC ACCG 3′ | 5′ CGGGTTATTAGTAGAAACAAGGGTATTTTTC 3′ |
| HuN/S40726-NA clone | 5′ TGCCGGCCAGCAAAAGCAGGGTCAAG 3′ | 5′ CGGGTTATTAGTAGAAACAAGGGTC 3′ |
| HuN/S40726-M clone | 5′ TGCCGGCCAGCAAAAGCAGGTAGATGTTTAGAG 3′ | 5′ CGGGTTATTAGTAGAAACAAGGTAGTTTTTTAC 3′ |
| HuN/S40726-NS clone | 5′ TGCCGGCCAGCAAAAGCAGGGTGACAAAAAC 3′ | 5′ CGGGTTATTAGTAGAAACAAGGGTGTTTTTTATC 3′ |
| HuN/S40726-PB2/V627E | 5′ CCATTTGCAGCAGCCCCGCCGGAGCAGAGTAGG 3′ | 5′ CTCCGGCGGGGCTGCTGCAAATGGTAATAG 3′ |
| HuN/S40726-PB2/V627K | 5′ CCATTTGCAGCAGCCCCGCCGAAGCAGAGTAGG 3′ | 5′ CTTCGGCGGGGCTGCTGCAAATGGTAATAG 3′ |
| HuN/S40726-PB2-pcDNA3.1 | 5′ GGAGACCCAAGCTGGCTAGCATGGAAAGAATAAA AGAACTAAGAGATTTG 3′ | 5′ CTCTAGACTCGAGCGGCCGCTTAATTGATGGCCAT CCGAATC 3′ |
| HuN/S40726-PB1-pcDNA3.1 | 5′ GGAGACCCAAGCTGGCTAGCATGGATGTCAATCCG ACT 3′ | 5′ CTCTAGACTCGAGCGGCCGCCTATTTTTGCCGTCTG AG 3′ |
| HuN/S40726-PA-pcDNA3.1 | 5′ GGAGACCCAAGCTGGCTAGCATGGAAGACTTTGTG CGACAATG 3′ | 5′ CTCTAGACTCGAGCGGCCGCCTATCTTAGTGCATG TGTGAGGAAGG 3′ |
| HuN/S40726-NP-pcDNA3.1 | 5′ GGAGACCCAAGCTGGCTAGCATGGCGTCTCAAGG CACCA 3′ | 5′ CTCTAGACTCGAGCGGCCGCTTAATTGTCATACTCC TCTGCATTGTC 3′ |
| SH/S1053-PB2-pcDNA3.1 | 5′ GGAGACCCAAGCTGGCTAGCATGGAAAGAATAAA AGAACTAAGAGATTTG 3′ | 5′ CTCTAGACTCGAGCGGCCGCTTAATTGATGGCCAT CCGAATC 3′ |
| SH/S1053-PB1-pcDNA3.1 | 5′ GGAGACCCAAGCTGGCTAGCATGGATGTCAATCCG ACT 3′ | 5′ CTCTAGACTCGAGCGGCCGCCTATTTTTGCCGTCTG AG 3′ |
| SH/S1053-PA-pcDNA3.1 | 5′ GGAGACCCAAGCTGGCTAGCATGGAAGACTTTGTG CGACAATG 3′ | 5′ CTCTAGACTCGAGCGGCCGCCTATCTTAGTGCATG TGTGAGGAAGG 3′ |
| SH/S1053-NP-pcDNA3.1 | 5′ GGAGACCCAAGCTGGCTAGCATGGCGTCTCAAGG CACCA 3′ | 5′ CTCTAGACTCGAGCGGCCGCTCAATTGTCATACTC CTCTGCATTGTC 3′ |
新窗口打开
1.4 重组质粒的构建
提取HuN/S40726毒株的病毒RNA,按照TOYOBO反转录试剂盒说明书将病毒RNA反转录成cDNA,然后利用高保真酶Primer STAR和克隆引物扩增8个基因片段。扩增产物经琼脂糖凝胶电泳检测,用Omega胶回收试剂盒纯化回收。同样使用pBD克隆引物扩增pBD载体使之线性化,并用DpnI酶处理。利用Vazyme CloneExpress II 重组克隆试剂盒进行同源重组反应,将病毒的各片段克隆于pBD载体中。以病毒的PB2-pBD质粒为模版,按照点突变试剂盒的说明书进行突变反应,实现定点突变。阳性重组质粒经中提后用于转染。1.5 病毒的救获以及序列鉴定
按照LipofectamineTM3000脂质体转染试剂盒方法,将病毒的8个片段的阳性重组质粒混合,每个阳性质粒500 ng,共转染293T细胞,48 h后将细胞液接种9—10日龄鸡胚,0.4 mL/枚,37℃培养,48 h后收取尿囊液进行血凝(HA)试验,HA试验阳性的尿囊液分装冻存于-80℃。对救获的病毒提取RNA,扩增全基因组进行测序,利用DNAstar软件比较救获病毒与原病毒是否相同,以及突变毒株是否实现定点突变。1.6 小鼠感染性试验
救获的病毒稀释至106EID50/50 μL,采用干冰麻醉小鼠,8只小鼠依次鼻腔接种50 μL。感染3d后,随机剖杀3只小鼠,取脑、脾、肺、肾、鼻甲通过鸡胚滴定,检测病毒在小鼠各脏器内的复制情况。其余5只小鼠,每天观察其临床表现,记录小鼠14 d内的体重变化。攻毒后小鼠饲养于IVC鼠笼中,提供优质充足的饲料和饮水。环境温度为21℃左右。1.7 小鼠半数致死量(MLD50)的测定
将病毒稀释至101—106EID50/50 μL,每个剂量鼻腔感染5只小鼠。每天观察小鼠的临床表现,记录14 d内小鼠的体重变化以及死亡情况。根据Reed-Muench方法计算病毒的小鼠半数致死量(MLD50)。1.8 聚合酶活性试验
使用双荧光素酶报告系统来比较聚合酶的活性。构建HuN/S40726病毒及其突变病毒的聚合酶复合表达质粒系统,以SH/S1053病毒为背景毒株构建聚合酶复合表达质粒系统作为对照,所用载体为pcDNA3.1载体。按照LipofectamineTM3000脂质体转染试剂盒方法,将构建好的病毒的PB2,PB1,PA,NP表达质粒与萤火虫荧光素酶报告质粒p-Luci以及内参TK质粒共转染293T细胞,33℃和37℃下培养24 h后,裂解细胞,离心收取上清液,荧光素酶的测定按照荧光素酶试剂盒的推荐步骤进行。2 结果
2.1 HuN/S40726毒株对BALB/c小鼠的致病性分析
本研究中,笔者通过对比研究低致病性H7N9代表毒株,HuN/S40726和SH/S1053病毒对哺乳动物模型小鼠的致病性,发现低致病性H7N9代表株SH/S1053病毒仅能在小鼠的鼻甲和肺脏中低拷贝复制,且并不致死小鼠,其MLD50为≥6.5 log10EID50/ 0.1 mL(图1-B);然而,2015年在湖南分离的HuN/S40726病毒却可以在小鼠的鼻甲和肺脏高效复制,并可以跨越血脑屏障,在小鼠的脑中复制,其MLD50为3.38 log10EID50/0.1 mL(图1-A),呈现与SH/S1053病毒脏器复制能力的极显著差异。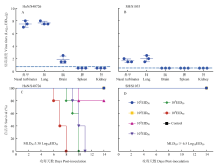 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1HuN/S40726毒株对BALB/c小鼠的致病力
-->Fig. 1Virulence of HuN/S40726 in BALB/c mice
-->
2.2 可能导致HuN/S40726病毒发生致病力变化的相关基因位点对比分析
在之前的研究中我们发现,对家禽呈现低致病力的H7N9病毒同样对哺乳动物模型小鼠不表现任何的致病力[19]。通过分析上述两个代表株致病能力差异的结果,我们认为HuN/S40726毒株呈现对小鼠的高致病力,有可能与其病毒基因发生了突变或者获得了一些致病力相关基因位点有关。因此,我们对两株代表毒株进行了可能导致毒株发生致病力变化的相关基因位点对比分析,结果发现两株病毒仅在PB2蛋白627位氨基酸存在差异,HuN/S40726毒株为PB2/627V、SH/S1053毒株为PB2/627E(表2)Table 2
表2
表2代表毒株致病力相关基因位点对比分析
Table 2Comparative analysis of the genetic site in the pathogenic factors of the H7N9 strain
| 基因片段 Gene segment | 氨基酸位点及区域 Amino acids mutations /Insertion | 病毒Viruses used in this study | |
|---|---|---|---|
| HuN/S40726 | SH/S1053 | ||
| HA | Cleavage site | PKGR/G | PKGR/G |
| G186V | V | V | |
| Q226L | L | L | |
| A138S | A | A | |
| PB2 | E627K | V | E |
| D701N | D | D | |
| K526R | K | K | |
| Q591K | Q | Q | |
| PB1 | I368V | V | V |
| L598P | L | L | |
| M1 | N30D | D | D |
| NS1 | P42S | S | S |
新窗口打开
2.3 PB2蛋白627位氨基酸分析
为确认PB2蛋白627V是否在自然界其他病毒中存在并是否大量存在,下载GISAID数据库中2013—2018年的H5、H7N9病毒的PB2基因序列,通过分析PB2蛋白627位氨基酸发现,PB2蛋白的627位氨基酸相对保守,几乎所有禽源H5、H7N9病毒此位点为E;在1 148株人源H7N9病毒中,826株病毒为627K,288株病毒为627E,另外34株病毒存在627V(表3)。上述结果显示,自然界一直以来同时存在着627E/K/V 3种变体,更有可能代表着不同的致病力特征。Table 3
表3
表3自然界中H5、H7N9病毒PB2蛋白627位点氨基酸分析
Table 3Analysis of PB2 protein 627 Aa site in H5 and H7N9 viruses in nature
| 基因 Gene | 关键性位点变化 Key sites | HuN/S40726毒株 strain | GISAID下载(2013-2018) | ||
|---|---|---|---|---|---|
| 禽源H7N9 Avian H7N9 | 人源H7N9 Human H7N9 | 禽源H5 Avian H5 | |||
| PB2 | 627E | 0/1 | 597/601 | 288/1148 | 862/863 |
| 627V | 1/1 | 0/601 | 34/1148 | 0/863 | |
| 627K | 0/1 | 4/601 | 826/1148 | 1/863 | |
新窗口打开
2.4 救获病毒以及定点突变病毒对BALB/c小鼠的致病性
为了了解是否PB2蛋白E627V的改变导致HuN/S40726病毒的致病力变化,我们通过反向遗传学技术、点突变技术,分别救获 rHuN/S40726重组毒以及两株单点氨基酸突变病毒,rHuN/S40726-PB2/627E、rHuN/S40726-PB2/627K。以106EID50/ 0.05ML感染小鼠,结果显示,rHuN/S40726-PB2/627K点突变病毒能在小鼠的鼻甲和肺脏中高效复制,在脑中低拷贝复制,MLD50为4.5 log10EID50,与以往的研究报道中PB2/627K能够增强病毒对哺乳动物的致病力结果相一致[13,14,15,16,17,18,19];rHuN/S40726重组病毒与HuN/S40726野生毒株对小鼠的致病力一致,均能致死小鼠,MLD50 分别为3.5 log10EID50和3.38 log10EID50,说明rHuN/S40726重组病毒对小鼠一样呈现对小鼠的高致病性特征;rHuN/ S40726重组病毒点突变株rHuN/S40726-PB2/627E仅在小鼠的鼻甲和肺脏中复制,不能在小鼠的脑内复制,也不能造成小鼠的死亡,其MLD50大于6.5 log10EID50,相比rHuN/S40726重组毒致病力降低了至少1 000倍(详见图2)。以上结果说明,PB2蛋白V627E的突变可以明显降低HuN/S40726病毒对小鼠的致病力。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2救获病毒对BALB/c小鼠的致病力
-->Fig. 2Virulence of rescued viruses in BALB/c mice
-->
2.5 聚合酶活性检测
PB2蛋白627位氨基酸的改变,一般会影响病毒聚合酶活性,本研究中笔者推测HuN/S40726病毒PB2蛋白E627V改变影响了病毒聚合酶活性,进而改变了病毒对哺乳动物的致病性。为进一步揭示HuN/S40726病毒PB2蛋白627V影响病毒对小鼠致病力的内在机制,构建了HuN/S40726病毒PB1、PA、NP基因以及PB2的3种突变基因表达质粒,通过在细胞上表达聚合酶来分析PB2蛋白627位氨基酸的突变对聚合酶活性的影响。结果显示,不论是在33℃还是37℃下,与PB2/627E共表达质粒组合相比,PB2/627V,PB2/627K组合均能提高病毒在哺乳动物细胞中的聚合酶活性,与病毒的致病性呈正相关(图3-A)。同样的,以SH/S1053病毒为背景,PB2/627V、PB2/627K组合也均能提高H7N9病毒的聚合酶活性(图3-B),远高于PB2/627E共表达质粒组合的聚合酶表达活性。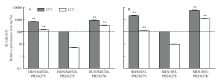 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3H7N9禽流感病毒的聚合酶活性
**, P<0.01: 与PB2/627E转染组差异极显著
-->Fig. 3Polymerase activity of H7N9 avian influenza virus
**, P<0.01:The values were significantly different from the PB2/627E transfection group
-->
3 讨论
自2013年中国上海市出现全球首例人感染H7N9病毒并死亡病例以来,H7N9病毒一直在威胁着人类的健康。截止2018年3月2日,H7N9病毒已有全球范围内实验室确诊病例1 567例,包括死亡病例615例(http://www.who.int/influenza/human_animal_interface/ HAI_Risk_Assessment/en/)。而经过4年来病毒在家禽中的不断传播、遗传进化,2017年初,低致病性的H7N9病毒在其裂解位点区域增加了4个氨基酸的插入(-KRTA-),使得该类型病毒突变成了高致病性H7N9病毒,给我国的养禽业以巨大的打击。流感病毒是一种单股负链RNA病毒,频繁的变异是它的天性。将低致病性流感病毒突变为高致病性流感病毒是最不希望监测到的突变,使得一种新型流感病毒可以在人类中飞沫传播。在本研究中,笔者通过常规监测在1株低致病性H7N9病毒中发现了这个令人担忧的PB2 E627V突变,这种突变使得对哺乳动物小鼠的致病力增加1 000倍以上,彰显了单个基因位点改变病毒致病力特性的巨大作用。而一旦该类病毒在家禽中得以传播开来,对人的致病性风险将增加很大。该发现为防控H7N9提供了科学依据。
以往研究数据显示,病毒的单个基因/关键性位点或多个基因/关键性位点往往决定着流感病毒致病力和传播能力的变化[11]。在H5、H7N9流感病毒研究中,有关PB2蛋白627位氨基酸的改变,均显示影响着病毒对宿主的致病力变化和是否能够在宿主间具有传播能力[13,14,15,16,17,18,19,20]。PB2蛋白627K(绝大多数人源流感病毒存在此氨基酸)是禽流感病毒能在哺乳动物细胞中有效复制的关键影响位点。相反的,基本上全部的禽源病毒具有PB2 627 E(绝大多数禽源流感病毒存在此氨基酸)也因为该位点限制了禽源病毒在哺乳动物体内的复制能力[16,19]。最近的一项研究表明,流感病毒PB2蛋白627位点的突变与宿主体内的ANP32A蛋白有关,ANP32A充当“内鬼”,辅助病毒进入细胞后复制活动,而禽流感无法利用哺乳动物的ANP32A蛋白,除非病毒发生PB2蛋白E627K的突变[31]。我们之前报道过低致病性H7N9病毒和高致病性H7N9病毒均对小鼠无致病力,而当病毒在哺乳动物体内获得PB2蛋白E627K,D701N等突变后,H7N9病毒对小鼠、雪貂的致病力可以显著的提高甚至致死小鼠和雪貂,并可在雪貂之间经呼吸道飞沫传播[2,19]。本研究中,笔者在2015年对湖南省开展动物流感病毒监测中,分离到1株对小鼠表现为高致病力的H7N9病毒(HuN/S40726),对其致病力、传播能力等关键性的分子特征进行分析后,发现其PB2蛋白627位氨基酸为V,其有别于禽源H7N9病毒特征的PB2蛋白627E和人源H7N9病毒特征的PB2蛋白627K。是否该病毒PB2蛋白627V使得HuN/S40726病毒对小鼠呈高致病性。通过反向遗传学技术,救获了HuN/S40726重组毒以及对其PB2 627位氨基酸突变的重组毒株 rHuN/S40726-PB2/627E、rHuN/S40726-PB2/627K。通过小鼠致病性评估试验,PB2蛋白E627V的改变显著的增强了HuN/S40726病毒对小鼠的致病力,使得病毒MLD50由≥6.5 log10EID50变化为3.5 log10EID50,病毒毒力增强了1 000倍以上。进一步的分子机制研究发现,HuN/S40726病毒通过显著提高HuN/S40726病毒在哺乳动物细胞中的聚合酶活性,改变了该病毒对小鼠的致病性。综上所述,PB2蛋白的627V是HuN/S40726病毒对哺乳动物小鼠表现高致病力的重要分子基础。
分析GISAID数据系统下载的2013-2018年的人源H7N9病毒序列,我们发现人源H7N9病毒中已经存在部分的病毒具有PB2蛋白627V,而禽源H7N9病毒中并未发现具有PB2蛋白627V的毒株,显示该类型对人的感染同样存在大的风险性。因此,对于H7N9病毒还应采取不间断的流行病学调查工作,密切关注其遗传进化以及生物学特性的变化。
4 结论
PB2蛋白627位氨基酸(V)决定了HuN/S40726病毒对小鼠的高致病力。PB2蛋白E627V的改变能够显著增强HuN/S40726病毒在哺乳动物细胞中的聚合酶活性,是引起HuN/S40726病毒对哺乳动物致病力的重要因素。The authors have declared that no competing interests exist.
