0 引言
【研究意义】血吸虫病(Schistosomiasis)是一种分布广泛、危害严重的人畜共患寄生虫病,在76个国家和地区呈地方性流行;血吸虫性成熟雌虫产生的大量虫卵沉积在宿主肝脏和肠系膜静脉形成肉的芽肿是导致宿主损伤的根本原因,大量虫卵排出体外又造成血吸虫病的传播和流行[1,2,3]。血吸虫雌雄合抱是雌虫性成熟和产卵的前提,只有与雄虫合抱的雌虫才能发育成熟,而未与雄虫合抱的雌虫生长缓慢,生殖系统处于发育阻遏状态,不能正常产卵[4]。合抱的雌雄虫分离后,雌虫慢慢变小,生殖器官逐渐萎缩退化,重新回到发育阻遏状态[5,6,7]。因此,从控制血吸虫雌虫的生殖发育来防治血吸虫病具有重要意义。【前人研究进展】ELAV(embryonic lethal abnormal vision)-like 是一类家族基因,该家族成员最早在果蝇体内发现,因胚胎期致死及视觉异常表型而得名。该家族基因编码RNA结合蛋白,通过转录后调节影响mRNA的转运、定位和翻译,控制蛋白的时空表达,并调控RNA与蛋白质的结合及其相互作用,决定基因的表达水平及终产物,进而发挥不同的生物学功能[8,9]。ELAV-like 1是该家族成员之一,在果蝇神经元中通过转录后调控机制限制神经突触的生长,对神经系统的发育和维持有重要作用[10,11]。人类中与ELAV-like 1同源的基因HuR在细胞中广泛表达,通过与ARE(AU-rich element)元件结合来调节mRNA的稳定性,它的异常表达导致生长发育异常、自身免疫和肿瘤等疾病的发生[12,13,14]。HuR对胚盘的形态学发生和血管形成以及胎儿的维持也有重要作用,该基因缺失将导致胚胎致死或发育异常[15]。果蝇中与ELAV-like同源的RBP9,不仅对神经元成熟有重要作用,还与卵母细胞的分化有关,该基因突变导致卵子缺陷,引起雌性不孕[16]。【本研究切入点】在分析日本血吸虫由单性感染和混合感染而来的25 d雌虫的转录组差异时发现,SjELAV-like 1在25 d发育阻遏雌虫体内高表达,这预示该基因可能对日本血吸虫的生长发育有重要的影响。【拟解决的关键问题】本研究以日本血吸虫发育阻遏雌虫体内高表达的SjELAV-like 1为研究对象,克隆、表达该基因,分析其重组抗原的免疫原性及SjELAV-like 1蛋白的分布情况,并分析该基因在虫体内的差异表达,评估该基因沉默对日本血吸虫形态和生殖发育的影响,为进一步研究该基因的生物学功能奠定基础。1 材料与方法
本研究于2016年8月至2017年10月完成,完成地点为中国农业科学院上海兽医研究所农业部动物寄生虫学重点开放实验室。1.1 材料
1.1.1 主要试剂 Ex Taq HS、T4 DNA Ligase、pGEM T-easy载体、限制性内切酶EcoR I 和Xho I 、DNA Marker、SMARTer® RACE 5′/3′ Kit、Prime-Script RT reagent Kit with gDNA Eraser、SYBR® Premix Ex TaqTMⅡ购自TaKaRa生物工程有限公司;DNA胶回收试剂盒、质粒回收试剂盒购自Axygen生化科技有限公司;弗氏完全佐剂和不完全佐剂购自 Sigma 公司;硝酸纤维素膜(Whatman)购自北京经科宏达生物技术有限公司;HRP-goat anti-mouse IgG购自上海碧云天生物技术研究所;增强型HRP-DAB底物显色试剂盒购自天根(北京)生化科技有限公司;DAPI Stock Solution、Alexa Fluor® 488 goat anti-mouse IgG(H+L)、TRIzol® reagent购自上海英潍捷基生物公司;4%多聚甲醛、50%戊二醛;所有引物合成及测序均由上海英骏生物技术公司完成,所有小干扰RNA(siRNA)均有上海吉玛制药技术有限公司合成。1.1.2 菌种、质粒、血清和实验动物 日本血吸虫中国大陆株尾蚴由中国农业科学院上海兽医研究所钉螺室提供。pET28a质粒由农业部动物寄生虫学重点开放实验室保存,大肠杆菌BL21、DH5α购自上海全氏金生物有限公司;6 周龄雄性BABL/c小鼠购自斯莱克实验动物有限公司;日本血吸虫全虫可溶性蛋白抗血清由农业部动物寄生虫学重点开放实验室制备。
1.2 方法
1.2.1 虫体的收集 BABL/c小鼠以腹部贴片法[17],在感染后7、14、18、21、25、28、35、42 d剖杀,以肝门静脉灌注法收集虫体;并分别收集18、21、25、28、35、42 d合抱分开的雌、雄虫体。以单钉螺逸出的尾蚴感染小鼠,25 d后剖杀,结合形态观察,分别收集雌、雄虫体,单性感染雌虫较正常发育雌虫小,雄虫无明显差异。所收集虫体均用PBS洗涤3次,于液氮罐中冻存备用。1.2.2 SjELAV-like 1基因序列的获得与分析
1.2.2.1 SjELAV-like 1基因序列的获得 根据前期研究发现的在Gene DB中登录的发育阻碍雌虫高表达的部分基因序列(Sjp_0001640),利用Primer5.0设计5′和3′RACE引物(表1)。TRIzol 法提取日本血吸虫总RNA,用分光光度计测定浓度,根据SMARTer® RACE 5′/3′Kit说明书进行5′和3′端的扩增,将扩增产物回收与pGEM T-easy 载体连接,转化至大肠杆菌DH5α中,挑选单克隆扩大培养,菌液PCR 鉴定阳性克隆,抽提质粒测序。
Table 1
表1
表1本研究中的引物
Table 1The primer sequence in this study
| 名称 Name | 引物序列 Primer sequence(5'-3') | 用途 Use | |
|---|---|---|---|
| GSP1 | R | GGGCGGGTTAGAAATGGAATTGT | 5'RACE |
| GSP2 | R | TGGCAATCGTTGTTGAGTACCGT | 5'RACE |
| GSP3 | F | TGGTGGACCAATTCATCCAACT | 3'RACE |
| GSP4 | F | TGCTAACGCAGTAGCTGCAGGAGGT | 3'RACE |
| SjELAV-like 1-a | F | CCGGAATTCGTTGGTTCAATGTCAG ATAGTCCAT | PCR扩增 Amplification by PCR |
| R | CCGCTCGAGTTGTTGTTGTTGTCAA TGTAATCAC | PCR扩增 Amplification by PCR | |
| SjELAV-like 1-b | F | GTGACCTATTCAGTCAACCTAACAA | 荧光定量PCR |
| R | TGTTATTTGGTCCAATCTGTGTATT | qRT-PCR | |
| Sjβ-tublin | F | CTGATTTTCCATTCGTTTG | 荧光定量PCR |
| R | GTTGTCTACCATGAAGGCA | qRT-PCR | |
| NC | F | UUCUUCGAACGUGUCACGUTT | RNA干扰 |
| R | ACGUGACACGUUCGGAGAATT | RNAi | |
| S1 | F | GCUAUACCUGUACGUAUUATT | RNA干扰 |
| R | UAAUACGUACAGGUAUAGCTT | RNAi | |
| S2 | F | GCGACAGUGAAUUUACCUUTT | RNA干扰 |
| R | AAGGUAAAUUCACUGUCGCTT | RNAi |
新窗口打开
1.2.2.2 生物信息学分析 利用在线工具ORF finder(www.ncbi.nlm.nih.gov/go rf/gorf.html)分析获得的基因序列,找出编码序列;利用 ProtParam 工具(http://web.expasy.org/protparam/)计算编码蛋白质的理论分子量、等电点、氨基酸组成等;利用SignalP 3.0 (www.cbs.dtu.dk/services/SignalP)在线分析该蛋白有无信号肽;利用 TMHMM 服务器(www.cbs.dtu.dk/ services/TMHMM-2.0/)分析编码蛋白有无跨膜结构;采用NCBI服务器中的CDD(www.ncbi.nlm.nih.gov/ structure/cdd/cdd.shtml)程序进行保守结构域分析。通过NCBI中的Blast功能进行同源性分析。
1.2.3 重组质粒pET28-SjELAV-like 1的构建及表达
1.2.3.1 重组质粒的构建 根据获得的SjELAV-like 1基因序列的编码区,利用Primer 5.0设计上下游引物SjELAV-like 1-a(表1),根据Prime-Script™ RT reagent Kit with gDNA Eraser(Takara)试剂盒说明进行反转录,获得日本血吸虫cDNA,以之为模板进行PCR扩增,用EcoR I和Xho I限制性内切酶对纯化回收的PCR产物和pET28a载体进行双酶切,在T4 DNA Ligase的作用下连接转化至大肠杆菌BL21中,菌液PCR 鉴定阳性克隆,抽提其重组质粒进行双酶切鉴定并测序。
1.2.3.2 在大肠杆菌中的表达 将测序正确的阳性克隆接种于LB培养基中扩大培养,待菌液OD600至 0.8 时,加入终浓度为1 mmol·L-1的IPTG诱导表达,分别收集0、1、2、3、4、6、8 h的菌体蛋白,以确定最佳诱导时间;大量表达重组蛋白经3次冻融,超声破碎后,分别收集上清和包涵体;将包涵体洗涤溶解后,用His-bind镍柱亲和层析法纯化蛋白,梯度透析进行蛋白复性,SDS-PAGE 电泳分析收集的菌体蛋白和纯化的重组蛋白。
1.2.4 重组蛋白rSjELAV-like 1多克隆抗体的制备 将50 µg纯化的重组蛋白rSjELAV-like 1与等量完全弗氏佐剂乳化,皮下注射免疫小鼠,增强免疫用不完全弗氏佐剂,每次免疫间隔2周,共免疫3次。第3次免疫后7 d,眼眶采血,低速离心分离得小鼠抗rSjELAV-like 1血清。
1.2.5 Western blotting检测 将IPTG诱导前和诱导4 h后的菌体蛋白或日本血吸虫全虫可溶性蛋白进行SDS-PAGE 电泳,低温转移至硝酸纤维素膜(NC)上,以日本血吸虫全虫可溶性蛋白免疫小鼠血清或小鼠抗rSjELAV-like 1血清作为一抗,正常小鼠血清作为对照,4℃孵育过夜,以HRP标记的山羊抗小鼠IgG作为二抗,室温孵育45 min,增强型HRP-DAB显色观察。
1.2.6 荧光定量PCR 分别提取不同时期、不同状态的虫体总RNA,测定浓度,按照PrimeScriptTM RT reagent Kit说明书反转录为 cDNA。根据SjELAV-like 1基因序列设计并合成上下游引物SjELAV-like 1-b,预期扩增片段长度108 bp,并以Sjβ-tublin为内参,预期扩增基因片段长度为234 bp,引物使用浓度为10 pmol(表1)。按照SYBR® Premix Ex TaqTMⅡ说明书,采用荧光染料法进行荧光定量PCR,每个反应均做三孔重复。利用ABI 7500 Software v2.0.5软件分析结果。
1.2.7 间接免疫荧光试验 取日本血吸虫成虫,制成8 μm的冰冻切片,于4℃用丙酮固定30 min后,用5% BSA封闭 2 h。以小鼠抗rSjELAV-like 1血清作为一抗,正常小鼠血清作为对照,4℃孵育过夜,Alexa Fluor® 488 goat anti-mouse IgG作为荧光二抗,室温孵育45 min,10 µg·mL-1 DAPI室温避光复染 5 min,置荧光显微镜下观察。
1.2.8 RNAi试验
1.2.8.1 siRNA的筛选 根据SjELAV-like 1基因序列设计siRNA S1和S2,长度为21 nt,同时设阴性对照siRNA NC,由上海吉玛制药技术有限公司合成(表1)。12只BALB/c小鼠,随机平均分为4组,S1、S2、NC和PBS组,按1.2.1中的方法感染小鼠,感染后22 d,小鼠尾静脉注射1OD S1、S2、NC或等体积的PBS。48 h后剖杀小鼠,肝门静脉灌注法冲虫并收集虫体,提取各组虫体总RNA,反转录为cDNA,以之为模板,qRT-PCR检测干扰效果。
1.2.8.2 siRNA长期干扰 8只BALB/c小鼠,随机平均分为2组,小鼠感染后14 d,选择干扰效果好的siRNA,小鼠尾静脉注射1OD siRNA或NC,每4 d干扰一次,共干扰7次,至41 d时收集虫体并计数,qRT-PCR检测干扰效果。
1.2.8.3 肝组织虫卵计数 收集肝脏并称重,加入PBS,用匀浆机混匀后,定容至20 mL,取1 mL肝脏匀浆液,加入等体积10 % NaOH(W/V),56℃水浴锅中消化2 h,消化完全后混匀取5份50 μL 样品,镜检计数虫卵,计算减卵率。
肝减卵率=(对照组平均每克肝脏荷卵数-处理组平均每克肝脏荷卵数)/对照组平均每克肝脏荷卵数×100%
1.2.8.4 毛蚴计数 取4 mL 肝脏匀浆液于细颈平底烧瓶中,加入去氯水,并用一薄层棉花覆盖在液面下5 cm处,28℃孵化4 h后收集棉花上层清液,转移至15 mL 离心管中,加入50 μL碘酊染液固定毛蚴,4 000×g离心5 min,吸去上清,定容至2 mL,混匀取5份100 μL 样品,镜检计数尾蚴,计算减孵化率。
减孵化率=(对照组平均孵化率-处理组平均孵化率)/对照组平均孵化率×100%
1.2.9 电镜观察
1.2.9.1 扫描电子显微镜(SEM)观察 将长期干扰试验中收集的雌、雄虫体用PBS洗涤后,4℃置于4%戊二醛中固定24 h。固定好的标本经0.1 mol·L-1 PBS漂洗3次(15 min/次),1%锇酸固定2 h,0.1 mol·L-1 PBS漂洗3次(15 min/次),30%、50%、70%、80%、90%系列浓度乙醇脱水分别20 min,100%乙醇脱水2次(20 min/次),真空干燥,用离子溅射仪喷金后,用JEOL JSM-6380LV电镜对虫体作扫描电镜观察。
1.2.9.2 透射电子显微镜(TEM)观察 取上述固定后的雌、雄虫体,经PBS洗涤后,1%锇酸固定2 h,依次在50%乙醇、70%乙醇、90%乙醇、90%乙醇+90%丙酮(1﹕1)、90%丙酮、100%丙酮中脱水20 min,纯丙酮:包埋液按3﹕1、1﹕1和1﹕3,室温分别浸泡2 h、4 h和37℃过夜;将虫体置入包埋液中,60℃烘箱内24 h;LEICA-UC7型超薄切片机切片,醋酸铀和柠檬酸铅双染,FEI-T12型透射电镜观察。
1.2.10 统计学分析 采用 SPASS 22.0软件(IBM)对数据进行统计学分析。对有3个数值以上的样本数据进行方差分析,求标准差;对两组以上数据进行t检验,分析各组数据之间的差异是否显著。
2 结果
2.1 SjELAV-like 1基因序列的获得与分析
通过5′RACE及3′RACE扩增获得长为1 797 bp 的基因序列,序列分析发现,该序列有终止码,含有poly A尾,其中编码区1 533 bp,编码510个氨基酸,理论分子量为55.2 kD,等电点6.63。该序列编码的多肽含12个N端糖基化位点和RRM保守结构域,无信号肽和跨膜结构域。NCBI核苷酸比对结果显示该基因与埃及血吸虫ELAV-like(Gene Bank登录号:XM_012944479.1)和曼氏血吸虫ELAV-like 1(Gene Bank登录号:XM_018799857.1)分别有89%和87%的同源性,故将其命名为SjELAV-like 1,并提交至NCBI,Gene Bank登录号:MG515727。2.2 SjELAV-like 1的克隆、表达及纯化
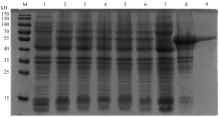
PCR扩增已知SjELAV-like 1编码区,琼脂糖凝胶电泳结果显示单一目的条带,与已知序列大小相符(图1)。SDS-PAGE 结果显示,重组质粒在大肠杆菌 BL21中成功表达,4 h达到最高表达量,且表达的蛋白主要以包涵体的形式存在;用His-bind镍柱亲和层析法获得较纯的重组蛋白,分子量约为55.2 kD左右,与预期大小相符(图 2)。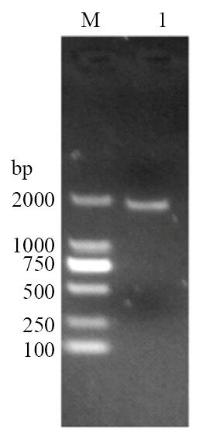 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图 1SjELAV-like 1 PCR产物核酸凝胶电泳
M:DL2000 DNA marker;1:SjELAV-like 1 PCR 产物
-->Fig. 1Agarose gel electrophoresis of PCR products of SjELAV-like 1 gene
M:DL2000 DNA marker; 1: PCR products of SjELAV-like 1 gene
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2SDS-PAGE分析重组蛋白SjELAV-like 1
M:蛋白 marker;1,2,3,4,5,6:IPTG诱导0,1,2,3,4,6 h后重组蛋白SjELAV-like 1的表达;7:上清;8:包涵体;9:纯化的重组蛋白SjELAV-like 1
-->Fig. 2Recombinant protein SjELAV-like 1was analyzed by SDS-PAGE
M: Protein marker; 1, 2, 3, 4, 5, 6: Expressing of rSjELAV-like 1 at 0, 1, 2, 3, 4 and 6 hour after induced by IPTG; 7: Supernatant; 8: Inclusion bodies; 9: Purified rSjELAV-like 1
-->
2.3 SjELAV-like 1蛋白的免疫原性检测
以全虫可溶性蛋白抗血清为一抗,Western blotting分析重组蛋白SjELAV-like 1在大肠杆菌中的表达,结果显示在55.2 kD 位置出现单一条带(图3-A),且与重组蛋白分子量大小相符,表明重组蛋白具有良好的免疫原性。利用本研究中制备的重组蛋白抗血清,以正常小鼠血清为对照,Western blotting 分析全虫可溶性蛋白,结果显示,以小鼠抗rSjELAV-like 1血清作为一抗,110 kD处有一明显的识别条带(图3-B),说明该蛋白在日本血吸虫体内的分子量为110 kD左右,大于预测分子量,这可能是糖基化位点增加其分子量,该蛋白无信号肽,也可能是由于未获得该基因的5′末端;阴性对照组在110 kD 处未有条带出现,表明重组蛋白具有良好的反应原性。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3Western blotting检测重组蛋白SjELAV-like 1的免疫原性和反应原性
(A)重组蛋白SjELAV-like 1免疫原性分析。M:预染蛋白marker;1:IPTG诱导前的表达;2:IPTG诱导4 h后的表达。(B)重组蛋白SjELAV-like 1反应原性分析。M:预染蛋白marker;1:小鼠抗rSjELAV-like 1血清为一抗;2:正常小鼠阴性血清为一抗
-->Fig. 3The immunogenicity and immunoreactivity of rSjELAV-like 1were detected by Western blotting
(A) Immunogenicity analysis of rSjELAV-like 1. M: Prestrain protein marker; 1: Expressing before IPTG induced; 2: Expressing after IPTG induced 4 h. (B) Immunoreactivity analysis of rSjELAV-like 1. M: Prestrain protein marker; 1: Anti-rSjELAV-like 1 mouse serum as primary antibody; 2: Negative mouse serum as primary antibody
-->
2.4 荧光定量分析SjELAV-like 1表达情况
结果表明,SjELAV-like 1在日本血吸虫不同时期中均有表达,25 d时表达量较高(图4-A)。在不同时期合抱分开的雌、雄虫体内,该基因在雌虫体内18 d时表达量最高,随后呈下降趋势,而在雄虫体内的表达量相对稳定(图4-B)。在不同感染状态的25 d 雌、雄虫体内,SjELAV-like 1的表达在单性感染的25 d发育阻遏雌虫体内显著高于混合感染的25 d正常发育雌虫(P<0.01),而在雄虫体内无此差异表达现象(图4-C)。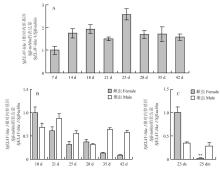 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图 4qRT-PCR检测 SjELAV-like 1在日本血吸虫体内的表达情况
A. 在不同发育阶段的表达。7,14,18,21,25,28,35和42 d:在8个时期虫体内的表达;B. 在不同时期和性别的表达。18,21,25,28,35和42 d:在6个时期合抱分开的雌、雄虫体内的表达;C. 在不同感染阶阶段和性别的表达。25ds:在单性感染的25d 虫体内的表达;25dm:在混合感染的25 d 虫体内的表达
-->Fig. 4Expressing situations of SjELAV-like 1 in S. japonicum were detected by qRT-PCR
A. Expressing situations at different developmental stages. 7, 14, 18, 21, 25, 28, 35, 42 d: Expressing in worms of eight stages; B. Expressing situations at different stages and in different sexes. 18, 21, 25, 28, 35, 42 d: Expressing in males and females from six stages of paired worms; C. Expressing situations at different infected conditions and in different sexes. 25ds: Expressing in 25 day worms from single sexual infected mice; 25dm: Expressing in 25 day worms from mixed sexual infected mice
-->
2.5 SjELAV-like 1在虫体内的定位
冰冻切片(8 μm)用小鼠抗rSjELAV-like 1血清或小鼠阴性血清作为一抗,荧光显微镜下可观察到Alexa Fluor® 488标记的山羊抗小鼠 IgG 二抗发出的绿色荧光,DAPI复染细胞核后发出的蓝色荧光,免疫荧光染色结果表明SjELAV-like 1蛋白主要分布在虫体表膜,虫体实质也有少量分布(图5)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5SjELAV-like 1蛋白的免疫组织定位
A,B:小鼠抗rSjELAV-like 1血清为一抗;C,D:正常小鼠阴性血清为一抗。t:体被;p:实质。与对照组相比,试验组特异性荧光主要分布于虫体体被,少量分布于虫体内部实质组织,试验组箭头所指荧光为蛋白分布的部位
-->Fig. 5Immunolocalization of SjELAV-like 1 in adult worm of S. japonicum (200×)
A, B: Anti-rSjELAV-like 1 mouse serum as primary antibody; C, D: Negative mouse serum as primary antibody. t: tegument;p: parenchyma. Compared with the control group, experimental group specific fluorescence was mainly distributed in the tegument of worms, only a small amount of distributed in part of the parenchyma. The arrows indicate the location of the protein distribution in the experimental group
-->
2.6 siRNA干扰试验
通过小鼠尾静脉注射不同的siRNA,利用qRT- PCR分析各组中SjELAV-like 1相对内参基因Sjβ-tublin的表达量时发现,S2相对PBS组和NC组,SjELAV-like 1的表达下降75%左右,而S1无显著性差异(图6-A)。S2长期干扰发现,S2组相对NC组,SjELAV-like 1的表达下降70%左右(图6-B)。与NC组相比,干扰组小鼠肝脏减卵率达58.27%(P<0.05),雌虫对肝脏卵贡献率降低40.49%(P<0.01),虫卵减孵化率达74.58%(P<0.01)(表2)。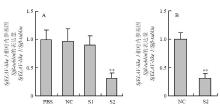 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6qRT-PCR检测干扰效果
A. 最佳干扰效果siRNA的筛选;B. S2体内长期干扰。PBS:空白对照;NC:阴性对照siRNA;S1:siRNA 1;S2:siRNA 2
-->Fig. 6Interference effects were detected by qRT-PCR
A. Selection of siRNA with a better interference effect; B. Long-term interference by S2 in vivo. PBS: Blank control; NC: Negative control siRNA; S1:siRNA 1; S2:siRNA 2
-->
Table 2
表2
表2RNA干扰后的肝脏减卵率和卵胚减孵化率
Table 2Liver egg and egg hatching reduction rate after RNAi
| 组别 Group | 平均卵负荷/克肝脏 Average egg burden/gram liver (x±s) (% reduction) | 平均肝卵负荷/条雌虫 Average egg burden/female worm(x±s) (% reduction) | 孵化率 Hatching rate (% reduction) |
|---|---|---|---|
| NC | 29990.97±7804.32 | 3561.4202±298.78436 | 40.56±5.25 |
| S2 | 12515.61±2313.164 | 2115.7648±473.02668 | 10.31±2.83 |
| (58.27%*) | (40.59%**) | (74.58%**) |
新窗口打开
2.7 电镜观察RNAi结果
2.7.1 SEM 小鼠体内干扰后,收集各组虫体,利用扫描电镜观察干扰对虫体形态学的影响,结果发现,干扰组(图7-A-D)与对照组(图7-E-H)相比,虫体结构发生了明显变化。正常血吸虫雄虫的抱雌沟起始部腹侧由突起的褶脊和凹陷组成,其上分布有许多小的泡状物,呈细颗粒状,而干扰后,血吸虫突起的褶脊塌陷,稍有萎缩,凹陷不明显,失去立体结构,呈现扁平状,表面小颗粒泡状物消失(图7-A,E);正常雄虫的抱雌沟中段背侧体壁表面平整无褶嵴,条索状皮嵴紧密联结,排列整齐,其中有半圆形感觉乳突存在,而干扰后,血吸虫条索状皮嵴间隙增大,表面呈不规律的凹凸状(图7-B,F);正常雄虫的后段体壁表面无褶嵴,布满凹陷,其中分布有蒂乳突,排列成网格状,而干扰后,虫体体壁突起肿胀变平,排列不规则,有部分融合,大部分网格状结构消失(图7-C,G);正常血吸虫雌虫中段体壁表面几乎无褶脊,其中分布有小而短的体棘,而干扰组雌虫表皮间隙稍有增大,表面体棘变少变钝(图7-D,H)。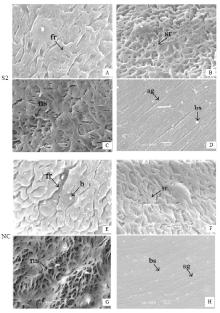 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7扫描电镜观察干扰后虫体体被
A-D:S2干扰;E-F:阴性对照。A,E:抱雌沟起始部腹侧体壁;B,F:雄虫中段背侧体壁;C,G:雄虫后段体壁;D,H:雌虫中段体壁。b:泡状物;fr:褶脊;sr:皮脊;ns:网状结构;bs:体棘;sg:体表间隙。与对照组相比,干扰组抱雌沟起始部腹侧体表泡状物消失,褶脊塌陷(A,E),体壁背侧中段条索状皮脊排列疏松(B,F),体壁后段网状结构消失(C,G),雌虫体壁中段体表组织间隙增大,体棘减少、变钝(D,H)
-->Fig. 7SEM observation of the tegument structures of worms after RNAi
A-D: S2 interference; E-F: Negative control. A, E: The beginning of the ventral body wall of gynaecophoral canal; B, F: The mid-portion of the dorsal body wall of males; C, G: The posterior portion of the body wall of males; D, H: The mid-portion of the body wall of females. b:Bubbles;fr:Fold ridge;sr:Surface ridge;ns:Network structure;bs:Body spines;sg:Surface gap. Compared with control group, in the beginning of the ventral body wall of gynecophoral canal of the male the surface bubble disappeared in the interference groups and the surface ridge collapsed (A, E), in the mid-portion of the dorsal body wall of the male the funicular surface ridge arranged loosely (B, F) and in the posterior portion of the body wall the network structure disappeared (C, G), in the mid-portion of the body wall of the female the surface gap increased and the body spines were dull (D, H)
-->
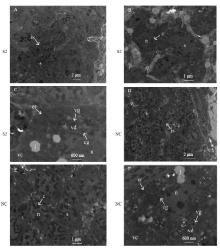
2.7.2 TEM 将干扰后收集的虫体用于观察雌、雄虫体的生殖腺,透射电镜下观察发现,干扰组(图8 A-C)与对照组(图8 D-F)相比,雌、雄虫体的生殖细胞明显发生了改变。正常雄虫睾丸内精母细胞(s)排列整齐紧密,呈规则的圆形或椭圆形,细胞核圆,核周围有染色质(c),S2干扰后,精母细胞数目减少,细胞间隙(is)增大(图8-A,D),且细胞肿大呈不规则的长椭圆形或梭形,大部分染色质消失(图8-B,E);正常雌虫卵黄腺内有卵黄细胞(vc),成熟卵黄细胞内含有卵黄滴(vd)、卵黄球(vg)和脂滴(l),卵黄滴包含于卵黄球内,数目较多,呈大小较均一的卵圆形,内质网(er)结构清晰,有规律的分布于细胞间质,皮质颗粒(cg)排列整齐,而干扰后的卵黄细胞,卵黄球数目减少,其包含的卵黄滴较少,且大小不一,形状不规则,内质网肿胀,界限模糊,且皮质颗粒在细胞内分布不规律(图8-C,F)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8透射电镜观察干扰后虫体生殖腺
A-C: S2干扰;D-F: 阴性对照。A,B,D,E:雄虫精母细胞;C,F:雌虫卵黄细胞。s:精母细胞;is:细胞间隙;c:染色质;er:内质网; vc:卵黄细胞;vg:卵黄球;vd:卵黄滴; l:脂滴;cg:皮质颗粒;n:细胞核。与对照组相比,干扰组精母细胞数目少(A,D),且细胞内染色质减少(B,E),卵黄细胞内卵黄球少,卵黄球内卵黄滴少,内质网肿大,皮质颗粒排列散乱(C,F)
-->Fig. 8TEM observation of the reproductive glands of worms after RNAi
A-C: S2 interference; D-F: Negative control. A, B, D, E: Spermatocyte of males; C, F: Vitelline cells of females. s: Spermatocyte; is: Intercellular space; c: Chromatin; er: Endoplasmic reticulum; vc: Vitelline cells; vg: Vitelline globules; vd: Vitelline droplets; l: Lipid droplets; cg: Cortical granule; n: Nucleus. Compared with the control group, the number of spermatocytes in the interference group was small (A, D), and the intracellular chromatin was reduced (B, E). There were fewer vitelline globules in the vitelline cells, less vitelline droplets in the vitelline globules, and the endoplasmic reticulum was enlargement, the cortical particles were scattered (C, F).
-->
3 讨论
ELAV-like家族基因编码的RNA结合蛋白存在于大多数真核细胞中,它在基因转录后调控中起重要作用,其通过可变性剪接和多聚腺苷酸化决定mRNA的时空表达,从而发挥它们的生物学功能[18]。研究还发现,RNA结合蛋白在细胞代谢过程中起着重要作用,它通过调控RNA调节子引起基因表达水平变化或突变,导致炎症、癌症等疾病的发生[19,20]。人类中与ELAV-like 1同源的HuR在机体各组织中广泛存在,有研究揭示:HuR蛋白在细胞分裂、细胞衰老、免疫细胞激活及肌肉分化等生命活动中起重要的调控作用,其功能异常与炎症、肿瘤等疾病的发生发展密切相关[21]。笔者前期研究发现SjELAV-like 1在日本血吸虫25 d发育阻遏雌虫体内高表达,提示该基因对日本血吸虫雌虫的生长发育有一定的影响(未发表)。qRT-PCR对 SjELAV-like 1 在日本血吸虫不同时期、不同状态,qRT-PCR对 SjELAV-like 1 在日本血吸虫不同时期、不同状态表达情况分析发现,该基因在不同时期雄虫体内的表达没有明显差异,应属于组成型表达,其在雄虫体内的表达情况也说明了这一点;但在雌虫体内,随着其生殖发育的完善该基因的表达逐渐下降,该基因在发育阻遏雌虫体内的表达显著高于同时期正常发育的雌虫,这预示着该基因产物可能有抑制雌虫成熟的作用。由于在雌虫体内该基因的表达逐渐下降,在发育早期,其在雌虫体内的含量高于雄虫,成熟后,其在雄虫体内的含量高于雌虫,可以推测,其在不同发育阶段的表达量早期取决于雌虫,后期由雄虫决定。在正常发育进程中,基因和蛋白的表达差异取决于其发育的需要,SjELAV-like 1在雌虫体内差异表达的表象,说明该基因应对血吸虫雌虫的生长发育有重要的影响。
血吸虫不仅可以通过体被从宿主体内获取营养,而且直接与宿主免疫系统接触,诱导产生免疫应答,许多表膜及表膜相关抗原是宿主保护性免疫反应的靶点,研究已发现多种膜表面蛋白可作为疫苗分子[22,23,24,25]。成熟期雌虫大部分位于雄虫抱雌沟内,因此,雄虫体被蛋白是激发宿主免疫系统的主要来源。本研究发现SjELAV-like 1蛋白主要定位于日本血吸虫体被,且具有良好的免疫原性;SjELAV-like 1在雄虫体内稳定表达,在虫体成熟后期主要来自于雄虫,这些皆为SjELAV-like 1作为候选疫苗分子的研究提供理论依据。
RNAi是发生在mRNA水平上的一种基因沉寂现象,即将外源性双链RNA引入细胞后引起细胞内与其同源的mRNA特异性降解,使该基因在RNA水平上被关闭而致其不表达[26]。筛选良好干扰效果的siRNA是进行干扰试验的关键,本研究中选取的S2对SjELAV-like 1的表达具有显著的沉默效果。由于SjELAV-like 1在14 d时的表达水平明显升高,选择在14 d时进行干扰。qRT-PCR检测发现干扰后虫体SjELAV-like 1的表达显著降低,且干扰后肝脏减卵率、雌虫对肝卵贡献率和卵胚孵化率均显著降低,说明该基因对日本血吸虫雌虫的生殖发育有重要作用。
血吸虫体被在摄取营养和免疫防御等方面有很重要的作用,它是虫体和宿主物质交换的场所,也是宿主对血吸虫感染免疫应答最直接的部位[27]。血吸虫在宿主体内生长发育过程中,不同发育阶段虫体都会出现一些体被蛋白的更换,每个阶段都呈现一些特异性或差异表达的虫体抗原,使宿主的免疫应答难以发挥免疫杀伤作用[28]。本研究通过特异性靶向干扰SjELAV-like 1基因的表达,结果造成虫体结构异常,会影响虫体从宿主获取营养。虫体体壁结构的改变及体被抗原的改变,能够使其免疫逃避机制紊乱,宿主或可通过机体的免疫应答对虫体产生一定的杀伤作用。
血吸虫在宿主体内营雌雄合抱生活,在合抱的雌、雄虫之间具有营养性和信号性物质的交换,雄虫为雌虫提供营养或能够调节雌虫的生长、代谢、性成熟的物质,因此,控制血吸虫雌雄合抱是控制血吸虫病的一种策略[29,30]。本研究通过雌雄合抱数目计数发现,实验组和对照组无显著性差异,可能与所用实验动物数目较少有关,也可能是该基因沉默并不影响雌雄合抱。血吸虫雌雄合抱,一般是前后端分别相对应的位置,这可能是雌、雄虫通过体被分布的感觉乳突或分泌型泡状物结构以识别合抱正确的位置,与雄虫直接接触的雌虫出现卵黄腺及卵巢的发育,促使卵黄细胞和卵细胞的形成[31]。SjELAV-like 1的干扰导致雄虫体被结构异常,可能会使其感觉乳突、信号性感受器不敏感,影响其对雌虫识别与信息传递,即使合抱的雄虫可能也无法提供雌虫生殖发育所需的物质,从而导致雌虫卵黄腺发育不良,卵黄细胞中的卵黄球及卵黄球内的卵黄滴减少,且大小不一。皮质颗粒广泛存在于动物界的雌性生殖细胞中,与受精卵的形成有关[32,33]。研究发现,血吸虫雌雄合抱后的雌虫卵黄细胞中出现典型的皮质颗粒[34]。皮质颗粒呈圆形,一般在同一区域成串排列,SjELAV-like 1干扰组卵黄细胞中的皮质颗粒大小不一,形状不规则,排列无规律,与对照组有明显区别。内质网是参与细胞生命活动的重要细胞器,而干扰后卵黄细胞中的内质网肿胀,界限不清。血吸虫雄虫精母细胞有较多染色质均匀分布,与细胞分裂、增殖有关,而干扰组雄虫精母细胞中绝大多数染色质消失,且细胞数目减少、异常肿大,排列疏松、间质增宽。
4 结论
成功克隆、表达了SjELAV-like 1基因,该基因沉默引起日本血吸虫形态结构的改变和生殖细胞亚细胞结构发生病理性变化,表明该基因表达水平的降低对日本血吸虫生殖发育有阻碍作用,可为其作为抗血吸虫病候选疫苗的分子或药物靶标提供理论依据。The authors have declared that no competing interests exist.
