0 引言
【研究意义】青花菜(Brassica oleracea var. italica)又名西兰花、绿菜花等,十字花科芸薹属甘蓝类蔬菜变种,一、二年生植物。青花菜营养全面,富含多种矿物质和维生素,同时富含4-甲酰基亚磺酰基丁基硫甙(glucoraphanin,GRA),4-甲酰基亚磺酰基丁基硫甙能被位于液泡中的黑芥子酶水解生成异硫氰酸盐类物质——莱菔硫烷(sulforaphane,SF或SFN)。流行病和临床医学研究表明,莱菔硫烷能够显著降低肝癌、胃癌、肺癌、膀胱癌、乳腺癌和结肠直肠癌等多种癌症的患病率[1-7],在降低糖尿病、高血压和心脑血管疾病等发病率方面具有很好的医学前景[8-11]。据报道,青花菜不同器官中莱菔硫烷含量差异较大,不同基因型材料也存在显著差异,种子中莱菔硫烷含量最高,芽苗在前期(5—7 d)含量较高,后期降低,花球中莱菔硫烷含量高于幼茎,叶片最低。另有研究表明,青花菜叶片中莱菔硫烷含量处于较高水平,这可能由不同发育时期的样品和基因型造成[12-18]。拟南芥研究结果表明,CYP79F1为莱菔硫烷代谢的上游调控基因,在莱菔硫烷的合成方面可能具有重要作用[19-22]。因此克隆青花菜该基因全长,分析其在青花菜不同发育时期各器官中的表达量与莱菔硫烷含量的相关性,将为进一步阐明青花菜莱菔硫烷含量分布的器官多样性提供科学依据,对青花菜不同器官的科学利用和新品种选育都具有重要意义。【前人研究进展】拟南芥硫甙代谢研究表明,CYP79F1能够将长链或短链甲硫氨酸催化形成相应的醛肟,尤其是短链脂肪酸(1C-4C)的合成尤为重要[19,21]。莱菔硫烷的前体为4-甲基亚磺酰基丁基硫甙,为短链脂肪酸合成途径,因此,CYP79F1在调控4-甲基亚磺酰基丁基硫甙的生成方面尤为重要。另外,CYP79F1过表达能够调控拟南芥株高(变矮)和植株大小,且与根部发育也具有直接的调控作用[23-25]。王红波等[26]通过转基因技术研究指出,CYP79F1的过表达能够显著增加4-甲基亚磺酰基丁基硫甙含量,吲哚组硫甙成分则相对降低,暗示该基因与脂肪族硫甙和莱菔硫烷代谢密切相关。CYP79F1过表达能够增加脂肪族硫甙成分在拟南芥上同样得到了证实[25,27-28]。【本研究切入点】青花菜富含抗癌活性成分莱菔硫烷已逐渐被大众认知,青花菜不同器官中莱菔硫烷含量多样性分布的原因目前尚未见报道。【拟解决的关键问题】从青花菜中克隆获得CYP79F1全长,分析其家族序列特征,研究其在青花菜不同发育时期各器官中的表达特性与莱菔硫烷含量相关性,为深入研究青花菜不同器官中莱菔硫烷代谢和转运机理奠定基础。1 材料与方法
试验于2015年8月至2017年7月在中国农业科学院蔬菜花卉研究所进行。1.1 试验材料
青花菜材料B691为纯合自交系材料(自交16代),由中国农业科学院蔬菜花卉研究所甘蓝青花菜课题组选育。试验材料于2015年8月中旬定植于露地,每份材料设置3次重复,每重复种植11株,行间距为45 cm×55 cm。2015年10月初开始对试验材料的根、茎、叶、发育时期的花球进行取样,待植株移栽到温室后,对抽薹期的花蕾(顶端蕾、成熟蕾、开花前1 d蕾和花)进行取样。相同材料保存2份,一份于超低温保存后真空冷冻干燥,机械粉碎后密封保存;另一份提取总RNA进行定量表达分析。
1.2 青花菜CYP79F1克隆
青花菜总RNA的提取采用Trizol法,RNA提取试剂盒和反转录试剂盒(MMLV反转录试剂盒)均由日本TaKaRa公司购置。按照TaKaRa试剂盒要求除去痕量DNA的总RNA,进行cDNA第一条链的合成。5′-RACE cDNA第一链的合成:根据Invitrogen公司Gene- RacerTM试剂盒要求进行总RNA的脱磷、脱帽处理,然后在5′端加上RNA Oligo,利用SuperScript反转录酶Ⅲ,以基因特异性引物进行反转录(表1)。3′-RACE cDNA第一链合成仍参照Gene-RacerTM试剂盒要求进行,所需引物信息见表1。cDNA核心克隆则参照报道的Brassica已知序列(Genebank:KP693683)设计核心引物(表1)。反应体系为:Taq 2X Master Mix(百泰克)25 μL,正向引物(10 μmol∙L-1)1 μL,反向引物(10 μmol∙L-1)1 μL,cDNA模板(80—100 ng)1 μL,双蒸水22 μL,共50 μL。PCR扩增条件为:95℃变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸45 s,35个循环;72℃延伸10 min。从反应产物中取10 μL在1%的琼脂糖凝胶上进行电泳分析。
将所有扩增产物进行1.5%TAE琼脂糖凝胶电泳检测后,使用1%琼脂糖凝胶电泳,回收PCR产物并与pEASY-Blunt Zero Cloning载体连接,构建重组质粒转化E. coli DH5α感受态细胞,筛选阳性克隆,送至华大生物技术有限公司测序,将测序结果与保守区序列进行比对拼接。
Table 1
表1
表1 CYP79F1扩增引物信息
Table 1The detail message of primers for cloning CYP79F1 gene
| 基因 Gene | 引物序列 Primer sequence (5′-3′) |
|---|---|
| 通用引物 Universal primer | GATCGCCCTTCTACGTCGTAT |
| 3′ RACE 外部引物 3′ RACE outer primer | GACAACCTCCTTGCTTACCTTCTC |
| 3′ RACE 内部引物 3′ RACE inner primer | GAGGGTTTATGGTTACGCTGTGAC |
| 5′ RACE 外部引物 5′ RACE outer primer | GGCCACGCGTCGACTAGTACGGGIIGGGIIGGGIIG |
| 5′ RACE 内部引物5′ RACE inner primer | GGCCACGCGTCGACTAGTAC |
| 通用引物Universal primer | GATCGCCCTTCTACGTCGTAT |
| 3′ RACE 特异引物1 3′ RACE specific primer 1 | GATCGCCCTTCTACGTCGTAT |
| 3′ RACE 特异引物2 3′ RACE specific primer 2 | GAAGGAGTTAGACGAAGTGGTGGGA |
| 5′ RACE 内部引物1 5′ RACE specific primer 1 | CGGAGGCAATCACAAATCAT |
| 5′ RACE 内部引物2 5′ RACE specific primer 2 | AGACGAACCGTTGTATGACA |
新窗口打开
1.3 生物信息学分析
利用DNAMAN 6.0进行基因拼接、氨基酸序列分析和蛋白二级结构预测,在线NCBI进行序列处理(https://www.ncbi.nlm.nih.gov/tools/vecscreen/,Vecscreen)与分析,Blastx和Blastp分析,蛋白质一级结构分析(http://web.expasy.org/protparam/,ProtParam)和修饰分析(http://myhits.isb-sib.ch/ cgibin/motif_scan,MotifScan),跨膜预测分析(http:// www.cbs.dtu.dk/services/TMHMM-2.0/,TMHMM),系统进化树构建在线分析(NCBI),亚细胞定位在线分析(https:// omictools.com/wolf-psort-tool,WoLF PSORT)。1.4 青花菜CYP79F1表达分析
利用软件Primer Premier 5.0软件设计扩增引物,引物序列为双向引物为F(5′-3′):GTCACGCCAGACG AAATCAAA和R(5′-3′):GCACAAGCCTGTCTTTT CCAACT,目标长度为169 bp,内参基因为actin-12,引物序列F(5′-3′):GGCTCTATCTTGGCTTCTCTCA GT和(5′-3′):CCAGATTCATCATACTCGGCTTT。参照TaKaRa SYBR® Green PCR Master Mix说明进行操作,在ABI 7500实时定量PCR仪上进行PCR扩增。反应体系为50 μL:25 μL SYBR® Premix,5 μL cDNA模板,双向引物各1 μL,1 μL Rox,加蒸馏水至50 μL。PCR反应程序为:95℃预变性30 s,95℃变性5 s,58℃退火30 s,40个循环,每样品各设置3次重复。反应完成后进行融解曲线和荧光值变化曲线分析,采用2-ΔΔCt法计算目的基因的相对表达情况。采用实时定量PCR时各样品加样量均为2 µL,然而由于受RNA浓度定量误差和RNA逆转录效率误差等影响,每个样品2 µL的cDNA含量并不完全相同,为校正此差异,使用内参基因(不同样品间表达量基本恒定)进行校正。根据Real-time PCR原始检测结果,按照2-△△ct相对定量法计算出各样品的目的基因相对定量结果 [16]。
1.5 莱菔硫烷含量的提取与HPLC分析
青花菜不同器官中莱菔硫烷含量的提取与HPLC分析参照李占省等[17,29]的方法进行。1.6 相关性分析与数据处理
利用统计学方法,将青花菜不同发育时期各器官中基因的表达量与莱菔硫烷含量进行相关性分析,具体采用Pearson相关性分析。试验数据采用Excel 2003进行基本处理,方差分析和卡方检验采用SPSS 17.0软件,试验结果用平均值±标准误(mean±SD,n=3)表示,one-way ANOVA用于显著性检验,多重比较采用Duncan’s新复极差法分析(P<0.05)。2 结果
2.1 青花菜CYP79F1全长克隆
根据PCR产物5′-RACE和3′-RACE扩增产物测序并拼接,长度为2 014 bp的序列(图1),前边包含62个非编码区,从63处开始翻译,到1 685 bp处终止,将拼接后的序列在线Blastx分析(NCBI),结果如图2所示,其中的小写字母通常被设定为没有三维结构的氨基酸。CYP79F1核心cDNA序列包含一个完整的1 620 bp的开放阅读框(open reading flame,ORF),5′端有62 bp的非翻译区(untranslate region,UTR),富含A和T,A(597)和T(541)的总含量达56.5%,G(459)和C(417)含量占总含量的43.5%。经DNAMAN 6.0分析和NCBI在线Blastx分析(图2),该基因编码区编码一条540个氨基酸残基的多肽,分子量61.434 kD,等电点8.29,pH 7.0时的带电荷数(ch)为6.63,3′端具有完整的Poly A尾巴。该基因检测到2个甲基化位点,DAM甲基化酶对应位点为GATC 2-A,DCM甲基化酶对应位点为CCWGG 2-C。该基因序列已在GenBank注册,登记号为MG012890。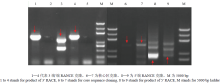 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1青花菜中CYP79F1全长克隆
-->Fig. 1The full length cloning of CYP79F1 in broccoli
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2CYP79F1与甘蓝型油菜blastx比对分析结果
-->Fig. 2The blastx result of CYP79F1 gene with Brassica napus
-->
2.2 CYP79F1编码蛋白质的特性分析
该基因编码区发现22个抗原肽段,其分值和长度变化分别为1.03—1.19和6—31个氨基酸。经氨基酸特性分析,构成蛋白质中共存在20种氨基酸,赖氨酸(Leu)含量最高(10.3%),其次是精氨酸(Arg)和谷氨酸(Glu),分别占6.9%,然后依次是甘氨酸(Gly)(6.5%)、异亮氨酸(Ile)和丙氨酸(Ala)(6.3%),色氨酸(Trp)含量最低,为1.5%。就构成氨基酸的特性而言,该蛋白包含82个强碱性氨基酸(H、K和R),66个强酸性氨基酸(D和E),240个疏水氨基酸(A、F、I、L、M、P、V和W)和152个极性氨基酸(C、G、N、Q、S、T和Y),预测该蛋白为亲水性蛋白(亲水平均值-0.11,疏水平均值-0.26)。
Blastp搜索显示,CYP79F1属于细胞色素家族P450超级家族,编码540个氨基酸。Motif Scan 分析显示,该蛋白存在细胞色素P450C半胱氨酸血红素-iron配体信号(Cytochrome P450 cysteine heme-iron ligand signature),位于第469—478氨基酸处。PROSITE数据库分析表明,该蛋白存在2处酰胺化位点(AMIDATION Amidation site),207—210和471—474;6处酪蛋白激酶II磷酸化位点(CK2_ PHOSPHO_SITE Casein kinase II phosphorylation site),246—249、307—310、318—321、344—347、458—461和509—512;4处N-豆蔻酰化位点(MYRISTYL N-myristoylation site),129—134、293—298、428—433和478—483。此外发现,6处蛋白激酶C磷酸化位点(PKC_PHOSPHO_SITE Protein kinase C),156—158、202—204、307—309、390—392、432—434和471—473;1处酪氨酸激酶磷酸化位点(TYR_PHOSPHO_SITE Tyrosine kinase phosphorylation site),434—442。
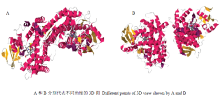
TMHMM显示,该蛋白为跨膜蛋白,存在2处跨膜区,第一个位于编码氨基酸7—35处,包含29个氨基酸;第二个位于编码氨基酸472—500处,包含29个氨基酸,其结构详见图3。该蛋白二级结构组成为:45%的H(alpha-helix)、6%的E(beta-sheet)和47%的C(loop或coil)。利用SWISSMODEL对青花菜CYP79F1蛋白的三级结构进行预测,详见图4。亚细胞定位预测位于细胞质中。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3CYP79F1蛋白跨膜结构预测
-->Fig. 3Prediction of transmembrane helices of CYP79F1 protein
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4CYP79F1蛋白的三级结构预测
-->Fig. 4Prediction of third structure of CYP79F1 protein
-->
2.3 CYP79F1 蛋白的同源比对分析
同源分析表明,该CYP79F1蛋白与十字花科作物中的甘蓝型油菜(B. napus)、野生甘蓝(B. oleracea)、芥蓝(B. oleracea var. alboglabra)、白菜(B. rapa)和萝卜(Raphanus sativus)等氨基酸序列高度同源,相似性分别为99%、99%、99%、97%和95%,其次是十字花科的菘蓝(Isatis tinctoria),又名北板蓝根,相似性为94%,这为分析两种基于该基因代谢中的相似成分与调控机理提供了依据[30]。2.4 CYP79F1的表达分析
定量表达分析显示,CYP79F1在青花菜的根和茎中表达量最高,其次是顶端蕾、开花前1 d蕾、成蕾、花、叶和花球,种子中该基因的表达量与抽薹期花中的表达量处于同一水平(图5)。从花蕾发育期可以看出,该材料自顶端蕾到花的发育过程中基本呈现逐渐降低的表达趋势,该结果已经多次验证并报道[16,31],暗示CYP79F1与花器官发育和激素代谢密切相关,其调控机理需要深入研究。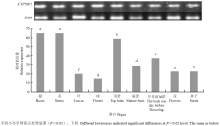 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5CYP79F1在青花菜不同器官中的表达分析
-->Fig. 5Expression analysis of CYP79F1 gene in different broccoli organs
-->
2.5 青花菜中莱菔硫烷含量HPLC分析
HPLC分析表明,青花菜不同发育时期各器官中莱菔硫烷含量差异显著(P<0.05)(图6)。结果表明,种子中莱菔硫烷含量最高,平均含量为4 855.64 mg∙kg-1 DW,与当前报道一致[14-18]。花器官发育时期总体含量处于较高水平,平均值为1 027.35 mg∙kg-1 DW,含量最高的为顶端花蕾(1 327 mg∙kg-1 DW),然后依次是成蕾(1 001.81 mg∙kg-1 DW)、开花前1 d蕾(994.39 mg∙kg-1 DW)和花(786.20 mg∙kg-1 DW),其余器官中,花球(456.45 mg∙kg-1 DW)高于幼茎(282.86 mg∙kg-1 DW),叶片(160.46 mg∙kg-1 DW)中莱菔硫烷含量处于较低水平,根中莱菔硫烷含量最低(17.73 mg∙kg-1 DW)。同时,莱菔硫烷含量检出值在花器官发育时期呈现出一定的变化规律,表现为顶端花蕾发育到花的过程中呈逐渐降低的趋势,顶端蕾中含量最高,是根中莱菔硫烷检出值的75倍,暗示莱菔硫烷含量合成与植物分化可能存在一定的关系。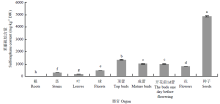 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6青花菜不同器官中莱菔硫烷含量HPLC分析
-->Fig. 6The content of sulforaphane in different broccoli organs by HPLC
-->
2.6 青花菜不同发育器官中莱菔硫烷含量与CYP79F1表达量相关性分析
Pearson相关性分析表明,CYP79F1表达量与根、茎、叶、花球、顶端蕾、成蕾、开花前1 d蕾、花和种子中莱菔硫烷生成量间的相关系数为-0.273,负相关性不显著(P=0.478)(表2)。为了明确顶端花蕾发育到花的过程中莱菔硫烷含量逐渐降低是否与CYP79F1表达量具有显著相关性,将该发育时期的莱菔硫烷含量与对应器官的基因表达量进行Pearson相关性分析。结果发现,两者呈显著正相关关系,相关系数为0.959(P=0.041)(表3)。表明CYP79F1在青花菜花器官发育中与莱菔硫烷的积累具有明显相关性,可能发挥了直接调控作用。Table 2
表2
表2不同器官中莱菔硫烷含量与基因表达量相关性分析
Table 2Pearson correlation between content of sulforaphane in different broccoli organs and gene expression
| 莱菔硫烷含量 Sulforaphane content | 基因表达量 Gene expression | |
|---|---|---|
| 莱菔硫烷含量 Sulforaphane content | 1 | -0.273 |
| - | 0.478 | |
| 基因表达量 Gene expression | -0.273 | 1 |
| 0.478 | - |
新窗口打开
Table 3
表3
表3抽薹期花蕾莱菔硫烷含量与基因表达量相关性分析
Table 3Pearson correlation between content of sulforaphane in bolting buds and gene expression
| 莱菔硫烷含量 Sulforaphane content | 基因表达量 Gene expression | |
|---|---|---|
| 莱菔硫烷含量 Sulforaphane content | 1 | 0.959* |
| - | 0.041 | |
| 基因表达量 Gene expression | 0.959* | 1 |
| 0.041 | - |
新窗口打开
3 讨论
CYP79F1在调控脂肪族硫甙合成方面发挥着重要作用,与青花菜中莱菔硫烷生成量密切相关,同时在植物发育过程中起着重要的调控作用[14,20-21,23]。目前,拟南芥中已经克隆该基因(AT1G16410),该基因属于细胞色素家族P450成员,在基因组中的长度为3 383 bp,其cDNA为1 200 bp。油菜中该基因位于基因组scaffold_526区域内,该scaffold DNA全长为436 263 bp。青花菜基因组不同于拟南芥和油菜,存在多倍化和重组事件,同时不同变种之间往往存在基因变异的可能,而青花菜中有关该基因与莱菔硫烷方面的研究鲜有报道。因此,本研究通过RACE技术,从青花菜中获得CYP79F1 mRNA全长为2 014 bp,同源比对结果表明,该序列与拟南芥、油菜基因相似性分别为86%和99%,与油菜亲缘关系更近,表明该基因在芸薹属异源四倍体基因组中能够稳定遗传,暗示了其在进化和重组中的保守性。经在线分析(NCBI),与该基因同源的还有芥蓝和野生甘蓝,其相似性均为99%,再次验证了该克隆的准确性和保守性[32]。目前,CYP79F1功能已在拟南芥和部分芸薹属作物中获得验证[19,21]。本研究预测青花菜中CYP79F1亚细胞定位于细胞质中,与当前报道一致,同时,CYP79F1编码蛋白为亲水性跨膜蛋白,存在2处跨膜区,各含有3个P450信号序列,含有2个信号肽序列,这与拟南芥上有关该基因在内质网上发挥功能的定位与结论一致[21,33]。此外,本研究揭示了该编码蛋白存在2处酰胺化位点,6处酪蛋白激酶II磷酸化位点,4处N-豆蔻酰化位点,6处蛋白激酶C磷酸化位点和1处酪氨酸激酶磷酸化位点,这方面研究尚未见报道,该发现为深入研究CYP79F1高级结构和功能修饰位点提供了依据和支持[34]。
本研究发现,CYP79F1在青花菜不同发育器官中存在明显的表达特异性,莱菔硫烷的生成量在不同器官存在多样性。在根中和茎中表达量较高,但相应器官中莱菔硫烷含量并不是处于较高水平,种子中莱菔硫烷含量处于最高水平,但其CYP79F1表达量并不高。相关性分析结果表明,青花菜发育不同发育时期的器官中,CYP79F1表达量与莱菔硫烷的生成量没有显著相关性,但在抽薹期发育的花蕾中则呈现出显著的正相关关系,暗示该基因在花器官发育过程中可能直接参与了莱菔硫烷的代谢调控,该发现也为少数报道该基因间接参与植物激素代谢和细胞分化途径提供了参考[35-37]。
由此可见,青花菜发育时期不同器官中莱菔硫烷含量多样性是一个复杂的调控网络和运输机制。本研究发现,CYP79F1在生殖器官中总体表达较为活跃,而在营养器官种呈现出不同的表达水平,营养器官中莱菔硫烷HPLC检测值明显低于生殖器官(花器官和种子),暗示CYP79F1在调控莱菔硫烷的生成量方面发挥了重要调控作用,但营养器官和生殖器官间是否存在莱菔硫烷的主动运输关系,还需要进一步验证。
此外,CYP79F1为脂肪族硫甙上游调控基因,尤其是能够直接调控3C和4C脂肪族硫甙生成,而对应的下游硫甙包括GRA、PRO、NAP等,这些硫甙成分与青花菜等十字花科蔬菜(作物)的风味、植保和营养密切相关,因此该基因可能在十字花科芸薹属作物中发挥了重要的调控作用[38-41]。本研究结论为深入研究CYP79F1与芸薹属作物硫甙成分与风味奠定了基础。CYP79F1与细胞分化和细胞增殖密切相关,这与拟南芥中报道的该基因能够调控拟南芥株高和大小的结论相一致 [36-37],也暗示了CYP79F1可能参与了多个代谢途径的调控。
4 结论
利用RACE技术从青花菜中获得了CYP79F1全长(2 014 bp),ORF为1 620 bp,编码540个氨基酸。该基因属于P450基因超家族,各含有3个P450信号序列,含有2个信号肽序列,属于亲水性跨膜蛋白,亚细胞定位于细胞质中,其编码的蛋白与油菜、芥蓝和野生甘蓝等芸薹属蔬菜具有高度同源性。CYP79F1在青花菜不同发育器官中存在明显的表达特异性,在营养器官根和茎中表达量最高,其次是花器官发育时期,总体处于较高水平,与花器官发育呈负相关关系。结合各时期发育器官中莱菔硫烷含量变化,推测该基因通过组织表达特异性,可能直接参与调控青花菜不同发育器官中莱菔硫烷的生成和积累。The authors have declared that no competing interests exist.
