0 引言
【研究意义】甘薯(Ipomoea batatas)是继小麦、水稻、玉米、马铃薯、大麦和木薯之后的世界第七大粮食作物,同时也是重要的饲料和轻工业原料[1,2,3]。病毒病是威胁甘薯生产的重要病害,全世界因病毒病造成的甘薯损失每年高达30%—50%,在中国每年造成的经济损失达40亿元[4,5]。甘薯羽状斑驳病毒(Sweet potato feathery mottle virus,SPFMV)是甘薯上的重要病毒,属于马铃薯Y病毒属(Potyvirus)成员,通过汁液或蚜虫以非持久性方式传播,在世界主要甘薯产区几乎均有发现[6,7,8]。SPFMV可侵染甘薯等8种旋花科植物,在植株不同的生长时期表现的症状也不相同,严重危害甘薯的产量和品质[9]。近年来,SPFMV在中国多省(市)均有发生,且分布地区呈逐年扩展的趋势[2-3,9]。因此建立一种简单、快速的检测方法对SPFMV的早期预警以及了解发病规律具有重要意义。【前人研究进展】2010年,张业辉等[10]建立了包括SPFMV在内的3种甘薯病毒的多重PCR检测方法,随后针对SPFMV的ELISA[11]、RT-PCR[2,11]、荧光定量RT-PCR[12,13]、反向斑点杂交[14]等检测方法被逐步建立。笔者实验室前期已通过生物学鉴定、电镜观察及RT-PCR等多种技术对山东地区的SPFMV等多种甘薯病毒进行了检测[2]。以上几种检测方法均为了解SPFMV的田间发病情况提供了技术保证。反转录环介导等温扩增技术(reverse transcription loop-mediated isothermal amplification,RT-LAMP)是2000年由Notomi 开发的一种新型核酸扩增方法,该技术针对目的序列设计4条引物,特异性识别6个序列区,利用DNA链置换聚合酶(BstDNA polymerase)在60—65℃恒温条件下进行高效扩增[15]。RT-LAMP已广泛应用于人类[16,17]、动物[18,19]、植物[20,21,22,23,24,25,26,27,28,29,30]病原菌的检测中,在粮食[20-22,27]、蔬菜[23,24,25,26]、果树[28]以及经济作物[29,30]的病毒病害检测工作中发挥了重要作用。乔奇等[27]建立了针对甘薯褪绿矮化病毒(Sweet potato chlorotic stunt virus,SPCSV)的RT-LAMP检测技术。迄今国内外还未见利用该技术检测SPFMV的报道。【本研究切入点】 现有RT-PCR和荧光定量PCR等分子检测技术虽然已有高特异性和灵敏度的特点,但需要特定的仪器和专业的实验人员来完成,不适用基层检测。血清学检测需要特异性抗血清,制作过程繁杂、成本昂贵,易出现假阳性。生物学鉴定和电镜观察费时费工,需要检测样品中病毒含量高。RT-LAMP作为一种新型的检测技术,具有简便、快速、特异等特点,不需要对模板进行热变性,可在等温条件下进行,短时间内即可获得试验结果[15]。基于此,本研究建立针对SPFMV的RT-LAMP快速检测技术。【拟解决的关键问题】 对SPFMV RT-LAMP检测技术的各反应条件进行优化,验证RT-LAMP扩增的特异性和灵敏度,建立一种SPFMV的新型、快速、灵敏的检测技术,为甘薯病毒病害的监测防控提供技术支持。1 材料与方法
试验于2016年5月至2017年9月在山东省农业科学院植物保护研究所植物病毒学实验室完成。1.1 材料
1.1.1 植物材料 从山东临沂地区甘薯苗床采集具有典型病毒病症状的甘薯样品,种植于防虫温室中;经RT-PCR检测确定甘薯病毒种类后,置于-80℃保存备用。选取经RT-PCR检测不含病毒的甘薯脱毒苗作为阴性对照。1.1.2 主要试剂 TransZol Plant多糖植物总RNA提取试剂盒、dNTPs购自北京全式金生物技术有限公司;HiScript® II 1st Stand cDNA Synthesis Kit购自诺唯赞生物公司;DL 2000 DNA Marker、M-MuLV反转录酶、RNase酶抑制剂购自TaKaRa公司;2×Es Taq MasterMix(Dye)购自康为世纪生物公司;Bst DNA大片段聚合酶、10×Thermopol Reaction Buffer、BspTⅠ和BsmⅠ购自NEB,特异性引物由生工生物工程(上海)股份有限公司合成;SYBR Green I核酸染料购自Solarbio公司;其他生化试剂及普通化学试剂均为进口或国产分析纯。
1.2 方法
1.2.1 引物设计 根据GenBank中SPFMV的CP基因序列(登录号:FJ155666),利用LAMP引物设计软件Primer Explorer V4设计RT-LAMP扩增引物SPFMV-F3、SPFMV-B3、SPFMV-FIP、SPFMV-BIP共4条;同时利用DNAMAN设计RT-PCR扩增引物SPFMV-F和SPFMV-R共2条,引物序列见表1。Table 1
表1
表1RT-LAMP和RT-PCR特异性检测SPFMV的引物
Table 1Primers used for SPFMV detection by RT-LAMP and RT-PCR
| 引物名称 Primer name | 基因位点 Genome position | 引物序列 Sequence (5′-3′) |
|---|---|---|
| SPFMV-F3 | 10546-10564 | 5′-GAGTCTTGCGCGATATGCA-3′ |
| SPFMV-B3 | 10746-10765 | 5′-ACCCCTCATTCCTAAGAGGT-3′ |
| SPFMV-FIP | 10624-10643, 10583-10600 | 5′-TAAGCGCGGCTGCCTTCATC-CATTCAACCACCCCTGCA-3′ |
| SPFMV-BIP | 10657-10688, 10708-10725 | 5′-TCGGTTGTTTGGTTTGGACGGA-ATCAGTTGTCGTGTGCCTC-3′ |
| SPFMV-F | 9827-9846 | 5′-TCTAATGAGAACACTGAATT-3′ |
| SPFMV-R | 10750-10771 | 5′-TTGCACACCCCTCATTCCTAAG-3′ |
新窗口打开
1.2.2 总RNA提取及cDNA合成 称取甘薯样品叶片约0.1 g,液氮冷冻后迅速研磨,按TransZol Plant多糖植物总RNA提取试剂盒说明书提取叶片总RNA,保存于-80℃备用。按照HiScript® II 1st Stand cDNA Synthesis Kit说明书,以RNA为模板合成cDNA,保存于-20℃备用。
1.2.3 RT-PCR检测 RT-PCR扩增体系:2×Es Taq
MasterMix 7.5 µL,SPFMV-F/R(10 µmol·L-1)引物各0.2 µL,cDNA 0.5 µL,ddH2O补足总体积至15 µL。反应条件:预变性94℃ 3 min,变性94℃ 30 s,退火50℃ 30 s,延伸72℃ 1 min,循环35次,终延伸72℃ 10 min。阴性样品叶片总RNA反转录的cDNA作为阴性对照的模板,ddH2O为空白对照模板。扩增产物经琼脂糖凝胶电泳检测。
1.2.4 RT-LAMP反应条件优化和检测体系的建立 RT-LAMP反应体系:SPFMV-FIP和SPFMV-BIP引物各1.2 µmol·L-1,SPFMV-F3和SPFMV-B3引物各0.2 µmol·L-1,dNTPs 0.125 mmol·L-1,Betaine 1 mol·L-1,1×Thermo Polreaction buffer,RNA酶抑制剂40 U,Bst DNA polymerase 8 U,M-MLV 200 U;RNA模板1 µL,补充ddH2O至25 µL(RNA模板为经RT-PCR检测及测序鉴定的感染SPFMV甘薯叶片总RNA)。RT-LAMP 反应条件:65℃ 1 h,85℃ 5 min。健康甘薯叶片总RNA反转录的cDNA作为阴性对照的模板,ddH2O为空白对照模板。设置SPFMV F3/B3﹕FIP/BIP引物浓度比梯度(1﹕1、1﹕2、1﹕4、1﹕6、1﹕8和1﹕10),dNTPs浓度梯度(0.025、0.125、0.225、0.325、0.425、0.525、0.625、0.725和0.825 mmol·L-1),Betaine浓度梯度(0.4、0.7、1.0、1.3和1.6 mol·L-1),不同的反应温度(59、61、63、65、67和69℃)和反应时间(20、30、40、50、60、70、80和90 min)。利用琼脂糖凝胶电泳检测反应产物。
1.2.5 RT-LAMP产物鉴定 将RT-LAMP产物经琼脂糖电泳分离后,切取大小200 bp左右的条带,回收纯化后连接于pMD18-T载体,连接产物转化大肠杆菌感受态DH5α,PCR鉴定后送阳性克隆到进行测序。利用BLAST对测序结果与GenBank已报道序列进行比对。
用DNAMAN软件分析RT-LAMP扩增片段序列,选用BsmⅠ(GAATGCN?)和BspTⅠ(C?TTAAG)进行酶切鉴定,BsmⅠ理论酶切片段大小为97和102 bp,BspTⅠ理论酶切片段大小为75和124 bp。利用苯酚和异丙醇回收纯化RT-LAMP扩增产物,取1 μg扩增产物分别进行BspTⅠ和BsmⅠ单酶切,反应体系参照酶试剂盒说明书。取20 µL酶切产物用3%琼脂糖凝胶电泳进行分析。
1.2.6 RT-LAMP特异性、灵敏度测定及荧光染料检测RT-LAMP产物 以分别携带SPFMV、甘薯C病毒(Sweet potato virus C,SPVC)、SPCSV、甘薯病毒2(Sweet potato virus 2,SPV2)、甘薯潜隐病毒(Sweet potato latent virus,SPLV)、甘薯G病毒(Sweet potato virus G,SPVG)和甘薯褪绿斑病毒(Sweet potato chlorotic fleck virus,SPCFV)的甘薯叶片总RNA为模板,利用优化好的反应体系进行RT-LAMP扩增和电泳检测,并与RT-PCR扩增结果进行对比。
将感染SPFMV的甘薯叶片总RNA用无RNA酶的水分别进行10-1、10-2、10-3、10-4、10-5、10-6和10-7的倍比稀释,以稀释后的RNA作为模板进行RT-LAMP和RT-PCR灵敏度对比试验,琼脂糖凝胶电泳检测扩增产物。
1.2.7 RT-LAMP方法的应用 提取从山东省采集的疑似SPFMV甘薯植株叶片总RNA,分别用优化后的RT-LAMP方法和普通RT-PCR方法进行检测,琼脂糖凝胶电泳分别检测反应产物。向RT-LAMP反应产物中加入0.1 µL SYBR green I 核酸染料,直接观察检测结果,阳性为绿色,阴性为橙色[27,28]。
2 结果
2.1 RT-LAMP反应体系优化
为了建立最优的RT-LAMP检测体系,对引物浓度、dNTPs浓度、Betaine浓度、反应温度和反应时间进行优化。引物优化结果显示,SPFMV F3/B3与FIP/BIP的浓度比例在1﹕4、1﹕6、1﹕8时能检测到条带,1﹕4时条带最亮,即F3/B3和FIP/BIP的引物浓度分别为0.2和0.8 µmol·L-1(图1-A)。对dNTPs浓度进行调整,结果显示dNTPs浓度为0.125—0.525 mmol·L-1时可检测到条带,其中以0.325和0.425 mmol·L-1效果最佳,本着节俭成本的原则确定dNTPs浓度为0.325 mmol·L-1(图1-B)。进一步设置不同的Betaine浓度,结果表明在0.4、0.7、1.0和1.3 mol·L-1时均能检测到条带,浓度为1.0 mol·L-1时,扩增效果最佳(图1-C)。设置不同的反应温度,在59—67℃均有条带,65℃时条带最为清晰(图1-D)。最后对反应时间进行优化,反应持续40 min时可观察到扩增条带,70 min时扩增条带最亮(图1-E)。综上,最终确定SPFMV最优的RT-LAMP检测体系为SPFMV-FIP和SPFMV-BIP引物各0.8 µmol·L-1,SPFMV-F3和SPFMV-B3引物各0.2 µmol·L-1,dNTPs 0.325 mmol·L-1,Betaine 1 mol·L-1。RT-LAMP反应条件为65℃ 70 min,85℃ 5 min。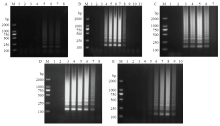 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1RT-LAMP反应体系的优化
-->Fig. 1Optimization of RT-LAMP assay conditions
M:DL2000 DNA marker;1、2:阴性对照和空白对照Negative control and blank control。A:F3/B3和FIP/BIP引物浓度比The ratio of primer concentration, 3-8: 1﹕1 (0.2 µmol·L-1﹕0.2 µmol·L-1), 1﹕2 (0.2 µmol·L-1﹕0.4 µmol·L-1), 1﹕4 (0.2 µmol·L-1﹕0.8 µmol·L-1), 1﹕6 (0.2 µmol·L-1﹕1.2 µmol·L-1), 1﹕8 (0.2 µmol·L-1﹕1.6 µmol·L-1), 1﹕10 (0.2 µmol·L-1﹕2.0 µmol·L-1);B:dNTPs浓度梯度The gradient of dNTPs concentration,3-11: 0.025, 0.125, 0.225, 0.325, 0.425, 0.525, 0.625, 0.725, 0.825 mmol·L-1;C:Betaine浓度梯度The gradient of Betaine concentration,3-7: 0.4, 0.7, 1.0, 1.3, 1.6 mol·L-1;D:温度梯度The gradient of temperature,3-8: 59, 61, 63, 65, 67, 69℃;E:时间梯度The gradient of time,3-10:20, 30, 40, 50, 60, 70, 80, 90 min
-->
2.2 RT-LAMP产物鉴定
将200 bp左右的RT-LAMP扩增条带进行测序,并与GenBank已报道序列进行比对。结果显示,序列与SPFMV(登录号AF015540.1)的核苷酸序列同源性为99%,说明本体系扩增序列为SPFMV的基因序列。RT-LAMP产物酶切结果显示,BsmⅠ酶切产生条带为97和102 bp,BspTⅠ酶切产生的条带为75和124 bp(图2),与理论值相符,进一步证明该体系扩增产物为SPFMV CP基因序列。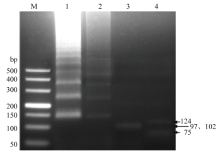 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2RT-LAMP产物酶切分析
-->Fig. 2Enzyme analysis of RT-LAMP products
M:DL500 DNA marker;1:RT-LAMP产物RT-LAMP product;2:纯化回收产物Purified product;3:BsmⅠ酶切产物RT-LAMP product digested with BsmⅠ;4:BspTⅠ酶切产物RT-LAMP product digested with BspTⅠ
-->
2.3 特异性检测
以分别含有SPVC、SPCSV、SPV2、SPLV、SPVG、SPCFV以及SPFMV病毒甘薯叶片的RNA为模板,利用普通RT-PCR和2.1优化的RT-LAMP两种方法进行扩增。结果显示,RT-LAMP和RT-PCR的扩增结果一致,并且只能在携带SPFMV的甘薯样品中扩增出条带,而携带其他病毒的甘薯样品皆没有扩增到条带(图3),表明建立的SPFMV RT-LAMP检测体系具有很好的特异性。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3SPFMV RT-LAMP(A)和RT-PCR(B)特异性检测
-->Fig. 3The specificity of RT-LAMP (A) and RT-PCR (B) assay for the detection of SPFMV
M:DL2000 DNA marker;1、2:阴性对照和空白对照Negative control and blank control;3-9: SPFMV, SPVC, SPCSV, SPV2, SPLV, SPVG, SPCFV
-->
2.4 RT-LAMP与RT-PCR灵敏度比较
提取感染SPFMV甘薯叶片总RNA,用紫外分光光度计测定其浓度为121.6 ng·L-1。将RNA按10倍梯度进行稀释,分别进行RT-LAMP和RT-PCR扩增。结果显示,RT-LAMP在RNA原液、10-1—10-4稀释液为模板下可扩增到条带,即本研究建立的SPFMV RT-LAMP方法检测到目标病毒的叶片RNA浓度最低为121.6×10-4 ng·μL-1(图4-A),而RT-PCR能在RNA原液、10-1—10-3稀释液模板中扩增到条带,即RT-PCR方法检测到目的病毒的叶片RNA浓度最低为121.6× 10-3 ng·μL-1(图4-B)。表明本研究建立的RT-LAMP方法较普通RT-PCR方法检测灵敏度高10倍。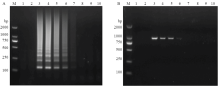 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4SPFMV RT-LAMP(A)和RT-PCR(B)灵敏度检测
-->Fig. 4Comparison of sensitivity of RT-LAMP (A) and RT-PCR (B) for the detection of SPFMV
M:DL2000 DNA marker;1、2:阴性对照和空白对照Negative control and blank control,3—10:RNA浓度分别为121.6、121.6×10-1、121.6×10-2、121.6×10-3、121.6×10-4、121.6×10-5、121.6×10-6和121.6×10-7 ng·μL-1 The concentration of RNA is 121.6, 121.6×10-1, 121.6×10-2, 121.6×10-3, 121.6×10-4, 121.6×10-5, 121.6×10-6 and 121.6×10-7 ng·μL-1, respectively
-->
2.5 RT-LAMP技术的田间检测应用
对采自山东的甘薯疑似病株分别进行RT-LAMP和RT-PCR检测,结果显示,12份样品中(部分结果)利用RT-LAMP检测方法检测出7份SPFMV阳性样品(图5-B),与RT-PCR检测结果一致(图5-A)。往RT-LAMP产物中加入SYVR green I核酸荧光染料,电泳检测有条带的样品迅速变为绿色,无条带的样品为橙色(图5-C),与RT-LAMP和RT-PCR检测结果一致。综上,表明本研究建立的RT-LAMP检测方法可用于田间甘薯样品SPFMV检测。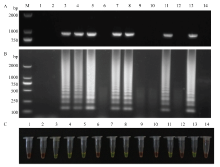 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5RT-PCR(A)和RT-LAMP(B)及可视化(C)检测SPFMV田间样品
-->Fig. 5Detections of SPFMV in field samples by both RT-PCR (A), RT-LAMP (B) and visual inspection of RT-LAMP products (C)
M:DL2000 DNA marker;1、2:阴性对照和空白对照Negative control and blank control;3—14:田间采集的甘薯样品Sweet potato samples collected in the field
-->
3 讨论
SPFMV是全球影响甘薯的最具破坏性的病毒之一,其寄主植物广泛,对甘薯的危害尤其严重[1,2,3,4,5,6,7,8,9]。由于甘薯主要为营养繁殖,容易造成病毒的逐年积累,造成甘薯产量降低,品质变劣和种性退化,严重危害甘薯产业发展。近年来地域间种质资源的频繁交流,也促使甘薯病毒病发生扩散[1,2,3]。因此,加强早期预警和种薯种苗的检验检疫,对防止甘薯病毒病的传播具有重要意义。目前,针对SPFMV的检测技术已经有很多,包括常规RT-PCR、荧光定量PCR、血清学检测等,但多有操作繁杂、耗时较长等特点[10,11,12,13,14]。RT-LAMP检测技术是一种新型的检测技术,具有快速、简单、灵敏等特点,已广泛应用于人类和动植物的各种病原微生物的快速诊断和检测[16,17,18,19,20,21,22,23,24,25,26,27,28,29,30]。2013年,乔奇等[27]建立的SPCSV RT-LAMP检测方法,实现了对SPCSV的快速检测。本研究建立了针对SPFMV的RT-LAMP检测体系,仅需70 min即可获得检测结果,并可通过荧光显色剂直接观察结果,不需要借助复杂仪器设备,节约了大量的成本和检测时间,适合在基层检测部门中广泛应用。多种甘薯病毒共同侵染时,一般具有协生作用[31,32,33,34]。作为中国甘薯的主要病毒,SPFMV常与其他多种病毒发生复合侵染现象,导致叶片扭曲、畸形和植株矮化等严重症状,使甘薯产量损失严重,对甘薯造成毁灭性危害[1,4-5]。但当SPFMV单独侵染甘薯时,植株体内病毒含量较低,引起的症状轻微,难以直接进行诊断鉴定[34]。对SPFMV的发生进行早期预警,可有效减少甘薯病毒病害造成的损失。本研究建立并优化的RT-LAMP体系具有高特异性和灵敏度,针对同属病毒侵染的样品,也实现了准确检测,且比常规RT-PCR检测方法的灵敏度高10倍。笔者实验室利用RT-LAMP对山东多地采集的145份甘薯疑似病样进行鉴定,其中检测到SPFMV阳性样品83份,发病率达57.24%(完整结果未提供),对病毒含量较低的样品也可有效检测。表明建立的SPFMV RT-LAMP检测方法具有快速、高效的特点,为种薯、种苗和脱毒苗的检测和鉴定提供了有利的技术支持。
4 结论
建立了SPFMV的RT-LAMP检测体系,实现了检测结果的可视化,具有简单、快速、特异和高灵敏度等优点,不需要复杂的仪器设备,适于科研机构和基层检测部门使用。The authors have declared that no competing interests exist.
