0 引言
【研究意义】根瘤菌可与豆科植物共生结瘤将大气中分子态氮转化为植物可以利用的氨态氮,还能以内生菌的形式与植物共生形成特殊的微环境,从而增强豆科植物的抗性、培肥地力、增加植物产量并改善品质[1-2]。土壤中75%以上的土著根瘤菌是低效或无效菌株,常能使豆科植物结瘤但不能进行高效固氮[3],因此,采用人工接种高效根瘤菌是十分重要的一项措施。然而,植物种类与根瘤菌种类及外在特殊的自然环境、土壤状况、与土著根瘤菌的竞争等均可影响接种目标根瘤菌存活率及繁殖能力,使得根瘤菌接种效率低,进而影响与豆科植物共生固氮,难以达到应有的增产效果[4-5]。因此如何提高根瘤菌接种效果对豆科植物生产具有重要意义。【前人研究进展】研究表明,大量微生物可定殖于植物根际,有些还可以内生菌的形式定殖于宿主体内,且可由根部向上运移至茎叶或繁殖器官内并进行大量繁殖[6-10]。然而有关内生根瘤菌在紫花苜蓿体内运移和定殖的动态变化及对营养和繁殖器官内微生物群落影响的研究较少。陈丹明等[11]首次发现紫花苜蓿种子内携带有根瘤菌。李剑峰等[6-7]发现紫花苜蓿内生根瘤菌主要存在于毛根和与种子形成的有关部位。而与土著根瘤菌相比,内生根瘤菌在竞争结瘤方面有明显优势,因此对内生根瘤菌的研究具有较强的理论与实践意义。种子及植株体内根瘤菌的分布和数量并不是恒定的,会受土壤状况、种子储藏、植物及菌株遗传特性等因素影响[12-14]。寻找利于提高苜蓿植株体内目标根瘤菌数量的方法具有较强的理论与实践意义。根瘤菌侵入宿主后,在体内运移时会遇到宿主的机械阻隔、菌体对宿主内环境的适应性和信号物质识别过程,这些阻碍或屏障会引发植物防御反应,进而降低根瘤菌定殖数量[6]。李剑峰等[7]发现添加LaCl3、生长素(IAA)、胞外多糖等外源物质可以减弱根瘤菌在苜蓿体内运移与定殖时遇到的防御反应,从而有提高苜蓿组织内根瘤菌定殖数量的趋势,但这一研究目前尚处初步阶段,如何研发高效的方法来提高苜蓿植株体内根瘤菌定殖数量的研究需要进一步深入。赤霉素可调控豌豆(Pisum sativum)结瘤,突变株根部因失去合成赤霉素的能力而不能结瘤,加入外源赤霉素后,可正常结瘤[15]。LIEVENS等[16]在根瘤菌侵入前2 d加入外源赤霉素合成抑制剂时阻断了田菁(Sesbania rostrata)根瘤的形成,而加入外源赤霉素后减弱了这种阻碍作用。由此表明赤霉素与细菌侵入有关。LIEVENS等[16]和DOBERT等[17]分别发现赤霉素在芸扁豆(Phaseolus lunatus L.)和田菁的根瘤、细菌侵染线和前感染区中表达能力较强。由此表明赤霉素可调控细菌的侵染过程和根瘤的形成。此外,赤霉素还可促进作物种子萌发、幼苗生长、种子发育、增加产量和改善品质等[18]。【本研究切入点】近年来有关赤霉素的研究主要集中在促进种子萌发和作物生长方面,而关于赤霉素对根瘤菌在豆科植物体内运移和定殖影响的研究鲜见报道。【拟解决的关键问题】本研究为提高根瘤菌接种效果,促进目标根瘤菌在苜蓿体内大量定殖,进而为其向繁殖器官转移并定殖,为形成携带的种子提供理论依据和技术支持。1 材料与方法
1.1 供试材料
供试菌株:荧光标记根瘤菌为Ensifer meliloti 12531f(12531f)和Ensifer meliloti LZgn5f(gn5f)。其原始菌株分别为Ensifer meliloti 12531(购自中国科学院微生物保藏中心—分离自非本苜蓿植株体内的外源根瘤菌),Ensifer meliloti LZgn5(分离自甘农5号紫花苜蓿种子的内源根瘤菌,经中国科学院微生物鉴定保藏中心测序鉴定),通过三亲本杂交法导入青色荧光蛋白质粒标记构建荧光标记根瘤菌株待用[19]。所有菌种培养于TY(Yeast Tryptone Agar)[20]固体穿刺管中并4℃保存于甘肃农业大学教育部草业生态系统重点实验室。供试苜蓿种子:甘肃农业大学教育部草业生态系统重点实验室提供的甘农5号紫花苜蓿种子(Medicago sativa L.Gannong No.5),净度为97%,发芽率为84%。
供试赤霉素:购自于兰州博域生物科技有限责任公司的赤霉素(Gibberellin GA3),含量不少于90%。
培养基:利用TY培养基进行菌种的保存、活化、培养及苜蓿各组织内荧光标记根瘤菌数量的检测。配方为胰蛋白胨0.5 g,酵母粉0.3 g,CaCl2·6H2O 0.13 g,蒸馏水100 mL,pH:7.0,121℃高温灭菌26 min,固体培养基加琼脂1.5 g·L-1。
营养液:Hoagland有氮营养液[21] 和Hoagland无氮营养液,以1 mol·L-1的NaOH溶液或1 mol·L-1 HCl溶液调节营养液pH为7.0±0.1。
1.2 试验设计及方法
1.2.1 赤霉素培养基的制备 将赤霉素装入无菌三角瓶,置于无菌操作台内紫外杀菌1 h,少量酒精溶解后无菌水稀释并过无菌滤膜(直径0.22 µm)3次,然后按赤霉素为0、0.5、1、10和100 mg·L-1的浓度要求加入配制好的40 mL TY液体培养基中。1.2.2 荧光标记根瘤菌菌液制备 将保存的两种荧光标记根瘤菌活化后接入50 mL TY液体培养基,28℃、180 r/min振荡至OD600为0.5—0.8,将该菌液按10%浓度加入不同赤霉素浓度的液体培养基内。待上述培养基培养至OD600为0.5—0.8后将其转移至50 mL无菌离心管中,8 000 r/min离心10 min,弃上清,留沉淀,加入等体积的无菌水,在涡旋振荡器上充分打散,制成菌悬液待用。
1.2.3 苜蓿幼苗的培养及接种 试验于2014年5月在甘肃农业大学温室内进行。选取健康饱满的甘农5号紫花苜蓿种子,置于已灭菌的50 mL三角瓶内,碘伏(购自兰州博域生物科技有限责任公司,有效碘含量0.45%—0.55%)浸泡3 min,无菌水清洗4次,每次1 min,无菌滤纸吸干水分待用。以上操作均在无菌操作台内进行。
将清洗干净的细沙150℃高温持续烘干5 h,121℃灭菌26 min,连续灭菌5次,冷却后装入75%乙醇消毒且杯底扎有网眼的塑料杯(直径6.0 cm、高7.5 cm,400 g/杯),然后放入水培盒中(长31 cm,宽19 cm,高10.5 cm),每盒3杯。每杯播种40粒已消毒的种子,表面覆盖干沙2 cm左右。每处理水培盒内一次性加入500 mL Hoagland有氮营养液,使其由杯底至下而上浸湿[22]。
待苜蓿幼苗长出真叶后,每杯定苗25株,将已制好的荧光标记根瘤菌菌悬液浇于盆栽表面,25 mL/杯。每处理6次重复,以无菌蒸馏水处理为对照。幼苗生长过程中用无菌水补充水分,接种后每15 d浇灌500 mL/盒Hoagland无氮营养液,至60 d幼苗收获。按表1设置试验处理 。
Table 1
表1
表1试验处理
Table 1Treatments for experiment
| 编号Number | 处理Treatment | 备注Comment |
|---|---|---|
| CK | 无菌水Sterile distilled water | 对照CK |
| F0 | 12531f+0 mg·L-1 gibberellin | 未添加赤霉素接种12531f Single inoculate 12531f |
| F0.5 | 12531f+0.5 mg·L-1 gibberellin | 12531f与0.5 mg·L-1赤霉素混合接种 Inoculate 12531f with 0.5 mg·L-1gibberellin |
| F1 | 12531f+1 mg·L-1 gibberellin | 12531f与1 mg·L-1赤霉素混合接种 Inoculate 12531f with 1 mg·L-1 gibberellin |
| F10 | 12531f+10 mg·L-1 gibberellin | 12531f与10 mg·L-1赤霉素混合接种 Inoculate 12531f with 10 mg·L-1 gibberellin |
| F100 | 12531f+100 mg·L-1 gibberellin | 12531f与100 mg·L-1赤霉素混合接种 Inoculate 12531f with 100 mg·L-1 gibberellin |
| G0 | gn5f+0 mg·L-1 gibberellin | 未添加赤霉素接种gn5f Single inoculate gn5f |
| G0.5 | gn5f +0.5 mg·L-1 gibberellin | gn5f与0.5 mg·L-1赤霉素混合接种 Inoculate gn5f with 0.5 mg·L-1 gibberellin |
| G1 | gn5f+1 mg·L-1 gibberellin | gn5f与1 mg·L-1赤霉素混合接种 Inoculate gn5f with 1 mg·L-1 gibberellin |
| G10 | gn5f +10 mg·L-1 gibberellin | gn5f与10 mg·L-1赤霉素混合接种 Inoculate gn5f with 10 mg·L-1 gibberellin |
| G100 | gn5f +100 mg·L-1 gibberellin | gn5f与100 mg·L-1赤霉素混合接种 Inoculate gn5f with 100 mg·L-1 gibberellin |
新窗口打开
1.3 测定指标
1.3.1 荧光标记根瘤菌生长的测定 测定培养1、3、5、7和9 d的含不同浓度赤霉素的荧光标记根瘤菌液体的OD600吸光度值。1.3.2 荧光标记根瘤菌在苜蓿体内运移和定殖的测定 接种后每隔15 d随机选取幼苗,将其分离为根、下部叶、下部茎、上部叶和上部茎;分别称取1 g,置于50 mL无菌三角瓶内,碘伏消毒3 min,无菌水冲洗4次,每次1 min。消毒后的植物组织各面在固体培养基上放置30 min后取出,平板28℃条件下培养48 h,未长出菌落时,表明已彻底消毒[23]。将彻底消毒的植物组织分别置于无菌研钵中加入2 mL无菌蒸馏水研磨(根部研磨液依次稀释为10、100、1 000倍,其他组织不稀释),4 000 r/min离心3 min,吸0.2 mL均匀涂布于TY固体培养基中,28℃培养48 h。黑暗条件下用手提紫外灯观察每皿内发光的荧光标记根瘤菌个数,并换算出每克样品(鲜重)内荧光标记根瘤菌的数量。
1.3.3 单株结瘤数及根瘤重的测定 幼苗生长60 d后每处理随机取5株测定单株结瘤数及单株根瘤重。
1.3.4 形态和生物量指标的测定 幼苗生长60 d后每处理每重复随机选取5株计算单株复叶数、刻度尺测量株高及根长。同时每处理随机选取10株,称取地上和根部鲜重(滤纸吸干表面水分)和干重(烘箱中105 ℃杀青20 min,然后80℃烘干至恒重)[24]。
1.3.5 叶绿素含量的测定 幼苗生长60 d后随机选取叶片,去除主脉和两头部分,剪碎,混匀,称0.2 g左右,用99%丙酮和95%乙醇1﹕1混合液定容50 mL,重复3次。将定容好的容量瓶置于黑暗处,每天摇动1次,直至叶片完全变白,记录吸光度值(OD645、OD663)[25]。
1.4 数据处理
采用Excel 2007进行数据整理及作图,SPSS16.0(SPSS V16.0,SPSS Inc.,Chicago,IL,USA)进行数据统计和分析,采用Duncan新复极差法进行各处理的多重比较。2 结果
2.1 赤霉素对荧光标记根瘤菌生长的影响
不同赤霉素浓度对荧光标记根瘤菌12531f生长的影响为先增大后减小,至7 d时达最大,第9天后逐渐减小。赤霉素对12531f的生长无明显促进作用,虽然10 mg·L-1赤霉素对其生长的促进作用高于其他赤霉素浓度的处理,但与未添加赤霉素处理无显著差异(P>0.05),当浓度达100 mg·L-1时反而显著抑制其生长(P<0.05)(图1-A)。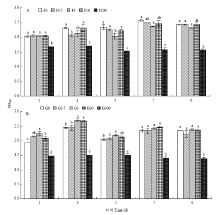 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1赤霉素对12531和gn5f生长的影响A:赤霉素对12531f 生长的影响;F0、F0.5、F1、F10和F100表示12531f接种液分别添加0、0.5、1、10和100 mg·L-1赤霉素。B:赤霉素对gn5f生长的影响;G0、G0.5、G1、 G10和G100表示gn5f接种液分别添加0、0.5、1、10和100 mg·L-1赤霉素。不同小写字母表示差异显著(P<0.05)。下同
-->Fig. 1Effect of gibberellin on the growth of 12531f and gn5f A: Effect of gibberellin on the growth of 12531f; F0, F0.5, F1, F10 and F100 mean 0, 0.5, 1, 10 and 100 mg·L-1 gibberellin added into inoculant of 12531f, respectively. B: Effect of gibberellin on the growth of gn5f; G0, G0.5, G1, G10 and G100 mean 0, 0.5, 1, 10 and 100 mg·L-1 gibberellin added into inoculant of gn5f, respectively. The different small letters mean significant difference at P<0.05. The same as below
-->
赤霉素对荧光标记根瘤菌gn5f生长的影响为先增大后减小,至第3天时达最大,随时间的增加,生长能力均降低。第1天至第3天,1 mg·L-1赤霉素对gn5f的生长促进作用最强,显著高于未添加赤霉素处理(P<0.05);第7天和第9天时仅在100 mg·L-1赤霉素浓度下显著抑制了其生长(P<0.05),其余各处理间差异不显著(P>0.05)(图1-B)。
综上,赤霉素对两种不同来源的荧光标记根瘤菌生长促进作用不同,其中10 mg·L-1赤霉素对12531f生长稍有促进,但无明显作用。而1 mg·L-1赤霉素对gn5f生长初期效果较好,但随着时间的延长则无明显作用。
2.2 赤霉素对荧光标记根瘤菌在苜蓿根内定殖的影响
荧光标记根瘤菌在根内的定殖数量呈现“先上升后下降”的趋势,赤霉素对不同荧光标记根瘤菌在苜蓿根内运移和定殖的影响不同(表2)。接种15 d时,仅在添加1 mg·L-1赤霉素时根部可检测到12531f,数量为1 801.80 cfu/g;30 d未添加赤霉素单独接菌时,根内12531f定殖数量最多,达8 591.00 cfu/g,显著高于其他处理(P<0.05),添加1、10和100 mg·L-1赤霉素后,根部也可检测到12531f,但各处理间无显著差异(P>0.05);45 d时,添加1和100 mg·L-1赤霉素时根内可检测到12531f,其余处理未检测到12531f;60 d时各处理和对照均未检测出12531f。Table 2
表2
表2赤霉素对荧光标记根瘤菌在苜蓿根内运移与定殖的影响
Table 2Effects of gibberellin on the migration and colonization of fluorescent tagged rhizobia in alfalfa roots
| 时间 Time | 赤霉素浓度 Gibberellin level (mg·L-1) | 荧光标记根瘤菌数量 Fluorescent tagged rhizobia number (cfu/g) | |
|---|---|---|---|
| 12531f | gn5f | ||
| 15 d | CK | 0 | 0 |
| 0 | 0 | 0 | |
| 0.5 | 0 | 2461.32±609.02f | |
| 1 | 1801.80±120.14b | 0 | |
| 10 | 0 | 0 | |
| 100 | 0 | 1362.36±334.64f | |
| 30 d | CK | 0 | 0 |
| 0 | 8591.00±991.89a | 0 | |
| 0.5 | 0 | 545.95±26.65f | |
| 1 | 202.20±92.28c | 11965.50±3947.63de | |
| 10 | 250.78±88.23c | 25975.00±1583.12b | |
| 100 | 929.90±21.31bc | 2027.30±519.21f | |
| 45 d | CK | 0 | 0 |
| 0 | 0 | 75534.00±5893.01a | |
| 0.5 | 0 | 1639.08±473.16f | |
| 1 | 634.45±61.05bc | 6202.14±1105.55ef | |
| 10 | 0 | 19013.00±2111.43c | |
| 100 | 242.46±25.45c | 16247.50±495.08cd | |
| 60 d | CK | 0 | 0 |
| 0 | 0 | 0 | |
| 0.5 | 0 | 0 | |
| 1 | 0 | 0 | |
| 10 | 0 | 0 | |
| 100 | 0 | 0 | |
新窗口打开
接种15 d时根内gn5f数量较少,30 d后数量逐渐增加,45 d未添加赤霉素单独接菌时,根内gn5f数量最多,达7.55×104 cfu/g,显著高于其他处理(P<0.05),而添加10 mg·L-1赤霉素时gn5f含量高于添加其他赤霉素的处理,达1.90×104 cfu/g;60 d时各处理和对照均未检测出gn5f。
2.3 赤霉素对荧光标记根瘤菌在苜蓿地上组织内运移和定殖的影响
由表3可看出,荧光标记根瘤菌在接种初期地上组织内的定殖数量较多,后期逐渐下降,且赤霉素对不同荧光标记根瘤菌在苜蓿地上组织内运移和定殖的影响不同。添加赤霉素后促进了12531f向下部茎、上部茎和上部叶内的运移和定殖。添加10 mg·L-1赤霉素显著提高了其向下部茎内的运移和定殖,接种15 d时数量最高,达54.72 cfu/g,显著高于其他处理(P<0.05);30 d后12531f定殖数量逐渐减少,至60 d时,仅在添加10 mg·L-1赤霉素处理下可检测出12531f,数量仅为1.32 cfu/g。接种15 d时,单独接种12531f 时下部叶内数量最多,达90.72 cfu/g,显著高于其他处理(P<0.05),后期数量逐渐减少,45 d后不能检测到该荧光标记根瘤菌。接种15 d时同样发现10 mg·L-1赤霉素促进了12531f向上部茎和上部叶内运移并定殖,数量分别为16.72 cfu/g和95.91 cfu/g,其余处理其余时间均未检测出12531f。对照未检测出12531f。Table 3
表3
表3赤霉素对荧光标记根瘤菌在苜蓿地上各组织内运移与定殖的影响
Table 3Effects of gibberellin on the migration and colonization of fluorescent tagged rhizobia in alfalfa aerial tissues
| 时间 Time | 赤霉素浓度 Gibberellin level (mg·L-1) | 荧光标记根瘤菌数量Fluorescent tagged rhizobia number (cfu/g) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 12531f | gn5f | ||||||||
| 上部叶 Upper leaf | 上部茎 Upper stem | 下部叶 Lower leaf | 下部茎 Lower stem | 上部叶 Upper leaf | 上部茎 Upper stem | 下部叶 Lower leaf | 下部茎 Lower stem | ||
| 15 d | CK | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 90.72±4.32a | 23.87±6.73b | 0 | 0 | 0 | 0 | |
| 0.5 | 0 | 0 | 7.82±1.51b | 0 | 0 | 0 | 9.47±2.73c | ||
| 1 | 0 | 0 | 0 | 12.07±1.00bc | 0 | 0 | 321.40±60.92a | 52.08±13.71a | |
| 10 | 95.91±16.78a | 16.72±2.30a | 0 | 54.72±13.29a | 0 | 0 | 0 | 0 | |
| 100 | 0 | 0 | 0 | 4.52±0.44c | 0 | 0 | 20.79±3.94b | 16.61±1.92bc | |
| 30 d | CK | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | 12.67±0.17bc | 0 | 0 | 0 | ||
| 0.5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 1 | 0 | 0 | 1.75±0.38bc | 0 | 0 | 0 | 1.28±0.10b | 0 | |
| 10 | 0 | 0 | 0 | 0 | 0 | 0 | 1.07±0.07b | 0 | |
| 100 | 0 | 0 | 0 | 11.83±0.93bc | 0 | 0 | 0 | 0 | |
| 45 d | CK | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4.92±0.02b | 10.57±0.55c | |
| 0.5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 36.79±10.82ab | |
| 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4.08±0.05c | |
| 100 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 60 d | CK | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 0.5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 1 | 0 | 0 | 0 | 0 | 0 | 5.90±0.58a | 72.73±5.63b | 1.60±0.30c | |
| 10 | 0 | 0 | 0 | 1.32±0.13c | 0 | 0 | 0 | ||
| 100 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
新窗口打开
添加赤霉素后促进了gn5f向下部茎和下部叶内运移并定殖。添加1 mg·L-1赤霉素提高了gn5f在下部茎内的定殖数量,15 d时数量最高,达52.08 cfu/g,但与该浓度处理接种45 d时无显著差异(P>0.05)。同样,1 mg·L-1促进了gn5f向下部叶内的运移和定殖,15 d时数量最高,达321.40 cfu/g,显著高于其他处理(P<0.05)。其余各处理间数量无显著性差异(P>0.05)。gn5f较难运移并定殖于上部茎和上部叶内,仅在添加1 mg·L-1赤霉素接种60 d时,上部茎内检测到少量gn5f,数量仅为5.90 cfu/g,上部叶内未检测到。对照未检测出gn5f。
由此表明,赤霉素对两种荧光标记根瘤菌运移和定殖的影响不同。10 mg·L-1赤霉素有利于12531f向下部茎和上部茎叶内运移和定殖,1 mg·L-1赤霉素有利于gn5f定殖于下部茎叶内,接种30 d后不利于其在地上各组织内定殖。因此,两种荧光标记根瘤菌在苜蓿地上组织表现出不同的运移及定殖规律,受菌种来源及遗传特性影响。
2.4 荧光标记根瘤菌液添加赤霉素接种对苜蓿结瘤的影响
添加适宜浓度赤霉素后的两种荧光标记根瘤菌接种苜蓿幼苗,可增加单株结瘤数和单株根瘤重(表4)。12531f添加10 mg·L-1赤霉素接种后苜蓿单株结瘤数分别高出对照和单独接菌处理75.71%和11.82%,但差异不显著(P>0.05);单株根瘤重分别高出对照和单独接菌处理1136.11%和55.05%,差异显著(P<0.05)。其余过高或过低赤霉素浓度对单株结瘤数和单株根瘤重均无促进作用。Table 4
表4
表4荧光标记根瘤菌接种液添加赤霉素对苜蓿单株结瘤数及根瘤重的影响
Table 4Effects of gibberellin added into inoculant of fluorescent tagged rhizobia on alfalfa nodule number and nodule weight
| 赤霉素浓度 Gibberellin level (mg·L-1) | 单株结瘤数 Nodule number (Nodules/plant) | 单株根瘤重 Nodule weight (g/plant) | ||
|---|---|---|---|---|
| 12531f | gn5f | 12531f | gn5f | |
| CK | 7.0±1.6a | 7.0±1.6ab | 0.0036±0.0011b | 0.0036±0.0011b |
| 0 | 11.0±2.4a | 12.3±1.7a | 0.0287±0.0045b | 0.0140±0.0050b |
| 0.5 | 0 | 0 | 0 | 0 |
| 1 | 0 | 12.8±3.7a | 0 | 0.0287±0.0045a |
| 10 | 12.3±1.7a | 3.0±1.1b | 0.0445±0.0138a | 0.0071±0.0044b |
| 100 | 0.7±0.02b | 2.5±1.0b | 0.0014±0.0001b | 0.0033±0.0022b |
新窗口打开
gn5f添加低浓度赤霉素接种苜蓿幼苗未提高单株结瘤数,当赤霉素浓度为1 mg·L-1时,单株结瘤数和单株根瘤重均达最高,其中单株结瘤数分别高出对照和单独接菌处理82.86%和4.07%,但差异不显著(P>0.05);单株根瘤重分别高出对照和单独接菌处理697.22%和105.00%,差异显著(P<0.05)。高于1 mg·L-1时,单株结瘤数和单株根瘤重则逐渐降低。
结果表明只有在适宜赤霉素添加浓度下接种才可促进苜蓿根瘤的形成,且不同来源的根瘤菌要选择不同的赤霉素浓度。
2.5 荧光标记根瘤菌液添加赤霉素接种对苜蓿幼苗生长的影响
两种荧光标记根瘤菌接种后均可增加苜蓿幼苗单株叶片数、株高和根长,荧光标记根瘤菌添加适宜浓度赤霉素后接种,3个指标均高于对照和单独接菌处理(表5)。12531f添加赤霉素后接种,随赤霉素浓度的升高,3个指标均逐渐增大,添加10 mg·L-1赤霉素后均达最高,单株叶片数分别高出对照和单独接菌处理113.94%和78.28%,差异显著(P<0.05);株高分别高出对照和单独接菌处理83.33%和50.24%,差异显著(P<0.05);根长分别高出对照和单独接菌处理115.28%和29.17%,差异显著(P<0.05);然后随赤霉素浓度的增加,单株叶片数、株高和根长则减小。gn5f添加赤霉素后接种,单株叶片数、株高和根长逐渐增加,添加1 mg·L-1后各指标均达到最大,其中单株叶片数分别高出对照和单独接菌处理32.12%和19.13%;株高分别高出对照和单独接菌处理95.24%和37.82%;根长分别高出对照和单独接菌处理76.39%和5.83%,但各处理间均无显著差异(P>0.05);然后随赤霉素浓度的增加,单株叶片数、株高和根长逐渐减小。Table 5
表5
表5荧光标记根瘤菌接种液添加赤霉素对苜蓿单株叶片数、株高和根长的影响
Table 5Effects of gibberellin added into inoculant of fluorescent tagged rhizobia on alfalfa seedlings leaf number, plant height and root length
| 赤霉素浓度 Gibberellin level (mg·L-1) | 单株叶片数 Leaf number per plant | 株高 Plant height (cm) | 根长 Root length (cm) | |||
|---|---|---|---|---|---|---|
| 12531f | gn5f | 12531f | gn5f | 12531f | gn5f | |
| CK | 16.5±0.6c | 16.5±0.6a | 16.8±0.2c | 16.8±0.2c | 7.2±0.7c | 7.2±0.7b |
| 0 | 19.8±1.5bc | 18.3±2.1a | 20.5±1.0bc | 23.8±2.7bc | 12.0±0.8b | 12.0±0.8a |
| 0.5 | 21.1±2.7bc | 19.4±1.3a | 23.1±2.2b | 28.5±3.1ab | 10.9±0.8b | 12.6±0.7a |
| 1 | 26.3±1.6b | 21.8±0.9a | 24.5±0.9b | 32.8±4.6a | 12.6±0.4b | 12.7±0.9a |
| 10 | 35.3±6.17a | 21.3±3.0a | 30.8±0.8a | 23.8±2.3bc | 15.5±0.8a | 12.3±0.3a |
| 100 | 18.9±0.7bc | 20.3±1.8a | 22.2±0.8b | 21.2±1.9bc | 12.1±0.5b | 12.3±0.6a |
新窗口打开
接种两种荧光标记根瘤菌可提高苜蓿幼苗的生物量,添加适宜赤霉素后生物量高于未添加赤霉素的单独接菌处理和对照(表6)。12531f添加赤霉素后接种,随赤霉素浓度的升高,生物量逐渐增加,到10 mg·L-1后地上和根干重均达最高;其中,地上干重分别高出对照和单独接菌处理214.27%和206.43%,差异显著(P<0.05);根干重分别高出对照和单独接菌处理1156.19%和1049.53%,差异显著(P<0.05);然后随赤霉素浓度的逐渐增加,生物量逐渐降低,但均高于对照和单独接菌处理。gn5f添加赤霉素后接种,随赤霉素浓度的升高,苜蓿生物量逐渐增加,浓度达1 mg·L-1时,地上和根干重均达最高;其中,地上干重分别高出对照和单独接菌处理125.98%和121.80%,差异显著(P<0.05);根干重分别高出对照和单独接菌处理864.43%和762.21%,差异显著(P<0.05);然后随赤霉素浓度的逐渐增加,生物量逐渐降低,但均高于对照和单独接菌处理。
Table 6
表6
表6荧光标记根瘤菌接种液添加赤霉素对苜蓿生物量的影响
Table 6Effect of gibberellin added into inoculant of fluorescent tagged rhizobia on alfalfa seedlings biomass
| 赤霉素浓度 Gibberellin level (mg·L-1) | 地上干重Aboveground dry weight (g/plant) | 根干重Root dry weight (g/plant) | ||
|---|---|---|---|---|
| 12531f | gn5f | 12531f | gn5f | |
| CK | 0.0743±0.0011b | 0.0743±0.0011c | 0.0194±0.0003c | 0.0194±0.0003c |
| 0 | 0.0762±0.0004b | 0.0757±0.0002c | 0.0212±0.0002c | 0.0217±0.0003c |
| 0.5 | 0.0196±0.004b | 0.1094±0.0033b | 0.0256±0.0002c | 0.0440±0.0006c |
| 1 | 0.1997±0.0342a | 0.1679±0.0197a | 0.1451±0.0313b | 0.1871±0.0144a |
| 10 | 0.2335±0.0238a | 0.1340±0.0133b | 0.2437±0.0328a | 0.1093±0.0203b |
| 100 | 0.1822±0.0115a | 0.1070±0.0005b | 0.1259±0.0162b | 0.0471±0.0004c |
新窗口打开
2.6 荧光标记根瘤菌液添加赤霉素接种对苜蓿叶绿素含量的影响
不同浓度赤霉素与两种荧光标记根瘤菌混合接种对苜蓿叶片叶绿素含量影响不同(图2)。单独接种12531f时叶片叶绿素(a+b)含量高于对照1.05%,但差异不显著(P>0.05);添加赤霉素后抑制了叶绿素的形成,含量低于对照和单独接菌处理(图2-A)。而单独接种gn5f时叶绿素含量高出对照29.02%,差异显著(P<0.05),添加赤霉素后其含量低于单独接菌处理;当添加100 mg·L-1赤霉素后其含量最低,低于对照和单独接菌处理23.78%和40.92%,差异显著(P<0.05)(图2-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2荧光标记根瘤菌接种液添加赤霉素对苜蓿叶片叶绿素含量的影响A:12531f 添加赤霉素接种;B:gn5f添加赤霉素接种
-->Fig.2Effect of gibberellin added into inoculant of fluorescent tagged rhizobia on alfalfa leaf chlorophyll content A: Gibberellin added into inoculant of 12531f; B: Gibberellin added into inoculant of gn5f
-->
3 讨论
3.1 赤霉素对荧光标记根瘤菌生长及其在苜蓿幼苗体内运移和定殖的影响
在农业生产中,赤霉素具有增大叶面积、促进种子发芽、刺激作物生长、增加作物产量、减少器官脱落等重要作用[26-28]。但关于赤霉素对根瘤菌生长的研究较少。陈文浩[29]研究发现添加 10-3 v/v GA3可使大豆根瘤菌的生长速率和数量发生显著提高,然而添加较低或较高浓度GA3时会抑制大豆根瘤菌的发育。本试验中添加10 mg·L-1赤霉素对12531f生长稍有促进作用,但效果并不明显,而1 mg·L-1赤霉素对gn5f生长初期效果较好,随着时间的延长则无明显作用。表明添加适宜赤霉素浓度后可促进两种荧光标记根瘤菌的生长,而过高或过低浓度时会抑制根瘤菌的生长。两种根瘤菌适宜的赤霉素浓度不同,可能是不同的根瘤菌基因型对相同激素水平会产生了不同的响应。接种45 d后根部12531f和gn5f的定殖量分别在2.20×102—8.60×103cfu/g和5.46×102—7.55×104 cfu/g之间,表明两种荧光标记根瘤菌均可在植物根部长期稳定定殖,占据生态位点,这为其向地上各组织运移并发挥促生作用奠定了基础。在地上组织内,叶片内荧光标记根瘤菌含量高于茎内,因为叶片是光合作用的场所,含较多碳水化合物,而茎是运输水分、矿物质、养分的通道,因此在营养富集的叶内菌落定殖的数量高于作为运输部位的茎[30]。但接种15 d后茎叶内根瘤菌定殖数量减少,表明根瘤菌侵入苜蓿后在其体内运移遇到了阻碍或屏障,降低了运移和定殖能力。迟峰等[23]同样发现根部接种绿色荧光标记根瘤菌A.caulinodans ORS571后,可由根部向上运移,且定殖数量在15 d时达最高,随后数量保持稳定或稍微下降。
10 mg·L-1赤霉素促进了12531f大量定殖于上部叶内,1 mg·L-1赤霉素促进了gn5f大量定殖于下部叶内,由此表明添加赤霉素后可减弱苜蓿对外源根瘤菌12531f的选择性屏障,使其大量运移并定殖于上部叶片。本试验已发现添加赤霉素并未明显促进两种荧光标记根瘤菌的生长,因此,赤霉素促进根瘤菌在苜蓿体内运移并定殖的原因很可能是因为添加赤霉素提高了植物体内IAA的含量[31],而IAA能使入侵微生物较容易侵染定殖于植物组织[32-33],增加根瘤菌的侵染能力,使得大量根瘤菌向地上各组织内运移并定殖。陈文浩[29]研究发现,经GA3处理可诱导大豆根瘤菌80号氧化还原蛋白上调,表明赤霉素可能通过调控此蛋白表达从而调控根瘤菌的发育;经 GA3处理的292号转运蛋白表达量表现出明显的降低,而292号蛋白在调控蒺藜状苜蓿(Medicago truncatula)与苜蓿中华根瘤菌(Sinorhizobium meliloti)共生互作形成及功能相关的蛋白方面已具有重要作用[34]。由此解释了经GA3处理大豆根瘤菌具有更好的根系侵染能力,添加适宜赤霉素后促进了两种荧光标记根瘤菌向地上各组织内运移并定殖。
两种荧光标记根瘤菌所需的赤霉素浓度不同,这是因为菌种来源不同,对赤霉素的响应不同。12531f的原始菌株为12531,分离自非本苜蓿植株体内的外源根瘤菌,gn5f的原始菌株gn5是分离自甘农5号紫花苜蓿种子的内源根瘤菌,寄主对内源根瘤菌gn5f的防御性反应弱于外源根瘤菌12531f,从而使得运移并定殖于植物体下部茎和叶内时所需赤霉素浓度不同,说明了赤霉素对不同基因型根瘤菌影响不同,受菌种来源及遗传特性影响。
根瘤菌可由根部向地上的茎叶内运移并定殖,但存在选择性屏障。本研究发现该屏障可能存在于苜蓿下部与上部的分界点之间,降低运移至上部茎和叶内的gn5f根瘤菌数量,但上部叶内12531f数量高于下部叶片,又表明宿主对不同根瘤菌菌株的选择性屏障不同。
3.2 荧光标记根瘤菌添加赤霉素接种对苜蓿幼苗的影响
苜蓿含种带根瘤菌[11,14],虽已发现未接种根瘤菌时苜蓿也可结瘤,但数量少于接种两种荧光标记根瘤菌的处理,说明种带根瘤菌的竞争结瘤能力低于所接种的目标根瘤菌[35]。内生根瘤菌可提高植物体内IAA和GA的含量,提高植物对磷的利用效率,提高植物叶片光合作用,从而具有促进生长、增加产量及种子含氮量的作用[23, 36]。添加赤霉素后促进了两种荧光标记根瘤菌在苜蓿体内的运移和定殖,因此对苜蓿的生长具有促进作用。本试验中以12531f添加10 mg·L-1赤霉素和gn5f添加1 mg·L-1赤霉素处理后苜蓿结瘤、叶片数、株高、根长和生物量的效果较好。这可能是因为赤霉素可促进束缚型IAA释放游离型IAA,增加细胞内IAA的水平,而IAA可提高内生根瘤菌的定殖数量[7],因此内生根瘤菌发挥了固氮优势和促进植株生长的能力,提高了苜蓿结瘤能力,促进了植株的生长,从而增加了生物量[35]。
叶绿素是植物进行光合作用的主要物质,苜蓿叶片光合特性、生理代谢和光合产物代谢的变化可共同影响植株生长发育[37-38]。本试验发现单独接菌时叶片叶绿素含量高于对照,添加赤霉素后其含量低于未添加赤霉素的单独接菌处理,其原因可能是赤霉素具有分解色素的作用,会降低色素合成的速度,使色素合成速度跟不上赤霉素促进细胞增大的速度等[39],因此添加赤霉素后降低了叶绿素的含量。
可见,适宜浓度的赤霉素对根瘤菌的生长、在植物体内运移和定殖、结瘤和苜蓿生长均有一定的促进作用,但需根据菌株的遗传特性来选择适宜的浓度。本研究初步探索了赤霉素对两种根瘤菌生长的影响,且只探索了赤霉素对根瘤菌在苜蓿幼苗各组织内的运移和定殖的影响,因此,后续研究会继续探索赤霉素
对根瘤菌在田间营养和生殖生长阶段苜蓿体内的运移和定殖的影响。此外,仍会继续寻找利于根瘤菌生长的其他外源物质,并筛选更多优良的根瘤菌,为促进根瘤菌的运移和定殖效果并实现目标根瘤菌导入良种苜蓿种子提供理论依据。
4 结论
12531f添加10 mg·L-1赤霉素接种,gn5f添加1 mg·L-1赤霉素接种利于二者在苜蓿幼苗体内运移并定殖。上述两种菌液添加相应浓度赤霉素接种苜蓿幼苗,对单株结瘤数、单株根瘤重、单株叶片数、株高、根长、地上鲜重、地上干重、根鲜重、根干重均有促进作用。(责任编辑 杨鑫浩)
The authors have declared that no competing interests exist.
