0 引言
【研究意义】西瓜(Citrullus lanatus)为葫芦科西瓜属一年生草本植物,是一种世界性的园艺作物,有“夏季水果之王”的美誉[1]。西瓜基因组重测序数据的完成为西瓜遗传图谱构建、主要农艺性状QTL(quantitative trait locus)分析及品质育种提供了重要参考信息。分子标记是用来开展园艺作物遗传图谱构建、QTL分析、分子标记辅助选择育种等研究的一种有效工具。其中SSR(simple sequence repeats)、AFLP(amplified fragment length polymorphism)以及CAPS(cleaved amplified polymorphic sequence)等分子标记已被广泛运用到番茄、黄瓜、西瓜等园艺作物基因定位、遗传多样性分析等遗传育种领域[2-4]。西瓜主要以果肉为食用部分[5],可溶性固形物含量与果肉硬度是衡量西瓜果实品质及口感的重要性状,对于西瓜贮藏加工以及商品价值具有重要意义。长期以来,人们从栽培措施、生理指标和遗传规律等角度对西瓜可溶性固形物含量及果肉硬度开展了多项研究,但是其为数量性状,表达受多基因控制,而且数量性状易受环境影响[6-7],存在明显基因与环境的相互作用,其传统选育方法效率较低,限制了西瓜常规育种进程。因此,在西瓜高通量测序基础上开发CAPS标记,构建遗传图谱,分析果实相关性状QTL位点,深入了解西瓜果实性状的遗传机制,能够为品种选育提供理论依据。【前人研究进展】国内外****对西瓜可溶性固形物、果肉硬度、种子百粒重、种皮底色等果实与种子相关性状进行了较多研究。HASHIZUME等[8]利用BC1P1群体构建遗传图谱,在第八连锁群上定位到1个与可溶性固形物含量相关的QTL位点。REN等[9]整合了利用RILs(recombinant inbred lines)和F2群体构建的4张连锁图谱,定位出与可溶性固形物含量相关的4个QTL位点。CHENG等[10]利用F2:3群体田间数据及F2群体分子标记数据,共定位出10个果实相关性状QTL位点,其中与可溶性固性物相关QTL位点1个。在西瓜种子性状研究方面,多数研究集中于西瓜种子大小遗传规律及相关基因定位研究;在种子的种皮底色方面,MAVI等[11]研究表明种皮底色在一定程度上影响种子品质以及种子耐贮性。MCKAY等[12]最早对西瓜种皮底色进行了研究,认为种皮底色由3对基因控制。尚建立等[13]认为种皮颜色可能还与形成种皮的色素含量有关。【本研究切入点】目前针对西瓜果实的一些相关性状的遗传规律,前人已开展了很多研究,但仍需进一步完善。西瓜的可溶性固形物含量及果肉硬度报道较少,在西瓜种皮底色的遗传研究方面,虽有报道但并未明确其遗传机理,有待进一步研究。【拟解决的关键问题】本研究利用在西瓜果实与种子相关性状存在较大差异的亲本构建BC1P1群体,采用CAPS标记对西瓜可溶性固形物、果肉硬度、种子百粒重、种皮底色等果实与种子性状进行遗传连锁图谱的构建与QTL分析,为今后进一步开展西瓜重要相关性状基因挖掘、精细定位、基因克隆及分子标记辅助育种奠定基础。1 材料与方法
田间试验于2014年3—9月在东北农业大学香坊实验实习基地配置杂交组合,并获得回交群体;2015年5—8月在东北农业大学向阳实验基地种植两亲本、F1代及回交群体。分子试验于2015年9月至2016年5月在东北农业大学园艺学院西甜瓜分子育种实验室进行。1.1 供试材料
母本为东北农业大学园艺学院西甜瓜分子育种研究室提供的西瓜品系‘W1-1’(花园母本),中心和边缘可溶性固形物含量分别为10.97%和8.81%,中心和边缘硬度分别为1.24×105和0.56×105 Pa,种子百粒重为4.05 g,种皮底色为灰褐色。父本‘PI186490’由美国农业部农业研究署西南农业试验站Angela R. Davis博士提供,为黏籽西瓜,味苦,中心和边缘可溶性固形物含量分别为2.88%和2.95%,中心和边缘硬度分别为9.23×105和7.41×105 Pa,种子百粒重为12.60 g,种皮底色为灰黄色。两亲本杂交获得F1代植株,并以‘W1-1’为轮回亲本,与F1代回交,获得由225个单株组成的BC1P1群体。1.2 田间试验及方法
1.2.1 田间试验设计 种植父母本及F1代植株各15株,3次重复,对BC1P1群体225株西瓜采取顺序排列设计。株行距0.6 m×0.8 m,试验面积约130 m2,吊蔓栽培,双蔓整枝,每株选留一个果实。1.2.2 田间性状调查及方法 授粉后35 d统一采摘成熟果实,对其果实相关性状进行性状调查并收集种子。 西瓜果实中心和边缘可溶性固形物含量(%)用手持折光仪(LH-T90)进行测量,中心及边缘果肉硬度(105 Pa)用硬度计(KMH-51型)进行测量。种子相关性状待统一晾干后进行,种子百粒重(g)用电子天平(FA1004N)进行测量,种皮底色通过目测法进行调查。
1.3 分子试验及方法
1.3.1 DNA提取与重测序 分别对‘W1-1’、‘PI186490’、F1代各单株生长点下幼嫩叶片进行混合采样,BC1P1群体各单株进行单独采样,采样后立即液氮速冻并保存在-80℃超低温冰箱直至DNA提取。采用改良的CTAB法提取基因组DNA[14]。并使用SAM3000超微量分光光度计及1%琼脂糖胶对DNA样品浓度和质量进行检测,并将合格的双亲材料DNA样品送至深圳华大基因研究院,在Illumina HiSeq 2000测序平台下,进行深度为20×的基因组重测序。
1.3.2 CAPS标记开发 获得两亲本材料的基因组重测序数据后,按严格的标准过滤掉测序质量较低及包含有测序接头读段,使用BWA软件将过滤后的高质量读段(Clean reads)比对回帖到西瓜参考基因组中[15],然后用SAMTOOLS和VCFTOOLS软件在基因组范围内寻找两亲本之间的SNP位点,再利用东北农业大学西甜瓜分子育种研究室自编Perl语言脚本提取位于SNP位点前后约500 bp片段序列作为候选CAPS分子标记的序列。最后通过SNP2CAPS软件分析酶切位点信息,用7种在西瓜基因组上酶切位点丰富的限制性内切酶(EcoR I,BamH I,Hind III,Pst I,Xba I,Xho I,Hinf I)将SNP位点转化为CAPS标记,并在酶切位点上下游约500 bp序列范围内设计引物。选取均匀分布在全基因组上的450个CAPS位点,利用Primer Premier 6软件根据含有候选CAPS标记的序列进行引物设计。引物命名原则为将全基因组按物理距离平均分为450份,将引物从1到450进行编号,引物名称为W+引物编号。
PCR扩增体系和程序:PCR扩增体系,2 μL模板DNA,2 μL引物(上下游各1 μL),0.1 μL Taq酶,0.15 μL dNTPs,1 μLTaq Buffer,6.75 μL超纯水。扩增程序采用降落PCR扩增:94℃预变性7 min,94℃变性1 min,60℃退火30 s,72℃延伸90 s,30个循环,每个循环降0.5℃,94℃变性1 min,45℃退火30 s,72℃延伸90 s,72℃终止延伸7 min。酶切体系为:1 μL限制性内切酶缓冲液,0.5 μL限制性内切酶(10 u·μL-1,THERMO),9 μL超纯水,PCR扩增产物5 μL,37℃水浴2 h。酶切产物用1%琼脂糖凝胶电泳检测。
1.4 数据分析方法
1.4.1 表型数据分析 采取3次重复测量各表型性状。利用Microsoft Excel 2003软件进行数据录入;SPSS19.0软件对试验数据进行描述性统计与相关性分析。1.4.2 遗传图谱的构建和QTL分析 利用QTL IciMappingV3.3软件对筛选出的分子标记进行分析并构建遗传图谱,采用Kosambi函数计算图距,选择LOD值≥3.0,用Map命令构建遗传连锁图谱。QTL分析使用Windows QTL CartographerV2.5软件。采用1 000次重复置换测验,估算基因组范围内α=0.05水平上的LOD阈值,以LOD值≥3.0为阈值。采用复合区间作图法(composite interval mapping,CIM),以1.0 cM步行速度在全基因组内进行扫描。QTL命名方式为性状英文缩写+连锁群号+QTL编号。使用MapChart2.1软件绘制遗传连锁图谱,根据分子标记在染色体上的位置,依次将连锁群命名为chr.1—11,其分别对应西瓜基因组1—11号染色体。
2 结果
2.1 亲本、F1代及BC1P1群体各性状表型分析
各性状在双亲间存在不同程度的差异,如表1所示,F1代可溶性固形物含量、果肉硬度、种子百粒重均介于双亲之间。对上述数据进行差异显著性检验表明各目标性状在父母本间的表型差异均达到极显著水平,可用于下一步分析。BC1P1群体中均表现出广泛的变异且变异幅度较大,如图1各性状均基本符合正态分布,可以进行QTL分析。同时相关性分析结果显示(表2),西瓜中心果肉硬度与边缘果肉硬度呈极显著正相关,与中心可溶性固形物呈极显著负相关,与边缘可溶性固形物呈显著负相关。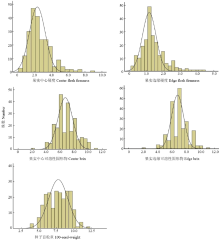 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1BC1P1群体果实与种子相关性状频次直方图
-->Fig.1Histogram for the fruit and seed traits of BC1P1 population
-->
本研究母本种皮底色为灰褐色,父本种皮底色为灰黄色,F1种子均为黑色,在回交世代中的种皮底色主要包括黑色与非黑色两种(图2),其中非黑色种皮分为浅灰褐色和深灰褐色,区别不明显,辨别困难,因此将其定义为非黑色类型。在BC1P1群体中,黑与非黑种皮的分离比例为109﹕116,近似1﹕1。
Table 1
表1
表1西瓜果实与种子相关性状双亲值及在BC1P1群体中的分布
Table 1Parents values of traits related to fruit and seeds of watermelon and distribution in BC1P1 population
| 性状 Traits | 亲本与F1均值 The mean value of parents and F1 generation | BC1P1 群体 Distribution in BCIP1 population | ||||||
|---|---|---|---|---|---|---|---|---|
| 母本 W1-1 | 父本 PI 186490 | F1 | 均值 Mean | 标准差 SD | 极差 Range | 峰度 SEK | 偏度 SES | |
| 中心可溶性固形物Center brix (%) | 10.97±0.61 | 2.88±0.38 | 4.54±0.60 | 6.84 | 1.47 | 8.9 | -0.002 | 0.252 |
| 边缘可溶性固形物Edge brix (%) | 8.80±0.92 | 2.95±0.61 | 4.67±0.53 | 6.95 | 1.29 | 8.9 | 0.675 | 0.007 |
| 果实中心硬度Center flesh firmness (105 Pa) | 1.24±0.16 | 8.16±1.78 | 4.51±0.95 | 2.70 | 1.36 | 8.6 | 2.77 | 1.375 |
| 果实边缘硬度Edge flesh firmness (105Pa) | 0.56±0.12 | 7.41±1.42 | 3.14±1.01 | 1.40 | 0.72 | 4.20 | 2.72 | 1.357 |
| 种子百粒重100-seed-weight (g) | 4.05±0.14 | 12.60±0.32 | 10.05±0.24 | 7.37 | 1.58 | 8.0 | -0.68 | -0.03 |
新窗口打开
Table 2
表2
表2西瓜果实与种子相关性状相关性分析
Table 2Correlation analysis of fruit and seeds in watermelon associated traits
| 性状 Traits | 中心果肉硬度 Center FF | 边缘果肉硬度 Edge FF | 中心可溶性固形物 Center BR | 边缘可溶性固形物 Edge BR | 种子百粒重 100SWT |
|---|---|---|---|---|---|
| 中心果肉硬度 Center FF | 1 | ||||
| 边缘果肉硬度 Edge FF | 0.700** | 1 | |||
| 中心可溶性固形物 Center BR | - 0.368** | -0.309** | 1 | ||
| 边缘可溶性固形物 Edge BR | -0.105* | -0.153* | 0.614** | 1 | |
| 种子百粒重 100SWT | 0.095 | 0.05 | -0.098 | 0.047 | 1 |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2亲本、F1代及BC1P1群体种子
-->Fig. 2Seeds of parents, F1 and BC1P1 population
-->
2.2 SNP位点挖掘与分析
对‘W1-1’和‘PI186490’进行全基因组重测序后,分别获得92 838 313和91 970 999个高质量读段,其中比对到西瓜参考基因组的分别为91 439 063(约为西瓜总参考基因组的98.49%),90 110 237(约为西瓜总参考基因组的97.98%),覆盖了参考基因组的90.20%和88.03%,平均覆盖深度为26×和25×。经SNP位点挖掘与分析,结果表明1—11号染色体共检测出751 532个SNP位点。SNP位点在各染色体的分布密度情况如表3所示。两个亲本材料之间SNP位点的密度范围是1 693—3 048/103 kb。4号染色体SNP位点最少,11号染色体SNP位点最多。Table 3
表3
表3SNP位点在染色体中的分布密度
Table 3The average SNP density in 11 chromosomes in parents of W1-1 and PI186490
| 染色体 Chromosome | 基因位点 Loci (103 kb) | 总数 Total |
|---|---|---|
| 1 | 2074 | 70705 |
| 2 | 1973 | 67916 |
| 3 | 1949 | 56409 |
| 4 | 2262 | 54991 |
| 5 | 1693 | 57085 |
| 6 | 2573 | 69513 |
| 7 | 2273 | 71553 |
| 8 | 1938 | 50668 |
| 9 | 2110 | 73816 |
| 10 | 1902 | 54040 |
| 11 | 1836 | 49780 |
| 3048 | 75056 | |
| 总计 | 25631 | 751532 |
新窗口打开
SNP变异类型分析如表4所示,碱基的颠换、转换数量分别为238 022、513 173。其中碱基颠换数量最多为AT→TA变异(72 139;30.3%),数量最少为CG→GC(35 007;14.70%)。碱基转换数量为CT→TC变异(255 872;49.86%),AG→GA(257 301;50.01%)。
2.3 CAPS标记开发及多态性分析
在重测序基础上,经7种限制性内切酶酶切位点分析后,在两亲本材料中共获得4 934个CAPS标记位点。选取450对均匀分布在全基因组上的CAPS引物,并用‘W1-1’、‘PI 186490’和F1对CAPS引物多态性进行筛选,获得200对共显性多态引物,多态率为44.44%。2.4 西瓜遗传图谱的构建
运用QTL IciMappingV3.3软件对200个多态性标记进行连锁分析。如图3所示,构建了一张包含200个CAPS标记、11个连锁群(分别对应于西瓜11条染色体)的西瓜遗传连锁图谱,覆盖基因组长度1 376.95 cM,标记间平均遗传距离6.88 cM。各连锁群长度从96.99 cM(chr.10)到164.4 cM(chr.9)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3遗传连锁图谱及QTL分析结果
-->Fig. 3QTL analysis of watermelon fruit and seeds associated traits on genetic linkage map
-->
Table 4
表4
表4两亲本间SNP变异类型及数量
Table 4The SNP variation types and amount between the two parental materials
| 类型 Type | 数量 Amount | 比率 Ratio (%) | 总数 Total | |
|---|---|---|---|---|
| 颠换 Transversions | AT→TA | 72139 | 30.30% | 238022 |
| AC→CA | 65586 | 27.55% | ||
| TG→GT | 65290 | 27.43% | ||
| CG→GC | 35007 | 14.70% | ||
| 转换 Transitions | CT→TC | 255872 | 49.86% | 513173 |
| AG→GA | 257301 | 50.01% |
新窗口打开
对每条染色体CAPS标记间物理图谱与遗传图谱进行共线性分析,如图4所示,其中第4、5、6、8、10号染色体的物理图谱和遗传图谱共线性关系最好,R2均在0.95以上,表明这几条染色体的CAPS分子标记与参考基因组测序数据有很高的一致性。第2、3、7、9、11号染色体的线性关系较好。1号染色体中物理距离与遗传距离在线性分析中R2值较低,线性关系比较差。
2.5 西瓜果实与种子相关性状QTL分析
利用Windows QTL CartographerV2.5复合区间作图法对BC1P1群体的果实相关性状进行QTL分析,共检测到与果实、种子性状相关的QTL位点15个,分别分布在2、6、8、9号染色体上,如表5和图3所示。其中定位在8号染色体上的QTL数量最多(6个QTL位点)。2.5.1 与可溶性固形物含量相关QTL位点 本研究检测出与中心可溶性固形物含量相关QTL位点3个(CTSS2.1、CTSS2.2、CTSS8.1),其中在2号染色体上检测到2个QTL位点,加性效应分别为0.8343、1.0631,贡献率分别为8.06%、13.04%;在8号染色体上检测到1个QTL位点,加性效应为1.1782,贡献率为15.73%,为主效QTL位点。
与边缘可溶性固形物相关QTL位点1个(ETSS2.1),该位点位于2号染色体上,加性效应为0.6366,贡献率为6.03%。
2.5.2 与果肉硬度相关QTL位点 在果肉硬度方面,共检测出与中心果肉硬度相关QTL位点3个(CFF6.1、CFF6.2、CFF8.1),其中在6号染色体上检测到2个QTL位点,加性效应分别为-0.7941、-0.8626,贡献率分别为8.12%、9.65%;在8号染色体上检测到1个QTL位点,加性效应为-1.0105,贡献率为13.7%。
与边缘果肉硬度相关的QTL位点共2个(EFF6.1、EFF6.2),都位于6号染色体上,加性效应分别为-0.7941和-0.8626,贡献率分别为8.12%和9.65%。
2.5.3 与种皮底色相关QTL位点 在种皮底色方面,本研究检测出与种皮底色相关QTL位点4个(SCC8.1、SCC8.2、SCC8.3、SCC8.4),在8号染色体上检测到4个QTL位点,加性效应分别为-0.8661、-0.5669、-0.8009、-0.8332,贡献率分别为74.59%、29.61%、66.065%、68.79%,4个QTL位点均为主效QTL位点。
2.5.4 与种子百粒重相关QTL位点 本研究检测出与种子百粒重相关QTL位点2个(SHW6.1、SHW9.1),其中6号染色体检测到1个QTL位点,加性效应为-1.6622,贡献率为13.83%;8号染色体检测到1个QTL位点,加性效应为-1.0446,贡献率为5.25%。
Table 5
表5
表5西瓜果实与种子性状相关QTL及其效应分析
Table 5QTL loci and the effects of fruit and seed traits in watermelon
| 性状 Trait | 位点 QTL | 染色体 Chromosome | 相邻标记 Adjacent markers | 图谱位置 Position | 标记区间 Marker range | LOD值 LOD value | 加性效应 Additive | 贡献率 R2 (%) |
|---|---|---|---|---|---|---|---|---|
| 中心可溶性固形物 Center BR | CTSS2.1 | 2 | W34.1—W34 | 29.6 | 28.60—31.21 | 5.16 | 0.8343 | 8.06 |
| CTSS2.2 | 2 | W34—W36 | 36.2 | 31.22—38.57 | 7.58 | 1.0631 | 13.04 | |
| CTSS8.1 | 8 | W163.2—W163.4 | 112.6 | 108.62—116.53 | 9.19 | 1.1782 | 15.73 | |
| 边缘可溶性固形物 Edge BR | ETSS2.1 | 2 | W30—W31 | 12.5 | 11.46—17.23 | 3.21 | 0.6366 | 6.03 |
| 中心果肉硬度 Center FF | CFF6.1 | 6 | W126—W127.1 | 48.7 | 41.73—51.10 | 4.40 | -0.7941 | 8.12 |
| CFF6.2 | 6 | W129.2—W131 | 60.5 | 60.44—61.80 | 6.41 | -0.8626 | 9.65 | |
| CFF8.1 | 8 | W163.2—W163.4 | 112.6 | 108.62—116.53 | 8.04 | -1.0105 | 13.72 | |
| 边缘果肉硬度 Edge FF | EFF6.1 | 6 | W126—W127.1 | 48.7 | 41.73—51.12 | 4.38 | -0.4463 | 9.12 |
| EFF6.2 | 6 | W129.2—W131 | 60.5 | 60.44—61.80 | 5.14 | -0.4360 | 8.65 | |
| 种皮底色 Seed coat color | SCC8.1 | 8 | W179—W179.2 | 30.7 | 20.69—31.74 | 13.29 | -0.5669 | 29.61 |
| SCC8.2 | 8 | W179.2—W179.3 | 20.4 | 19.29—20.69 | 48.60 | -0.8009 | 66.06 | |
| SCC8.3 | 8 | W180—W180.1 | 16.4 | 14.04—16.42 | 68.69 | -0.8661 | 74.59 | |
| SCC8.4 | 8 | W180.1—W180.2 | 12.8 | 11.74—14.04 | 54.11 | -0.8332 | 68.79 | |
| 种子百粒重 100-seed weight | SHW6.1 | 6 | W123—W124 | 26.7 | 23.65—30.84 | 7.71 | -1.6622 | 13.83 |
| SHW9.1 | 9 | W207—W208 | 157.8 | 152.25—157.82 | 3.42 | -1.0446 | 5.25 |
新窗口打开
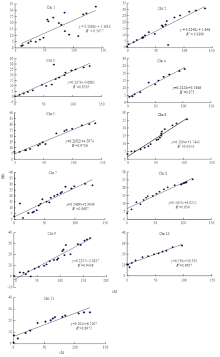 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4物理距离与遗传距离间共线性关系
-->Fig. 4Colinearity between the physical map and genetic map
-->
3 讨论
3.1 SNP标记挖掘及转化CAPS标记
前人研究指出由于西瓜遗传距离较近,因此多态性较低,本研究中所用到的CAPS标记是基于亲本重测序数据开发获得,多态率为44.44%,因此更具有针对性。基于父母本双亲重测序数据,各作物CAPS标记的多态性从39.50%—56.83%[16]。基于重测序数据所开发的CAPS标记更准确、有效。张成才等[17]从茶树ESTs中挖掘的后选SNPs进行重测序验证,将SNP转化为CAPS。POOTAKHAM等[18]基于高通量测序技术得出有关橡胶树的SNP位点,在27个SNP标记中,有10个标记在28份材料中检测出多态性。束永俊等[19]基于大豆重测序数据,共设计139个CAPS标记,其中79对引物具有酶切多态性,多态率为56.83%。由于CAPS标记可以通过简单的PCR、酶切以及琼脂糖电泳完成,将SNP标记转化为CAPS标记可提升SNP标记在西瓜分子遗传育种中的应用进程。明确SNP位点分布情况可以更加高效精确进行遗传图谱构建及基因精细定位。3.2 基于亲本基因组重测序分子标记的开发及遗传图谱的构建
自2000年拟南芥基因组序列最先被测序以来[20],一些园艺作物全基因组测序逐步完成,如萝卜、黄瓜、茄子等[21-23],西瓜基因组测序的完成为分子标记开发以及基因定位等提供了新的途径[24]。对不同西瓜种质资源进行全基因组重测序并挖掘全基因组SNP位点,构建遗传连锁图谱定位重要农艺性状的主效基因已成为西瓜分子遗传育种研究中一个重要研究内容[25-27]。本研究利用基于父母本材料全基因组重测序数据开发的200个CAPS标记在回交群体内构建一张遗传距离全长为1 376.95 cM,标记间的平均遗传距离为6.88 cM的高密度遗传图谱图谱,本研究所开发的CAPS标记其基因组座位已知,可以明确其物理距离,便于日后开展图谱加密及基因精细定位等研究工作,且CAPS与其他分子标记(如SSR、RAPD、AFLP等)相比具有多态性高、DNA用量少、操作简便等优点[28]。本研究所用BC1P1群体,相比以往基于F2及RIL群体的基因定位研究[6,10,29],拥有大量的来自轮回亲本的基因片段,便于定位从野生亲本导入栽培品种的特有基因。在其他植物中,如模式植物拟南芥中,BC1P1群体也经常被用来做QTL分析[30-32]。分子标记不能完全覆盖整个基因组,是限制西瓜重要农业性状相关QTL分析及分子遗传育种的重要因素。分子标记的物理距离与遗传距离共线性分析是衡量分子标记分布与遗传图谱构建的重要参考[33]。在本研究中,大部分染色体的物理图谱距离和遗传图谱距离表现出较好的共线性,表明本研究使用的CAPS标记能很好地覆盖基因组。而第1号染色体中物理距离与遗传距离在线性分析中R2值较低,线性关系比较差,原因可能是这些CAPS标记的遗传图谱距离与物理图谱距离存在较大差异,使遗传距离与物理图谱距离共线性较差[32]。
3.3 西瓜果实与种子相关性状QTL分析
西瓜果实糖含量及果肉硬度是影响西瓜果实商品性的重要农艺性状,由于可溶性固形物含量的测定简单迅速,西瓜中心部位和边缘部位可溶性固形物含量与各种糖含量均呈极显著正相关,通常用可溶性固形物的含量评价西瓜的甜度[29]。近年来,随着食用型西瓜种子的商品化,对西瓜种子相关性状的研究也变得越来越来重要。在本研究中所定位果实(可溶性固形物含量及硬度)与种子性状(百粒重及种皮底色)相关QTL位点共15个,贡献率从5.25%(种子百粒重SHW9.1)—74.5%(种皮底色SCC8.1)。研究表明西瓜的可溶性固形物、果肉硬度、种子百粒重受多基因控制,为数量性状[6]。在番茄、甜瓜、南瓜等经济作物中,关于可溶性固形物含量遗传规律的研究也表明这些重要的农艺性状也受多基因调控[34-36]。在西瓜果实可溶性固形物含量相关QTL分析的研究中,郭绍贵等[29]对RIL群体在3个不同环境下的可溶性固形物含量性状进行QTL分析定位,共测到了分布在不同连锁群上18个QTL位点。在西瓜基因组公布后,REN等[9]利用多种类型标记在两个RIL和两个F2群体内构建了一张整合遗传图谱将可溶性固形物相关的QTL位点定位到第1、2、6、7、8号染色体上,且两个主效QTL(Qbrix2-1、Qbrix2-2)均位于2号染色体上。CHENG等[10]也在F2群体内将中心可溶性固形物含量定位于2号染色体上。本研究在回交群体中仍将中心可溶性固形物定位于第2、8号染色体上,将边缘可溶性固形物含量定位于第2号染色体上,表明位于第2号染色体上与西瓜果实糖含量相关的主效QTL受群体类型和环境变化影响较小,但定位区间较大,候选较多,需进一步深入研究。在果实硬度相关QTL分析的研究中,刘传奇等[6]将与西瓜果实中心硬度以及果实边缘硬度相关QTL位点均定位在第6号染色体中,两位点相邻中间间隔一个标记。本研究将西瓜中心果肉硬度定位于6、8号染色体上,表明中心果肉硬度可能受多基因控制;将边缘果肉硬度定位于6号染色体上,且在6号染色体上的分别与中心和边缘果肉硬度相关的QTL位点定位在相同区间,中心和边缘果肉硬度也有显著的正相关性(R2=0.700,P<0.01),表明西瓜果实中心和边缘果肉硬度可能受相同的基因调控。此外,果实中心硬度相关的QTL位点CFF8.1和与果实中心可溶性固形物相关的QTL位点CTSS8.1位于8号染色体同一位置,相关性分析结果也表明两者间极显著相关(R2=-0.368,P<0.01),表明西瓜果肉硬度与糖分积累可能存在一定的相关性,且该区间内可能存在一因多效的现象,有待进一步的深入研究。
西瓜种皮底色受多种因素影响,例如种子的水分含量[37],色素种类及含量[38],基因调控[12]等,其中基因调控被普遍认为是影响种皮底色的主要因子。MCKAY等[12]最早对西瓜种子皮色进行了研究,认为种子皮色主要由3个基因控制。本研究共定位出4个与种皮底色相关的QTL位点,均分布于8号染色体上,其中SCC8.3、SCC8.4贡献率均大于60%(其加性效应分别为-0.8661、-0.8332),本研究结果与MCKAY等[12]研究结果不一致,可能是由于作图群体、连锁图谱和环境条件的不同。在其他作物中种皮底色也受多基因调控,如芝麻,ZHANG等[39]利用六世代群体检测到4个与芝麻种皮底色相关的QTL位点,表明芝麻种皮底色由多个主效基因控制。种子百粒重是衡量西瓜种子饱满度及其他品质的重要标准。陈璐璐等[40]研究表明,黄瓜种子百粒重为数量性状,受多基因控制。REN等[9]整合了利用RILs和F2群体构建的四张连锁图谱,将与西瓜种子百粒重相关的1个QTL位点定位在6号染色体上。百粒重与种子大小有着显著的相关性,周慧文等[41]利用CAPS标记在F2代群体中进行QTL分析,研究认为西瓜种子大小性状相关的候选基因在6号染色体上。本研究共定位出与种子百粒重相关位点QTL位点2个,分别位于6、9号染色体上。与前人研究相对比,本研究结果不仅印证影响西瓜种子百粒重的主效QTL在不同环境中、不同群体内仍然在6号染色体上,同时检测到了更多的微效QTL。
4 结论
基于双亲的全基因组重测序数据共挖掘了751 532个SNP位点,根据7种内切酶的酶切位点信息将其转化为450个CAPS标记,筛选出其中覆盖全基因组且具有多态性的200个CAPS标记。对225个单株组成的BC1P1群体进行基因分型及遗传连锁图谱构建,该图谱包含11条染色体,覆盖长度1 376.95 cM,标记间的平均遗传距离为6.88 cM。QTL分析结果表明,检测到控制西瓜中心可溶性固形物、边缘可溶性固形物、中心果肉硬度、边缘果肉硬度、种子百粒重、种皮底色等6个性状的15个QTL位点,主要分布于2、6、8号染色体上,其中包括5个大于15%的主效QTL位点(CTSS8.1、SCC8.1、SCC8.2、SCC8.3、SCC8.4)。研究结果为进一步开展西瓜果实与种子相关性状主效基因的精细定位及克隆奠定了理论依据。The authors have declared that no competing interests exist.
