0 引言
【研究意义】支链酮酸脱氢酶β(branched chain keto acid dehydrogenase β, BCKDHB)是支链氨基酸转化为支链脂肪酸的重要催化剂,是脂肪组织代谢中的重要调控因子[1]。MicroRNAs(miRNAs)是一类由19—22个核苷酸组成的非编码小分子RNA,通过自身种子序列与靶基因特定位点的碱基配对,造成mRNA的降解,或者抑制mRNA的翻译[2]。很多生物信息学软件可根据靶基因序列预测理论上有结合位点的miRNAs[3]。笔者前期试验通过在线软件预测得到miR-433-3p与BCKDHB的靶标关系,然而目前关于miR-433-3p的研究多是关于癌症的发生和发展[4]。本研究旨在探讨miR-433-3p与BCKDHB的靶标关系及其对绵羊前体脂肪细胞分化的影响。【前人研究进展】有关miRNAs调控脂肪代谢的研究已有报道。例如,miR-103可加速甘油三酯的积聚,miR-107在肥胖大鼠中表达上调,促进脂肪生成[5];miR-758表达下调,可导致abca1(ATP binding cassette subfamily A member 1)基因表达量降低,减少胆固醇的聚集[6];miR-302a参与肝脏脂肪酸代谢[7];miR-27a/b促进脂蛋白酯酶(lipoprotein lipase, LPL)的表达[8];过表达miR-122会导致胆固醇和脂肪酸代谢的紊乱[9]。MiR-143通过下调ERK5(mitogen-activated protein kinase 5)基因抑制前体脂肪细胞的分化[10]。MiR-1、miR-206和miR-133在白色脂肪组织和棕色脂肪组织间也存在差异表达[11]。这些研究表明miRNAs在调控脂肪代谢中发挥重要功能。BCKDHB参与支链氨基酸转变为支链脂肪酸的过程和丙酸代谢反应,并在通路分析过程中发现BCKDHB基因参与脂肪代谢[12]。笔者前期的研究初步发现,miR-433-3p与绵羊的BCKDHB 3′-UTR有潜在的结合位点。所以推测,在绵羊脂肪细胞中miR-433-3p可以调控BCKDHB的表达。然而,miR-433-3p对脂肪代谢相关基因的调控研究未见报道。已有的报道表明,miR-433-3p可负向调控肿瘤相关基因参与癌症的发生[13],或作用于SMG5(nonsense mediated mRNA decay factor)的3′ UTR参与非线粒体衍生物(no mitochondrial derivative, NMD)通路[14],或通过结合Runx2(runt related transcription factor 2)mRNA抑制由BMP2(bone morphogenetic protein 2)诱导的成骨细胞分化等[15]。【本研究切入点】目前对BCKDHB在支链氨基酸代谢通路中的作用已经明确,但miR-433-3p对BCKDHB的靶向作用尚不清楚。【拟解决的关键问题】本研究旨在研究绵羊前体脂肪细胞中miR-433-3p对BCKDHB的调控。利用生物信息学软件预测miR-433-3p与绵羊BCKDHB的靶标关系,通过双荧光素酶报告系统验证靶标关系。将miR-433-3p过表达合成物(Mimics)转染到绵羊前体脂肪细胞中。检测BCKDHB mRNA和蛋白的表达量。对绵羊前体脂肪细胞进行诱导分化,对分化过程中脂滴的积累进行鉴定,并分析miR-433-3p和BCKDHB表达量的变化。由此,可解析miR-433-3p调控BCKDHB的表达机制,并为进一步研究miR-433-3p在绵羊前体脂肪细胞分化中的作用提供依据。1 材料与方法
1.1 试验材料
1.1.1 生物试剂 引物、miRNA Mimics、miRNA NC(negative control)购自上海生工有限公司;DMEM/F12购自Hyclone;胎牛血清购自四季青公司;快速琼脂糖凝胶回收DNA试剂盒、pUC-T质粒、PAGE制胶试剂、ECL发光液购自北京康为世纪有限公司;Trizol购自Sigma公司;质粒提取试剂盒购自Omega公司;50×TAE、LB固体培养基和液体培养基购自北京索莱宝公司;哺乳动物全蛋白提取试剂盒、BCA试剂盒购自江苏凯基生物公司;限制性内切酶Xho I及Xba I、RT-PCR Kit购自Takara公司;LipofectamineTM3000转染试剂购自Invitrogen公司;用于Western blotting的抗体购自武汉三鹰生物技术有限公司。1.1.2 试验样品的采集 采集约4月龄绵羊的尾部脂肪组织用于试验研究。采集过程为:用无菌的剪刀、镊子剪下大小适中的尾部脂肪组织块(太谷县羊肉加工屠宰厂),在装有含1%双抗(青霉素和链霉素)的无菌PBS的培养皿中冲洗,浸泡于15 mL离心管中。置于冰盒暂存,1 h内送回实验室。本研究所有试验均于2016年6月到2017年3月在山西农业大学动物科技学院遗传育种与繁殖实验室完成,其中测序工作由华大基因生物科技有限公司完成。
1.2 试验方法
1.2.1 靶标关系预测 用TargetScan、miRanda和DIANA-microT 3个软件对BCKDHB进行miRNAs的预测。挑选miRSVR score(miR support vector regression score)在0.7及其以上的miRNAs,便于进一步筛选并保证结果的可靠性。并使用Bioinformatics & Evolutionary Genomics在线软件制作韦恩图得到3个软件预测的交集miRNAs。1.2.2 引物设计 根据GenBank公布的绵羊BCKDHB序列,利用Primer 5.0设计BCKDHB 3′-UTR和CDS (coding sequence)引物。根据miRNABase公布的miR-433-3p的成熟序列,设计miR-433-3p的引物。内参引物采用公布的RPL13和U6引物序列。所用引物序列见表1。
Table 1
表1
表1PCR引物序列
Table 1Primer sequences for PCR
| 基因 Gene | 引物序列 Primer sequence |
|---|---|
| BCKDHB 3′-UTR | F: CGCTCGAGCGGACCAGGAAGATCATGACCAGAC R: CTAGTCTAGACTAGTTCGCAGCTCATCAGCCAAT |
| BCKDHB CDS | F: CCTCCGAGATCAGCTCAACG R: AGGGCATCATAGCACTTCCAC |
| RPL13 | F: ATCCACAAGAAGACAGCCCG R: GGACCGGTACTCTTTCAGGC |
| miR-433-3p | F: ACACTCCAGCTGGGATCATGATGGGCTCCT R: CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGA GACACCGAG |
| U6 | F: CTCGCTTCGGCAGCACA R: AACGCTTCACGAATTTGCGT |
新窗口打开
1.2.3 目的片段扩增与克隆 根据设计的引物,对BCKDHB 3′-UTR进行PCR扩增。体系为7.6 μL的2×Taq master mix,6 μL的ddH2O,上下游引物各0.6 μL,1 μL的cDNA。对扩增产物进行1%琼脂糖凝胶电泳检测。紫外照射下找出与设计的PCR产物相同长度的目的片段,割胶回收并纯化目的片段。
将纯化的目的DNA过夜连接至pUC-T质粒中。连接体系为:1 μL的pUC-T质粒,4 μL的目的片段和5 μL的2×Solution Buffer。连接后转化至感受态细胞,并涂至LB固体培养基(提前吸收完全蓝白斑筛选的X-gal和IPTG)进行菌落的过夜培养。待出现蓝白斑后,进行白斑的筛选,挑取单菌落在LB液体培养基中摇菌。之后进行保菌,并送公司测序。
1.2.4 重组质粒构建及双酶切鉴定 将上述连有目的片段并测序正确的克隆载体pUC-T和Pmir-GLO(双荧光素酶报告基因载体)重组,构建双荧光素酶报告载体,以3 μL的Pmir-GLO、5 μL 的DNA片段(已连接pUC-T)、1 μL 的T4连接酶和1 μL的T4 Buffer为连接体系。过夜连接后进行感受态细胞的转化后,均匀涂至LB固体培养基(完全吸收氨苄)进行菌落的过夜培养。待出现白斑后,挑取单菌落在LB液体培养基中摇菌。进行菌液PCR验证阳性单克隆载体,并送公司测序。
对构建成功的重组质粒进行双酶切鉴定。酶切体系为:10×QuickCut Buffer 5 μL,DNA插入片段1 μg,QuickCut Xho I及Xba I各1 μL。轻轻混匀后瞬时离心,并在37°C下保温2 h。
1.2.5 细胞培养 以含20%胎牛血清、1%双抗的DMEM/F12为培养基,在37°C,5% CO2的培养箱中培养绵羊前体脂肪细胞。并以10%胎牛血清、1%双抗的DMEM/High glucose的培养基将HEK-293T细胞培养在37°C,5% CO2的培养箱中。
1.2.6 共转染验证靶标关系 用LipofectmineTM3000转染试剂分3组进行转染:过表达组(Mimics组),转染目的片段的重组质粒和miR-433-3p mimics;阴性对照组(NC组),转染目的片段的重组质粒和NC;空白对照组(Blank组),仅转染含目的片段的重组质粒。转染用量参照LipofectmineTM3000转染试剂说明书。转染72 h后,收集细胞,使用双荧光素酶报告系统检测细胞的荧光活性。
1.2.7 单转染后基因和蛋白的表达 用LipofectmineTM 3000转染试剂分2组进行转染,即过表达组(Mimics组)和阴性对照组(NC组)。转染36 h后,Trizol裂解细胞提取总RNA,并参照反转录试剂盒进行反转录。转染48 h后,使用全蛋白提取试剂盒提取总蛋白。
一步法反转录的cDNA用于miR-433-3p的RT-qPCR定量分析。两步法反转录的cDNA用于BCKDHB的定量分析,反应体系参照Takara反转录试剂盒说明书。对miR-433-3p及BCKDHB进行RT-qPCR定量分析,反应体系参照Takara RT-qPCR试剂盒说明书。
BCKDHB蛋白量用Western blotting检测。使用10%聚丙烯酰胺凝胶电泳2 h,冰上转膜1 h,脱脂奶粉封闭1 h。PBST稀释3 000倍的一抗(兔源)过夜孵育,PBST稀释1 000倍的二抗(驴抗兔)孵育1 h。用PBST清洗2—3遍后对硝酸纤维素膜(NC膜)上的蛋白条带进行ECL曝光显影。
1.2.8 绵羊前体脂肪细胞的诱导分化 用完全培养基DMEM/F12(10%胎牛血清,1%双抗)培养绵羊前体脂肪细胞2 d。待细胞融合度达80%—90%以后,更换为分化培养基(89% DMEM F12,10%胎牛血清,1%双抗,250 μmol·L-1 IBMX,500 μM DEX,8 μmol·L-1胰岛素),为试验周期的第0、2天后改用维持培养基(89% DMEM/F12,10%胎牛血清,1%双抗,10 μmol·L-1 胰岛素)继续培养4 d。
1.2.9 油红O染色 0.5 g油红O干粉溶于少量异丙醇中,定容至100 mL,过滤后与ddH2O 以3:2的比例混合最大转速离心5 min除去沉淀,制成油红O工作液。分化2,4,6 d的细胞每孔加入10%甲醛溶液,过夜固定。用60%异丙醇浸泡细胞5 min后,加入油红O工作液染色10 min。最后用ddH2O清洗4次,在倒置显微镜下观察并采集图像。
1.3 数据分析与处理
试验数据均采用Excel整理,使用SPSS19.0软件对共转染组以Mimics、NC、Blank处理组为变量进行方差分析,以Mimics、NC组为变量对单转染组中BCKDHB表达量进行独立样本t检验,对分化过程中BCKDHB和miR-433-3p在0、2、4、6 d的表达量分别进行多重比较的方差分析。使用GraphPad Prism 6.0制作试验结果中重组质粒荧光活性和过表达miR-433-3p后miR-433-3p、BCKDHB表达量的直方图,以及诱导分化过程中miR-433-3p和BCKDHB表达量的折线图。2 结果
2.1 预测的靶标关系
基于BCKDHB序列,在miRSVR score为0.7时,用TargetScan、miRanda和DIANA- microT分别预测到41、4和313个miRNAs。图1显示的是这些软件预测到的3个共同miRNAs,即miR-433-3p、miR-132-3p和miR-212-3p。3个miRNA与BCKDHB均有较高的A-U互补位点。miR-433-3p与BCKDHB的3′ UTR的第8—28个碱基有结合位点,miR-132-3p和miR-212-3p在第201—220个碱基有结合位点,但miR-132-3p本课题组已有研究,且miR-132-3p和miR-212-3p与BCKDHB 3′-UTR有相同的结合位点,有相似碱基序列。所以本试验将miR-433-3p作为研究对象。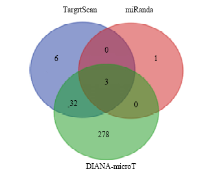 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1TargrtScan,miRanda和DIANA-microT软件预测的与BCKDHB 3°-UTR结合的miRNAs
-->Fig. 1The miRNAs bound with BCKDHB 3°-UTR predicted by TargetScan, miRand and DIANA-microT
-->
2.2 构建的重组质粒
以构建的含目的片段和Pmir-GLO重组质粒菌液为模板,对目的片段进行扩增。经琼脂糖凝胶电泳得到138 bp的目的片段,并对重组质粒进行菌液PCR、双酶切鉴定。同时,公司测序结果验证了重组质粒构建成功(图2)。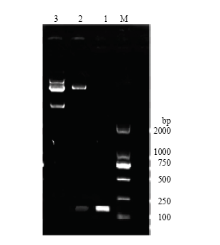 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2菌液PCR和双酶切鉴定的重组双荧光质粒(M:DL2000 marker;1:重组双荧光质粒菌液PCR鉴定;2:重组双荧光质粒的双酶切鉴定;3:正常双荧光质粒电泳)
-->Fig. 2Identified recombinant dual-fluorescence plasmid with bacterial-liquid PCR and double digestion (M: DL2000 marker; 1: Identified recombinant dual-fluorescence plasmid by bacterial-liquid PCR; 2: Identified recombinant dual-fluorescence plasmid by double digest protocol; 3: Electrophoresis of dual-fluorescence plasmid)
-->
2.3 双荧光素酶活性
荧光活性检测结果表明,过表达组Pmir-GLO重组质粒的荧光活性(2.54±0.26)显著低于(P<0.01)阴性对照组(4.67±0.24)和空白对照组(5.85±0.13),而阴性对照组与空白对照组间的荧光活性无显著差异。由此说明,miR-433-3p与BCKDHB 3′-UTR有靶标关系(图3)。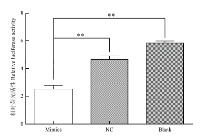 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3BCKDHB基因3′-UTR重组双荧光质粒的相对荧光活性(NC:阴性对照组;Mimics: 过表达miR-433-3p;Blank:空白对照组;)
-->Fig. 3The relative luciferase activity of BCKDHB 3′-UTR recombinant dual-fluorescence plasmid (NC: Negative control; Mimics: Overexpressing miR-433-3p; Blank: Transfected recombinant dual-fluorescence plasmid)
-->
2.4 过表达miR-433-3p后BCKDHB的表达量
图4给出的是过表达组和阴性对照组的miR-433-3p和BCKDHB的表达量。组内比较表明,miR-433-3p表达量高时,无论是对照组还是过表达组的BCKDHB表达量低;反之,BCKDHB的表达量则高。组间比较表明,过表达组miR-433-3p的表达量(4.89±0.32)高于阴性对照组(0.69±0.15)(P<0.01),表明成功过表达了miR-433-3p;而过表达组BCKDHB的表达量(0.25±0.02)低于阴性对照组(1.03±0.02)(P<0.01),表明过表达miR-433-3p后,绵羊前体脂肪细胞中BCKDHB的表达量显著降低。这些结果充分说明miR-433-3p负调控BCKDHB的表达。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4miR-433-3p和BCKDHB在过表达miR-433-3p前后的表达变化(NC:阴性对照;Mimics:过表达miR-433-3p)
-->Fig. 4The expression changes of miR-433-3p and BCKDHB pre- and post-overexpression of miR-433-3p (NC: Negative control; Mimics: Overexpression of miR-433-3p)
-->
2.5 过表达miR-433-3p后BCKDHB蛋白的表达量
图5给出的是转染48 h后收取的细胞进行的Western blotting定量分析。可见,过表达组的BCKDHB蛋白表达量低于阴性对照组(P<0.05)。这一结果说明,过表达miR-433-3p下调BCKDHB mRNA表达的同时,也下调了BCKDHB蛋白的表达。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5过表达miR-433-3p前后BCKDHB蛋白的表达(NC:阴性对照;Mimics:过表达miR-433-3p;β-actin:内参)
-->Fig. 5Expressions of BCKDHB protein pre- and post- overexpression of miR-433-3p (NC: Negative control; Mimics: Overexpression of miR-433-3p; β-actin: Reference)
-->
2.6 BCKDHB及miR-433-3p表达对脂肪细胞分化的影响
绵羊前体脂肪细胞分化2 d的细胞形态如图6-A 所示,视野中有少量脂滴聚积;图6-B给出的是分化4 d时的细胞形态,视野中脂滴数量相对于2 d有所增多;当分化到6 d时,如图6-C所示,有大量的脂滴聚积。图7给出的3张图分别为绵羊前体脂肪细胞分化2,4,6 d时的油红O染色,可以看到随着细胞的分化进程,染色的脂滴数越来越多,脂滴形态也逐渐增大。以上结果说明绵羊前体脂肪细胞逐渐分化成成熟的脂肪细胞。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6分化2,4和6天的绵羊前体脂肪细胞(A:分化2天的前体脂肪细胞细胞;B:分化4天的前体脂肪细胞;C:分化6天的前体脂肪细胞)
-->Fig. 6The ovine preadipocytes of 2 , 4 and 6 day during differentiation(A: The preadipocytes of 2 day during differentiation; B: The preadipocytes of 4 day during differentiation; C: The preadipocytes of 6 day during differentiation)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7细胞在分化2,4和6天的油红O染色(A:分化两天后油红O染色的前体脂肪细胞细胞;B:分化4天后油红O染色的前体脂肪细胞;C:分化6天后油红O染色的前体脂肪细胞)
-->Fig. 7The ORO stain of 2, 4 and 6 day during differentiation(A: The ORO stain of 2 day during preadipocytes differentiation; B: The ORO stain of 4 day during preadipocytes differentiation; C: The ORO stain of 6 day during preadipocytes differentiation)
-->
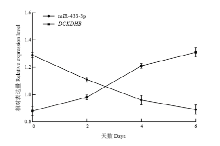
图8给出的是绵羊前体脂肪细胞经过诱导分化,在0、2、4、6 d BCKDHB和miR-433-3p的表达量。结果显示,绵羊前体脂肪细胞在胰岛素的刺激下开始分化,BCKDHB在0 d(0.88±0.02)—2 d(0.98±0.01)间表达量逐渐上升。随着维持分化培养基中胰岛素浓度的升高,BCKDHB的表达量从2—4 d(1.21±0.01)过程中快速上升。之后生成的脂滴积累,BCKDHB从4—6 d(1.31±0.02)缓慢上升,BCKDHB的表达量趋于平稳。miR-433-3p的表达量在脂肪开始分化0 d(1.29±0.01)—2 d(1.11±0.01)快速下降,到6 d(0.89±0.02)脂肪积累增多时平稳下降。这些结果说明,在绵羊前体脂肪细胞诱导分化过程中,miR-433-3p和BCKDHB基因存在负调控关系。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8BCKDHB和miR-433-3p在不同分化天数中的表达变化
-->Fig. 8The expression levels of BCKDHB and miR-433-3p during preadipocyte differentiation
-->
3 讨论
经预测的与BCKDHB 3′-UTR结合的miRNAs有3个。其中,miR-132-3p和miR-212-3p的序列分别为:5′-UAACAGUCUACAGCCAUGGUCG-3′和5′-UAAC AGUCUCCAGUCACG -3′。即这两个miRNAs有相同的成熟序列,且在种子区有8个相同的碱基,说明二者为基因簇,并有相似的功能[16]。本课题组已就miR-132-3p对BCKDHB的表达调控进行了研究,试验还在进行中,还未做出结果。因此,本文研究miR-433-3p对BCKDHB的调控机制,miR-132-3p与miR-433-3p是否共同影响BCKDHB的表达还需后续进一步的研究。MiR-433-3p在其他物种中也有重要的调控作用。MiR-433-3p在人类肿瘤的发生和发展中发挥着广泛的作用很早就有研究报道,并对人类脑胶质瘤中miR-433-3p和miR-433-5p的作用做出了探究,发现miR-433-3p可负调控CREB控制胶质瘤的发生和转移,以此推测miR-433-3p可作为一个潜在的脑胶质瘤细胞的标识和诊断对象[17-18]。在HeLa细胞中,miR-433-3p负向调控TYMS(胸苷酸和酶)对5-氟尿嘧啶的敏感性抑制肿瘤的转移[19]。miR-433- 3p还抑制人肝癌细胞的迁移和造血干细胞生长增生引起的骨髓增生性的肿瘤发生[20-21]。也有报道说明,在鼠中miR-433-3p通过靶向调控DKK1(成骨分化基因)调控成骨细胞的分化[22]。本试验主要研究miR-433-3p在绵羊前体脂肪细胞中对BCKDHB的调控作用。
基因表达受复杂的分子网络调控。关于miRNA对BCKDHB的表达调控研究已有报道。例如,在大鼠体内过表达miR-277,可抑制BCKDHB的表达,阻碍支链氨基酸的分解,抑制脂肪的生成[23]。本研究中,过表达miR-433-3p,导致BCKDHB表达量下降。这些研究说明,BCKDHB的表达不只受单个miRNA的调控。此外,BCKDHB表达还受上游基因和转录因子的调控。支链氨基酸转移酶基因BCAT2是BCKDHB的上游基因,敲除BCAT2后,可促进BCKDHB在小鼠性腺周围脂肪中的表达,加速支链脂肪酸的生成,导致血液中的支链氨基酸浓度比正常浓度低,同时也导致了边缘脂肪组织中BCKDHB的表达量上升[24-26]。在BCAA代谢通路中BCAT2和BCKDHB参与的生化反应为可逆反应,通过营养调控在日粮中添加亮氨酸提高BCAT2的表达,从而导致BCKDHB的消耗增加,相对表达量下降[26-28]。另外,过氧化物酶体增殖物激活受体PPARγ是调控脂肪细胞分化的一个关键转录因子。摄入大量的PPARγ配体,可提高BCKDHB的转录活性,提高其表达量[29],与前人研究结果类似,本研究改变了调控BCKDHB的因素miR-433-3p,结果抑制了BCKDHB的表达。
本研究中,BCKDHB与miR-433-3p在绵羊前体脂肪细胞分化中的表达有一定的相关性,即前者随细胞分化表达量提高,后者则表达量降低。在已有的报道中,对3T3-L1前体脂肪细胞诱导分化0—6 d,BCKDHB表达量逐渐上升,利用PPARγ配体和罗格列酮(RSG)处理促进细胞分化,显著提高了BCKDHB的表达量[24]。这一趋势与本研究中BCKDHB的表达趋势一致,但其未检测调节miRNAs的表达情况。CHAVALI等报道,miR-433-3p在小鼠前体脂肪细胞分化过程中的表达量也随分化时间而下降[29]。这一结果与本文中的miR-433-3p表达趋势一致。说明miR-433-3p通过调节靶基因影响脂肪细胞分化。此外,过表达miR-433-3p会抑制成骨细胞分化的标志基因的表达量[15],说明miR-433-3p还影响成骨细胞的分化。
4 结论
经理论预测,miR-433-3p与BCKDHB的3°-UTR存在结合位点;经试验验证,过表达miR-433-3p会抑制BCKDHB基因和蛋白的表达;在绵羊前体脂肪细胞分化中,二者存在负相关关系。这些结果充分说明BCKDHB与miR-433-3p间的靶标关系,为进一步研究BCKDHB调节绵羊脂肪代谢的分子机理奠定了理论基础。The authors have declared that no competing interests exist.
