0 引言
【研究意义】冬小麦生育时期中幼苗期是形成根、叶片、分蘖等器官的重要时期,是培育壮苗、为夺取小麦高产奠定基础的关键时期,而此阶段也是小麦对土壤氮素含量的敏感期[1-2]。因此,研究小麦壮苗发育的生理机制及其对栽培措施的响应,对小麦品种选育、生育前期栽培管理等具有重要理论参考意义。【前人研究进展】氮素是作物生长发育必需的营养元素,氮肥运筹和施肥技术的改善是获取作物高产的重要措施[3-4]。前人研究表明适当增施氮肥可显著提高作物叶片叶绿素含量,提高抗氧化酶活性,延缓衰老,提高小麦光合性能[5-6]。但近年来研究发现过高的氮肥投入对作物产量提升的作用减弱,不仅使得氮肥利用率降低[7],而且流失的氮素进入水体、大气,造成环境污染[8-9]。此外,过高的施氮量也不利于作物个体的生长发育,研究表明基肥施氮量过大导致小麦苗期分蘖发生增多,生育后期小麦植株个体间相互遮挡,群体中下部透光弱[10],降低植株茎秆木质素含量,导致茎秆细弱抗倒伏能力降低[11]。因此,研究氮肥农艺管理措施对小麦高产高效生产有重要意义[12]。植物激素如细胞分裂素(CTK)、生长素(IAA)、脱落酸(ABA)等在作物生长发育中,尤其在氮素吸收代谢进程中起着重要作用[13-14]。同时,氮素供应也影响内源激素的合成代谢,两者相互作用调控作物发育[15]。增加氮素供给可促进细胞分裂素合成[16],细胞分裂素则增强硝酸还原酶活性,提高叶片氮素同化能力[17]。低氮素下茎中IAA向根系运输,且根系中IAA合成增强,促使根系伸长[18-19]。氮肥和CTK对谷子植株发育有显著交互作用[20]。外源CTK与适量氮肥配合施用可提高小麦花后叶片的光合性能,提高籽粒产量[21]。【本研究切入点】施氮对小麦生长发育影响的研究已有报道,但外源细胞分裂素对不同氮素水平下小麦苗期叶片光合性能、内源激素和产量形成的影响需要深入研究。【拟解决的关键问题】通过分析不同氮素水平与外源6-BA配合对小麦产量及产量构成因素、苗期地上部植株干重、叶片叶绿素含量、硝酸还原酶和谷氨酰胺合成酶活性、荧光参数和内源激素含量等影响,研究两种氮素水平下外源激素改善幼苗光合性能的生理机制,以期为喷施外源激素调控小麦生长提供理论依据。1 材料与方法
1.1 试验设计
试验包括室外大田试验和室内营养液培养试验。田间试验于2014—2015年在山东省泰安市山东农业大学农学试验农场进行。试验地耕层(0—20 cm)土壤含有机质14.7 g·kg-1、全氮1.24 g·kg-1、速效氮87.2 mg·kg-1、速效磷9.6 mg·kg-1、速效钾85.3 mg·kg-1。选用济麦22(JM22)为试验材料,种植密度为300×104株/hm2。前茬为玉米,籽粒收货后秸秆全部田。采用随机区组设计,以氮肥为主区,喷施激素为副区。试验以尿素作氮源设2个施氮水平,以纯氮计,低施氮量120 kg·hm-2、常规施氮量240 kg·hm-2。于小麦3叶期(GS13[22]),分别于7:00和19:00叶面喷施浓度为30 mg·L-1的人工合成细胞分裂素(6-BA)和300 mg·L-1洛伐他汀(lovastatin)(一种细胞分裂素合成抑制剂),清水为对照,6-BA和lovastatin试剂的溶解及喷施浓度分别参照XU等[23]和CROWELL等[24]的方法。试验共设置6个处理,即N1、N1+6-BA、N1+Lov、N2、N2+6-BA、N2+Lov。为使激素能更好地附着于叶片,激素及清水均含0.5%的吐温-20,连续喷施2 d。试验小区面积9 m2,各小区10行种植,行距0.25 m,行长3 m,随机区组排列。磷肥用量为100 kg P2O5·hm-2,钾肥用量为100 kg K2O·hm-2。播种前基施50%氮肥和全部磷钾肥,拔节期(GS31)追施50%氮肥。其他田间管理同一般高产田。室内试验的小麦种植于RXZ-500D人工气候培养箱(宁波江南仪器厂,浙江宁波市)。小麦种子用1%次氯酸钠浸泡30 min,再用去离子水冲洗多次去除残留次氯酸钠,在去离子水中浸泡催芽。挑选大小一致露白的种子,以珍珠岩代替土壤,种植于塑料花盆中(高15 cm,直径15 cm),每盆播种10株,花盆放置在塑料盒(50 cm×40 cm×10 cm)中,每盒6盆。每盒倒入1.5 L营养液,每日更换。营养液成分如下:以硝酸铵为氮源,设置高氮(3.75 mmol·L-1)和低氮(0.63 mmol·L-1)两个水平。营养液其他成分分别为4 mmol CaCl2,5 mmol KCl,4 mmol MgSO4,1 mmol KH2PO4,25 μmol Fe-EDTA,0.5 μmol H3BO3,0.74 μmol MnSO4,0.27 μmol ZnSO4,0.001 μmol CuSO4,0.001 μmol CoCl2,0.005 μmol Na2MoO4。气候箱内温湿度及光照变化如图1所示。小麦生长至3叶期时,分别于气候箱设定时间的7:00和19:00叶面喷施浓度为30 mg·L-1的6-BA和300 mg·L-1的lovastatin,以喷施清水为对照,共6个喷施组合处理,即HN、HN+6-BA、HN+Lov、LN、LN+6-BA、LN+Lov。为使激素能更好地附着于叶片,用0.5%Tween20混合于激素溶液中。每处理6盆,3次重复。
1.2 室内试验测定项目和方法
室内试验中每处理选取小麦植株基部全展开叶10片,用于测定叶绿素组分含量、光合参数、荧光参数和内源激素含量。1.2.1 叶片叶绿素组分测定 参考赵世杰等[25]的方法,测定叶片叶绿素a(Chl a)和叶绿素b(Chl b)含量。
1.2.2 光合参数测定 采用Li-6400便携式光合仪(Li-Cor Inc.,USA)测定叶片净光合速率(Pn,μmol CO2·m-2·s-1)、气孔导度(Gs,mmol·m-2·s-1)、胞间CO2浓度(Ci,μmol·mol-1)和蒸腾速率(Tr,mmol H2O·m-2·s-1)。测定时使用开放式气路系统,选用红蓝2叶室,叶室温度设定为25°C,光照强度为1 200 μmol·m-2·s-1。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1人工气候箱中温度、光照、相对湿度变化
-->Fig. 1Changes of temperature, illumination intensity, and relative humidity in plant growth chamber
-->
1.2.3 荧光参数测定 参考STRASSER[26]和SCHANSKER等[27]的方法测定并计算叶片快速叶绿素荧光动力学参数。测定前夹上夹子,叶片暗适应30 min。然后用Handy-PEA植物效率分析仪(Hansatech, UK)测定叶片快速叶绿素荧光动力学曲线(O-J-I-P曲线)。以下为本试验用到的荧光参数:Fo(20 μs 测得的荧光,O相);Fk(300 μs 时荧光,K 相);Fj(2 ms 时荧光,J 相);Fi(30 ms 时荧光, I 相);Fm (最大荧光, P 相);Vk、 Vj、Vi (K、J、、I相的相对可变荧光);Wk(相对可变荧光Fk占Fj - Fo振幅的比例);Ψo(捕获的激子将电子传递到电子传递链中超过QA的其他电子受体的概率);PIabs(PIabs= RC/ABS×[φPo/(1-φPo)]×[ψo/(1-ψo)],以吸收光能为基础的光化学性能指数)。
1.2.4 叶片内源激素含量测定 采用高效液相色谱法(HPLC)测定叶片中4种内源激素的含量[28]。流动相为甲醇﹕乙腈﹕0.6%乙酸(50﹕45﹕5,v/v),所用分析柱为Symmetry C18(150 mm×4.6 mm,5 μm),柱温为25℃,流动相流速0.6 mL·min-1,检测波长为254 nm。玉米素、赤霉素、生长素、脱落酸标样均购自美国Sigma公司。
1.2.5 植株干重测定 每处理取5株,3次重复,60℃下烘干至恒重。
1.3 大田试验测定项目和方法
成熟期各处理选取不带边行的1 m2小麦,统计穗数、穗粒数,3次重复,收获后脱粒,晾干至恒重称量。1.4 数据统计分析
用DPS7.05统计分析软件对数据进行方差分析和显著性检验(LSD法),用SigmaPlot 10.0进行作图。2 结果
2.1 田间条件下喷施外源6-BA及其抑制剂对小麦籽粒产量及其构成因素的影响
由表1可以看出,常规施氮量处理的穗数、穗粒数、千粒重、籽粒产量均显著高于低氮肥处理。与对照N1、N2处理相比,喷施外源6-BA显著提高了小麦籽粒产量,N1+6-BA和N2+6-BA处理的籽粒产量分别提高10.48%和16.61%,这是由于喷施外源6-BA显著提高了产量构成因素中的单位面积穗数和穗粒数;与对照N1、N2处理相比,N1+6-BA和N2+6-BA处理的单位面积穗数分别提高12.74%和12.31%。与对照N1、N2处理相比,喷施抑制剂lovastatin降低了单位面积穗数,显著提高了穗粒数,但对籽粒千粒重和产量无显著性影响。Table 1
表1
表1细胞分裂素及其抑制剂对小麦籽粒产量及其构成因素的影响
Table 1The effects of exogenous 6-BA and lovastatin on grain yield and its components of wheat grain
| 处理 Treatment | 穗数 Ear numbers (No./hm2) | 穗粒数 Kernels per spike (No./ear) | 千粒重 1000-grain weight (g) | 产量 Grain yield (g·m-2) |
|---|---|---|---|---|
| N1 | 750.09 d | 30.19 d | 32.27 c | 628.15 d |
| N1+6-BA | 845.62 c | 32.92 c | 32.94 bc | 694.01 c |
| N1+Lov | 701.23 d | 35.20 ab | 33.16 bc | 659.28 cd |
| N2 | 972.53 b | 33.04 c | 33.41 b | 1010.30 b |
| N2+6-BA | 1092.29 a | 35.04 b | 35.31 a | 1178.14 a |
| N2+Lov | 937.65 b | 36.08 a | 33.83 b | 986.54 b |
新窗口打开
2.2 室内条件下喷施外源6-BA及其抑制剂对小麦植株地上部干重的影响
从图2可知,喷施外源6-BA及其抑制剂lovastatin后,小麦地上部植株干重随着时间推移呈逐渐增加的趋势(图2),高氮水平下的植株干重显著高于低氮水平。与对照HN、LN相比,喷施外源6-BA显著提高了小麦植株干重,HN+6-BA、LN+6-BA处理12 d后的植株干重分别提高21.39%、43.92%,而喷施抑制剂lovastatin显著降低了小麦植株干重,HN+Lov、LN+Lov处理后12 d的植株干重分别降低58.55%、30.69%。由此表明,细胞分裂素可促进小麦植株地上部光合产物的积累。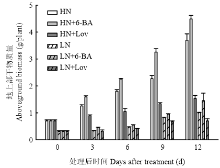 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2细胞分裂素及其抑制剂对小麦地上部干重的影响
HN、HN+6-BA、HN+Lov、LN、LN+6-BA、LN+Lov分别表示高氮下喷清水的对照、高氮下喷施外源细胞分裂素、高氮下喷施细胞分裂素合成抑制剂、低氮下喷清水的对照、低氮下喷施外源细胞分裂素、低氮下喷施细胞分裂素合成抑制剂
-->Fig. 2The effects of exogenous 6-BA and lovastatin on aboveground biomass of wheat
HN, HN+6-BA, HN+Lov, LN, LN+6-BA, LN+Lov represent spraying water (including Tween-20), 6-BA (30 mg L-1), Lovastin (300 mg L-1) under two nitrogen concentrations applications, respectively. The same as below
-->
2.3 喷施外源6-BA及其抑制剂对小麦叶片叶绿素含量的影响
由表2可以看出,高氮水平的叶绿素a(Chl a)、叶绿素b(Chl b)含量均显著高于低氮水平,12 d后Chl a、Chl b含量分别提高103.39%、94.44%。与对照HN处理相比,外源6-BA显著提高了9—12 d Chl a含量和3—12 d Chl b含量;处理后12 d,Chl a和Chl b含量分别提高35.83%和48.57%;与对照LN相比,LN+6-BA处理12 d后Chl a和Chl b含量分别提高35.59%和83.33%。与对照HN、LN相比,喷施lovastatin显著降低了Chl a和Chl b含量,HN+Lov、LN+Lov处理后12 d的Chl a和Chl b含量分别降低45.00%和79.66%、45.71%和88.89%。这表明内源细胞分裂素能促进叶绿素a及叶绿素b的合成,尤其是促进叶绿素b的合成。Table 2
表2
表2细胞分裂素及其抑制剂对小麦叶片叶绿素组分含量的影响
Table 2The effect of exogenous 6-BA and lovastatin on the content of chlorophyll a and b
| 处理 Treatment | 处理后时间 Days after treatment (d) | ||||
|---|---|---|---|---|---|
| 3 | 6 | 9 | 12 | ||
| 叶绿素a Chl a | HN | 1.71 b | 1.83 a | 1.48 b | 1.20 b |
| HN+6-BA | 1.99 a | 1.87 a | 1.83 a | 1.63 a | |
| HN+Lov | 1.33 d | 1.15 c | 1.19 c | 0.66 d | |
| LN | 1.21 e | 1.18c | 1.07 c | 0.59 d | |
| LN+6-BA | 1.52 c | 1.46 b | 1.41 b | 0.80 c | |
| LN+Lov | 1.14 f | 0.74 d | 0.38 d | 0.12 e | |
| 叶绿素b Chl b | HN | 0.55 b | 0.53 a | 0.34 b | 0.35 b |
| HN+6-BA | 0.64 a | 0.55 a | 0.51 a | 0.52 a | |
| HN+Lov | 0.50 c | 0.36 c | 0.31 b | 0.19 c | |
| LN | 0.41 e | 0.42 b | 0.26 c | 0.18 c | |
| LN+6-BA | 0.46 d | 0.45 b | 0.28 c | 0.33 b | |
| LN+Lov | 0.28 f | 0.22 d | 0.12 d | 0.02 d | |
新窗口打开
2.4 喷施外源6-BA及其抑制剂对小麦叶片光合性能的影响
由图3可知,喷施外源6-BA及其抑制剂3—12 d,各处理叶片气孔导度(Gs)基本不变,而叶片蒸腾速率(Tr)呈升高趋势。与对照HN处理相比,HN+6-BA处理显著提高了叶片Gs、Tr、Ci、Pn;处理后12 d,Gs、Tr、Pn、Ci分别提高68.32%、58.66%、30.72%、51.61%;但与对照LN处理相比,LN+6-BA处理显著降低了叶片的Tr及Ci。与对照HN、LN相比,喷施lovastatin显著降低了Gs、Tr、Pn。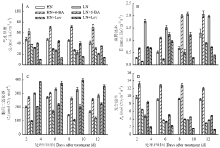 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3细胞分裂素及其抑制剂对小麦叶片光合参数的影响
-->Fig. 3The effects of exogenous 6-BA and lovastatin on the photosynthetic parameters of wheat leaf
-->
2.5 喷施外源6-BA及其抑制剂对小麦叶片荧光特性的影响
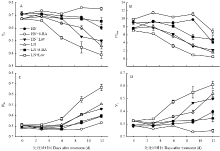
2.5.1 快速叶绿素a荧光诱导动力学曲线及拐点的变化 由图4可以看出,与对照HN、LN相比,喷施外源6-BA使OJIP曲线下降,而喷施抑制剂lovastatin处理使OJIP曲线上升,处理后12 d,曲线中出现明显的拐点K(图4-A,C)。以HN+6-BA处理的OJIP曲线作为参照,将其他处理的OJIP曲线标准化,结果表明,低氮水平在J(2 ms)点和I(30 ms)点的荧光强度明显高于高氮水平(图4-B,D)。喷施lovastatin明显提高了叶片J点和I点相对可变荧光值。与HN+6-BA相比,LN+Lov处理的J点和I点荧光值较高。与对照LN相比,LN+6-BA处理明显降低了叶片J点和I点荧光。值得注意的是处理后3 d,与HN+6-BA处理相比,LN+Lov处理的OJIP曲线在30 ms(I点)附近上升最明显,而处理后12 d,LN+Lov处理的OJIP曲线在2 ms(J点)附近上升最明显。各处理相比,J点的荧光强度趋势表现为:LN+Lov>LN>HN+Lov>LN+6-BA>HN>HN+6-BA。2.5.2 不同处理对荧光参数的影响 处理后0—12 d,各处理捕获的激子将电子传递到电子传递链中QA下游的其他电子受体的概率(Ψo)和以吸收光能为基础的性能指数(PIabs)总体表现为下降的趋势;而K点的可变荧光Fk占振幅Fo - Fj的比例(Wk)和J点的可变荧光Fj占振幅Fo - Fp的比例(Vj)总体表现为上升的趋势(图5)。
与对照HN、LN相比,喷施6-BA显著提高了Ψo和PIabs,显著降低了Wk和Vj值;处理后12 d,HN+6-BA处理的Ψo和PIabs分别提高24.69%和64.82%;Wk和Vj分别降低37.52%和15.46%。处理后12 d,LN+6-BA处理的Ψo和PIabs分别提高42.38%和194.07%;Wk和Vj分别降低22.09%和36.05%。与对照HN、LN相比,喷施lovastatin显著降低了Ψo和PIabs,而显著提高了Wk和Vj。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4细胞分裂素及其抑制剂对叶片快速叶绿素荧光诱导动力学曲线、相对可变荧光差值(ΔVt)的影响
-->Fig. 4The effects of exogenous 6-BA and lovastatin on the OJIP transients, ΔVt in wheat leaves
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5细胞分裂素及其抑制剂对小麦叶片荧光参数的影响
-->Fig. 5The effects of exogenous 6-BA and lovastatin on the chlorophyll fluorescence parameters of wheat leaves
-->
2.6 喷施外源6-BA及其抑制剂对小麦叶片内源激素含量的影响
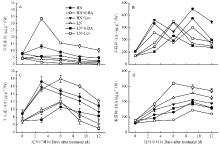
处理后0—12 d,叶片内源玉米素(Zt)含量在3 d含量最高,之后呈逐渐降低的趋势(图6-A)。与对照HN、LN相比,喷施6-BA显著提高了3—12 d叶片Zt含量,处理后12 d,HN+6-BA、LN+6-BA处理叶片Zt含量分别提高108.71%和138.50%。与对照HN、LN相比,喷施lovastatin显著降低了内源Zt含量,处理后12 d,HN+Lov和LN+Lov处理叶片Zt含量分别降低59.70%和79.91%。高氮水平的叶片赤霉素(GA3)含量呈双峰变化趋势,分别在处理后3、9 d有峰值;低氮水平的叶片GA3含量呈先升高后降低趋势,其含量在处理后6 d有最大值(图6-B)。与对照HN、LN相比,喷施6-BA显著降低了3—12 d叶片GA3含量;处理后12 d,HN+6-BA和LN+6-BA处理叶片GA3含量分别降低14.79%和8.03%,喷施lovastatin则显著提高了叶片GA3含量,处理后12 d,HN+Lov和LN+Lov处理叶片GA3含量分别提高73.02%和22.57%。
处理后0—12 d,叶片内源生长素(IAA)含量呈先升高后降低的变化趋势(图6-C)。与对照HN相比,HN+6-BA降低了处理后3 d的叶片IAA含量,但显著提高了其6—12 d含量;与对照LN相比,LN+6-BA降低了处理后3—6 d 叶片IAA含量,但提高了其叶片9—12 d含量;与对照HN、LN相比,喷施lovastatin则显著降低了叶片IAA含量,HN+Lov处理后12 d IAA含量降低14.61%,LN+Lov处理后12 d叶片IAA含量降低18.65%。
处理后0—12 d,叶片内源脱落酸(ABA)含量呈先升高后降低的变化趋势(图6-D)。与对照HN、LN相比,喷施6-BA显著降低了3—12 d叶片ABA含量;处理后12 d,HN+6-BA和LN+6-BA处理叶片ABA含量分别降低25.04%和29.40%。喷施lovastatin则显著提高了叶片ABA含量,处理后12 d,HN+Lov和LN+Lov处理叶片ABA含量分别提高18.32%和20.20%。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6细胞分裂素及其抑制剂对小麦叶片内源激素含量的影响
-->Fig. 6The effects of cytokinin and lovastatin on the contents of endogenous hormones in wheat leaves
-->
2.7 喷施外源6-BA及其抑制剂对小麦叶片硝酸还原酶(NR)与谷氨酰胺合成酶(GS)活性的影响
处理后0—15 d,小麦叶片硝酸还原酶(NR)及谷氨酰胺合成酶(GS)活性呈先上升后下降趋势。与对照HN、LN相比,喷施6-BA显著提高了叶片NR及GS活性;处理后15 d,HN+6-BA和LN+6-BA处理叶片NR、GS活性分别提高40.60%、48.56%和82.90%、43.03%。外喷抑制剂lovastatin则显著降低了叶片NR及GS活性,处理后15 d,HN+Lov和LN+Lov处理叶片NR、GS活性分别降低64.81%、25.47%和57.31%、57.67%(图7)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7细胞分裂素及其抑制剂对小麦叶片NR及GS活性的影响
-->Fig. 7The effects of exogenous 6-BA and lovastatin on the activities of NR and GS in wheat leaves
-->
2.8 小麦叶片内源激素含量与光合参数及综合性能指数的关系
由表3相关分析结果表明,叶片内源玉米素(Zt)含量与净光合速率(Pn)、气孔导度(Gs)呈极显著正相关关系,与胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)相关性不显著。赤霉素(GA3)含量与Ci呈显著负相关关系,与Pn、Gs、Tr无显著性相关关系。生长素(IAA)含量与Pn、Gs呈极显著正相关关系,脱落酸(ABA)含量则与Pn、Gs呈极显著负相关关系,与Ci呈显著性正相关关系。综合性能指数(PIabs)是反映植物光合机构活性最敏感的指标,相关分析结果表明PIabs与叶片内源Zt、IAA含量呈极显著正相关关系;PIabs与ABA含量呈极显著负相关关系,与GA3含量的相关不显著(图8)。这表明提高内源Zt、IAA含量,降低ABA含量,有利改善小麦幼苗期叶片光合机构活性,提高叶片光合速率。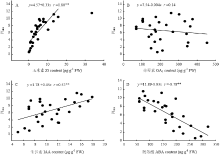 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8叶片内源激素与综合性能指数的相关关系
-->Fig. 8Relationship between performance index and the hormone concentrations in wheat leaves
-->
Table 3
表3
表3叶片内源激素含量与光合参数的相关性
Table 3Relationship between photosynthetic parameters and the hormone concentrations in wheat leaves
| 净光合速率 Pn | 气孔导度 Gs | 胞间二氧化碳浓度 Ci | 蒸腾速率 Tr | |
|---|---|---|---|---|
| 玉米素 Zt | 0.81** | 0.76** | -0.07 | -0.02 |
| 赤霉素 GA3 | -0.02 | -0.02 | -0.42* | -0.32 |
| 生长素 IAA | 0.68** | 0.67** | -0.29 | -0.16 |
| 脱落酸 ABA | -0.80** | -0.80** | 0.40* | 0.01 |
新窗口打开
2.9 小麦叶片内源激素含量与硝酸还原酶(NR)与谷氨酰胺合成酶(GS)活性关系
相关分析结果表明,叶片内源Zt、IAA含量与硝酸还原酶(NR)、谷氨酰胺合成酶(GS)活性呈显著或极显著正相关关系(图9);GA3含量与NR、GS活性相关关系不显著;内源脱落酸ABA含量与NR、GS活性呈二次曲线相关关系且达显著水平。由此说明,提高叶片内源Zt或IAA含量,有利叶片氮素合成代谢,而叶片ABA含量过高不利叶片氮素合成代谢。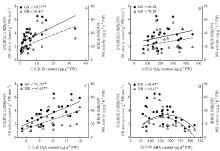 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9小麦叶片内源激素含量与谷氨酰胺合成酶及硝酸还原酶活性的关系
-->Fig. 9Relationship between the activity of GS and NR and the hormone concentrations in wheat leaves
-->
3 讨论
3.1 喷施外源6-BA对小麦籽粒产量的调控效应
小麦苗期的植株生长情况是生育中后期生长的基础,调控苗期植株发育对中后期植株个体和群体的发展起决定作用。前人研究表明产量三要素中粒重、穗粒数、单位面积穗数可被氮肥运筹和外源生长调节剂等的栽培措施调控[4, 10, 21]。本研究中与低施氮量相比,常规施氮量显著提高了小麦单位面积穗数、穗粒数和千粒重,显著提高籽粒产量。一方面,前人研究发现,增施氮肥可促进分蘖节中细胞分裂素的合成,有利分蘖的发生,促进了分蘖的发育成穗,最终提高单位面积穗数[29-30]。另一方面较高的氮肥供应促进了小麦穗高位小花的发育,减少了不孕小穗数,提高结实率,最终穗粒数显著提高[31]。再者,增大施氮量提高了籽粒中淀粉合成酶活性,可促进粒籽粒灌浆,提高籽粒粒重[32]。两种施氮量水平下喷施外源6-BA显著提高了小麦籽粒产量,这是由于外源6-BA显著提高了小麦单位面积穗数和穗粒数。分析原因后认为,外源细胞分裂素可提高分蘖节和分蘖芽中内源细胞分裂素的含量,有利于分蘖芽从休眠转向萌发转换,促进分蘖芽的生长[29]。ZHENG等[33]的研究结果表明外源6-BA降低了小麦穗中部和基部小穗的小花退化速率,提高了小花结实率,最终提高了穗粒数。3.2 喷施外源6-BA对小麦苗期叶片光合和荧光特性的调控效应
植物干物质积累主要来源于叶片的光合作用,而绿色植物则通过光合膜上的叶绿素蛋白复合体利用光能进行光合作用。本试验研究结果表明两种氮素水平下喷施6-BA处理均提高了小麦苗期地上部干物质积累量,喷施抑制剂降低了地上部干物质积累量。这是由于外源6-BA处理的叶片气孔导度较高,且净光合速率高于对照处理,叶片制造的光合产物较多地积累在植株中。叶片较高的叶绿素含量有利于光合作用[34],两种氮素水平下喷施外源6-BA提高了叶绿素a(Chl a)和叶绿素b(Chl b)含量。一方面细胞分裂素可促进叶绿素循环及PSII相关关键基因的上调表达,维持色素蛋白复合体的稳定,减少叶绿素降解[35]。另一方面细胞分裂素可提高叶绿素合成中间产物5-氨基酮戊酸的合成速率,进而有利叶绿素的合成[36]。Chl a和Chl b是叶绿素的两种重要组分。Chl a 可吸收和传递光能,少数激发态Chl a 具有光化学活性,能将光能转化为电能[37]。Chl b 不具有光化学活性,但可吸收和传递光能,调控捕光天线大小及维持其稳定[38]。适量增加氮肥供应可提高PSII的活性和光化学最大效率,提高表观光合作用电子传递速率,降低非辐射能量耗散,使叶片所吸收的光能较充分地用于光合作用[39]。本研究采用快速荧光动力学分析方法,结果表明与低氮水平相比较,高氮水平的Chl a 荧光诱导动力学曲线发生改变,低氮水平的J点和I点相对可变荧光值升高,而高氮水平则降低了Wk和Vj数值,提高了Ψo值,这说明提高氮素供应可减弱放氧复合体损伤,显著提高PSII反应中心电子传递链供体侧和受体侧的电子传递能力。前人研究认为植物光合机构的发育与功能维持都有细胞分裂素的参与调控[40]。提高内源细胞分裂素含量可阻止光合蛋白复合体的降解[41]。低氮素条件下喷施外源6-BA也可降低Wk和Vj数值,提高Ψo和PIabs值,表明喷施外源细胞分裂素可修复因氮素供应减少导致的放氧复合体损伤,提高PSII反应中心电子传递链供体侧和受体侧的电子传递能力。相关性分析表明内源Zt含量与净光合速率、气孔导度、光系统性能指数PIabs呈极显著正相关,ABA含量与净光合速率、气孔导度、PIabs呈极显著负相关关系。喷施抑制剂lovastatin降低了内源Zt含量,提高了ABA含量,这进一步证明了喷施外源6-BA能提高叶片内源Zt含量,降低ABA含量,有利于改善叶片光系统性能,提高叶片光合能力。
3.3 喷施外源6-BA对小麦苗期叶片谷氨酰胺合成酶(GS)和硝酸还原酶(NR)活性的调控效应
硝酸还原酶(NR)和谷氨酰胺合成酶(GS)是氮素同化的关键酶[42]。较高的氮素同化酶活性有利于叶片保持较高的光合性能[43]。KROUK[44]研究认为氮素与激素信号通路之间是双向连接的关系,氮素依赖其浓度影响植物发育进程,而激素可反馈调控植物对氮素的转运和积累。有研究认为细胞分裂素(CTK)、生长素(IAA)、脱落酸(ABA)参与了硝酸盐信号系统调控植株整体水平的发育[45]。有研究表明较高的氮素供应可促进细胞分裂素合成关键基因IPT的上调表达,从而促进细胞分裂素的合成[46]。施用外源细胞分裂素则可提高氮素高亲和力转运系统相关基因的表达,促进氮素由根系向地上部运输[47]。有研究认为氮素浓度对根、茎内源ABA含量无显著性影响,且氮素信号系统是否与内源ABA含量变化有关尚不明确,然而,近年来,越来越多的证据表明ABA参与了氮素信号系统[13]。SIGNORA等[48]研究发现ABA在参与调控氮素影响植物根系发育中起重要作用。本研究发现两种氮素水平下喷施外源6-BA显著提高了GS和NR活性,喷施抑制剂lovastatin则显著降低了两种酶活性。两种氮素平下喷施6-BA提高了叶片内源Zt含量,降低ABA含量,喷施抑制剂lovastatin则降低了叶片内源Zt含量,提高了ABA含量。相关性分析表明叶片Zt和IAA含量均与GS和NR活性呈极显著或显著性线性正相关关系,内源ABA含量则与GS和NR活性呈显著性二次曲线关系,这表明内源Zt、IAA和ABA含量变化在氮素同化中起重要作用。喷施外源细胞分裂素通过调节内源Zt、IAA、ABA含量,进而调控GS和NR活性。4 结论
喷施外源6-BA处理提高了叶片内源Zt和IAA含量,降低了ABA含量,一方面提高了叶片Chl a、Chl b含量和NR和GS活性,从而提高叶片氮素同化能力和光能捕获、传递转化能力;另一方面提高了PSII反应中心电子传递链供体侧和受体侧的电子传递能力,提高光系统II活性,最终改善叶片的光合性能,幼苗能够积累更多的光合产物,提高地上部植株干重。低氮与外源6-BA配合使用可修复因氮素供应减少而导致的光系统性能降低,提高小麦幼苗植株干重。因此苗期喷施外源6-BA可促进幼苗发育成壮苗,提高小麦穗数和穗粒数,提高籽粒产量。The authors have declared that no competing interests exist.
