0 引言
【研究意义】在农业生产中,尤其对于食叶类蔬菜等,提高植物生物量,可以提高生产效率,降低成本,具有重要意义。叶片作为光合作用的器官,对于植物的发育和生物量的积累至关重要。叶片的发育包括叶原基的起始、极性的建立和叶片的扩展。叶片的发育受小RNA、转录因子和激素的协调调控[1]。越来越多的研究表明,miRNA作为一个关键调控因子启动和参与植物体内多条发育途径。植物中最大的miR169家族基因,参与植物的逆境响应和生长发育调控。利用已有的ath-miR169d过表达和低表达的转基因拟南芥材料,解析其介导叶片发育调控的分子机制,可为调节植物营养生长,增加总生物量提供理论依据。【前人研究进展】MiR156/SPL调控模块与TCP4互作形成的复合体参与拟南芥的叶片发育[2]。miR160通过靶向调节3个ARF同源基因ARF10、ARF16和ARF17参与调控叶原基的形成和莲座叶正确叶序的建立[3-5]。MiR164通过对CUC1(CUP-SHAPED COTYLEDON1)和CUC2的调控介导器官边界的形成[5-7]。miR319通过对TCP的靶向调节参与叶片发育过程中的细胞分裂和生长[8-9]。生长素产生于顶端分生组织(shoot apical meristem,SAM),参与调节植物发育的多个过程,包括根和叶片形态建成、器官形成和维管组织的发育等[10]。生长素的合成涉及多条发育进程[11],其中主要的天然生长素形式,吲哚乙酸IAA的合成主要经过两步化学反应,首先色氨酸(Trp)通过转氨作用形成吲哚丙酮酸(IPA),然后IPA再被YUCCA(YUC)家族基因编码的含黄素单加氧酶催化形成IAA[12]。目前研究发现,PIN蛋白家族是主要的介导生长素由胞内向胞外、以及细胞之间定向移动的转运体[13]。拟南芥miR169家族包括14个基因,最终产生4个成熟的miRNA异构体(a、b/c、d/e/f/g和h/i/j/k/l/m/n)。不同的miR169异构体在植物发育过程中表达模式不同[14],其靶基因是转录因子NF-Y的A亚基[15]。NF-YA与NF-YB、NF-YC形成三聚体,发挥调控功能。研究表明,NF-Y转录因子参与植物发育、信号转导和逆境响应[16-22]。并且拟南芥miR169d/NF-YA2调控模块介导逆境诱导的早花[23]和根形态建成[24]。【本研究切入点】在前期研究中,发现ath-miR169d过表达转基因植株莲座叶的生长受到影响,但其是否参与叶片发育的调控及其分子机制还未见报道。【拟解决的关键问题】通过对不同转基因材料的莲座叶表型、叶片表皮细胞的形态等指标的观察,结合ath-miR169d表达模式的分析,以及内源生长素的定量检测和基因表达情况检测等研究,明确ath-miR169d对叶片发育的影响,进而解析其分子调控机制。1 材料与方法
试验于2015—2016年在中国农业科学院生物技术研究所完成。1.1 植物材料
拟南芥哥伦比亚生态型(Col)。植物生长条件为22℃,相对湿度60%,光周期16 h/8 h。p35S::miR169d株系为作物基因组与遗传改良实验室保存[23]。1.2 pmiR169d::GUS载体的构建和转基因株系的获得
通过PCR方法从基因组DNA中扩增ath-miR169d前体序列上游2 kb片段(引物序列分别为pmiR169d- FW:5′-ACCCTAACTCATGATGAAGG-3′和pmiR169d- RV:5′-CACCTGTCGACGTACTAGATC T-3′)。与pEASY-T1载体连接,转化,经测序验证后重组至植物双元载体pCAMBIA1303。并经蘸花法转化拟南芥Col野生型,筛选获得至少10个独立转化事件的转基因阳性材料。1.3 STTM miR169d载体构建和转基因株系的获得
STTM是一类短的(~100 nt)人工合成非编码RNA,参照文献[25]模拟miR169d的前体序列,设计STTM miR169d序列(5′-GGATCCcggcaagtcatcTACcttg gctcaGTTGTTGTTGTTATGGTCTAATTTAAATA-3′,5′-TGGTCTAAAGAAGAAGAATcggcaagtcatcTACcttggctcaGAGCTC-3′),斜体部分分别为BamHⅠ和XhoⅠ酶切位点,中间48 nt为linker序列,可以形成一个弱的颈环结构,小写字体为能够与miR169d互补配对的序列,其中10—12 nt设计为3个不配对碱基突出部分,从而可以与miR169d结合并不被其降解,导致miR169d沉默。经测序验证正确后酶切连接至植物双元载体载体pPZP212上。该载体经蘸花法转化拟南芥Col野生型,并筛选获得至少10个独立转化事件的转基因阳性材料。1.4 GUS染色
为了全面分析ath-miR169d在拟南芥中的表达情况,将不同龄期的幼苗整株进行染色。具体步骤参考文献[26]方法。1.5 总RNA、miRNA提取和实时荧光定量PCR
利用Trizol(ambion)提取拟南芥总RNA,然后将总RNA反转录成cDNA(5×All-In-One RT MasterMix,abm,加拿大)。使用SYBR Premix Ex TaqTM(CodeQPK-201,TOYOBO)试剂进行实时荧光定量PCR分析,拟南芥Actin2作为内参。利用miRcute miRNA提取分离试剂盒(DP501,TIANGEN,北京)提取拟南芥的miRNA,然后反转录为cDNA(TIANGEN miRcute miRNA cDNA第一链合成试剂盒,KR201),再用TIANGEN miRcute miRNA荧光定量检测试剂盒(FP401),进行荧光定量PCR。拟南芥U6作为内参。每个基因型均做3个独立生物学重复,包含至少3个以上单株样品。所用仪器为ABI7500,利用2-ΔΔCT方法分析试验结果[27],所用引物序列见表1,miRNA荧光定量的反向引物为试剂盒自带通用引物。Table 1
表1
表1实时荧光定量PCR引物
Table 1Primers for RT-qPCR
| 引物名称 Primers name | 引物序列 Primers sequence (5′-3′) |
|---|---|
| actin2-FW | TCCCTCAGCACATTCCAGCA |
| actin2-RV | GATCCCATTCATAAAACCCCAGC |
| YUC2-F1 | CCATGATCCGTACGTGGAGG |
| YUC2-R1 | GACGCTATGCAAGTGGAACG |
| YUC2-F2 | GTGACACGGATCGGTTAGGG |
| YUC2-R2 | GCCAACGTCCAAAACAGGAG |
| PIN1 qPCR F1 | GCTATGATCCTCGCTTACGG |
| PIN1 qPCR R1 | CGGAGGTTCATGGCGTAAGG |
| PIN1 qPCR F2 | AAAACGACGCAGGCTAAGGT |
| PIN1 qPCR R2 | TGAAGGAAATGAGGGACCAG |
| ARF1 qPCR F1 | GCTCGCTTTGGATCCAGTGG |
| ARF1 qPCR R1 | AGAGGTCCAGCACAGGCATG |
| ARF1 qPCR F2 | TGGATCAAAGCGAACCCACT |
| ARF1 qPCR R2 | TCCGTAGCACCGAGAAGCCA |
| ARF2 qPCR F1 | CGCTCGTCGTCGGTATTCAAG |
| ARF2 qPCR R1 | ACTCGCTTCGGTAGTCCACT |
| ARF2 qPCR F2 | CTTCCTCCACCTCCGAGGTT |
| ARF2 qPCR R2 | AGTGGGAGGCTGTCGAGACA |
| U6 FW | GGGGACATCCGATAAAATTGG |
| U6 RV | GGACCATTTCTCGATTTGTGC |
| miR169d FW | GTGTCCTGAGCCAAGGATGAC |
新窗口打开
1.6 IAA的定量分析
16 h/8 h光周期条件下培养4周的拟南芥幼苗地上部分全部收获,转基因材料和野生型分别随机选5株混样(200 mg),委托中国科学院遗传发育研究所利用气相色谱-质谱联用进行IAA定量分析。1.7 基因芯片分析
分别提取ath-miR169d转基因株系和野生型的总RNA,利用Agilent 2100分析仪器检测总RNA的质量和数量,并通过变性琼脂糖凝胶检测RNA的完整度,对质检合格的RNA样品委托上海欧易公司进行基因芯片分析,所用芯片为拟南芥Agilent V4.0。2 结果
2.1 Ath-miR169d影响拟南芥莲座叶生长
前期研究发现ath-miR169d不仅参与调控拟南芥的开花时间[23],同时也影响叶片的发育,ath-miR169d过表达拟南芥的莲座叶与野生型相比少且小。为探究其对叶片发育的调控功能,通过构建并获得STTM[25]miR169d的转基因拟南芥株系,抑制了内源miR169d的表达。如图1-a为STTM miR169d的转基因拟南芥株系中的miR169d的相对表达量。与野生型相比,STTM株系莲座叶多且大(图1-b、1-c)。ath-miR169d过表达株系的莲座叶直径是4.29 cm,短于野生型(5.03 cm),STTM株系是6.5 cm,大于野生型(图1-d)。而且,STTM miR169d株系会不断生长新叶,一直持续到抽薹结实后仍有新叶的发生及生长,但野生型在抽薹结实之后就不再长新叶(图1-c)。40 d苗龄的ath-miR169d过表达株系莲座叶数为13.8,野生型和STTM分别为16.6和20.4(图1-d)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1ath-miR169d过表达和STTM miR169d拟南芥株系莲座叶表型
a:miR169d在STTM miR169d拟南芥株系中的表达量;b:20 d龄幼苗;c:抽薹开花阶段植株;d:40 d苗龄的miR169d过表达和STTM株系莲座叶数目及直径(cm),每个株系统计30个单株。*表示P<0.05时差异显著,**表示表示P<0.01时差异显著。下同
-->Fig. 1Rosette phenotypes of ath-miR169d overexpression and STTM miR169d lines
a: Relative expression of ath-miR169d in STTM ath-miR169d lines; b: 20-day-seedling; c: Plants at bolting stage; d: Number and diameter of rosettes for 40-day-seedling miR169 overexpression (OE) and STTM lines. Thirty plants were measured for each line. * stands for significant difference at P<0.05 level, ** stands for significant difference at P<0.01 level. The same as below
-->
2.2 Ath-miR169d过表达导致拟南芥叶片表皮细胞变小
表皮细胞的数目和大小决定了叶片的大小,为探究ath-miR169d过表达株系叶片变小的原因,利用扫描电镜观察了各个拟南芥株系的表皮细胞形态。ath-miR169d过表达株系叶片表皮细胞(图2-a)小于野生型株系的表皮细胞(图2-b),说明ath-miR169d通过介导叶片表皮细胞的大小进而影响了叶片的大小。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图28周龄幼苗叶片的扫描电镜观察
a:ath-miR169d过表达株系;b:野生型
-->Fig. 2SE micrograph of a leaf of 8-week-old plants
a: ath-miR169d OE plant; b: Wild type plant
-->
2.3 Ath-miR169d主要在拟南芥顶端分生组织和叶片维管系统中表达
为解析在拟南芥叶片发生和叶片发育中的功能,克隆ath-miR169d的2 kb启动子片段,构建pmiR169d::GUS表达载体并获得了其转基因拟南芥株系。对pmiR169d::GUS转基因拟南芥株系染色分析结果表明,ath-miR169d主要在顶端分生组织和叶维管系统中表达。随着pmiR169d::GUS幼苗的生长,报告基因GUS的表达逐渐增强,且在新生叶片中的表达高于老叶片(图3)。顶端分生组织是叶原基形成的部位,维管系统则负责水分、矿质元素和营养物质的运输,因而ath-miR169d在该部位的表达可能与叶片发育相关。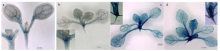 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3转基因株系中ath-miR169d的表达模式
-->Fig. 3Expression profile of ath-miR169d in transgenic plant
-->
2.4 Ath-miR169d过表达降低了转基因株系中内源IAA的含量
植物体内生长素主要产生于SAM,是植物器官发生的主要调节因子。考虑到ath-miR169d在SAM中大量表达,为分析其是否影响拟南芥生长素的代谢,检测了4周龄地上部幼苗中内源生长素的含量,发现在ath-miR169d过表达株系中,内源IAA含量与WT相比降低了38.6%(图4-a),说明ath-miR169d参与了IAA代谢途径的调控。为进一步探究ath-miR169d参与调控叶片起始和发育的分子机制,对4周龄ath-miR169d过表达株系幼苗进行基因芯片表达谱分析。与野生型相比,分别有2 268和2 562个基因显著下调和上调表达(log2FC>1 or<-1 with P-value of 0.05)。对表达发生显著变化的基因进行Kyoto Encyclopedia of Genes and Genomes(KEGG)分析,结果表明,在富集比例前10的代谢路径中,富集基因数量最多的是“次级代谢产物合成途径”和“植物激素信号转导途径”(图4-b),其中,有多个生长素信号途径基因表达发生了变化。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4转基因与野生型株系中IAA的含量(a)和转基因株系中差异表达基因的KEGG分析(b)
-->Fig. 4Concentrations of IAA in transgenic plants and WT (a) and KEGG analysis with the differentially expressed genes between transgenic plants and WT (b)
-->
2.5 Ath-miR169d过表达株系和STTM低表达株系中生长素信号途径基因表达发生变化
鉴于Ath-miR169d过表达拟南芥株系中IAA含量明显下降,推测IAA合成途径中的基因可能受到影响,通过对基因芯片表达谱分析发生IAA合成途径关键基因YUC2、外运载体蛋白基因PIN1的表达明显降低,采用qPCR的方法对这些基因在miR169d过表达株系和STTM低表达株系中的表达量进行检测。结果表明,与野生型相比,ath-miR169d过表达株系中YUC2和PIN1表达显著下调,而STTM miR169d株系中这两个基因都显著上调表达(图5)。Ath-miR169d过表达株系中YUC2表达下调与IAA含量降低结果吻合,IAA的减少也导致IAA转运体PIN1的下调表达。ELLIS等[28]报道IAA应答因子ARF1和ARF2的过表达促进叶片衰老,为了进一步分析ARF1和ARF2在ath-miR169d过表达植株和低表达株系中的作用,对其表达进行了分析,结果表明,在ath-miR169d过表达植株中ARF1和ARF2的表达明显上升,在低表达株系中则显著下调表达,因ARF1和ARF2是转录抑制因子,推测其上调表达阻碍了叶片的发育,并促进植株衰老。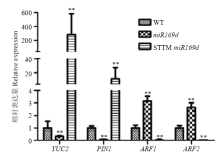 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5Ath-miR169d过表达株系和STTM低表达株系中YUC2、PIN1、ARF1和ARF2的相对表达量
-->Fig. 5Relative expression levels of YUC2, PIN1, ARF1 and ARF2 in Ath-miR169d overexpression plants and STTM miR169d plants
-->
3 讨论
miR169家族是植物中最大且进化保守的一个miRNA家族,其家族成员在调节胁迫应答和生长发育过程中发挥着重要的作用,miR169的靶基因主要是NF-YA转录因子,miR169/NF-YA这个调控模块可以感受内源信号或外部环境的激活,使植物表现出增强适应内外环境变化的特性。对蒺藜状苜蓿的研究发现,在NF-YA的5′端有一个内含子可以进行选择性剪切,在这个区域中有一个ORF可以编码一个蛋白(uORF1p),这个蛋白的表达可以下调NF-YA,其与miR169呈现出功能上的互补,在根瘤发育的早期阶段miR169调控占主导地位,而在后期时uORF1p发挥显著功能[29]。LI等[21]研究表明miR169/NF-YA5调控模块可以响应干旱并提高拟南芥的抗旱性,拟南芥在缺水环境中miR169表达受到抑制,NF-YA也就脱离了miR169的控制而上调表达,进而使植物抗旱性增强,经过进一步研究发现这条通路是ABA介导的。这些研究使得NF-YA的上游调控机制变得更加清晰,也为植物环境胁迫下的分子应答机制研究提供了理论支撑。作物基因组与遗传改良研究室王磊课题组前期在拟南芥中发现了受逆境胁迫诱导的另一个模块miR169/NFYA2,它可以通过响应逆境使植物提前开花,并且miR169/NF-YA2调控模块所引起的早花现象独立于其他开花调控途径[23]。而且miR169defg异构体及其靶基因参与调控了拟南芥根的形态建成[24]。根中转录因子NF-YA2和NF-YA10会响应磷饥饿而显著上调表达[30]。这些研究结果表明,miR169及其靶基因NF-YA家族成员,可以直接或间接地作为发育与响应非生物逆境之间的一个感应子或者连接体,发挥重要的功能。生长素是植物体内重要的生长发育调控因子,各种来自外界的逆境均可以影响其在植物体内的稳态和转运,从而影响植物的生长发育[31]。本研究发现拟南芥miR169d的表达发生变化会影响莲座叶的生长,并且这种作用是通过生长素信号途径介导的,从而发现了miR169一个新的调控功能。这种调控功能在蔬菜类作物中展现了应用前景。但是,miRNA都是通过对靶基因的调控实现其功能,本研究中ath-miR169d如何通过其靶基因NF-YA家族调控了生长素途径还需要进一步研究分析。另外,在前期研究中发现也miR169d参与拟南芥开花时间的调控,那么生长素是否也介导了这一生物学过程?miR169d是如何协调介导叶片发育和开花时间的调控等问题,都值得进一步探讨。
4 结论
Ath-miR169d通过介导生长素信号途径参与了拟南芥叶片发育的调控,ath-miR169d表达量发生变化会影响叶片的数量和大小,最终影响整个植株的生物量。The authors have declared that no competing interests exist.
