0 引言
【研究意义】棉花是中国重要的经济作物,随着劳动力紧缺以及成本增加,植棉的机械化、规模化成为现代植棉业的必然趋势[1]。目前,人工打顶制约了棉花生产轻简化、规模化、精准化和机械化作业的发展[2]。发展和运用可代替人工打顶的化学打顶技术,具有广阔前景。探索化学打顶剂对棉花形态性状、激素调控及蛋白质差异表达的效应,将明确其调控的分子机制,为开发新型生长调节剂及棉花化学打顶技术的应用提供参考,具有重要的理论和实践意义。【前人研究进展】打顶是棉花栽培过程中的关键环节,化学打顶更是棉花轻简化栽培的必然趋势。前人就化学打顶与人工打顶对棉花的影响差异进行了许多研究,发现化学打顶可以起到类似人工打顶的效果,但不同打顶方式塑造的棉花株型不同[3],同时对棉花内源激素含量[4]、物质分配[5-6]、代谢活动等产生的影响不同。袁青锋等[7]研究表明,化学打顶与人工打顶处理相比,棉花的株高、果枝数和结铃数等较高,两种处理的单铃重、衣分、籽棉和皮棉产量水平相当;杨成勋等[8]发现棉花化学打顶后,株宽显著低于人工打顶,改善了冠层中下部透光率,增加了光合面积和光合时间,利于产量的形成;康正华等[9]对棉花进行了不同化学打顶剂处理,表明部分化学打顶剂处理具有增产效果;李莉等[10]研究表明,打顶后加速植物生长的激素含量降低,促进植物成熟与衰老的激素含量升高,加速了棉花的衰老。氟节胺打顶处理后棉花倒四叶内源激素发生了不同程度的变化,与人工打顶处理相比变化趋势及作用时间存在差异,最终达到打顶的效果[11]。由上可知,激素在棉花生长发育过程中发挥着重要作用,研究植物激素的信号传导和作用机理也是蛋白质组学的重要内容之一。杨惠娟等[12]针对烟草打顶的研究发现,打顶前后有9个蛋白质差异表达,其中,促进烟草叶片光合作用和抗性相关蛋白的表达增强,与光呼吸能量代谢相关的蛋白表达下调。iTRAQ技术[13]是一种植物蛋白质应答分子机制有效研究技术。基于iTRAQ技术研究化学打顶条件下的蛋白质组学,有利于了解打顶后棉花的生理与分子反应机制。【本研究切入点】前人对化学打顶技术研究多集中于农艺性状、经济性状以及产量品质等方面,对棉花蛋白质组差异表达的影响鲜有报道。【拟解决的关键问题】通过设置人工与化学打顶两个处理,对棉花形态性状、激素调控机制及蛋白质差异表达情况开展研究,探究其生理调控的分子机制,为棉花轻简化栽培提供理论依据。1 材料与方法
1.1 试验材料与田间设计
试验于2015—2016年在河北农业大学清苑实验农场进行,土质为壤土。2015年试验地的土壤基础地力情况:有机质含量19.79 g·kg-1、碱解氮含量70.84 mg·kg-1、速效磷含量35.42 mg·kg-1、速效钾含量149.45 mg·kg-1;2016年试验地的土壤基础肥力情况:有机质含量18.41 g·kg-1、碱解氮含量52.14 mg·kg-1、速效磷含量28.66 mg·kg-1和速效钾含量170.67 mg·kg-1。供试品种为冀棉863,设人工打顶、化学打顶和未打顶3个处理。采用随机区组试验设计,3次重复,每个小区长12 m,宽11.5 m。宽窄行种植,大行行距100 cm,小行50 cm,密度45 000株/hm2。
所有处理于7月20日进行打顶处理。化学打顶剂为水乳剂,主要成分包括缩节胺(N,N- Dimethylpiperidinium chloride,DPC)、缓释剂、助剂等,由中国农业大学农学与生物技术学院作物化学控制研究中心和北京市农业技术推广站共同研发,新疆金棉科技有限责任公司生产。化学打顶剂用量为1.125 L·hm-2,人工喷施。其他田间管理措施采用常规高产栽培模式。
1.2 田间取样及调查
株高调查:在7月20日打顶后,每10 d选择10株代表性植株进行调查,至株高不再变化。激素样品取样:于打顶日开始,每10 d取一次样品,共取6次,选取部位为主茎最高效叶片倒四叶,测定生长素(IAA)、赤霉素(GA3)、脱落酸(ABA)和玉米素核苷(ZR)含量。
蛋白质组学样品:在打顶后20 d(8月10日)选取人工打顶和化学打顶处理主茎倒四叶,叶片装入样品袋后,用液氮速冻后转至-80℃保存备用。
1.3 蛋白质组测定分析
1.3.1 激素含量测定 激素测定方法采用间接酶联免疫吸附法(ELISA)。试剂盒由中国农业大学化控室提供,使用美国BIO-RAD 680酶标仪测定OD值,并制作logit曲线计算样品中激素的含量。1.3.2 蛋白质组学测定 蛋白提取与定量:样品用液氮磨成干粉,加入200 μL TEAB溶解;超声破碎15 min后,12 000 r/min离心20 min取上清;加入4倍体积的冷丙酮(含终浓度为10 mmol·L-1 DTT)沉淀2 h;12 000 r/min离心20 min,收集沉淀;再加入800 μL的冷丙酮(含终浓度为10 mmol·L-1 DTT)重悬沉淀;12 000 r/min离心20 min,收集沉淀,然后风干沉淀;加入100 μL TEAB溶解蛋白得到蛋白样品。选择常规的Bradford定量方法定量总蛋白质。
蛋白酶切与标记:选取100 μg蛋白质,体积整体调节到100 μL,然后加入500 μL 50 mmol·L-1 NH4HCO3稀释,加入2 μg Tryspin 酶液;37℃消化过夜8—16 h;取出上述酶解液,加入等体积的0.1% FA酸化;将上述酸化后的酶解液加入到活化平衡后的Strata-X C18柱子中除盐,冷冻抽干后用20 μL 0.5 mol·L-1 TEAB复溶。标记采用8-plex标记,人工打顶样品分别用115、116和117标记,化学打顶样品分别用118、119和121标记,6个样本标记完以后等量混合。
肽段分离与蛋白质鉴定:使用Thermo DINOEX Ultimate 3000 BioRS色谱仪进行分离,将混合后的样本分成12个组分。分离后的肽段进行LC-MS/MS分析,质谱仪是Thermo公司的Orbitrap质量检测器,型号为Q exactive HF。
蛋白质功能鉴定:对鉴定蛋白质进行GO、COG和KEGG分析,全面反映蛋白质功能。Gene ontology(GO)是一个国际标准化的基因功能分类体系,提供了一套动态更新的标准词汇表来全面描述生物体中基因和基因产物的属性。Cluster of orthologous groups of proteins(COG,蛋白相邻类的聚簇)是对蛋白质进行直系同源分类的数据库。Kyoto encyclopedia of genes and genomes(KEGG)是系统分析基因功能、基因组信息数据库,它有助于把基因及表达信息作为一个整体网络进行研究。
1.4 数据统计与分析
株高及激素含量数据采用Microsoft Excel 2010进行统计,通过SPSS 21.0进行方差分析检验其差异显著性。蛋白质数据分析采用对MS/MS质谱数据经过系列优化处理后与数据库进行相似性比较打分从而进行蛋白鉴定。使用与AB Sciex 5600 plus配套的搜索引擎ProteinpilotTM V4.5。对于proteinpilot的鉴定结果进一步过滤,对于鉴定到的蛋白,认为unused score≥1.3(即可信度水平在95%以上),每个蛋白至少包含一个unique肽段的蛋白为可信蛋白;对于鉴定的肽段,以conf≥95过滤,即可信度在95%以上认为可信肽段,对于蛋白质定量,为得到更全面的关于某蛋白的定量信息,Proteinpilot软件使用了conf≥15的所有肽段,
不符合该条件的肽段不包含在本报告中。
2 结果
2.1 不同打顶处理对棉花株高的影响
由图1可以看出,两年试验中3种打顶处理的株高从处理后20 d开始出现差异显著,表现为未打顶处理最高,化学打顶处理次之,人工打顶最低。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同打顶处理对棉花株高的影响
图中处理间标有相同字母表示差异不显著(P>0.05)。下同
-->Fig. 1Effects of different topping treatments on plant height of cotton
The same lowercases in the figure indicate no significant difference among treatments (P>0.05). The same as below
-->
2.2 不同打顶处理对棉花功能叶激素含量的影响
由图2可以看出,2015年试验中3种打顶处理棉花功能叶中GA3含量呈先升高后降低趋势,在处理后20 d时未打顶处理含量显著高于其他两个处理,在处理后30 d时化学打顶处理显著高于人工打顶处理,3种打顶处理之间差异显著,处理后40 d时化学打顶与未打顶处理无显著差异,显著高于人工打顶处理。打顶处理后,棉花叶片IAA和ABA含量先升高,在处理后40 d时达到最大值,之后逐渐下降,在处理后30 d时未打顶处理IAA含量显著低于其他两个处理,未打顶处理ABA含量峰值显著低于其他两个处理,其余时期无显著差异。ZR含量在处理后20 d内逐渐升高,之后在250 ng·g-1值上下波动,3种打顶处理之间无显著差异。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图22015年不同处理对棉花主茎功能叶激素含量的影响
-->Fig. 2Effects of different topping treatments on the hormone content of cotton functional leaves in 2015
-->
由图3可以看出,2016年试验中3种打顶处理GA3含量变化差异较大,在处理后30 d时未打顶处理显著高于其他两个处理,在处理40 d之后未打顶>化学打顶>人工打顶,3种处理之间达到显著差异。3种打顶处理的IAA和ABA含量变化均为单峰曲线,在处理后40 d时达到最大值,化学打顶处理IAA含量峰值显著低于其他两个处理,未打顶处理ABA含量峰值显著低于其他两处理。ZR含量呈先升高后降低的趋势,在处理后40 d达到最大值,3种打顶之间无显著差异。
综上可知,不同打顶处理对棉花功能叶GA3含量影响较大,对IAA和ABA含量有一定影响,对ZR含量基本无影响。与人工打顶处理相比,化学打顶与未打顶处理后期叶片GA3含量下降相对较晚。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图32016年不同处理对棉花主茎功能叶激素含量的影响
-->Fig. 3Effects of different topping treatments on the hormone content of cotton functional leaves in 2016
-->
2.3 不同打顶处理对棉花蛋白质组表达影响
2.3.1 蛋白质定量分析 对人工打顶与化学打顶处理棉花主茎功能叶进行iTRAQ蛋白质组学分析,以人工打顶处理叶片为对照,比较两者之间的差异表达蛋白,当差异倍数达到1.2倍及以上(即up-regulate≥1.2和down-regulate≤0.83),且经过显著性统计检验其P-value≤0.05时,视为显著差异蛋白。结果显示总鉴定蛋白为3 065个,两个处理之间检测到的总差异蛋白质数量为69个,其中29个上调,40个下调表达。
本研究中,质谱产生的二级谱图数、解析的二级谱图数分别为352 145和76 544,谱图鉴定率达到了21%以上,鉴定到的肽段和蛋白数总体分别为14 676和3 147(表1)。
2.3.2 鉴定蛋白质功能注释 通过对鉴定蛋白质进行GO、KEGG和COG注释,以利用不同来源的数据库全面反映蛋白质的功能,揭示蛋白质在各个生命活动中的生物学意义。从图4可以看出,由于背景注释库的局限性,GO功能注释到的蛋白质最多,为2 996个蛋白质,COG注释到2 159个蛋白质,KEGG注释到1 858个蛋白质。
2.3.3 鉴定蛋白质的COG注释分析 COG是对蛋白质进行直系同源分类的数据库,通过对鉴定到的蛋白质同COG数据库进行了比对,对这些蛋白质进行了功能分类(图5)。其中,1.9%蛋白质功能未知,10.5%参与能量代谢,7%参与氨基酸运输及代谢,9%涉及碳水化合物运输及代谢,其他差异蛋白可分别归入翻译后修饰、翻译、辅酶运输与代谢、信号传导等方面。
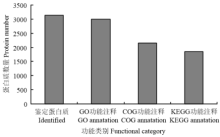 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同功能注释结果统计图
-->Fig. 4Statistical results of different function annotation results
-->
Table 1
表1
表1蛋白质鉴定信息统计表
Table 1Protein identification information statistics
| 样品名 Sample | 总谱图数 Total number of spectrum | 鉴定谱图数* Number of identified spectrum | 谱图鉴定率 Ratio of identified spectrum (%) | 鉴定肽段数* Number of identified peptide | 鉴定蛋白数 Number of identified proteins | Unique-2** |
|---|---|---|---|---|---|---|
| ALL | 352145 | 76544 | 21.73 | 14676 | 3147 | 2203 |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5COG注释分析
A:核糖核酸加工与修饰RNA processing and modification;B:染色质结构和动态变化Chromatin structure and dynamics;C:能量产物与转换Energy production and conversion;D:细胞循环调控、细胞分裂、染色体分裂Cell cycle control, cell division, chromosome partitioning;E:氨基酸转运与代谢Amino acid transport and metabolism;F:核苷酸转运与代谢Nucleotide transport and metabolism;G:碳水化合物转运与代谢Carbohydrate transport and metabolism;H:辅酶转运与代谢Coenzyme transport and metabolism;I:脂质转运与代谢Lipid transport and metabolism;J:翻译、核糖体结构和生物合成Translation, ribosomal structure and biogenesis;K:翻译Translation;L:复制、重组和修饰Replication, recombination and repair;M:细胞壁/薄膜/膜的生物合成Cell wall/membrane/envelope biogenesis;N:细胞活力Cell motility;O:翻译后修饰、蛋白质周转、伴侣Posttranslational modification, protein turnover, chaperones;P:无机离子转运与代谢Inorganic ion transport and metabolism;Q:次级代谢产物的合成、转运与分解Secondary metabolites biosynthesis, transport and catabolism;R:一般功能预测General function prediction only;S:未知功能Function unknown;T:信号转导机制Signal transduction mechanisms;U:细胞内转运、分泌和液泡运输Intracellular trafficking, secretion, and vesicular transport;V:防御机制Defense mechanisms;Z:细胞骨架Cytoskeleton
-->Fig. 5COG annotation analysis
-->
2.3.4 鉴定和差异蛋白质GO分析 为了能够更加清楚的分析差异蛋白质的功能,对差异蛋白质进行独立的功能注释分析(图6)。GO总共有3个本体,分别描述基因的分子功能、细胞组分、参与的生物过程。在生理过程中,有19个功能存在明显差异,细胞成分组织或合成、细胞过程、代谢过程、生物调节等功能涉及的差异蛋白比例较大。在细胞组分中,细胞、细胞组分、膜腔、细胞器等两处理之间差异蛋白显著。在分子功能中,两处理在抗氧化物酶活性、结合、催化酶活性和结构分子活性等方面都出现了显著差异。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6鉴定和差异蛋白质GO功能注释结果统计柱状图
A:生物附着Biological adhesion;B:生物调节Biological regulation;C:碳固定Carbon utilization;D:细胞增殖Cell proliferation;E:细胞成分组成或生物合成Cellular component organization or biogenesis;F:细胞过程Cellular process;G:死亡Death;H:发育过程Developmental process;I:建立定位Establishment of localization;J:生长Growth;K:免疫系统过程Immune system process;L:定位Localization;M:转移Locomotion;N:代谢过程Metabolic process;O:多机体过程Multi-organismal process;P:多细胞生物过程Multicellular organismal process;Q:生物过程的负调节Negative regulation of biological process;R:色素沉着Pigmentation;S:生物过程的正调节Positive regulation of biological process;T:生物过程调节Regulation of biological process;U:复制Reproduction;V:繁殖过程Reproductive process;W:刺激响应Response to stimulus;X:周期过程Rhythmic process;Y:信号Signaling;Z:病毒繁殖Viral reproduction;AB:细胞Cell;AC:细胞组分Cell part;AD:胞外区Extracellular region;AE:胞外区组分Extracellular region part;AF:高分子配合物Macromolecular complex;AG:膜封闭腔Membrane-enclosed lumen;AH:细胞器Organelle;AI:细胞器组分Organelle part;AJ:抗氧化活性Antioxidant activity;AK:结合Binding;AL:催化活性Catalytic activity;AM:电子载体活性Electron carrier activity;AN:酶调节剂活性Enzyme regulator activity;AO:分子传导活性Molecular transducer activity;AP:核酸结合转录因子活性Nucleic acid binding transcription factor activity;AQ:蛋白结合转录因子活性Protein binding transcription factor activity;AR:结构分子活性Structural molecule activity;AS:转移载体活性Transporter activity
-->Fig. 6GO function annotation results of identification and differentially expressed proteins
-->
2.3.5 鉴定差异蛋白质基本信息 表2列出了所有差异蛋白质的相关信息。差异表达蛋白质为69个,其中涉及碳水化合物和能量代谢的蛋白质有14个,涉及蛋白质和氨基酸代谢有16个,应激与防御相关蛋白有14个,还涉及其他代谢过程。主要富集的Pathway途径有精氨酸和脯氨酸代谢、光合作用碳固定过程、谷胱甘肽代谢和苯丙氨酸代谢等。能量代谢相关蛋白多下调表达,应激相关蛋白多上调表达。
Table 2
表2
表2差异蛋白质相关信息
Table 2Information of differentially expressed proteins
| 登录号 Accession | 蛋白质名称 Protein name | 覆盖率 Percent coverage (%) | Unique肽段数 Number of unique peptide | 平均比值 Mean ratio | 上调/下调 Up/down | ||
|---|---|---|---|---|---|---|---|
| 碳水化合物和能量代谢Carbohydrates and energy metabolism | |||||||
| 1 | gi|823205454 | 顺乌头酸水合酶Aconitate hydratase | 19.89 | 9 | 1.38 | 上调Up | |
| 2 | gi|823245379 | ATP -柠檬酸合成酶β链蛋白2 ATP-citrate synthase beta chain protein 2 | 10.86 | 5 | 1.61 | 上调Up | |
| 3 | gi|823225464 | V型质子ATP柠檬酸合成酶β链蛋白2 V-type proton ATPase catalytic subunit A-like | 35.63 | 22 | 1.55 | 上调Up | |
| 4 | gi|211906492 | 二氢硫辛酰胺脱氢酶Dihydrolipoamide dehydrogenase | 57.37 | 36 | 0.72 | 下调Down | |
| 5 | gi|823248555 | 丙酮酸磷酸双激酶Pyruvate, phosphate dikinase | 27.73 | 27 | 0.46 | 下调Down | |
| 6 | gi|823252144 | 3-磷酸甘油醛脱氢酶2 Glyceraldehyde-3-phosphate dehydrogenase 2 | 55.65 | 7 | 0.80 | 下调Down | |
| 7 | gi|823178076 | 花瓣死亡蛋白样亚型X1 Petal death protein-like isoform X1 | 31.40 | 14 | 0.58 | 下调Down | |
| 8 | gi|728814163 | 腺苷激酶2样蛋白Adenosine kinase 2 -like protein | 35.78 | 11 | 0.80 | 下调Down | |
| 9 | gi|823235796 | 长链酰基辅酶A合成酶9 Long chain acyl-CoA synthetase 9 | 9.55 | 6 | 1.52 | 上调Up | |
| 10 | gi|823192309 | 促氧增强蛋白1 Oxygen-evolving enhancer protein 1 | 60.24 | 38 | 0.46 | 下调Down | |
| 11 | gi|823226989 | 叶绿素a-b结合蛋白CP26 Chlorophyll a-b binding protein CP26 | 48.11 | 20 | 0.67 | 下调Down | |
| 12 | gi|823196524 | 光合NDH亚基的亚基B 2 Photosynthetic NDH subunit of subcomplex B 2 | 16.90 | 6 | 0.64 | 下调Down | |
| 13 | gi|91208901 | 光系统I的脱辅基蛋白A2 Photosystem I P700 apoprotein A2 | 26.98 | 18 | 0.81 | 下调Down | |
| 14 | gi|823244385 | 镁螯合酶亚基I Magnesium-chelatase subunit ChlI | 27.01 | 5 | 1.23 | 上调Up | |
| 氨基酸转运与代谢 Amino acid transport and metabolism | |||||||
| 15 | gi|823141836 | δ-1-吡咯啉-5-羧酸脱氢酶12A1 Delta-1-pyrroline-5-carboxylate dehydrogenase 12A1 | 21.84 | 11 | 1.39 | 上调Up | |
| 16 | gi|728838588 | 白三烯a-4水解酶 Leukotriene a-4 hydrolase | 7.59 | 4 | 1.70 | 上调Up | |
| 17 | gi|728844471 | 天冬氨酸转氨酸 Aspartate aminotransferase | 16.37 | 2 | 4.80 | 上调Up | |
| 18 | gi|823159039 | 谷氨酸-乙醛酸转氨酶2亚型X2 Glutamate-glyoxylate aminotransferase 2 isoform X2 | 60.08 | 45 | 0.81 | 下调Down | |
| 19 | gi|823136465 | 铁氧还蛋白依赖性谷氨酸合酶 Ferredoxin-dependent glutamate synthase | 37.19 | 63 | 0.63 | 下调Down | |
| 20 | gi|823261456 | 乙酰谷氨酸激酶 Acetylglutamate kinase | 5.28 | 1 | 0.47 | 下调Down | |
| 21 | gi|728812439 | TTC30A蛋白 Tetratricopeptide repeat 30A | 40.37 | 19 | 0.61 | 下调Down | |
| 蛋白质代谢Protein metabolism | |||||||
| 22 | gi|728824713 | 40S核糖体SA 40S ribosomal SA | 28.71 | 8 | 1.23 | 上调Up | |
| 23 | gi|823230293 | 60S核糖体蛋白L35 60S ribosomal protein L35 | 32.52 | 5 | 1.26 | 上调Up | |
| 24 | gi|823151186 | 50S核糖体蛋白L1 50S ribosomal protein L1 | 36.77 | 14 | 0.65 | 下调Down | |
| 25 | gi|823142478 | 延伸因子Tu Elongation factor Tu | 60.41 | 35 | 0.57 | 下调Down | |
| 26 | gi|823121537 | 蛋白同源物 Calnexin homolog | 21.50 | 10 | 0.80 | 下调Down | |
| 27 | gi|823179809 | 26S蛋白酶体非酶的调节亚基6同源物 26S proteasome non-ATPase regulatory subunit 6 homolog | 18.86 | 7 | 1.90 | 上调Up | |
| 28 | gi|728845927 | 增殖相关2G4 Proliferation-associated 2G4 | 26.97 | 11 | 0.59 | 下调Down | |
| 29 | gi|763774985 | 假定蛋白B456_007G137300 Hypothetical protein B456_007G137300 | 32.38 | 12 | 0.60 | 下调Down | |
| 30 | gi|728843779 | 真核翻译起始因子3亚基C Eukaryotic translation initiation factor 3 subunit C | 2.61 | 2 | 3.31 | 上调Up | |
| 续表2 Continued table 2 | |||||||
| 登录号 Accession | 蛋白质名称 Protein name | 覆盖率 Percent coverage (%) | Unique肽段数 Number of unique peptide | 平均比值 Mean ratio | 上调/下调 Up/down | ||
| 应激与防御Stress and defense | |||||||
| 31 | gi|728841368 | 蛋白酶样1 Protease Do-like 1 | 25.06 | 13 | 0.61 | 下调Down | |
| 32 | gi|823136882 | 过氧化物酶2E Peroxiredoxin-2E | 23.79 | 8 | 0.70 | 下调Down | |
| 33 | gi|728831702 | 谷胱甘肽还原酶 Glutathione reductase | 18.17 | 9 | 0.80 | 下调Down | |
| 34 | gi|763817009 | 假定蛋白B456_013G268400 Hypothetical protein B456_013G268400 | 45.33 | 13 | 1.44 | 上调Up | |
| 35 | gi|763745098 | 假定蛋白B456_002G023400 Hypothetical protein B456_002G023400 | 29.34 | 19 | 0.68 | 下调Down | |
| 36 | gi|823197978 | 肽基脯氨酰顺反异构酶CYP37 Peptidyl-prolyl cis-trans isomerase CYP37 | 18.12 | 9 | 0.75 | 下调Down | |
| 37 | gi|823255313 | 病程相关蛋白STH-2 Pathogenesis-related protein STH-2-like | 40.25 | 4 | 3.44 | 上调Up | |
| 38 | gi|823140817 | 谷胱甘肽合成酶 Glutathione synthetase | 3.64 | 2 | 1.62 | 上调Up | |
| 39 | gi|823144035 | 类甜蛋白 Thaumatin-like protein | 58.04 | 10 | 3.03 | 上调Up | |
| 40 | gi|3493172 | 纤维蛋白 Fiber annexin | 30.06 | 8 | 1.40 | 上调Up | |
| 41 | gi|728849090 | 绒毛蛋白4 Villin-4 -like protein | 8.56 | 8 | 0.81 | 下调Down | |
| 42 | gi|728844030 | 过氧化物酶15 Peroxidase 15 | 17.20 | 5 | 2.53 | 上调Up | |
| 43 | gi|728842549 | 谷胱甘肽S-转移酶F9 样蛋白 Glutathione S-transferase F9 -like protein | 39.53 | 9 | 1.34 | 上调Up | |
| 44 | gi|823256355 | α-双加氧酶1 Alpha-dioxygenase 1-like | 35.51 | 21 | 1.42 | 上调Up | |
| 其他代谢Other metabolic processes | |||||||
| 45 | gi|823223491 | 13S-亚油酸脂氧合酶2-1,叶绿体同工型X1 Linoleate 13S-lipoxygenase 2-1, chloroplastic-like isoform X1 | 35.95 | 38 | 1.27 | 上调Up | |
| 46 | gi|763771208 | 假定蛋白B456_006G2539002 Hypothetical protein B456_006G2539002 | 14.05 | 5 | 0.78 | 下调Down | |
| 47 | gi|728845748 | 假定ycf39 Putative ycf39 | 23.65 | 13 | 0.76 | 下调Down | |
| 48 | gi|823160532 | TIC62蛋白 Protein TIC 62 | 25.30 | 13 | 0.60 | 下调Down | |
| 49 | gi|823197509 | 41 kD的叶绿体茎环结合蛋白 Chloroplast stem-loop binding protein of 41 kD | 58.31 | 28 | 0.66 | 下调Down | |
| 50 | gi|823223767 | 铁氧还蛋白-NADP还原酶 Ferredoxin-NADP reductase | 56.35 | 18 | 0.58 | 下调Down | |
| 51 | gi|763745695 | 假定蛋白B456_002G058700 Hypothetical protein B456_002G058700 | 7.84 | 3 | 6.17 | 上调Up | |
| 52 | gi|823238550 | 腺苷酸激酶5 Adenylate kinase 5 | 23.06 | 11 | 0.53 | 下调Down | |
| 53 | gi|823239569 | 核糖核酸酶1 Ribonuclease 1-like | 13.45 | 3 | 4.62 | 上调Up | |
| 54 | gi|728835192 | 5-样蛋白复合物成分 Exocyst complex component 5 -like protein | 9.31 | 7 | 1.24 | 上调Up | |
| 55 | gi|823261674 | PATL-3 Patellin-3-like | 24.87 | 11 | 0.66 | 下调Down | |
| 56 | gi|823250412 | 21 kD种子蛋白质类 21 kD seed protein-like | 62.22 | 10 | 17.52 | 上调Up | |
| 57 | gi|823244306 | 水解酶结构域蛋白卤酸脱卤酶At3g48420型X1 Haloacid dehalogenase-like hydrolase domain-containing protein At3g48420 isoform X1 | 25.68 | 8 | 0.53 | 下调Down | |
| 未知蛋白Unknown proteins | |||||||
| 58 | gi|823165227 | 未分类蛋白LOC105797154 Uncharacterized protein LOC105797154 | 25.67 | 16 | 1.76 | 上调Up | |
| 59 | gi|728849395 | 假定蛋白F383_10336 Hypothetical protein F383_10336 | 51.65 | 26 | 0.70 | 下调Down | |
| 60 | gi|823223578 | 未分类蛋白LOC105768857 Uncharacterized protein LOC105768857 | 18.27 | 2 | 0.75 | 下调Down | |
| 续表2 Continued table 2 | |||||||
| 登录号 Accession | 蛋白质名称 Protein name | 覆盖率 Percent coverage (%) | Unique肽段数 Number of unique peptide | 平均比值 Mean ratio | 上调/下调 Up/down | ||
| 61 | gi|728833746 | 假定膜蛋白C2G11.09 Putative membrane C2G11.09 | 3.59 | 2 | 0.77 | 下调Down | |
| 62 | gi|823196841 | UPF0603蛋白At1g54780 UPF0603 protein At1g54780 | 35.93 | 13 | 0.77 | 下调Down | |
| 63 | gi|728839934 | 1-多聚腺苷酸结合蛋白样2 Polyadenylate-binding protein 1-like 2 | 20.25 | 11 | 0.71 | 下调Down | |
| 64 | gi|823161041 | α-1-衣被亚基 Coatomer subunit alpha-1-like | 6.18 | 5 | 1.56 | 上调Up | |
| 65 | gi|823139418 | CBS域含蛋白质CBSX1 CBS domain-containing protein CBSX1 | 43.10 | 7 | 0.59 | 下调Down | |
| 66 | gi|823218276 | 低丰度蛋白质:蛋白质IWS1同源物 LOW QUALITY PROTEIN: protein IWS1 homolog | 1.42 | 1 | 1.22 | 上调Up | |
| 67 | gi|823209765 | 未分类蛋白OsI_027940 isoform X3 Uncharacterized protein OsI_027940 isoform X3 | 3.85 | 1 | 0.70 | 下调Down | |
| 68 | gi|823213773 | 蛋白P21 Protein P21 | 26.03 | 4 | 2.02 | 上调Up | |
| 69 | gi|823203900 | 未分类蛋白LOC105762887同工型X1 Uncharacterized protein LOC105762887 isoform X1 | 21.83 | 8 | 0.38 | 下调Down | |
新窗口打开
3 讨论
3.1 不同打顶处理下棉花株高与激素含量的差异
由本研究结果可知,不同打顶处理后棉花株高出现显著差异,处理后期化学打顶处理显著高于人工打顶,但显著低于未打顶处理,这可能是喷施化学打顶剂后棉花需要一定的时间吸收转化,在这期间棉花继续生长,这与袁青锋等[7-8]研究结果一致。这说明化学打顶处理能在一定程度上控制棉花株高。不同打顶处理后棉花主茎功能叶激素含量也表现出一定差异,但两年结果中3种打顶处理的ZR含量在各时期差异不显著。两年试验中3种打顶处理前期各激素含量基本无差异,这与赵强[14]研究结果一致,但与叶春秀等[11]研究结果不相同;前人研究表明人工打顶导致棉花生长中后期GA合成量减少[10],本试验后期化学打顶的GA3含量显著高于人工打顶,说明化学打顶可以缓解人工打顶后期GA含量快速下降,可能利于防止棉花早衰,有待于进一步研究证实。3.2 不同打顶处理下棉花功能叶的蛋白质组差异
在蛋白质组水平上,应用iTRAQ技术对两种打顶方式下棉花主茎功能叶进行了蛋白质组学分析,鉴定出了一定数量差异蛋白,涉及与植物生长发育密切相关的碳水化合物和能量代谢等诸多方面,一些与GA代谢相关的蛋白质表达丰度也发生了变化。3.2.1 与能量代谢及应激代谢相关的蛋白质 打顶处理后,棉花主茎功能叶中与参与碳水化合物和能量代谢相关的许多蛋白质的表达丰度发生变化,涉及糖酵解、三羧酸循环、卡尔文循环等碳水化合物代谢途径。在三羧酸循中,乌头酸水合酶是三羧酸循环中的辅酶,催化柠檬酸和异柠檬酸相互转化。柠檬酸合酶催化来自糖酵解或其他异化反应的乙酰CoA与草酰乙酸缩合合成柠檬酸,是TCA循环的关键酶。本研究中顺乌头酸水合酶(aconitate hydratase)和ATP-柠檬酸合成酶β链蛋白2(ATP-citrate synthase beta chain protein 2)表达上调,这表明化学打顶与人工打顶处理相比,促进了三羧酸循环,加快了碳水化合物代谢。V型质子ATP酶催化亚基A蛋白(V-type proton ATPase catalytic subunit A-like protein)表达上调,促进了短链脂肪酸的代谢。
在C3植物叶片中,丙酮酸磷酸双激酶(pyruvate orthophosphate dikinase,PPDK)是糖酵解途径的关键酶,参与碳固定,并为氨基酸合成提供碳骨架[15]。3-磷酸甘油醛脱氢酶在细胞的碳代谢的中心环节,催化糖酵解中唯一的氧化反应[16]。本试验中丙酮酸磷酸双激酶与3-磷酸甘油醛脱氢酶2(glyceraldehyde-3- phosphate dehydrogenase 2)均表达下调,这表明与人工打顶相比,化学打顶处理的叶片中糖酵解途径减弱,这说明人工打顶后棉花需要更多的能量来响应,棉花化学打顶有效缓解棉花因打顶造成的剧烈反应,从而维持棉花的持续稳定增长。
谷胱甘肽代谢途径对维持细胞内活性氧与自由基动态平衡、抵御胁迫具有重要作用[17]。此途径中谷胱甘肽-S-转移酶F9样蛋白(glutathione S-transferase F9-like protein)和谷胱甘肽合成酶(glutathione synthetase)表达上调,谷胱甘肽还原酶(glutathione reductase)表达下调,总体上加快了谷胱甘肽的合成以及对有害物质的清除。精氨酸和脯氨酸代谢途径中delta-1-吡咯啉-5-羧酸脱氢酶12A1(delta-1-pyrroline- 5-carboxylate dehydrogenase 12A1)和天冬氨酸转氨酶(aspartate aminotransferase)表达上调,加快了三羧酸循环,乙酰谷氨酸激酶(acetylglutamate kinase)表达下调,对尿素循环造成了一定影响,精氨酸合成多胺调节植物的生长发育,从而提高棉花植株的抗逆能力[18]。
前人研究表明菠菜受到硫化氢胁迫后,光合作用和能量代谢提高来响应胁迫[19],本试验中化学打顶处理后棉花叶片中碳水化合物和能量代谢相关蛋白多数下调表达,抗逆相关蛋白质表达上调,这说明化学打顶对棉花的机械损伤更小,人工打顶后棉花提高能量代谢来抵御打顶造成的损伤,但化学打顶后可能产生抑制植株生长的物质,棉株通过自身抗逆反应来适应自身变化。
3.2.2 与GA代谢相关的蛋白质 DELLA蛋白在GA和IAA、ABA等其他植物激素信号传导途径中具有交互调节作用,是GA调控作用的关键,其在其他环境信号间的调控机制也被逐一发现[20],如光的信号转导[21]。DELLA蛋白是一类被广泛定性的GA信号抑制因子[22]。GID1蛋白与GA及DELLA蛋白结合后形成赤霉素受体GA-GID1-DELLA蛋白复合体,然后SCF聚合体标记该三聚体,诱导泛素26S蛋白酶体降解DELLA蛋白,解除DELLA蛋白对植物生长的抑制作用,产生GA效应[23-26]。该试验中26S蛋白酶体的非ATP酶调节亚基6同源物(26S proteasome non-ATPase regulatory subunit 6 homolog)表达上调,加快降解DELLA蛋白,促进植株生长。因此,与人工打顶处理相比,化学打顶处理更能促进棉花的纵向生长。
ABA抑制GA诱导的一些过程,如PKABA蛋白激酶是ABA正调节相关蛋白,它过表达可抑制GA调节的GAMYB和α-淀粉酶基因的表达[27-28]。GA也调节ABA的代谢和信号转导[29],HvSPY是GA负调控因子,却在ABA信号转导中起正调节作用,但不依赖ABA途径[30]。本研究中α-双加氧酶1(Alpha-dioxygenase 1)参与ABA负调控介导的信号转导通路,其表达上调,可能抑制ABA表达,延缓植物衰老。镁螯合酶亚基Chl I-1(Magnesium-chelatase subunit ChlI-1)是叶绿素生物合成的关键酶,正调节ABA信号,但不与ABA结合[31],该蛋白表达上调,促进ABA产生效应。并且GA的变化会直接影响IAA的生物合成与降解,IAA又直接作用于细胞,导致细胞或者细胞壁的伸长变异,这又会导致植株节间长度或者节数变化,最终导致植株形态变化。此外,与光合作用相关的蛋白质光合NDH亚基的亚基B 2(photosynthetic NDH subunit of subcomplex B 2)和叶绿素a、b结合蛋白CP26(chlorophyll a-b binding protein CP26)参与控制碳水化合物代谢,影响蔗糖利用效率和细胞壁的合成,其表达下调导致化学打顶处理植株光合能力减弱,本研究中后期人工打顶处理棉花主茎叶GA含量显著低于化学打顶处理,光合能力也受到抑制,这与前人研究结果一致[32-33]。这说明打顶存在对GA调控的抑制,但化学打顶对GA的抑制比人工打顶要弱,GA减少会加速叶片的衰老,化学打顶能在一定程度上防止棉花早衰。
前人研究表明GA与类胡萝卜素合成途径有共同的前体,并且有些类胡萝卜素能直接合成ABA[34]。糖酵解产物乙酰辅酶A和丙酮酸促进前体物质IPP的生成,加快了植物MEP途径,为棉花叶片GA含量升高提供了条件。GA代谢及信号传导正相关蛋白多上调,与人工打顶相比,化学打顶促进了GA的合成与表达,植物通过减少赤霉素来减缓植株生长从而适应环境,这同样说明化学打顶与人工打顶相比,对植株造成的伤害更小,更有利于植株的生长发育,但关于不同打顶方式影响棉花生长的具体分子机制还有待于进一步研究。
4 结论
与人工打顶相比,化学打顶处理有效控制了棉花株高,提高了生育后期GA含量,IAA、ABA和ZR含量无显著差异。基于iTRAQ技术的蛋白质组学分析,鉴定得到69个差异表达蛋白质,与植物生长发育相关的碳水化合物和能量代谢相关蛋白多下调表达,与GA调控正调节相关蛋白多上调表达,人工打顶激活了植物的能量代谢与应激反应来调控棉花的生长,而化学打顶更多的是通过调控GA激素的代谢过程来适应外部环境的变化。The authors have declared that no competing interests exist.
