0 引言
【研究意义】在复杂的自然环境中,昆虫通过其敏锐的化学通讯系统来识别所处环境中的各种化学信息物质,并做出反应[1]。昆虫对性信息素以及植物挥发物的信息识别主要通过嗅觉系统,但是某些昆虫触角化学感受蛋白也被证实能够感受性信息素及植物挥发物成分[2-3]。而在昆虫化学感受系统中,往往存在着两类酸性、低分子量的蛋白,即气味结合蛋白(odorant- binding proteins,OBPs)和化学感受蛋白(chemosensory proteins, CSPs),其中根据功能的差异,OBPs又被分为普通气味结合蛋白(general odorant-binding proteins,GOBPs)和信息素结合蛋白(pheromone- binding proteins,PBPs)[4],CSPs由于最早发现于昆虫化学感受器官,因此被认为与感受化学信息有关,故被称为化学感受蛋白[5-6]。作为中国的本土蜜蜂,中华蜜蜂(Apis cerana cerana,简称中蜂)善于采集零星蜜源,具有灵敏发达的嗅觉和化学感受系统[7]。触角是蜜蜂重要的嗅觉器官,除了高丰度地表达OBPs外,笔者团队前期发现了一个高丰度表达于工蜂触角的化学感受蛋白CSP1[8],鉴定其是否参与对性信息素及植物挥发物的化学感受识别功能,将对于明确触角独特CSPs蛋白功能,以及丰富中蜂甚至昆虫对化学信息素的化学感受机制,都具有重要的理论意义。【前人研究进展】OBPs和CSPs广泛存在于昆虫的化学通讯系统中,二者分别含有6个和4个保守的半胱氨酸,分别形成3对和2对二硫键。典型的OBPs一般特异表达于触角等嗅觉器官,与嗅觉功能相关;而作为昆虫化学通讯系统的重要组成部分,CSPs除具有化学感受功能外,还具有复杂的生理功能,如肢体再生[9]、胚胎发育[10],甚至型变中的行为调控[11]等。然而愈来愈多报道证明许多CSPs也体现了与OBPs类似的嗅觉功能和特征,如在苜蓿盲蝽(Adelphocoris lineolatus)[12-13]、西花蓟马(Frankliniella occidentalis)[14]和烟粉虱(Bemisia tabaci)[15]中,CSPs参与包括驱避性气味在内的不同寄生植物挥发物的识别;在沙漠蝗(Schistocerca gregaria)[16]、竹节虫(Carausius morosus)[17]和日本弓背蚁(Camponotus japonicas)[18]中,CSPs也能与昆虫信息挥发物高亲和力结合。由于CSP1高丰度地表达于工蜂触角,因此CSP1有可能与中蜂的化学感受和嗅觉生理功能有着密切的联系。蜜蜂的化学感受蛋白家族主要包括6个CSPs,且这些CSPs的表达部位与表达时期各不相同,而功能方面则包含了从胚胎发育、化学感受信号传导到角质层的合成等[8,19]不同的作用功能。如意大利蜜蜂(Apis mellifera ligustica,简称意蜂)中CSP5主要参与了胚胎表皮生成[10],CSP3主要与幼虫信息素中的脂肪酸成分结合[20]。而中蜂的CSP3则发现表达于工蜂触角B型毛形感器[21],也可与某些植物挥发物结合,因此可能作为中蜂化学感受系统的一部分,在其搜寻蜜源时作为气味分子运载体发挥一定的作用[3]。【本研究切入点】在前期研究中,鉴定了中蜂的一个化学感受蛋白CSP1[22],并发现其高丰度地表达于工蜂触角[8],暗示CSP1很可能与中蜂的嗅觉和化学感受功能密切相关。本研究从CSP1的体外功能、作用模式以及亚细胞定位等3方面对中蜂CSP1基因功能进行深入解析。【拟解决的关键问题】对中蜂的一个触角高丰度表达的化学感受蛋白CSP1进行结合功能和模式分析及亚细胞定位。包括获得重组的中蜂CSP1蛋白;利用荧光竞争试验解析CSP1与各种化学信息素的结合功能;通过分子对接解析CSP1与各种化学信息分子的作用模式及可能起主要作用的氨基酸关键位点;利用免疫电镜技术获得CSP1在工蜂触角上的亚细胞定位情况。1 材料与方法
试验于2016 年在中国计量大学生命科学学院/生物计量及检验检疫技术浙江省重点实验室完成。1.1 试剂与仪器
中蜂CSP1重组蛋白质粒pET-32a(+)/CSP1由笔者实验室保存于大肠杆菌DH5α中;凝胶回收和质粒提取试剂盒、pMD18-T载体以及实验所需内切酶均购于TaKaRa公司;镍柱ProteinIsoTM Ni2+-NTA Resin购于北京全式金生物技术有限公司;Ampicillin、甲醇和各种磷酸盐等化学试剂均购自上海生工生物工程股份有限公司;9-ODA(纯度>95 %)为中国科学院西双版纳植物园文平博士馈赠,其他所有化学信息素和气味信息(纯度>97%及以上)均购自上海百灵威化学技术有限公司,其他试剂均为国产分析纯试剂。1.2 方法
1.2.1 中蜂CSP1重组蛋白的诱导 将克隆的中蜂CSP1[22]构建至pET-32a (+)载体中,获得的pET-32a (+)/CSP1质粒转入BL21(DE3)感受态菌中,平板涂布后,挑取单克隆菌落接种于5 mL LB培养基(含氨苄青霉素60 μg·mL-1)中,37℃ 220 r/min 振荡培养过夜,次日按1%(V/V)接种量转接 200 mL LB培养基(含氨苄青霉素60 μg·mL-1),继续培养至 OD600 ≈ 0.4左右时,向原菌液加入 IPTG 至终浓度为 1 mmol·L-1,30℃ 200 r/min诱导5 h。1.2.2 中蜂CSP1重组蛋白的纯化 将200 mL诱导好的CSP1大肠杆菌菌液,离心弃上清,加入5 mL的细菌裂解液放置30 min后,超声破碎15 min,离心后取上清,利用镍柱对表达于细胞裂解上清液内的CSP1重组蛋白进行亲和层析纯化,最后经过PBS透析液(pH 7.4)透析72 h后,经SDS-PAGE鉴定后,最终获得可溶的具有生物活性的CSP1重组蛋白,利用Bradford法对CSP1重组蛋白浓度进行测定和定量,并置于-20℃保存备用。
1.2.3 中蜂CSP1蛋白与1-NPN荧光探针的相互作用 利用RF-5301PC型荧光分光光度计(日本岛津公司)研究 CSP1与1-NPN的相互作用,测试1-NPN 是否可作为荧光报告子[23]。设定荧光分光光度计的激发波长为281 nm,荧光发射与激发狭缝宽度为5 nm,扫描范围为290—500 nm。用PBS缓冲液将CSP1重组蛋白稀释至1 µmol·L-1,取3 mL于石英比色皿中,并以100 µmol·L-1的 1-NPN 溶液进行滴定,每次混匀静止3 min,记录蛋白最大荧光发射波长处的荧光强度。根据下列Scatchard方程[24]对光谱数据线性化:
$$\frac{[D_t]-[D]}{[D]}=-K([D_t]-[D])+nK[P_t] \ \ (1)$$
式中,[Dt]为总1-NPN浓度,[D]为体系中游离1-NPN浓度,K为重组蛋白与荧光报告子的结合常数,[Pt]为试验中CSP1的浓度,n为二者结合位点数。
1.2.4 中蜂CSP1蛋白的荧光竞争试验 1-NPN 作为荧光报告子,利用竞争结合试验[3]来研究候选配基与中蜂CSP1重组蛋白的解离常数。测试时将9种不同配基用甲醇配制成浓度为1 mmol·L-1,并分别逐次地加入到CSP1与1-NPN的混合液中,记录体系最大荧光发射光谱。根据以下公式[25]计算各个配基的解离常数 KD:
$$K_D=\frac{[IC_{50}]}{(1+\frac{[1-NPN]}{K_{1-NPN}})}\ \ (2)$$
式中,[IC50]为50%的荧光报告子被替换时候选配基的浓度,[1-NPN]是混合液中游离的1-NPN浓度,K1-NPN为CSP1与1-NPN的解离常数。
1.2.5 中蜂CSP1蛋白与气味信息的分子对接 CSP1的预测三维晶体结构是由SWISS-MODEL工作区[26]基于甘蓝夜蛾(Mamestra brassicae)的CSPMbraA6晶体结构(PDB entry code,1n8v)[27]中预测获得。所有信息气味物质的3D结构均是从NCBI的PubChem中下载获得。利用Molegro Virtual Docker(MVD)4.2软件将气味物质的3D结构与CSP1蛋白预测晶体结构进行对接,其中根据MolDock Optimizer和MolDock Score两项指标作为搜索标准和评分依据[28]。根据MolDock Score选出最佳对接模型进行作用机理分析,获得结合时配基周围的CSP1残基分布以及氢键产生情况,以此获得各种气味信息与CSP1的结合模式。
1.2.6 中蜂CSP1蛋白的胶体金免疫定位 将纯化后的中蜂CSP1重组蛋白按文献[29]多抗制备方法免疫注射新西兰大白兔,免疫获得多克隆抗体。先对中蜂触角进行低温固定、脱水、渗透、包埋、聚合后进行超薄切片,然后对样品切片进行免疫胶体金标记:将附有切片的载网置于ddH2O,润湿5 min;0.01 mol·L-1 PBS(含有1% BSA、0.05% TritonX-100、0.05% Tween20 pH 7.4)常温封闭5 min;CSP1兔抗用0.01 mol·L-1 PBS(含有1% BSA、0.05% Tween20 pH 7.4)稀释50倍,将载网置于稀释好的抗体上孵育过夜(同时做空白对照);洗涤之后用稀释100倍的结合有金颗粒的二抗标记1 h;洗涤后用3%的醋酸双氧铀染色5 min,再用柠檬酸铅染色3 min,最后用滤纸吸干,将载网装载入日立H-7650型透射电子显微镜中观察拍照。
2 结果
2.1 重组CSP1蛋白的诱导及纯化
将pET-32a (+)/CSP1质粒转入BL21(DE3)感受态菌中,用IPTG诱导CSP1重组表达,并用镍柱进行纯化、经PBS透析后最终获得中蜂CSP1重组蛋白。蛋白诱导和纯化后的SDS-PAGE电泳结果(考染结果)如图1所示,泳道1为IPTG诱导前的对照,泳道2为IPTG诱导后结果,泳道3为纯化后的CSP1重组蛋白。由图1可明显看出经IPTG诱导的CSP1重组蛋白产生表达以及纯化情况。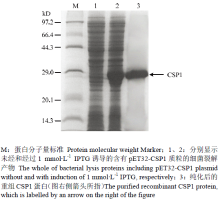 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1诱导和纯化CSP1蛋白的SDS-PAGE
-->Fig. 1SDS-PAGE of induced and purified recombinant CSP1 protein
-->
2.2 中蜂CSP1与1-NPN报告子的荧光光谱分析
发射光谱扫描确定CSP1的激发波长在281 nm,用100 μmol·L-1的1-NPN溶液滴定1 μmol·L-1重组CSP1蛋白溶液,并进行荧光扫描,如图2所示,荧光光谱的多项式拟合以及Scatchard方程线性化拟合的相关系数分别达到0.9993和0.9933,显示拟合较好。根据公式(1),1-NPN与CSP1的解离常数K1-NPN为2.10 μmol·L-1,结合位点数n为 0.99,表明CSP1与1-NPN结合时基本上为1﹕1结合,因此1-NPN能够用于CSP1与候选化学信息素功能研究时的竞争性荧光报告子。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2荧光配基1-NPN与重组CSP1蛋白的结合分析
-->Fig. 2Binding of fluorescent ligand 1-NPN with the recombinant CSP1 protein
-->
2.3 中蜂CSP1与不同化学信息配基的竞争性荧光结合分析
共选择了9种化学信息配基进行配基竞争性荧光结合试验,如图3所示,9种配基均能将1-NPN从CSP1的相对荧光值竞争至50%以下,所有配基的解离常数如表1所示,亲和力最强的是两种蜂王信息素成分对羟基苯甲酸甲酯(HOB)和9-ODA以及植物挥发物成分3-蒈烯,三者的解离常数KD均<10 μmol·L-1,其他6种配基与CSP1的解离常数均>10 μmol·L-1。Table 1
表1
表1候选化学信息素与重组CSP1蛋白的结合试验和分子对接
Table 1Binding assay and docking analysis of candidate semiochemicals with the recombinant CSP1 protein
| 分类 Classification | 化学信息素 Semiochemicals | [IC50] (µmol·L-1) | KD解离常数 Dissociation constant (μmol·L-1) | MolDock 得分 MolDock score | 氢键HBond | |
|---|---|---|---|---|---|---|
| 能量 Energy | 残基 Residues | |||||
| 信息素类 Pheromones | 对羟基苯甲酸甲酯Methyl 4-hydroxybenzoate (HOB) | 10.1 | 7.68 | -77.72 | -7.15 | Asp40 |
| 9-羰基-2癸烯酸 9-ODA | 12.53 | 9.53 | -132.69 | -12.79 | Tyr26 | |
| 法尼醇Farnesol | 15.12 | 11.49 | -112.32 | -6.00 | Asp40 | |
| 香草醇Vanillyl alcohol | 31.61 | 24.03 | -74.53 | -3.69 | Asp40 | |
| 植物挥发物 Plant volatiles | 3-蒈烯3-carene | 12.89 | 9.80 | -68.20 | — | — |
| 正己醇n-hexanol | 14.51 | 11.03 | -60.56 | -6.10 | Asp40 | |
| 月桂烯Myrcene | 14.86 | 11.30 | -86.55 | — | — | |
| α-松油醇α-terpineol | 15.03 | 11.43 | -61.83 | — | — | |
| β-紫罗兰酮β-ionone | 19.52 | 14.84 | -96.57 | — | — | |
新窗口打开
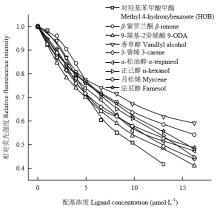 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3候选配基与荧光配基1-NPN于重组CSP1蛋白的竞争结合
-->Fig. 3Competitive binding assay of candidate ligands with 1-NPN with the recombinant CSP1
-->
2.4 以对羟基苯甲酸甲酯为代表的蛋白与配基作用模式分析
根据斜纹夜蛾的CSPMbraA6晶体结构(PDB entry code,1n8v),利用SWISS-MODEL预测获得CSP1的三维晶体结构。HOB的3D结构在NCBI(注册码:7456)中下载获得。根据MVD中的MolDock能量得分情况,推测CSP1与HOB的最佳结合模式。基于该模型找到CSP1与HOB相互作用过程中能量贡献主要的8个氨基酸残基,包括4个疏水性残基(Phe30、Phe44、Leu70和Phe85),3个极性中性残基(Tyr26、Tyr27和Ser41)和1个酸性残基(Asp40)。其中主要有两个α-螺旋结构:含Tyr26、Tyr27和Phe30,以及Asp40、Ser41和Phe44,与其他的两个氨基酸残基,共同组成了一个HOB的结合腔(图4-A)。且预测HOB苯环中羟基上的氧原子分别与CSP1肽链中Asp40两个羧基上的氧原子各产生一个氢键(图4-B蓝色虚线)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4中蜂CSP1与对羟基苯甲酸甲酯的分子对接
-->Fig. 4Molecular docking of CSP1 with HOB
-->
2.5 中蜂CSP1蛋白的胶体金免疫定位
利用胶体金标记免疫电镜定位技术对中蜂化学感受蛋白CSP1进行了触角定位,结果如图5所示,可以看出大量的金颗粒被标记在嗅觉感器的板形感器周围的附属组织中(图5-B、5-C),而对于蜜蜂的主要嗅觉感受器——板形感器内部(图5-D),虽然也有金颗粒的标记,但在数量上明显低于板形感器周围的附属细胞组织,这也与中蜂的普通气味结合蛋白ASP2主要表达于嗅觉功能的板形感器[30]存在显著差异,所以笔者认为CSP1尽管能与信息素等气味信息物质结合,但与气味结合蛋白的生物特征存在明显区别。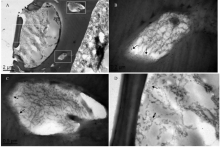 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5基于免疫电镜的中蜂CSP1触角板形感器中的的亚细胞定位
-->Fig. 5Immunocytochemical localization of CSP1 in antennae sensilla placodea (Sp) in A. c. cerana
-->
3 讨论
在前期研究中,CSP1基因被证实高丰度地表达于中蜂的工蜂触角,表明其可能与中蜂的嗅觉功能有关[8,22]。为进一步深入研究CSP1的结合功能和模式,本研究首先获得了CSP1的重组蛋白,再利用竞争荧光法研究了基于1-NPN荧光配基的CSP1与9种候选化学信息素配基的结合作用。1-NPN是一种常用于研究昆虫蛋白功能的荧光报告子,已经应用于多种CSPs的功能研究中[3,15,31],本试验中1-NPN与CSP1的KD值为2.10 μmol·L-1,与其他昆虫CSPs相比,如1-NPN与造纸胡蜂(Polistes dominulus)的CSP以及家蚕(Bombyx mori)中BmCSP4的KD值为分别为2.2和4.8 μmol·L-1[32-33],均高于中蜂CSP1与1-NPN的KD,表明CSP1与1-NPN的结合较强,1-NPN能够用于CSP1与候选化学信息素功能研究时的竞争性荧光报告子。在所有测试的化学信息素中,CSP1与两种蜂王信息素成分——对羟基苯甲酸甲酯(HOB)和9-ODA结合力最强,HOB与9-ODA属于蜂王上颚腺信息素成分之一[34],其作用为抑制工蜂卵巢发育[35],抑制工蜂培育新蜂王[36],吸引工蜂聚集到蜂王周围[37]。这与先前报道的另外两个中蜂信息素结合蛋白ASP1[38]和OBP10[39]功能相似,而且CSP1与HOB的亲和力要较二者更强,表明CSP1可能在工蜂感受蜂王上颚腺信息素的生殖调控和社会行为方面甚至较PBPs发挥着更重要的作用。
此外,本研究选用的5种植物挥发物成分包括2种烯烃、2种醇类和1种酮类,都是常见的花香味植物性挥发物[40-43],均与CSP1具有较强的亲和力,说明作为中蜂化学感受系统中的信息转运蛋白,CSP1可能在中蜂访花和寻找蜜源植物时作为气味分子转运载体而发挥一定的作用。在5种植物挥发物中CSP1与3-蒈烯亲和力最强,由于3-蒈烯不但存在于很多植物花香成分中,还存在于对某些昆虫如烟粉虱产生驱避作用的寄主植物中[44],而烟粉虱CSP1也被证实与3-蒈烯有较强的亲和力[15],不过3-蒈烯是否能对中蜂产生驱避作用还需要进一步研究。此外,β-紫罗兰酮是一种非常易于与各种昆虫嗅觉相关蛋白结合的花香类物质[13,45-47],本研究中CSP1与其也有较强的亲和力,解离常数KD为14.84 μmol·L-1,亲和力要强于中蜂另外一个化学感受蛋白CSP3(KD为23.07 μmol·L-1[23]),与两个中蜂信息素结合蛋白ASP1(KD为14.69 μmol·L-1[38])和OBP10(KD为10.20 μmol·L-1[39])较为接近,而明显弱于中蜂气味结合蛋白ASP2(与β-紫罗兰酮的KD为5.14 μmol·L-1[3]),表明CSP1在β-紫罗兰酮这种蜜蜂偏好性气味的识别和结合能力强于化学感受蛋白CSP3,接近信息素结合蛋白ASP1和OBP10,但不及普通气味结合蛋白ASP2。
利用分子对接对CSP1与荧光竞争测试配基进行能量预测(表1),作为蛋白与小分子结合时的自由能表征值,MolDock得分与荧光结合结果基本相符。另外发现在9种测试化学信息物质中,有5种能与CSP1蛋白间产生氢键,且其中4种都与Asp40作用产生氢键,暗示Asp40在CSP1与化学信息素的结合过程中发挥着重要作用。在气味结合蛋白AcerASP2与配基的结合过程中,其疏水结合腔中的Lys74和Lys51残基也容易与配基产生氢键[23]。表明嗅觉相关蛋白与气味信息物质的结合很有可能是与信息分子和蛋白结合腔内的某些特定氨基酸残基间产生氢键密切相关。然而另一方面,3-蒈烯、α-松油醇、月桂烯和β-紫罗兰酮等4种物质均未与CSP1产生氢键,表明氢键的作用也是局限性的,还会受到气味分子整体结构与CSP1疏水内腔微结构的其他相互作用的综合因素影响和限制。
通过免疫胶体金电镜定位,CSP1主要被标记在板形感器的周围附属组织;在板形感器内部也有少量标记。这与中蜂普通气味结合蛋白ASP2主要表达于嗅觉功能的板形感器[30]存在差异显著。此外,在中蜂化学感受蛋白CSP3的免疫定位中,几乎所有的板形感器即嗅觉感器几乎没有任何标记,但是发现板形感器周边的裂缝内的浅沟却被明显标记[21]。因此,CSP1尽管能与蜂王信息素和某些化学信息物质具有较强结合能力,但与普通气味结合蛋白的组织定位存在明显区别,与气味结合蛋白的作用方式也大相径庭。
4 结论
中蜂CSP1与两种蜜蜂蜂王信息素成分对羟基苯甲酸甲酯(HOB)和9-ODA以及植物挥发物成分3-蒈烯具有较强的结合能力,且与对羟基苯甲酸甲酯亲和力最强。而CSP1的胶体金免疫电镜定位试验发现板形感器的内部以及周围附属组织中均有金颗粒的标记,但周围附属组织中的金颗粒多于感器内部,这与普通气味结合蛋白ASP2主要表达于嗅觉功能的板形感器存在差异,所以笔者认为CSP1是一种能与信息素等物质识别,但与其他嗅觉基因定位生理特征存在明显区别的化学感受蛋白。The authors have declared that no competing interests exist.
