0 引言
【研究意义】牡丹隶属于芍药科芍药属,在国内作为传统名花深受人们的喜爱,兼具观赏和药用价值[1]。近年来,在牡丹栽培管理过程中,由于土壤和苗木消毒不严,栽培方法不当,管理不善以及气候等因素,真菌病害有逐年加重趋势,且出现了几种新病害[2-3]。《中国牡丹全书》共报道27种牡丹病害[2],《河南省经济植物病害志》共报道25种牡丹病害[4]。种植面积的扩大和各种传统病害的积累以及新型病害的出现严重影响了牡丹原有价值的表现。因此,筛选防治牡丹病害的有效药剂具有重要意义。【前人研究进展】目前,对牡丹病害的研究仅限于病原菌的鉴定及病害的大田防治,对病害防治药剂筛选的研究较少[5]。苯并咪唑类杀菌剂如多菌灵和甲基托布津在牡丹叶霉病的大田防治上显示出良好的控制效果[6]。研究发现,多菌灵、戊唑醇及嘧菌酯对叶霉病菌(Cladosporium paeoniae)孢子萌发均有很强的抑制作用,表明3种杀菌剂均可作为保护剂在病害发生前期喷施[7]。嘧菌酯、苯醚甲环唑和多菌灵3种杀菌剂对牡丹黑斑病菌(Alternaria suffruticosae)的菌丝生长及孢子萌发有很强的抑制作用,在防治牡丹黑斑病上表现出较好的应用潜力[8]。多菌灵、嘧菌酯及苯醚甲环唑均可用于牡丹黄斑病的化学防治[9]。此外,百菌清可湿性粉剂对牡丹黄斑病也有很好的抑制效果[10]。多菌灵、氟环唑及嘧菌酯可作为柱枝孢叶斑病化学防治的备选药剂而应用在牡丹病害的综合防控中[11]。戊唑醇和嘧菌酯可以抑制牡丹腔孢叶斑病菌(Hainesia lythri)的生长[12]。咯菌腈属于苯吡咯类保护性杀菌剂,商品名适乐时。咯菌腈对链格孢(Alternaria alternata)、玉米小斑离蠕孢(Bipolaris maydis)、灰葡萄孢(Botrytis cinerea)、油菜菌核病菌(Sclerotinia sclerotiorum)及禾谷丝核菌(Rhizoctonia cerealis)的菌丝生长均有很强的抑制作用,敏感性基线分别为0.77[13]、0.04[14]、0.01[15]、0.02[16]及0.03 μg·mL-1[17]。咯菌腈处理可使油菜菌核病菌菌丝细胞膨大,原生质浓缩、外渗等,最终导致细胞破裂死亡;田间试验则表明,咯菌腈对油菜菌核病具有很好的保护作用及一定的治疗作用[18]。咯菌腈与噻菌灵无交互抗性,已对噻菌灵产生抗药性的扩展青霉(Penicillium expansum)的菌丝生长及孢子萌发对咯菌腈均较为敏感,是采后苹果青霉病防治上的一种理想药剂[19]。进一步的研究则证实真菌对咯菌腈的敏感性受其体内组氨酸激酶的调控,III组组氨酸激酶中保守氨基酸的突变或缺失均可引起病菌对咯菌腈的敏感性降低[20-21]。咯菌腈不但对多种病原菌有抑制活性,而且能促进幼苗生长,提高抗病性相关酶的活性[22]。【本研究切入点】2017年3月30日,在中国农药信息网(http://www.chinapesticide.gov.cn/hysj/index. jhtml)上查询,咯菌腈原药、制剂及其为主要成分的复配剂共99条,而在该网上登记注册用于防治牡丹病虫害的药剂仅一种——烯酰吗啉水分散粒剂,用来防治观赏牡丹霜霉病。咯菌腈尚未有在牡丹病害防治上应用的报道,在牡丹病害防治方面的前景有待探索。【拟解决的关键问题】以牡丹叶霉病菌、牡丹黑斑病菌、牡丹黄斑病菌(Phyllosticta commonsii)及牡丹腔孢叶斑病菌为研究对象(前两种引起的病害比较严重和普遍,腔孢叶斑病是洛阳地区出现的新型病害),明确咯菌腈对这4种病菌生长的抑制作用,分析咯菌腈在牡丹病害化学防治上的应用前景,为牡丹病害的化学防控打下基础。1 材料与方法
试验于2016年2—6月在河南科技大学林学院植物病原物分子生物学实验室完成。1.1 试验材料
1.1.1 供试菌株 2013年实验室分离保存的牡丹叶霉病菌、牡丹黑斑病菌、牡丹黄斑病菌、牡丹腔孢叶斑病菌菌株,由河南科技大学林学院植物病原物分子生物学实验室提供。1.1.2 供试药剂 97.9%咯菌腈原药,先正达中国投资有限公司生产,预溶于甲醇中,配制成1.0×104 μg·mL-1的母液备用。
1.1.3 供试培养基 马铃薯蔗糖琼脂培养基(potato sugar agar,PSA)用于菌株活化、菌丝生长和产孢试验。水琼脂培养基(water agar,WA)用于孢子萌发和芽管伸长试验。磷酸二氢钾葡萄糖琼脂培养基(KH2PO4 dextrose agar,KDA)用于产孢时间试验,其成分KH2PO4 1.0 g、KNO3 1.0 g、KCl 0.5 g、MgSO4 0.5 g、淀粉0.2 g、葡萄糖0.2 g、蔗糖0.2 g、琼脂18—20 g、H2O 1 L[15]。
1.2 仪器设备
SW-CJ-IFD型双人单面垂直净化工作台,苏州智净技术有限公司;SPX-250B5H-II型生化培养箱,上海新苗医疗器械制造有限公司;LS-50LD型立式压力蒸汽灭菌锅,江阴滨江医疗设备有限公司;101型电热鼓风干燥箱,北京永光明医疗仪器有限公司;CX41型Olympus系统显微镜,Olympus(中国)有限公司。1.3 试验方法
1.3.1 咯菌腈对病菌菌丝生长的影响 采用含毒介质培养法即菌丝生长速率法进行测定[23]。将分离纯化的菌株在PSA平板上培养5—10 d后,用打孔器在菌落边缘打制直径5 mm的菌饼,接种在含系列浓度药剂的PSA平板正中央,其中对牡丹腔孢叶斑病菌浓度梯度设置为0、0.0003125、0.000625、0.00125、0.0025、0.005、0.01 μg·mL-1,对牡丹黑斑病菌和牡丹黄斑病菌浓度梯度均设置为0、0.03125、0.0625、0.125、0.25、0.5、1 μg·mL-1,25℃黑暗培养一定天数(黑斑7 d、黄斑12 d、腔孢叶斑12 d),待不含药的对照平板菌落直径达到70—80 mm时,用十字交叉法测量每个平板的菌落直径,每处理3个重复,计算各浓度处理下咯菌腈对菌丝生长的抑制率。菌丝生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。1.3.2 咯菌腈对病菌孢子萌发的影响 采用涂布平板法测定[24]。菌株在PSA平板上25℃培养10 d后,用0.1%吐温80溶液洗下分生孢子,4层纱布过滤除去菌丝,将滤液在5 000 r/min下离心10 min,去除上清液,将分生孢子重悬于0.1%吐温80溶液中,调节孢子浓度至105个/mL,制成孢子悬浮液备用。吸取100 μL孢子悬液涂布在含0、0.1、0.5、1、5、10、50 μg·mL-1咯菌腈的WA平板上,每处理3次重复,置于25℃培养箱中黑暗培养病菌(叶霉病菌24 h、黄斑病菌12 h、黑斑病菌12 h、腔孢叶斑病菌18 h),直到对照的萌发率达到95%以上,每皿随机观察100个孢子,统计孢子萌发数,以芽管长度超过孢子最大直径的一半作为萌发标准,计算萌发抑制率。孢子萌发抑制率=(对照孢子萌发率-药剂处理孢子萌发率)/对照孢子萌发率×100%。
1.3.3 咯菌腈对病菌孢子芽管伸长和芽管形态的影响 操作步骤同1.3.2,涂布平板黑暗培养一定时间后,在显微镜下使用测微尺对芽管长度进行测量,每皿随机选取10根芽管测量,求出平均芽管长度,计算各药剂浓度对芽管伸长的抑制率。芽管伸长抑制率=(对照芽管平均长度-药剂处理芽管平均长度)/对照芽管平均长度×100%。测量结束后对各个药剂浓度下的孢子及芽管形态拍照。
1.3.4 咯菌腈对病菌产孢时间的影响 参照康业斌等[25]的方法进行。按照1.3.2的方法制作孢子悬浮液,取0.1 mL孢子悬浮液涂布在含CK、0.1、0.5、1、5、10、50 μg·mL-1咯菌腈的KDA平板上,每处理3次重复,于25℃培养箱中黑暗培养,每隔12 h观察记录产孢结构形成情况,直到分生孢子出现,记录分生孢子产生的时间。
1.3.5 咯菌腈对病菌产孢量的影响 对于牡丹黑斑病菌及腔孢叶斑病菌,结合1.3.1进行,十字交叉法测完菌落直径后,继续培养18 d(黑斑病菌)及7 d(腔孢叶斑病菌)后测定产孢量。对于叶霉病菌,取0.1 mL孢子悬液,涂布在含0、0.2、0.3、0.4、0.5、0.6及0.8 μg·mL-1咯菌腈的PSA平板上,培养3 d后测量产孢量。取10 mL 0.1%吐温80溶液至平板中,用玻璃刮铲刮下孢子,然后用移液枪将孢子液移入10 mL的离心管中,在振荡器上振荡降低孢子间的表面张力使孢子充分溶解在溶剂中,用移液枪吸取50或100 μL孢子液打入血球计数板的计数室,对每格孢子计数并确定稀释倍数,孢子浓度大的稀释至105个/mL,浓度小的不稀释,在10×镜下进行计数,计算各浓度处理下药剂对病原菌产孢的抑制率。产孢抑制率=(对照产孢量-药剂处理产孢量)/对照产孢量×100%。
1.3.6 数据分析 利用Excel 2007进行数据处理,采用DPS-6.55Patch软件中的数量型数据机值分析模块计算药剂抑制菌丝生长、孢子萌发、芽管伸长及产孢量的有效中浓度EC50,并采用最小显著差异法(Least-Significant Difference,LSD)进行显著性检验。
2 结果
2.1 咯菌腈对病菌菌丝生长的抑制作用
咯菌腈对3种牡丹病原真菌均有很强的抑制作用,其中对腔孢叶斑病菌的抑制作用最强,EC50为0.01 μg·mL-1;对黑斑病菌的抑制作用较强,EC50<0.1 μg·mL-1;而对黄斑病菌的抑制作用较弱(表1)。由于叶霉病菌在PSA上培养时菌丝少,不易测定,故本文未对叶霉进行菌丝生长抑制作用的测定。2.2 咯菌腈对病菌孢子萌发的影响
由表1可知,咯菌腈对叶霉病菌、黄斑病菌、黑斑病菌、腔孢叶斑病菌的孢子萌发都有较强的抑制作用,相比较下,咯菌腈对腔孢叶斑病菌孢子萌发的抑制作用最强,EC50仅为1.26 μg·mL-1,对叶霉病菌、黄斑病菌、黑斑病菌孢子萌发的抑制作用较弱,但咯菌腈对这3种病菌孢子萌发的抑制作用相差不大,EC50在3.27—3.45 μg·mL-1。2.3 咯菌腈对病原真菌芽管伸长及形态的影响
咯菌腈对叶霉病菌、黄斑病菌、黑斑病菌、腔孢叶斑病菌的芽管伸长都有较强的抑制作用,其中对腔孢叶斑病菌芽管伸长的EC50为0.04 μg·mL-1,抑制作用最强(表1)。咯菌腈对4种病原菌分生孢子芽管伸长均有明显抑制作用,最小药剂浓度对病原菌分生孢子芽管伸长的抑制率已达到40%—70%,而且随着浓度增大,抑制作用越强,各浓度间差异显著(表2)。2.3.1 牡丹黑斑病菌 黑斑病菌孢子在培养12 h后,芽管长度达到317 μm,不同浓度的咯菌腈对芽管伸长均有很强的抑制作用,0.1 μg·mL-1抑制率即达到50.16%,随着浓度升高,抑制率逐渐增大;50 μg·mL-1时,抑制率达到95%(表2)。咯菌腈对黑斑病菌芽管伸长的EC50为0.08 μg·mL-1,表明药剂对黑斑病菌芽管伸长有很强的抑制作用(表1)。
在WA上涂布12 h后,黑斑病菌分生孢子从一端或两端萌发形成菌丝状芽管,细胞形态正常,能正常生长并分化形成菌丝,但并未产生分枝(图1-A)。在含药平板上,分生孢子及芽管均出现畸形。低浓度下(0.1 μg·mL-1),药剂对孢子及芽管致畸作用不明显(图1-B)。随着药剂浓度升高,致畸作用增强,0.5、1和5 μg·mL-1时,分生孢子两端、中间均有细胞萌发,在萌发时,芽管已开始产生分枝(图1-C—E)。而在10和50 μg·mL-1时,分生孢子及芽管均有肿胀现象,生出的芽管不规则畸形,并表现为基部膨大,顶端膨大及中间局部膨大;芽管分枝间距缩短,分生孢子变形严重(图1-F、1-G)。
Table 1
表1
表1咯菌腈对牡丹病原真菌菌丝生长、孢子萌发、产孢量及芽管伸长的抑制作用
Table 1Inhibitory effect of fludioxonil on mycelial growth, conidia germination, sporulation and germ tube elongation of peony pathogenic fungi
| 生长阶段 Stage | 病原菌 Pathogen | 毒力回归方程 Regression equation (y=) | EC50 (95%置信区间) (μg·mL-1) (95% CL) | 相关系数 R (%) |
|---|---|---|---|---|
| 菌丝生长 Mycelial growth | 牡丹黑斑病菌 A. suffruticosae | 6.73+1.49x | 0.07 (-1.13-0.07) | 0.998 |
| 牡丹腔孢叶斑病菌 H. lythri | 8.00+1.44x | 0.01 (-1.73-0.02) | 0.94 | |
| 牡丹黄斑病菌 P. commonsii | 5.84+1.85x | 0.35 (-0.38-0.42) | 0.99 | |
| 孢子萌发 Conidial germination | 牡丹黑斑病菌 A. suffruticosae | 4.65+0.66x | 3.45 (0.66-4.52) | 0.99 |
| 牡丹叶霉病菌 C. paeoniae | 4.61+0.68x | 3.71 (0.77-5.87) | 0.98 | |
| 牡丹腔孢叶斑病菌 H. lythri | 4.91+0.93x | 1.26 (0.27-1.85) | 0.98 | |
| 牡丹黄斑病菌 P. commonsii | 4.56+0.86x | 3.27 (0.63-4.23) | 0.99 | |
| 产孢 Sporulation | 牡丹黑斑病菌 A. suffruticosae | 7.14+1.67x | 0.05 (-1.12-0.08) | 0.98 |
| 牡丹叶霉病菌 C. paeoniae | 7.95+7.11x | 0.38 (-0.36-0.43) | 0.97 | |
| 芽管伸长 Germ tube elongation | 牡丹黑斑病菌 A. suffruticosae | 5.62+0.56x | 0.08 (-0.80-0.16) | 0.98 |
| 牡丹叶霉病菌 C. paeoniae | 5.29+0.44x | 0.22 (-0.42-0.38) | 0.98 | |
| 牡丹腔孢叶斑病菌 H. lythri | 6.07+0.76x | 0.04 (-0.55-0.28) | 0.94 | |
| 牡丹黄斑病菌 P. commonsii | 5.50+0.68x | 0.18 (-0.35-0.44) | 0.98 |
新窗口打开
Table 2
表2
表2咯菌腈对牡丹4种病原真菌芽管伸长的影响
Table 2Effects of fludioxonil on germ tube elongation of four peony pathogenic fungi
| 药剂浓度 Concentration (μg·mL-1) | 牡丹黑斑病菌 A. suffruticosae | 牡丹叶霉病菌 C. paeoniae | 牡丹腔孢叶斑病菌 H. lythri | 牡丹黄斑病菌 P. commonsii |
|---|---|---|---|---|
| 0 | 317.00±42.53a | 239.00±34.77a | 316.00±8.72a | 248.33±16.44a |
| 0.1 | 157.67±9.24b/50.16% | 138.67±11.72b/41.84% | 68.00±7.55b/78.48% | 151.33±23.03b/50.16% |
| 0.5 | 108.00±0c/65.93% | 109.33±16.92bc/54.39% | 53.67±7.77c/82.91% | 78.67±17.39c/65.93% |
| 1 | 67.00±0d/78.86% | 84.00±8.89cd/64.85% | 39.67±4.93d/87.34% | 57.33±23.18c/78.86% |
| 5 | 51.33±1.53d/83.92% | 63.33±11.59de/73.64% | 35.33±5.51d/88.92% | 54.67±30.89cd/83.91% |
| 10 | 44.33±3.06de/86.12% | 50.00±10.58e/79.08% | 8.67±2.08e/97.15% | 21.67±7.57de/86.12% |
| 50 | 17.33±1.53e/94.64% | 40.67±4.04e/82.85% | 2.33±1.15e/99.37% | 13.00±4.00e/94.64% |
新窗口打开
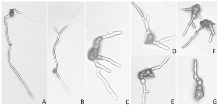 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同浓度药剂处理12 h后牡丹黑斑病菌分生孢子及芽管形态
-->Fig. 1Abnormality of conidia and germ tubes of A. suffruticosae treated with different concentrations of fludioxonil for 12 h
A: CK (100×); B: 0.1 μg·mL-1 (100×); C: 0.5 μg·mL-1 (400×); D: 1 μg·mL-1 (400×); E: 5 μg·mL-1 (400×); F: 10 μg·mL-1 (400×); G: 50 μg·mL-1 (400×)
-->
2.3.2 牡丹叶霉病菌 叶霉病菌分生孢子涂布24 h后,芽管长度可达到239 μm(表2)。低浓度药剂(0.1 μg·mL-1)即对芽管伸长产生了强烈的抑制作用,芽管长度仅138.67 μm,抑制率达到41.84%;浓度升高,抑制作用增强。咯菌腈对叶霉病菌芽管伸长的EC50为0.22 μg·mL-1,抑制作用明显(表1)。
分生孢子涂布24 h后,在WA平板上,分生孢子一端萌发形成菌丝状芽管,细胞形态正常,几乎不形成分枝(图2-A)。药剂浓度为0.1、0.5 μg·mL-1的平板上,咯菌腈对芽管的致畸作用不明显(图2-B、2-C)。药剂浓度在1 μg·mL-1以上时,分生孢子可以从一端或两端萌发,长出两根芽管;咯菌腈对叶霉病菌孢子及芽管致畸作用较弱,芽管基部稍有膨大,但畸形现象均不太明显(图2-D—G)。
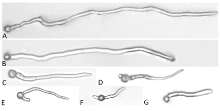 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同浓度药剂处理24 h后牡丹叶霉病菌分生孢子及芽管形态
-->Fig. 2Abnormality of conidia and germ tubes of C. paeoniae treated with different concentrations of fludioxonil for 24 h
A: CK (100×); B: 0.1 μg·mL-1 (100×); C: 0.5 μg·mL-1 (200×); D: 1 μg·mL-1 (200×); E: 5 μg·mL-1 (200×); F: 10 μg·mL-1 (200×); G: 50 μg·mL-1 (200×)
-->
2.3.3 牡丹腔孢叶斑病菌 分生孢子涂布18 h后,其芽管长度可达316 μm(表2)。低浓度药剂即对芽管伸长产生强烈的抑制作用,0.1 μg·mL-1时,芽管长度仅为68 μm,抑制率达到78.48%,而在高浓度50 μg·mL-1时,孢子芽管可以萌发,但长出的芽管基本不伸长,仅为2.33 μm,抑制率在99%以上。咯菌腈对腔孢叶斑病菌芽管伸长的EC50为0.04 μg·mL-1,抑制作用最为强烈(表1)。
涂布平板18 h后,在不含药剂的WA平板上,分生孢子从一端萌发,形成较长的形态正常的菌丝状芽管,尚未产生分枝(图3-A);低浓度药剂(0.1、0.5 μg·mL-1)可导致分生孢子从两端萌发长出芽管,芽管形态正常,不分枝(图3-B、3-C);高浓度药剂(1、5、10、50 μg·mL-1)时,分生孢子略膨大,一般从一端开始萌发,甚至不萌发,但咯菌腈对分生孢子及芽管的致畸作用均不太明显(图3-D—G)。
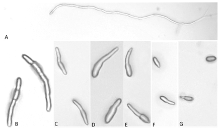 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同浓度药剂处理18 h后牡丹腔孢叶斑病菌分生孢子及芽管形态
-->Fig. 3Abnormality of conidia and germ tubes of H. lythri treated with different concentrations of fludioxonil for 18 h
A: CK (100×); B: 0.1 μg·mL-1 (400×); C: 0.5 μg·mL-1 (400×); D: 1 μg·mL-1 (400×); E: 5 μg·mL-1 (400×); F: 10 μg·mL-1 (400×); G: 50 μg·mL-1 (400×)
-->
2.3.4 牡丹黄斑病菌 涂布平板12 h后,黄斑病菌芽管长度可达248.33 μm(表2)。0.1 μg·mL-1时,咯菌腈对芽管伸长的抑制率已达50%以上,说明抑制作用强烈;随着浓度升高,抑制作用增强(表2)。咯菌腈对黄斑病菌芽管伸长的EC50为0.18 μg·mL-1,抑制作用明显(表1)。
涂布平板12 h后,分生孢子周围可长出2—3根芽管,并且已开始产生分枝(图4-A)。低浓度下(0.1、0.5、1 μg·mL-1),芽管可正常生长和分枝,但基部有膨大现象(图4-B—D)。随着浓度升高(5、10 μg·mL-1),芽管基部及中间部位膨大明显,分枝数明显增多(图4-E、4-F),但芽管顶端的菌丝形态正常。50 μg·mL-1时,分生孢子不能萌发或仅从一端萌发,且芽管形态正常(图4-G)。
2.4 咯菌腈产孢时间和产孢量的影响
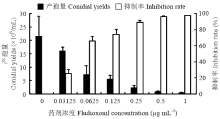
黑斑病菌分生孢子在KDA平板上培养120 h后,对照平板及0.1 μg·mL-1的平板上出现了分生孢子梗及分生孢子,其他含药平板均未出现产孢结构。由图5可知,在PSA上黑斑病菌可大量产孢,咯菌腈对黑斑病菌产孢有强烈的抑制作用,0.03125 μg·mL-1时,抑制率即可达到20%以上;随着药剂浓度增高,产孢量越来越少,抑制率逐渐增大。咯菌腈对黑斑病菌产孢的EC50为0.05 μg·mL-1,抑制作用强烈(表1)。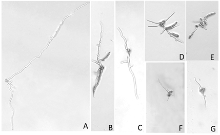 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同浓度药剂处理12 h后牡丹黄斑病菌分生孢子及芽管形态
-->Fig. 4Abnormality of conidia and germ tubes of P. commonsii treated with different concentrations of fludioxonil for 12 h
A: CK (100×); B: 0.1 μg·mL-1 (200×); C: 0.5 μg·mL-1 (200×); D: 1 μg·mL-1 (200×); E: 5 μg·mL-1 (200×); F: 10 μg·mL-1 (200×); G: 50 μg·mL-1 (200×)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5咯菌腈对牡丹黑斑病病菌产孢的影响
-->Fig. 5Effects of fludioxonil on sporulation of A. suffruticosae
-->
叶霉病菌分生孢子在KDA平板上培养60 h后,对照及含药平板上均出现了分生孢子梗和分生孢子,对照平板上,分生孢子梗发生3—6次分枝,每个分枝上有4—6个相连排列成念珠状的分生孢子;浓度为0.1 μg·mL-1时,分生孢子梗发生3—4次分枝,每个分枝上有3—4个分生孢子;0.5、1 μg·mL-1时,分生孢子梗发生1—2次分枝,每个分枝含1—3个孢子;5、10 μg·mL-1时,分生孢子梗可发生分枝,仅1—2个孢子;而50 μg·mL-1时,很少能观察到产孢结构。叶霉病菌在PSA上可大量产孢(图6)。低浓度下,0.2 μg·mL-1时,药剂对产孢有一定的抑制作用,且随着药剂浓度升高,抑制作用增强,0.5 μg·mL-1时抑制率即可达到90%左右。咯菌腈对叶霉病菌产孢的EC50为0.38 μg·mL-1,抑制作用稍弱于黑斑病菌(表1)。
腔孢叶斑病菌在KDA平板上培养84 h后,对照平板出现了分生孢子座和分生孢子;继续培养至120 h,各供试药剂浓度均未出现产孢结构。腔孢叶斑在PSA上培养时可大量产孢,但不同浓度的咯菌腈却对腔孢叶斑产孢有促进作用,产孢量同对照相比差别显著(图7)。
黄斑病菌分生孢子在KDA平板上培养36 h后,对照平板上出现了分生孢子器;继续培养至48 h,低浓度(0.1、0.5、1 μg·mL-1)的平板上出现了分生孢子器,其余平板均未观察到产孢结构。由于黄斑病菌分生孢子产生于分生孢子器中,不易计数,故未进行黄斑病菌产孢量测定。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6咯菌腈对牡丹叶霉病病菌产孢的影响
-->Fig. 6Effects of fludioxonil on sporulation of C. paeoniae
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7咯菌腈对牡丹腔孢叶斑病病菌产孢的影响
-->Fig. 7Effects of fludioxonil on sporulation of H. lythri
-->
3 讨论
由于牡丹的观赏时间在每年的4月份,此时牡丹新叶生出不久,生长健壮,对不良环境的抵抗力强。且4月份时温度较低,病原菌尚不活跃,牡丹园没有太多的接种体,故此时间牡丹上很少有病虫害的危害。进入7、8月份后,温度升高,日照加强,不利于喜凉耐荫的牡丹的生长,生长势下降,易造成牡丹叶片干枯。温度升高会导致病原菌繁殖速度加快,牡丹园接种体数量加大,易侵染生长势下降的牡丹叶片,造成牡丹叶部病害大片发生,严重时整个牡丹园一片枯焦。由于此时已过了牡丹的观赏时节,此外7、8月份后牡丹的长势并不会引起人们的关注,故严重发生的牡丹叶部病害一直未能引起人们足够的重视[26]。但牡丹叶片所合成的有机物,不但满足牡丹当年生长的需要,且为牡丹来年的开花提供充足的养分供应。感染叶斑病后,牡丹叶片光合作用及营养物质合成等生理功能受到破坏,导致根养分贮藏减少,这会对当年的花芽长势及来年的开花品质产生严重影响,故对牡丹叶部病害的防治不能松懈[27]。目前,防治牡丹叶部病害的药剂少之又少,在中国农药信息网上仅能查询到一种用于防治牡丹病害的药剂,生产中的用药多为波尔多液、多菌灵等传统药剂为主。多菌灵尽管对黑斑病菌的芽管伸长和产孢有一定的抑制作用,但对叶霉病菌、腔孢叶斑病菌、黄斑病菌的菌丝生长、孢子萌发及产孢量的抑制作用均较弱,不适合应用于牡丹病害的化学防治,故对牡丹叶部病害的防治效果并不明显[7-9,12]。咯菌腈属于苯吡咯类的保护性杀菌剂,可抵抗多种病原真菌的侵染。由本试验可看出,咯菌腈对牡丹4种病原真菌的抑制活性由强到弱依次为腔孢叶斑病菌、黑斑病菌、黄斑病菌及叶霉病菌。咯菌腈对多种病原真菌的菌丝生长均有强烈的抑制作用[13-17],而本研究则表明,咯菌腈除对病菌菌丝生长有影响外,对孢子萌发、芽管伸长及产孢也有很强的抑制作用,说明咯菌腈对病菌的影响是全面的。ERRAMPALLI[19]研究表明,咯菌腈抑制扩展青霉分生孢子萌发的EC50为0.08—0.11 μg·mL-1;这比本研究测定的咯菌腈对4种病菌孢子萌发的EC50小,这可能是由于供试病菌的不同造成。范子耀等[28]研究表明,咯菌腈对马铃薯早疫病菌的敏感性基线为0.04 μg·mL-1。本研究中咯菌腈对牡丹黑斑病菌的菌丝生长、孢子萌发、芽管伸长及产孢都有强烈的抑制作用,这同范子耀等的结果一致。咯菌腈对其他链格孢属真菌引起的病害,如烟草赤霉病、早疫病、多种作物黑斑病是否有效果,尚需进一步研究。
牡丹叶部病害较为复杂,7、8月份的牡丹园除了多发性的叶霉病、黑斑病外,腔孢叶斑病、黄斑病也时有发生,且往往是多种病害同时发生,牡丹叶片上可同时见到多种病害,使用一种药剂很难同时对当前多种牡丹病害均有防治效果,故有必要筛选同时对多种牡丹病原真菌有抑制活性的杀菌剂或复配组合[11]。三唑类药剂对牡丹病原真菌菌丝生长的抑制作用较强,而甲氧基丙烯酸酯类杀菌剂对病菌的孢子萌发有强烈的抑制作用[7-9,12]。而由本试验可以看出,咯菌腈对供试的4种病原真菌的孢子萌发及芽管伸长均有强烈的抑制活性。咯菌腈与苯醚甲环唑以5﹕1复配对马铃薯早疫病菌的增效比可达到2.02,田间防效可达85%以上,增产率40%以上[29]。这为生产中通过将三唑类杀菌剂与咯菌腈或甲氧基丙烯酸酯类药剂复配来达到同时防治多种牡丹病害提供了参考。
由于牡丹是园林植物,栽培管理较为精细,生产中对牡丹病害的防治应注重多种方法的综合应用。牡丹是耐荫植物,遮阳棚的搭建对保持牡丹长势及病虫害防治都有一定的促进作用。田间遮光30%条件下,牡丹叶片内总酚、类黄酮、谷胱甘肽的含量显著高于未遮光及其他遮光处理[30]。牡丹园调查时发现,遮阳棚或树荫下的牡丹,不但花期延长,且其7、8月份病害发生的严重度明显比在阳光下暴晒的小;12月份调查时,遮阳棚或树荫下的牡丹仍能看到绿色的叶片,但阳光下暴晒的牡丹叶片,则全部落叶;此外,秋季清除病枝落叶对牡丹病害的发生也有一定程度的缓解作用(未发表资料)。但在病害暴发流行时,化学防治是必要甚至是唯一可依赖的手段。本研究结果表明,咯菌腈对4种牡丹病原真菌的菌丝生长、孢子萌发及芽管伸长均有很强的抑制活性,可以单剂或复配剂应用于牡丹病害的综合防治中。
4 结论
咯菌腈对牡丹黑斑及腔孢叶斑病菌的菌丝生长、孢子萌发及芽管伸长均有很强的抑制作用,但对腔孢叶斑产孢却有一定的促进作用;对叶霉和黄斑病菌孢子萌发及芽管伸长、黄斑病菌菌丝生长及叶霉病菌产孢的抑制作用强烈;由于咯菌腈内吸活性较弱,无法抑制已侵入牡丹叶片的病原真菌的生长,故建议作为保护剂在病害发生前施用。The authors have declared that no competing interests exist.
