0 引言
【研究意义】柑橘溃疡病(citrus bacterial canker,CBC)由柑橘黄单胞杆菌柑橘亚种(Xanthomonas citri subsp. citri,Xcc)引起,该病传播快、发病高。目前,只能通过喷洒铜制剂农药或集中销毁果苗加以控制,但其造成的经济损失较大。因此,寻找潜在的抗病基因并进行分子育种显得尤为重要。转录因子(transcription factors,TF)是分子育种实践中被广泛利用的候选基因,它是能够与真核基因启动子区域中顺式作用元件发生特异性互作而影响下游基因表达的一类反式作用因子[1]。转录因子中,BZIP(basic leucine zipper)是一个进化上十分古老的亚类。在目前已经完成全基因组测序的植物中,BZIP类转录因子在总数上占较大比重。这个家族中的成员参与多种生物学过程,包括植物生长、花发育、种子成熟、衰老、光信号、损伤、病菌防御以及对各种环境胁迫的响应等[2]。若能获得有潜力的BZIP候选基因用于柑橘抗溃疡病分子育种,将会有很大的现实指导意义。【前人研究进展】JAKOBY等[3]对拟南芥基因组全序列进行分析,根据碱性结构域及其他保守的结构域,将拟南芥的73个BZIP类转录因子基因家族成员分为A、B、C、D、E、F、G、H、I和S类共10个亚家族。不同家族成员其行使的功能也不相同,A亚族主要参与ABA和逆境胁迫的调控表达;C亚族作用于种子发育和逆境胁迫;D亚族在抗氧化和病菌防御方面起重要作用;E亚族与I亚族亮氨酸拉链结构相似性很高,但功能研究较少;G亚族在光信号转导和种子成熟过程中发挥作用;H亚族在光合作用过程起关键作用;I亚族参与赤霉素代谢;S亚族参与逆境胁迫和糖类信号代谢,而B亚族和F亚族报导很少。除拟南芥外,其他植物BZIP转录因子的分类也大致如此[4]。不同的植物含有的BZIP类转录因子家族成员数量不同。现在拟南芥、大豆、水稻、玉米、葡萄、大麦、黄瓜、白菜中鉴定出的BZIP转录因子数分别为75[3]、100[5]、89[6]、125[7]、55[8]、89[9]、64[10]、136[11]。目前,有关BZIP蛋白的研究主要集中在模式植物的ABA信号通路及一些非生物胁迫方面,如ABI5和ABFs是ABA的响应元件,在拟南芥中通过参与转录水平的蛋白磷酸化和泛素化来稳定相关蛋白从而调节ABA的信号途径[12];从枳壳中分离的PtrABF转到烟草中可通过清除活性氧或者增强其对活性氧的耐性来调节逆境应答,抵御干旱胁迫[13]。此外,BZIP转录因子与其他信号通路间的关系也有报道,如ABF2是糖代谢途径的一个重要组成部分,该基因的过表达可以增强植物对多重胁迫的抗性[14],而DREB2C可以与ABF2互作,调节与ABA响应相关基因的表达[15]。【本研究切入点】目前也有BZIP转录因子在植物病害方面的研究,主要涉及D类BZIP成员,但在柑橘溃疡病方面还鲜有研究,因此,以柑橘为材料针对BZIP转录因子进行研究具有一定的价值。【拟解决的关键问题】探索CsBZIP40对溃疡病菌侵染、外源激素和物理创伤的响应模式,分析其抗病育种价值。1 材料与方法
1.1 材料与试剂
试验材料为纽荷尔脐橙及四季橘(Calamondin)叶片,分别取自于西南大学柑橘研究所温网室和资源育种室苗圃。试验开始于2016年1月,柑橘叶片材料采自9月期间,在中国农业科学院柑桔研究所改良课题实验室完成。溃疡病菌由国家柑橘苗木脱毒中心提供,是亚洲种A株系,其对野生锦橙发病率是91%,病斑面积是4.5 mm2,病斑总面积是90.4 mm2,病斑所含病原菌数量是2.99×106 cfu/mm2,病情指数73.3%。植物总RNA提取试剂盒购自Aidlab公司;实时荧光染料购自BIO-RAD公司;胶回收试剂盒及质粒提取试剂盒购自Omega公司;克隆载体pGEM-T easy、反转录试剂盒和大肠杆菌(E. coli)DH5α感受态细胞购买自TaKaRa公司;GFP融合载体由本实验室构建和保存;根癌农杆菌EHA105感受态细胞由笔者实验室制备和保存。
1.2 数据挖掘、注释与信息学分析
柑橘(甜橙,C. sinensis)的基因组和蛋白组数据下载于公共数据库Phytozome(https://phytozome.jgi. doe.gov)和华中农业大学甜橙基因组数据库CAP[16](http://citrus.hzau.edu. cn/cgi-bin/orange/)。采用三步法综合注释流程对BZIP家族进行了专业注释[17],首先以拟南芥的BZIP家族73条完整序列与上述来源的蛋白质组数据进行比对初步获得甜橙中的BZIP蛋白序列;然后去掉其中的错误注释和重复序列,并且从NCBI数据库中检测EST数据支持并对上述错误的注释进行校正,最终得到的BZIP蛋白序列进行SCIPIO[18]分析,获得相应的染色体定位数据、基因结构数据、DNA和CDS序列以及上述两数据库中未注释的BZIP成员,自此,便完成了数据挖掘和注释。将得到的BZIP成员按照染色体定位进行命名,如CsBZIP01:Cs为Citrus sinensis 缩写,BZIP是基因家族的缩写,01是根据在染色体上的位置给这个成员的序号。最大似然(maximum-likelihood)系统发育树采用PhyML-aLRT 3.0[19] 进行分析并用MEGA 6.0[20]进行进化树展示。构建进化树使用了甜橙全部的全长BZIP蛋白序列,序列对比和编辑采用MAFFT和Bioedit V7.2[21]。基因的染色体定位和基因复制关系(全基因组复制、片段复制、随机复制)的图形展示使用Mapchart软件[22]。
经过注释,笔者从转录组中获得的一个与溃疡病相关基因被命名为CsBZIP40,根据CsBZIP40基因序列设计引物F:5′-ATGGCGAGTCACAGAATTGGA-3′、R:5′-TCAAAAGTTCGAGAAATGATT-3′,以纽荷尔脐橙叶片cDNA为模板进行PCR扩增,反应条件:94℃预变性5 min;94℃ 15 s,57℃ 30 s,72℃ 2 min,35个循环;72℃延伸3 min;4℃保存。回收PCR产物,连接pGEM-T easy载体,重组质粒转化E. coli DH5α感受态细胞,蓝白斑筛选,挑取阳性克隆,PCR验证后送上海英骏公司测序。用ProtParam程序(http://web. expasy.org/protparam/)对氨基酸序列的分子量、理论等电点(pI)、氨基酸含量、不稳定指数、亲水性进行预测;利用在线软件CELLO[23](http://cello.life.nctu. edu.tw/)进行亚细胞定位预测;用cNLS Mapper[24-25](http://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)进行核定位信号预测;利用MEME[26]在线软件(http://meme-suite.org/)分析CsBZIP的结构域。
根据基因组数据库中基因CsBZIP40序列设计特异引物F:5′-AAATTAAACAAATGTAAAGAAGA T-3′、R:5′-AGCTCCAATTCTGTGACTCGCCAT-3′,以基因组DNA为模板,扩增得到CsBZIP40 基因启动子并测序,利用网站PlantCARE[27] 数据(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析预测启动子序列的顺式作用元件。
1.3 亚细胞定位
根据CsBZIP40 核苷酸序列设计去除了终止子并且两端都含有BamHⅠ酶切位点和保护碱基的引物F:5′-CGCGGATCCATGGCGAGTCACAGAATTGG-3′、R:5′-CGCGGATCCAAAGTTCGAGAAATGATTTT-3′,以测序正确的DNA为模板(连有pGEM-T easy载体),进行PCR扩增,其产物回收后连接在FJ905222(Binary vector pCX-DG)双元载体上,构建出rsGFP:: CsBZIP40重组载体转化大肠杆菌,筛选阳性克隆提取质粒,进行PCR及酶切验证,将验证正确的质粒转化农杆菌,再进行上述阳性克隆子检测,验证农杆菌中是否含有上述质粒。将含重组质粒pCX-DG-rsGFP:: CsBZIP40-35S-CaMV-nos和作为对照的空载体pCX-DG-rsGFP-35S-CaMV-nos农杆菌菌液配成OD600=0.1的菌悬液,参照XU等[28]的方法将菌悬液注射在洋葱表皮细胞下两三层叶肉组织中,平均每1 cm2的表皮注射200 µL,28℃暗箱培养48 h,然后撕取表皮制成装片,荧光显微镜明、暗视野下观察表达情况,并拍照记录。1.4 溃疡病菌侵染对CsBZIP40的诱导表达
将采集的纽荷尔脐橙和四季橘叶片用75%无水乙醇的棉花擦净后自来水冲净,再用无菌水清洗两次后摆放到灭菌的培养皿中。将OD600=0.5的溃疡病菌液稀释1 000倍,用针刺法分别接种到荷尔脐橙和四季橘叶片上。28℃光照培养0、1、3、5 d后,切取病斑备用,以未接种溃疡病菌的叶片作对照。从切下含病斑的叶片中提取总RNA并反转录成cDNA,利用实时荧光定量PCR(qRT-PCR)分析各样品中CsBZIP40的表达量。1.5 外源激素及机械损伤对CsBZIP40的诱导表达
将纽荷尔脐橙和四季橘叶片清洗干净,用打孔器将叶片打成直径为7 mm的叶圆片,然后将叶圆片分别浸泡在浓度为100 μmol·L-1茉莉酸甲酯(MeJA)、10 μmol·L-1水杨酸(SA)、10 μmol·L-1乙烯利(ET)溶液中。分别在0、6、12、24 h取样,提取总RNA并反转录为cDNA,qRT-PCR检测各诱导环境下不同时段CsBZIP40的表达量。以75%无水乙醇处理的叶圆片为茉莉酸甲酯的对照组,以水处理的叶圆片为水杨酸和乙烯利处理的对照组。将纽荷尔脐橙和四季橘叶片清洗干净后用手术刀在叶片两侧各划一刀,以未处理的叶片作对照,然后分别在0、6、12、24 h打孔取样(叶圆片中间有划痕),提取RNA后反转录为cDNA,qRT-PCR检测CsBZIP40的表达量。1.6 实时荧光定量PCR与统计分析
利用NCBI在线软件设计CsBZIP40基因定量引物F:5′-AGTTCCCTTTGGGCATCTCG-3′、R:5′-ACCATTTGCAGATCCGTCGT-3′,内参为甜橙Actin,引物序列为F:5′-CATCCCTCAGCACCTTC C-3′、R:5′-CCAACCTTAGCACTTCTCC-3′。在ABI 7500荧光定量PCR仪上检测该基因表达量。采用12 µL的PCR反应体系:6 µL 2X荧光染料、4.4 µL H2O、0.3 µL 10 mol·L-1引物、1 µL cDNA。反应程序:95℃ 10 min,95℃ 15 s,60℃ 1 min,40个循环。每个处理进行3次生物学重复和3次平行样重复。相对表达量采用2-ΔΔCt法计算(ΔCt=CtCsBZIP40-CtActin),使用Excel软件进行数据统计分析,使用Origin软件进行绘图,使用SPSS 20进行差异显著性分析,P<0.05表示差异显著。2 结果
2.1 BZIP基因家族注释
经过注释总计从参考基因组挖掘到了47个BZIP(附表1)。跟其他物种相比,柑橘的BZIP数量较少,这些BZIP基因位于9号染色体之外的所有染色体上,其中3号染色体上有13个BZIP,占所有BZIP的27%,其基因密度最大为4.5×10-7个/Mb,2号染色体上的BZIP基因密度是3.2×10-8个/Mb,其基因密度最小,仅占所有BZIP的2%(图1)。该家族中有15对基因发生了全基因组重复,CsBZIP42与CsBZIP43属于随机重复,在所有染色体上均没有节段重复事件发生,CsBZIP40没有发生染色体复制。基因组复制事件比其他物种少,这也是柑橘BZIP家族相对较小的原因。为得到较原始的BZIP进化数据,对这47个蛋白质序列与73个拟南芥BZIP蛋白数据进行进化分析,系统进化树将柑橘BZIP分为了10个亚家族,其中A亚家族10个,B亚家族1个,C亚家族5个,D亚家族7个,E亚家族3个,F亚家族1个,G亚家族4个,H亚家族3个,I亚家族5个,S亚家族8个(图2)。本试验中的CsBZIP40在柑橘中没有与之相近的同源基因,特异性较好,但与拟南芥中AT1G08320基因的同源,它们均属于在病菌防御方面发挥作用的D亚家族。Table S1
附表1
附表1甜橙的BZIP基因家族
Table S1The BZIP gene family in Citrus sinensis
| 名称 Name | CAP 序号 CAP ID | PHYTOZOME序号 PHYTOZOME ID | 氨基酸数目 Number of amino acid | 分子量 MW (Da) | 等电点 PI |
|---|---|---|---|---|---|
| CsBZIP01 | Cs1g02310 | orange1.1g018238m | 359 | 40694.61 | 7.58 |
| CsBZIP02 | Cs1g16230 | orange1.1g045786m | 453 | 50145.96 | 8.25 |
| CsBZIP03 | Cs1g21370 | orange1.1g029952m | 185 | 21565.79 | 10.53 |
| CsBZIP04 | Cs1g23780 | orange1.1g018605m | 353 | 37267.85 | 4.94 |
| CsBZIP05 | Cs1g25890 | orange1.1g041471m | 226 | 24569.46 | 11.45 |
| CsBZIP06 | Cs2g28995 | orange1.1g025739m | 249 | 27909.33 | 10.05 |
| CsBZIP07 | Cs3g06150 | orange1.1g017286m | 374 | 41773.1 | 7.56 |
| CsBZIP08 | Cs3g06870 | orange1.1g021146m | 317 | 35582.74 | 9.48 |
| CsBZIP09 | Cs3g08880 | orange1.1g036551m | 453 | 49075.38 | 10 |
| CsBZIP10 | Cs3g10860 | orange1.1g012287m | 466 | 50479.33 | 9.79 |
| CsBZIP11 | Cs3g16310 | orange1.1g039918m | 140 | 16314.25 | 5.36 |
| CsBZIP12 | Cs3g18860 | orange1.1g045277m | 335 | 37531.42 | 9.39 |
| CsBZIP13 | Cs3g18870 | orange1.1g036441m | 361 | 41242.84 | 6.87 |
| CsBZIP14 | Cs3g21220 | orange1.1g019163m | 345 | 38054.07 | 9.75 |
| CsBZIP15 | Cs3g21410 | orange1.1g025985m | 245 | 27174.87 | 4.91 |
| CsBZIP16 | Cs3g23480 | orange1.1g021624m | 310 | 33685.85 | 10.81 |
| CsBZIP17 | Cs3g25230 | orange1.1g041765m | 163 | 18766.02 | 6.51 |
| CsBZIP18 | Cs3g25760 | orange1.1g014471m | 424 | 46769.73 | 6.79 |
| CsBZIP19 | Cs3g27850 | orange1.1g022379m | 298 | 33464.56 | 4.44 |
| CsBZIP20 | Cs4g16750 | orange1.1g045005m | 149 | 17325.34 | 9.97 |
| CsBZIP21 | Cs5g11160 | orange1.1g015258m | 410 | 45514.84 | 8.45 |
| CsBZIP22 | Cs5g23040 | orange1.1g014327m | 426 | 46456.7 | 6.57 |
| CsBZIP23 | Cs5g30460 | orange1.1g013166m | 448 | 48302.27 | 6.2 |
| CsBZIP24 | Cs6g08980 | orange1.1g048456m | 211 | 23516.82 | 7.6 |
| CsBZIP25 | Cs6g14960 | orange1.1g043882m | 456 | 49574.58 | 9.04 |
| CsBZIP26 | Cs6g15200 | orange1.1g011345m | 488 | 53375.78 | 7.78 |
| CsBZIP27 | Cs6g16070 | orange1.1g020697m | 322 | 36003.97 | 6.9 |
| CsBZIP28 | Cs6g16800 | orange1.1g035544m | 727 | 78198.97 | 7.1 |
| CsBZIP29 | Cs6g19350 | orange1.1g042014m | 169 | 19480.68 | 6.15 |
| CsBZIP30 | Cs7g05140 | orange1.1g030957m | 168 | 18478.42 | 10.28 |
| CsBZIP31 | Cs7g07550 | orange1.1g015739m | 401 | 43551.26 | 6.77 |
| CsBZIP32 | Cs7g12290 | orange1.1g043159m | 201 | 22988.58 | 6.73 |
| CsBZIP33 | Cs7g13010 | orange1.1g018357m | 357 | 39491.03 | 7.79 |
| CsBZIP34 | Cs7g19070 | orange1.1g038233m | 332 | 36639.54 | 7.57 |
| CsBZIP35 | Cs7g25940 | orange1.1g041582m | 153 | 17288.13 | 10.94 |
| CsBZIP36 | Cs7g29820 | orange1.1g020026m | 332 | 37008.19 | 5.43 |
| CsBZIP37 | Cs8g06020 | orange1.1g013197m | 448 | 48529.33 | 10.18 |
| CsBZIP38 | Cs8g06860 | orange1.1g026806m | 233 | 26184.15 | 7.57 |
| CsBZIP39 | Cs8g07470 | orange1.1g044691m | 172 | 19237.29 | 6.24 |
| CsBZIP40 | Cs8g15030 | orange1.1g036039m | 508 | 56488.33 | 7.52 |
| CsBZIP41 | Cs8g15050 | orange1.1g037676m | 267 | 29628.91 | 7.87 |
| CsBZIP42 | Cs8g20530 | orange1.1g035677m | 168 | 19399.05 | 9.99 |
| CsBZIP43 | Cs8g20540 | orange1.1g038341m | 351 | 39448 | 6.05 |
| CsBZIP44 | orange1.1t00453 | orange1.1g014660m | 421 | 44628.42 | 9.11 |
| CsBZIP45 | orange1.1t01674 | orange1.1g032187m | 145 | 16628.35 | 8.49 |
| CsBZIP46 | orange1.1t03130 | orange1.1g007579m | 597 | 64817.56 | 6.98 |
| CsBZIP47 | orange1.1t04546 | orange1.1g037696m | 363 | 40884.68 | 7.01 |
新窗口打开
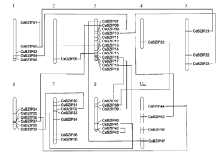 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1CsBZIPs在染色体上定位和复制
相互连接的两个基因表示一个基因复制事件
-->Fig. 1The location and duplication of CsBZIPs on chromosomes
The links between genes represented gene duplication events
-->
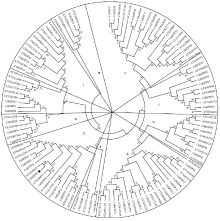 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2柑橘中的BZIPs与拟南芥中的BZIPs系统进化分析
-->Fig. 2The phylogenetic tree of BZIP transcription factors between Citrus and Arabidopsis
-->
CsBZIP转录因子家族的结构域分析结果显示motif 1的序列为QKTLAQNREAARKSRLRKKAYVQ QLE,motif 5的序列为KLTQLEQELQRARQQ,二者共同组成CsBZIP转录因子的核心元件,其他结构域的位置和数量所存在的差异造成CsBZIP间的功能差异(附图1)。根据柑橘BZIP家族的结构域差异进行分类,其结果与系统进化树分类结果相符。
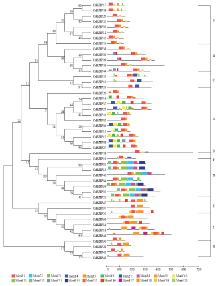 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT附图1甜橙中BZIPs的结构域分析
-->Fig. S1The motifs of BZIPs in Citrus sinensis
-->
2.2 CsBZIP40及其启动子的克隆与生物信息学分析
测序结果及序列分析得到CsBZIP40 cDNA全长为5 756 bp,开放阅读框长度为1 530 bp,编码509个氨基酸。CsBZIP40蛋白分子量为125 601.06,等电点是4.98,主要编码丙氨酸、半胱氨酸、谷氨酸、苏氨酸,含量分别为30.5%、22.5%、23.5%、23.6%,不稳定指数为42.66,脂肪酸系数为30.46,亲水指数为0.851,该蛋白整体表现为亲水的不稳定蛋白。克隆测序了CsBZIP40 的核心启动子序列,DNA片段有1.5 kb。该启动子含有参与逆境和植物激素应答相关的顺式作用元件Box-W1、HSE、ERE等(表1)。
Table 1
表1
表1PLACE预测CsBZIP40启动子区顺式作用元件
Table 1Cis-acting regulatory elements in promoter of CsBZIP40 predicted by PLACE
| 顺式元件 Cis-element | 序列 Sequence | 方向 Strand | 起始位 Start position (bp) | 特性 Characteristic |
|---|---|---|---|---|
| AuxRR-core | GGTCCAT | + | 29 | 生长素响应Auxin responsiveness |
| ERE | ATTTCAAA | + | 1359 | 乙烯响应Ethylene-responsive element |
| GARE-motif | AAACAGA | - | 967 | 赤霉素响应Gibberellin-responsive element |
| AAACAGA | + | 1273 | ||
| HSE | AAAAAATTTC | + | 310 | 热应激反应Heat stress responsiveness |
| Box-W1 | TTGACC | + | 378 | 真菌响应Fungal elicitor responsive element |
| AAAAAATTTC | - | 994 | ||
| MRE | AACCTAA | + | 525 | 光响应MYB binding site involved in light responsiveness |
| AACCTAA | - | 1246 | ||
| Skn-1_motif | GTCAT | - | 34 | 胚乳发育Endosperm expression |
| GTCAT | - | 361 | ||
| TC-rich repeats | ATTTTCTTCA | - | 303 | 胁迫响应Defense and stress responsiveness |
| GTTTTCTTAC | - | 862 | ||
| ATTTTCTTCA | + | 784 |
新窗口打开
2.3 CsBZIP40核定位信号预测及亚细胞定位
亚细胞定位结果显示CsBZIP40定位于细胞核的预测分值显著高于其他位置,预测CsBZIP40在细胞核优势表达。cNLS Mapper结果显示,CsBZIP40的氨基酸序列中特定位点核定位分值较高,预测这些氨基酸序列为核定位信号(表2)。瞬时表达结果表明,空载体在整个细胞中均有表达,而融合蛋白在细胞核中定位,说明CsBZIP40是在细胞核中表达并发挥功能的转录因子,与亚细胞定位的预测结果一致(图3)。Table 2
表2
表2CsBZIP40亚细胞定位及核定位信号预测
Table 2CELLO and NLS prediction of CsBZIP40
| 基因名称 Gene name | 亚细胞定位预测值 Subcellular localization prediction | 预测核定位信号 Nuclear localization signal prediction | |||
|---|---|---|---|---|---|
| 核定位预测值 Nuclear localization prediction | 非核定位预测值 Non-nuclear localization prediction value | 氨基酸序列 Amino acid sequence | 氨基酸位置 Amino acid position | 核定位预测值 NLS scores | |
| CsBZIP40 | 4.317 | ≤0.602 | QEKRKGPGSTSDRQLDAKTLRRLAQNREA | 189 | 4.2 |
| RKSRLRKKAYVQQLETSRIKLNQLEQELQRAR | 219 | 4.9 | |||
新窗口打开
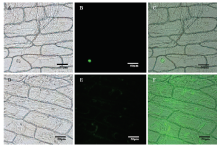 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3CsBZIP40和GFP在洋葱表皮细胞中的瞬时表达
A:CsBZIP40-GFP明视野 Image of CsBZIP40-GFP under bright field;B:CsBZIP40-GFP暗视野 Image of CsBZIP40-GFP under dark field;C:CsBZIP40-GFP明视野和暗视野图像重叠 Overlap of CsBZIP40-GFP under bright and dark field;D:GFP明视野 Image of GFP under bright field;E:GFP暗视野 Image of GFP under dark field;F:GFP明视野和暗视野图像重叠 Overlap of GFP under bright and dark field
-->Fig. 3The transient expression of CsBZIP40 and GFP in onion cells
-->
2.4 抗/感品种中CsBZIP40表达差异性
定量分析得知CsBZIP40在叶片接种溃疡病菌0、1、3、5 d不同时期的表达水平存在差异,在柑橘高感病品种纽荷尔脐橙接种溃疡病菌后CsBZIP40的表达变化上升幅度微小,随时间的变化幅度不明显,而在高抗病品种四季橘中的上调情况要明显高于纽荷尔脐橙,特别是在接种溃疡病菌3 d后CsBZIP40的表达有一个显著的上升,证明该基因是高感病品种纽荷尔脐橙和高抗病品种四季橘感染溃疡病菌后的一个差异表达基因,与笔者实验室转录组测序结果分析一致(图4)。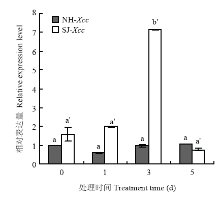 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4溃疡病菌对CsBZIP40的诱导表达
NH:纽荷尔脐橙Citrus junos; SJ:四季橘Calamondin。下同 The same as below
-->Fig. 4The expression of CsBZIP40 induced by Xcc
-->
2.5 外源激素及机械损伤对CsBZIP40的诱导表达分析
SA处理后,纽荷尔脐橙和四季橘叶片中的CsBZIP40表达没有显著性差异,可能由于此基因的启动子上没有与之相关的顺式作用元件(图5-A)。MeJA 处理后,纽荷尔叶片的CsBZIP40表达量明显上调,在12 h时表达量达到最高,但四季橘叶片中CsBZIP40的表达没有显著变化。此基因启动子没有茉莉酸响应的顺式作用元件,但是纽荷尔中CsBZIP40对茉莉酸甲酯有响应,可能与胁迫响应元件有关(图5-B)。经ET诱导后,纽荷尔和四季橘叶片的CsBZIP40表达量上调,两个品种中CsBZIP40表达量整体呈先升后降的趋势,在不同时间段的表达有显著差异,其中,四季橘在处理6 h后CsBZIP40表达下降,而纽荷尔在6 h 后CsBZIP40的表达趋势与四季橘相反,有明显的上调。两个品种对乙烯均有响应,这与启动子中乙烯顺式作用元件相关(图5-C)。在机械损伤后,纽荷尔中的CsBZIP40表达量要高于四季橘,整体来看四季橘受机械损伤后CsBZIP40表达量没有明显变化,而纽荷尔在损伤初期CsBZIP40表达量有明显上升后趋于稳定(图5-D)。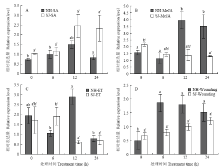 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同处理对CsBZIP40的诱导表达
A:水杨酸SA;B:茉莉酸甲酯MeJA;C:乙烯利ET;D:机械损伤Wounding
-->Fig. 5The expression of CsBZIP40 induced by different treatments
-->
3 讨论
植物在应对外界非生物胁迫过程中,不同基因启动子的顺式作用元件可与不同转录因子结合,然后激活或抑制相关抗逆基因的表达以使植物对胁迫作出针对性的调节反应。对CsBZIP40进行启动子分析,发现其启动子区存在生长素响应元件AuxRR-core、乙烯响应元件ERE、赤霉素响应元件GARE-motif、胁迫响应元件TC-rich repeats及参与热激响应元件HSE等,这些元件的存在表明该转录因子可能参与转录调控,与激素的代谢途径相关,进而影响生物或非生物逆境的响应。因此推测CsBZIP40可能参与植物的逆境响应。此外,该基因顺式作用元件中还含有与胚乳发育相关的Skn-1-motif及响应真菌诱导的作用元件Box-W1,推测其在植物生长发育和真菌入侵防御过程中也发挥相应作用。每个转录因子家族成员的多少与染色体间的节段重复,随机重复发生的频率有直接联系,例如,拟南芥、水稻和高粱的基因组中BZIP片段重复的概率为53%—59%[10],黄瓜为37%[10],玉米为46%[7],而柑橘基因组中没有片段重复的BZIP;从随机复制角度来看,黄瓜中BZIP随机复制的概率为12%,拟南芥为73%,水稻为56%[10],而柑橘中仅有2%。从总体来看,柑橘中的BZIP基因家族发生基因随机重复和片段重复的概率都比其他几个物种要低很多,因此柑橘中的该基因家族成员较少。同时每条染色体上的基因密度小也是造成该基因家族成员较少的原因。
CsBZIP40是笔者实验室转录组测序中得到的一个明显响应溃疡病菌侵染的基因,克隆纽荷尔中的转录因子CsBZIP40后,经氨基酸序列分析发现其具有D类BZIP亚家族的结构域,进化分析显示该基因与拟南芥中在病菌防御方面发挥作用的D亚家族AT1G08320同源,有研究证明拟南芥中的BZIP蛋白可以对昆虫危害和细菌感染作出应答[29],推测该基因可能也参与柑橘中的其他病害防御反应。
不同的激素种类或不同的环境刺激会诱导不同的抗性基因的表达,如CAM家族的CAM7与BZIP家族的HY5转录因子互作可以参与ABA应答[30];白菜中的BrABI5a和BrABI5b是ABA信号通路的正向调控因子[11];大麦HvRAF受水杨酸、乙烯、茉莉酸甲酯、高盐和病害的胁迫诱导[31],而本研究发现外源水杨酸并不会使四季橘和纽荷尔脐橙中CsBZIP40的表达水平显著上调,纽荷尔在茉莉酸甲酯诱导后有明显的差异表达,但乙烯利可以使CsBZIP40在四季橘和纽荷尔脐橙中均有较明显的差异表达,而且该基因也响应柑橘溃疡病菌。由此表明 CsBZIP40并不参与水杨酸的抗病信号途径,而参与乙烯和茉莉酸的信号响应。此外,在四季橘中乙烯的信号响应模式与溃疡病菌的响应有上升趋势,推测二者之间存在联系,关于CsBZIP40与乙烯信号途径及乙烯信号途径与溃疡病抗性间的联系有待进一步研究。
植物通过抗病信号途径上调下游相关防卫基因表达,抵制病原菌侵染,从而产生抗病性。同一植物对不同类型病原微生物的抗病反应涉及的抗病信号途径不同。本试验表明抗性品种四季橘在感染溃疡病后CsBZIP40表达量会上升,整体而言,CsBZIP40在纽荷尔中的表达量要低于四季橘,说明CsBZIP40是一个正向调节因子,在四季橘中,较高表达量的CsBZIP40可以调控下游基因的表达,从而引起抗性。纽荷尔中同样有这个基因,但是它并没有在溃疡病菌侵染时提升表达量,可能因为在纽荷尔中缺少识别溃疡病菌侵染的因子或者缺少信号转导途径将侵染信号传递给转录因子CsBZIP40,导致没有更多的CsBZIP40表达,从而无法更好地调节下游抗性基因的表达进而产生抗性。所以在四季橘和纽荷尔中,CsBZIP40表达量决定了是否抗溃疡病。实践中,可以采用在纽荷尔中过表达的方式来提升CsBZIP40对下游抗性基因的调控来进行分子育种,该基因对柑橘感染溃疡病后的抗性评价值得进一步研究。
4 结论
CsBZIP40与拟南芥的AT1G08320同源,该基因在柑橘中没有同源基因,属于与病原菌抗性相关的D类BZIP转录因子,序列和结构特异性较好;CsBZIP40是一个在细胞核中表达并响应溃疡病病菌的转录因子,经外源乙烯利诱导后有一个较明显的上调表达;在柑橘的抗溃疡病病菌分子育种中,CsBZIP40可作为一个很有潜力的候选基因来进行后期的功能性验证。The authors have declared that no competing interests exist.
