0 引言
【研究意义】盐胁迫是影响农作物生长发育的主要非生物胁迫之一,影响种子萌发和幼苗生长[1],能破坏植物体内生物膜的正常结构和功能,降低酶活性,影响植物代谢过程[2]。黄瓜(Cucumis sativas L.)是设施栽培的主要蔬菜作物之一,深受消费者喜爱,但黄瓜对盐胁迫抗性较弱,尤其是发芽期和幼苗期对盐胁迫更为敏感[3],因此对其盐害的研究显得尤其重要。【前人研究进展】一氧化氮(NO)是广泛存在于植物组织中的信号分子,能够调节植物的生长发育,并参与植物体对各种逆境胁迫的响应[4]。植物内源NO主要通过NO合酶(NOS)、硝酸还原酶(NR)催化及其他酶促反应和非酶促反应生成[5-7]。已有研究表明,NO在植物生长发育及逆境胁迫等生理过程中起信号传导作用[8-10],其包括干旱、盐害、高温、低温等多种非生物逆境的响应过程[11-12];NO在植物中的某些功能与活性氧代谢水平密切相关[13]。FAN等[14]研究表明,外源NO能提高樟树抵抗干旱胁迫的能力;这可能与NO的抗氧化性质有关[15];樊怀福等[16]提出外源NO能显著提高黄瓜幼苗叶片的净光合速率和叶绿素含量,显著降低低温对膜造成的伤害;吴旭红等[17]报道指出,外源NO处理能降低低温胁迫下南瓜幼苗的脂过氧化产物丙二醛的积累,促进脯氨酸和可溶性糖积累,增强抗氧化酶的活性,提高南瓜幼苗的抗寒性;NO还能减缓盐胁迫对玉竹的氧化损伤[18],降低盐胁迫对水稻叶绿素的降解和保持叶片光系统Ⅱ(PSⅡ)较高的量子产额[19]。【本研究切入点】大量研究表明NO参与调节植物的生长发育过程,响应各种非生物逆境。然而,有关内源NO在植物盐胁迫下对活性氧代谢和光合生理特征的影响及调控途径的研究却鲜有报道。【拟解决的关键问题】本研究针对黄瓜生产中出现的盐害问题,研究内源NO对盐害逆境下黄瓜幼苗活性氧代谢及光合生理特征的影响,旨在探讨黄瓜内源NO的生理生化调节机理及其调控途径,丰富对黄瓜抗盐机理的理论认识,同时为生产应用提供参考。1 材料与方法
试验于2016年11月—2017年1月在甘肃农业大学园艺学院玻璃温室内进行。1.1 试验材料与处理
选用黄瓜品种‘新春4号’为试材。种子经消毒后在28℃恒温箱催芽,将发芽一致的种子播种于盛有育苗基质的营养钵中(口径10 cm×高10 cm),温室温度控制在昼温25—30℃,夜温15—18℃,进行自然光照。待黄瓜幼苗四叶一心时,选取长势一致的黄瓜幼苗600株进行处理,每个处理独立重复3次。试验中所用药剂L-NAME(L-硝基精氨酸甲酯)和 cPTIO(4-羧基苯-4,4,5,5-四甲基咪唑-1-氧-3-氧化物)购于Sigma,USA;tungstate(钨酸钠)购于上海中泰化工公司。
试验设5个处理,如表1所示。
CK浇蒸馏水9 d(第1—9天),试验组先浇NaCl溶液6 d(第1—6天)模拟盐胁迫,后改浇蒸馏水3 d(第7—9天)解除盐胁迫。以上浇蒸馏水或NaCl溶液的量为100 mL,每24 h浇一次;叶面喷施溶液(蒸馏水,L-NAME,tungstate,cPTIO)的量以所有叶片正反面全湿并有溶液下滴为标准,每48 h喷一次;以上溶液浓度由预试验筛选得出。
Table 1
表1
表1试验处理
Table 1Test treatment
| 处理 Treatment | 方法 Method |
|---|---|
| 对照 CK | 浇蒸馏水+叶面喷施蒸馏水 Distilled water +leaf sprayed with distilled water |
| 氧化钠NaCl | 浇100 mmol∙L-1 NaCl溶液+喷蒸馏水 100 mmol∙L-1 NaCl solution+ distilled water |
| NaCl+L-NAME | 浇100 mmol∙L-1 NaCl溶液+喷200 μmol∙L-1 L-NAME溶液 100 mmol∙L-1 NaCl solution+200 μmol∙L-1 L-NAME solution |
| NaCl+tungstate | 浇100 mmol∙L-1 NaCl溶液+喷100 μmol∙L-1 tungstate溶液 100 mmol∙L-1 NaCl solution+100 μmol∙L-1 tungstate solution |
| NaCl+ cPTIO | 浇100 mmol∙L-1 NaCl溶液+喷200 μmol∙L-1cPTIO溶液 100 mmol∙L-1 NaCl solution+200 μmol∙L-1cPTIO solution |
新窗口打开
1.2 试验方法
试验过程中,分别于处理的第0、3、6和9天上午10:00从每组处理随机选取6株黄瓜幼苗,取第3片真叶进行光合作用相关指标的测定,与此同时,用电子天平称取第3片真叶,然后用锡箔纸包住,放于液氮中,贮存在-80℃的超低温冰箱中备用,用于以下指标的测定,每个指标重复测3次。1.2.1 NO含量的测定 采用Greiss试剂法测定NO含量,具体操作参照ZHOU等[20]的方法。
1.2.2 抗氧化酶活性的测定 采用氮蓝四唑光化还原法[21]测定超氧化物歧化酶(SOD)活性;愈创木酚法[22]测定过氧化物酶(POD)活性;参考HAVIR等[23]的方法测定过氧化氢酶(CAT)活性。
1.2.3 MDA、相对电导率和O2·-的测定 采用硫代巴比妥酸比色法测定MDA含量[24],浸泡法测定相对电导率[25];O2·-含量参照王爱国和罗广华[26]方法测定。
1.2.4 游离脯氨酸(Pro)和可溶性蛋白含量的测定 酸性茚三酮显色法测定Pro[24],考马斯亮蓝G-250染色法测定可溶性蛋白质含量[24]。
1.2.5 气体交换参数的测定 由CIRAS-2型(PP- system,英国)便携式光合仪测定气体交换参数,其参数设定为:环境温度25℃、PFD 800 μmol·m-2·s-1、CO2浓度为大气中的CO2(外接CO2缓冲瓶)、相对湿度75%。
1.2.6 叶绿素荧光参数的测定 叶绿素荧光参数由调制叶绿荧光成像仪IMAGING-PAM(德国WALZ公司)测定,将黄瓜幼苗暗适应30 min后,剪下其第3片真叶开始测叶绿素荧光动力学曲线,获得初始荧光(F0)、最大荧光(Fm)、PSⅡ最大光化学量子产量(Fv/Fm)、光化学淬灭系数(qP)和非光化学淬灭系数(NPQ)等叶绿素荧光参数。测定之前设检测光强度0.1 μmol·m-2·s-1,光化光强度81 μmol·m-2·s-1,饱和脉冲光强度2 700 μmol·m-2·s-1,脉冲光0.8 s,每隔20 s打1次。
1.3 数据处理
采用Excel 2010软件处理数据和绘图,SPSS 19.0软件进行统计分析,用Duncan’s新复极差法进行差异显著性检验(P<0.05)。2 结果
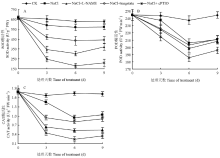
2.1 NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片NO含量的影响
由图1可以看出,经NO清除剂和合成抑制剂处理3 d、6 d和9 d后,黄瓜幼苗叶片NO含量较CK相比显著降低。单一盐胁迫处理的叶片在3 d、6 d时NO含量显著高于CK,且6 d时最为显著,比CK高18.5%。6 d时单一盐胁迫处理的比L-NAME、tungstate、cPTIO处理的分别高30%、27.2%和32%。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片NO含量的影响
不同字母表示差异达5%显著水平。下同
-->Fig. 1Effects of NO scavenger and synthetic inhibitor on NO content in cucumber seedling leaves under salt stress
Different letters above the bars indicate significant at 5% level. The same as below
-->
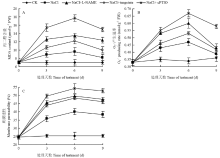
2.2 NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片抗氧化酶活性的影响
总体来看,0—9 d内CK黄瓜幼苗叶片SOD酶活性明显比其他处理高,且6 d时最为显著,比单一盐胁迫、L-NAME、tungstate、cPTIO处理的分别高10.9%、107.3%、45.3%、246.9%。6 d时单一盐胁迫处理的比L-NAME、tungstate、cPTIO处理的分别显著高87%、31%和213%(图2-A)。图2-B表明,0—9 d内CK黄瓜幼苗叶片POD酶活性明显比其他处理高,且6 d时最为显著,比单一盐胁迫、L-NAME、tungstate、cPTIO处理的分别高15.4%、19.8%、16.9%、27.9%;6 d时单一盐胁迫处理的比L-NAME、tungstate、cPTIO处理的分别高3.8%、1.4%和10.9%。
如图2-C所示,0—9 d内CK黄瓜幼苗叶片CAT酶活性明显比单一盐胁迫、L-NAME、tungstate、cPTIO处理的高,且6 d时最为显著;6 d时单一盐胁迫处理的比L-NAME、tungstate、cPTIO处理的分别高79%、15.9%和280%,而到9 d时CAT酶活性有所回升,可能与取消盐胁迫有关。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片SOD、POD、CAT酶活性的影响
-->Fig. 2Effect of NO scavenger and synthetic inhibitor on SOD, POD, CAT activity in leaves of cucumber seedlings under salt stress
-->
2.3 NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片MDA、O2·-、质膜透性的影响
由图3-A可知,CK的黄瓜幼苗叶片中MDA含量最低,经单一盐胁迫处理的叶片中MDA含量显著高于CK,且在处理6 d时最为显著,比CK高36.5%,而经L-NAME、tungstate、cPTIO处理的叶片在6 d时MDA含量均比单一盐胁迫高21.6%以上,且差异达显著水平。L-NAME、tungstate、cPTIO处理的黄瓜幼苗叶片MDA含量在0—6 d均呈上升趋势,而6—9 d呈下降趋势,这可能是6—9 d取消了盐胁迫引起的。在0—9 d L-NAME、tungstate、cPTIO处理的叶片中MDA含量从高到低依次为cPTIO>L-NAME>tungstate,表明NO清除剂和合成抑制剂处理导致盐胁迫下的黄瓜幼苗叶片MDA含量增加,加剧了盐胁迫对叶片的伤害。各处理下黄瓜幼苗叶片O2·-产生速率均比CK高,且在6 d时最为显著,比CK高38.2%以上,而在6 d时盐胁迫下经L-NAME、tungstate、cPTIO处理的幼苗叶片O2·-产生速率均显著高于单一盐胁迫处理的,分别达27.7%、12.8%、42.6%(图3-B),结果表明盐胁迫能引起黄瓜幼苗叶片内O2·-过量积累,且NO合成抑制剂和清除剂消除了叶片内源NO,使叶片内O2·-的累积更多,从而导致膜脂过氧化的程度加深,由此证明叶片内源NO可能对O2·-的积累产生了一定影响。
在盐胁迫条件下,黄瓜幼苗的质膜透性增加,电解质大量外渗,胁迫0—6 d时膜透性持续增加,6—9 d时膜透性有所减小。在6 d时单一盐胁迫、L-NAME、tungstate、cPTIO处理的分别显著高于CK 59%、95.2%、90.4%、113.4%(图3-C)。说明L-NAME、tungstate、cPTIO能有效消除细胞中的NO,显著增加了黄瓜幼苗叶片的质膜透性,使细胞膜的离子渗漏增加,破坏了细胞结构的完整性。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片MDA含量、O2·-产生速率、叶片质膜透性含量的影响
-->Fig. 3Effects of NO scavenger and synthetic inhibitor on MDA content, O2·- producing rate and plasma membrane permeability in leaves of cucumber seedlings under salt stress
-->
2.4 NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片脯氨酸(Pro)和可溶性蛋白含量的影响
由图4可以看出,盐胁迫处理3 d后各处理叶片内Pro和可溶性蛋白含量明显增加,到6 d时Pro和可溶性蛋白的含量最高,与CK有显著差异;经NO清除剂和合成抑制剂处理后,显著降低了Pro和可溶性蛋白的积累。6 d时,单一盐胁迫处理的黄瓜幼苗Pro高于NO清除剂和合成抑制剂处理的24.5%以上;而单一盐胁迫处理的黄瓜幼苗可溶性蛋白含量与tungstate处理的相当,但与L-NAME、cPTIO处理的有显著性差异,说明L-NAME和cPTIO能显著抑制和清除黄瓜幼苗内NO的含量,使细胞结构的完整性遭到破坏,加剧了盐胁迫导致的膜脂过氧化伤害,致使细胞的正常代谢遭到破坏。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片脯氨酸和可溶性蛋白含量的影响
-->Fig. 4Effects of NO scavenger and synthetic inhibitor on proline and soluble protein content in cucumber seedling leaves under salt stress
-->
2.5 NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片气体交换参数的影响
图5-A显示,盐胁迫下黄瓜幼苗的净光合速率(Pn)在0—6 d内随着处理天数的增加呈下降趋势,故6 d时的Pn最低,且此时单一盐胁迫处理的显著低于CK 59%,而L-NAME、tungstate、cPTIO处理的明显比单一盐胁迫处理的低77.7%以上;在0—6 d内幼苗的气孔导度(Gs)也随着处理天数的增加呈下降趋势,因此6 d时Gs最低,单一盐胁迫处理的显著比CK低43.7%,而L-NAME、tungstate、cPTIO处理的分别比单一盐胁迫处理的明显低23.3%、38%、39.9%(图5-B);在0—6 d内幼苗的蒸腾速率(Tr)也随着处理天数的增加呈下降趋势,6 d时Tr最低,单一盐胁迫处理的比CK低39.2%,差异显著,而L-NAME、tungstate、cPTIO处理的比单一盐胁迫处理的明显低21%以上(图5-C);在0—6 d内幼苗的胞间CO2(Ci)也随着处理天数的增加呈下降趋势,故6 d时的Ci最低,单一盐胁迫处理的比CK显著低20.1%,而L-NAME、tungstate、cPTIO处理的分别比单一盐胁迫处理的显著低13.9%、13.4%和15.5%(图5-D);9 d时的Pn、Gs、Tr、Ci都有所回升,可能由于取消了盐胁迫引起的。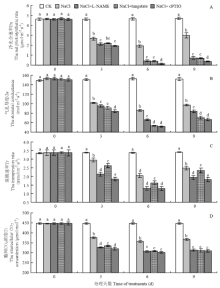 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片气体交换参数的影响
-->Fig. 5Effects of NO scavengers and synthetic inhibitors on gas exchange parameters of cucumber seedling leaves under salt stress
-->
2.6 NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片叶绿素荧光参数的影响
由图6-A可以看出,0—6 d内黄瓜幼苗在单一盐胁迫和tungstate处理下Fv/Fm随处理天数的增加而下降,但无显著差异,而在L-NAME、cPTIO处理下Fv/Fm随处理天数的增加而显著下降,且6 d时分别比CK显著降低5.1%和6.6%;在0—6 d内幼苗ΦPSⅡ也随着处理天数的增加呈下降的趋势,故6 d时的ΦPSⅡ最低,单一盐胁迫处理的比CK明显低13.1%,而L-NAME、tungstate、cPTIO处理的分别比单一盐胁迫处理的显著低23.1%、10.2%和45.9%(图6-B);幼苗qP值在6 d时最低,单一盐胁迫处理的比CK低15.1%,而L-NAME、tungstate、cPTIO处理的比单一盐胁迫处理的低24.3%以上(图6-C);在0—6 d内幼苗NPQ随着处理天数的增加呈上升的趋势,6 d时的NPQ最高,单一盐胁迫处理的比CK高58.6%,而L-NAME、tungstate、cPTIO处理的分别比单一盐胁迫处理的高35.7%、7%和38.2%,9 d时的NPQ有所下降(图6-D)。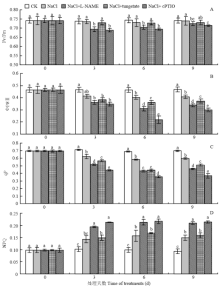 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6NO清除剂和合成抑制剂对盐胁迫下黄瓜幼苗叶片叶绿素荧光参数的影响
-->Fig. 6Effects of NO scavengers and synthetic inhibitors on chlorophyll fluorescence parameters of cucumber seedlings under salt stress
-->
3 讨论
L-NAME为一氧化氮合酶(NOS)抑制剂,能有效地抑制植物体内通过一氧化氮合酶途径产生的一氧化氮;tungstate为硝酸还原酶(NR)抑制剂,能有效地抑制植物体内通过硝酸还原酶途径产生的一氧化氮;而cPTIO为专一地一氧化氮清除剂,能有效地清除植物体内产生的一氧化氮[27]。本研究表明,NO清除剂cPTIO对盐胁迫下叶片内NO含量的影响最显著,而硝酸还原酶抑制剂tungstate对盐胁迫下叶片内源NO含量的影响较小,一氧化氮合酶抑制剂L-NAME对盐胁迫下叶片内源NO含量的抑制作用优于tungstate,由此说明NO清除剂和合成抑制剂能有效地清除和抑制叶片内源NO的含量,且一氧化氮合酶可能是黄瓜幼苗叶片内源NO合成的关键酶。已有大量研究表明适宜浓度的外源NO可显著提高对夏枯草盐害[28]、小麦干旱[29]、棉花低温[13]和小型大白菜弱光[30]等逆境的抵抗能力,说明NO对逆境下的植物具有保护作用。本研究发现,采用L-NAME、tungstate、cPTIO喷施盐胁迫下的黄瓜幼苗,降低了黄瓜叶片内源NO含量,导致其SOD、POD和CAT酶活性低于单独盐胁迫处理的,并且一氧化氮合酶抑制剂L-NAME处理的其SOD、POD和CAT酶活性低于硝酸还原酶抑制剂tungstate处理的,使其细胞内过量积累H2O2,产生膜脂质过氧化,由此表明黄瓜幼苗在盐胁迫下内源NO的变化可能直接调节了幼苗的抗氧化能力,且在盐胁迫下黄瓜幼苗的抗氧化系统可能主要通过一氧化氮合酶途径调控。
王文等[31]研究表明苯丙烯酸胁迫下添加低浓度外源NO后黄瓜幼苗内MDA含量显著降低。盐胁迫会对细胞膜造成膜脂过氧化伤害,使细胞膜的透性增大,导致膜内物质向外渗透,最终导致细胞死亡,而MDA是膜脂过氧化的主要产物之一,其积累是活性氧毒害作用的表现[32];植物在遭受逆境胁迫后体内产生的O2·-,可能通过两种途径被清除,一种途径是O2·-在SOD催化下可转变成O2和H2O2,H2O2又在CAT、POD等的作用下转变成O2和H2O[33];另一种途径是O2·-与NO结合形成ONOO-,从而减少了O2·-的量[34-35]。植物细胞的生物膜是一种半透膜,在逆境条件下生物膜透性反映了膜系统的稳定性[36]。肖雯等[37]研究表明细胞膜的通透性可以反映膜系统的完整性及其损伤程度,质膜透性越大植物受损伤程度也就越大。樊怀福等[38]研究表明外源NO显著降低了NaCl胁迫下黄瓜幼苗叶片的质膜透性,使细胞膜的离子渗漏减少,保护了细胞结构的完整性。本试验表明,经盐胁迫处理后,黄瓜幼苗MDA、O2·-和质膜透性高于正常条件下生长的幼苗。采用L-NAME、tungstate、cPTIO喷施盐胁迫处理下的黄瓜幼苗,其内源NO含量减少,导致其MDA含量、O2·-产生速率和质膜透性显著高于单独盐胁迫处理的,使其细胞膜造成严重的过氧化伤害,由此表明黄瓜幼苗在盐胁迫下内源NO的变化可能影响MDA的含量、O2·-的产生速率和质膜透性。
外源NO能促进盐胁迫下玉竹脯氨酸的积累,提高抗盐性[18];樊怀福等[38]报道指出外源NO可通过提高盐胁迫下黄瓜幼苗中的脯氨酸含量,增强其耐盐性。杨美森等[13]研究表明棉花在冷害胁迫下外源NO显著提高了可溶性蛋白质含量。本研究表明黄瓜幼苗在单一盐胁迫下脯氨酸和可溶性蛋白的含量显著高于NO清除剂和合成抑制剂处理的,说明内源NO能有效地缓解脂膜过氧化伤害。
光合作用是植物生长的基础,其生理过程对环境的变化非常敏感[39]。已有大量研究表明,盐胁迫能引起叶片光合机构受损和光合速率下降[40]。本研究结果显示,NaCl胁迫下黄瓜幼苗叶片Pn、Gs、Tr、Ci显著降低。吴雪霞等[41]报道,引起植物叶片Pn下降的原因有Gs和Ci下降导致的气孔限制和Gs下降而Ci升高导致的非气孔限制。本试验表明,黄瓜幼苗在盐胁迫下叶片Gs和Ci都呈下降趋势,说明了黄瓜叶片在盐胁迫下Pn下降的原因是由气孔限制引起的。而经L-NAME、tungstate、cPTIO喷施盐胁迫下处理的黄瓜幼苗,其内源NO含量降低,导致叶片Pn、Gs、Tr、Ci显著低于单一盐胁迫处理的且L-NAME处理的显著低于tungstate处理的,由此表明内源NO可以抵抗盐胁迫对黄瓜幼苗叶片光合作用的气孔限制且在盐胁迫下光合作用主要是通过一氧化氮合酶途径调控的。
与光合参数相比,叶绿素荧光参数能更直接地反映出植物叶片PSⅡ对光能吸收和利用的情况,这有助于更好地分析光合机构受逆境胁迫损伤的部位和程度[42-43]。本试验结果表明,NaCl胁迫下黄瓜幼苗叶片ΦPSⅡ、qP显著降低,NPQ显著升高,Fv/Fm降低但不显著。ΦPSII呈下降趋势,这表明PSII遭到破坏,捕捉光能的能力下降;qP下降,说明盐胁迫导致黄瓜幼苗叶片PSII反应中心的开放程度降低,使积累在PSII反应中心的光能过剩;NPQ显著升高,说明黄瓜幼苗热耗散保护机制没有失效,有效地保护了光合机构,而L-NAME、tungstate、cPTIO喷施盐胁迫下处理的黄瓜幼苗,其内源NO含量降低,Fv/Fm、ΦPSⅡ、qP低于单一盐胁迫处理的,NPQ高于单一盐胁迫处理的,与tungstate处理的相比,L-NAME处理的更为显著,表明内源NO可以有效抵抗盐胁迫对黄瓜幼苗叶片光合机构的损伤,且进一步反映了盐胁迫下光合作用主要是通过一氧化氮合酶途径调控的。
4 结论
在单一盐胁迫下黄瓜幼苗叶片内源NO含量增加,而采用L-NAME、tungstate、cPTIO喷施的盐胁迫下黄瓜幼苗叶片内源NO含量显著降低,抑制了叶片中抗氧化酶的活性且降低了脯氨酸、可溶性蛋白的含量,增加了丙二醛含量、超氧阴离子自由基产生速率和质膜透性,使细胞膜脂过氧化加剧,加重了盐胁迫对黄瓜幼苗的损伤。此外,气体交换参数显著降低,叶绿素荧光参数Fv/Fm、ΦPSⅡ、qP降低,NPQ显著升高,导致叶片光合机构受损,叶片光合速率下降,且L-NAME处理的比tungstate处理的更为显著。可见,黄瓜幼苗内源NO能减轻盐胁迫对黄瓜幼苗的伤害;在盐胁迫下,黄瓜幼苗的活性氧代谢和光合特性主要是通过一氧化氮合酶途径调控的。The authors have declared that no competing interests exist.
