0 引言
【研究意义】卵巢静止是由奶牛产后卵泡生长障碍,卵巢机能暂时性紊乱,卵泡不出现周期性活动所造成。该病是高产奶牛产后乏情发生的主要卵巢疾病[1]。而且,在奶牛遗传改良和良好的管理条件下,奶牛产奶量不断提高,但繁殖效率却逐渐下降[2]。对于现代奶牛养殖业,繁殖率低下正严重制约着奶牛养殖业的发展与经济效益[3]。因此,奶牛卵巢静止的发病机理以及防治已成为世界奶牛疾病领域的一项重要研究课题。【前人研究进展】卵巢静止的发生常与营养、季节、泌乳量和应激因素等有关。其主要原因是产后饲料中某些营养物质如蛋白质、维生素或生长因子的缺乏,使得奶牛营养状况不良,抑制了GnRH和LH的分泌[4-5],卵巢对激素的反应性降低,引起卵巢静止。另外,饲养管理不善,泌乳过度,子宫、卵巢疾病,全身性的疾病等也会引起卵巢静止。代谢组学技术现已在兽医领域中得到较多应用。许楚楚等应用核磁共振(nuclear magnetic resonance, NMR)技术确立了奶牛产后乏情的差异代谢物[6]。然而,气相色谱/质谱联用(gas chromatography/mass spectrometry, GC/MS)技术可以对血浆样品进行有效的定性定量分析,具有高效的分离率和良好的灵敏度[7]。孙玲伟等[8-9]应用该技术筛选了酮病和亚临床酮病以及脂肪肝奶牛血清代谢标识物,丰富了酮病、脂肪肝的发病机理和评估疾病病情。【本研究切入点】有关奶牛卵巢静止的病因、临床病理学及其生殖激素等已有报道,但是缺乏全景式的、系统的深入研究,即没有从整体对发生卵巢静止的奶牛血液中代谢物进行研究。【拟解决的关键问题】本试验首次应用GC/MS技术筛选卵巢静止奶牛和健康奶牛血浆差异代谢物,确定其参与的代谢通路及其差异代谢物网络,以便更好地了解卵巢静止的发生机制,为预防卵巢静止的发生奠定理论基础。1 材料与方法
1.1 试验时间与地点
本试验于2015年5月在黑龙江8511牛场内进行。1.2 试验动物
随机选取年龄、胎次相近的年泌乳量10吨左右的健康经产奶牛共206头,作为试验动物。按中国泌乳奶牛饲养标准进行规范管理,饲喂泌乳盛期全混日粮(TMR),主要成分:青贮32.60 kg,豆粕3.37 kg,湿玉米4.00 kg,膨大豆1.58 kg等;营养水平:干物质(DM):40.84%、粗蛋白:16.51%;脂肪:5.98%;钙:180.07 g;磷:89.96 g;酸性洗涤纤维(ADF):16.63%;中性洗涤纤维(NDF):30.97%;产奶净能:1.66 mcal/DM。平均每头奶牛每天的干物质采食量为21 kg,每天榨乳3次,持续供应干净的水。正常发情奶牛:在产后60—90 d表现发情症状,直肠检查和B超检查子宫、卵巢无异常,通过直肠检查有优势卵泡的生长,B超检查卵泡大小为正常的15—20 mm。
卵巢静止奶牛:产后60—90 d仍未见发情表现,直肠检查和B超检查子宫无异常,通过直肠检查卵巢上没有优势卵泡的生长,B超检查卵泡直径小于8 mm。
根据奶牛发情和卵巢静止判定标准,同时排除异常样本,本试验共选取22头表现发情且临床检查无其他疾病的健康奶牛为发情组(A),20头无发情表现且临床检查无其他疾病的奶牛为卵巢静止组(B)。试验动物临床资料及四种生殖激素水平见表1。
Table 1
表1
表1卵巢静止奶牛和发情奶牛临床资料及四种血浆生殖激素水平(均值±标准差)
Table 1Clinical data and level of four plasma reproductive hormones for inactive ovaries and estrus cows (Mean ± SD)
| 指标 Item | 发情组 Estrus group | 卵巢静止组 Inactive ovaries group |
|---|---|---|
| 头数 No | 22 | 20 |
| 年龄 Age | 3.24±1.36 | 3.06±1.21 |
| 胎次 Parity | 1.95±1.07 | 1.75±0.91 |
| 体况 Body condition | 2.92 ±0.43 | 2.85±0.32 |
| 日均泌乳量 (kg·d-1) | 33.04±7.01 | 37.4±8.34 |
| FSH (mIU·mL-1) | 7.56±3.78 | 10.17±3.82 |
| LH (ng·L-1) | 22.48±14.15 | 31.00±12.78 |
| E2 (pg·mL-1) | 56.24±16.40* | 42.53±7.40 |
| P4 (ng·mL-1) | 0.069±0.14 | 0.052±0.16 |
新窗口打开
1.3 血液样品采集
所有试验奶牛于上午采食和榨乳前经尾静脉采血,每头采集全血10 mL并置于加有3—5滴肝素钠的抗凝管中,将抗凝管缓慢倒置一次充分混匀后静置。5 min低速(4 000 r/min)离心,将600 µL上清液放于1.5 mL离心管中,再进行5 min高速(12 000 r/min)离心,将500 µL上清液放于1.5 mL离心管中,于-80℃冷冻保存,待测。1.4 血液生殖激素分析
采用双抗体夹心法测定奶牛血浆中P4、E2、FSH和LH的水平,FSH酶联免疫分析试剂盒(SBJ- B0061)、LH酶联免疫分析试剂盒(SBJ-B0064)、P4酶联免疫分析试剂盒(SBJ-B0063)、E2酶联免疫分析试剂盒(SBJ-B0062)均购自南京森贝伽生物科技有限公司。1.5 血液样品GC/MS分析
1.5.1 样品预处理 血浆样品室温下解冻后,每50 μL样品中加入10 μL的L-2-氯-苯丙氨酸作为内标物,漩涡震荡10 s后,再加入150 μL甲醇-乙腈混合溶液进行蛋白沉淀,涡旋震荡1 min 后,-20℃静置10 min;蛋白沉淀后的样品在低温下超声提取5 min,之后置于-20℃,静置10 min,随后样品在低温下离心10 min(15 000 r/min,4℃),并提取150 μL上清液于玻璃衍生瓶中,衍生瓶中的液体用快速离心浓缩仪挥干成固体;之后在玻璃衍生瓶中加入15 mg·mL-1的甲氧胺盐酸吡啶溶液80 μL,涡旋震荡2 min,放入震荡培养箱中37℃肟化反应90 min;之后在样品中加入含1%TMCS的BSTFA衍生试剂80 μL和20 μL的正己烷,涡旋震荡2 min,70℃恒温箱反应60 min后样本取出,室温下放置30 min后进行GC/MS分析。1.5.2 测定条件 本试验的分析仪器为Agilent公司的7890A-5975C气相色谱飞行时间质谱联用仪(Agilent,USA),采用无分流模式,在气相色谱质谱仪器中加入1 μL经过衍生化的提取物,经过毛细管柱后,样品经过分离进入质谱仪进行检测。在质谱仪中利用高纯氦气作中间载气,氦气负载的气流速1.0 mL·min-1。气相色谱的程序升温为:15℃·min-1,50—125℃;5℃·min-1,125—210℃;10℃·min-1,210—270℃;20℃·min-1,270—305℃,305℃ 维持5 min。在进样口时的温度为260℃,EI源温度为230℃,电压为-70 V。质量扫描范围:m/z 50—600,延迟5 min开始采集,采集速度为20谱/秒。
1.5.3 GC/MS数据预处理 将GC/MS的原始数据经ChromaTOF (v 4.34, LECO, St Joseph, MI)软件进行预处理,将数据矩阵(CSV格式)导出。分析样本共得到380个特征,内标用于数据的质量控制。一些特别影响结果的峰被从峰图中删除,包括内标峰和任何已知的假阳性峰(包括噪音、柱流失和衍生物化试剂峰),提出的矩阵经过去冗余和峰合并后[10],得到109个代谢物。用峰面积归一化法对样本质谱峰的响应强度进行归一化,得到归一化的数据矩阵[11]。
1.5.4 代谢物的鉴定 差异代谢物的鉴定通过如下方式进行:GC/MS工作站软件会自动地把每个化合物的特征离子片段谱(fragmentation patterns)的碎片质荷比和丰度与NIST数据库、Feihn代谢组学数据库的标准离子片段谱库比对,一般而言,匹配度超过70%的检测物均可被认为是标准物质[12]。
1.6 统计分析
发情奶牛和卵巢静止奶牛临床资料及四种生殖激素检测结果用SPSS17.0进行单因素方差分析(one- way, ANOVA),肩注“*”表示差异显著(P<0.05),肩注“**”表示差异极显著(P<0.01);血浆样品的GC/MS标准化数据矩阵导入SIMCA-P+14.0软件包(Umetrics,Umeå,Sweden),进行多元统计分析,先采用无监督的主成分分析(PCA)来观察各样本之间的总体分布和整个分析过程的稳定性,然后用有监督的(正交)偏最小二乘法(O)PLS-DA分析来区分各组间代谢轮廓的总体差异,找到组间的差异代谢物。为防止模型过拟合,采用七次循环交互验证和200次响应排序检验的方法来考察模型的质量。采用多维分析(O)PLS-DA和单维分析(t检验)相结合的办法,来筛选组间差异代谢物。PLS-DA分析中,变量权重值(variable important in projection, VIP)大于1的变量被认为是差异变量。筛选VIP>1;P<0.05的代谢物作为差异代谢物,最后进行差异代谢物代谢通路归属分析,采用KEGG pathway数据库对两组奶牛血浆样本进行代谢组学差异代谢物的互作网络构建分析。2 结果
2.1 血液生殖激素检测
卵巢静止组和发情组奶牛的年龄、胎次、体况和日均泌乳量没有差异。发情组与卵巢静止组相比,奶牛血中FSH,LH和P4含量无显著的差异,而E2含量显著的高于卵巢静止组(表1)。2.2 GC/MS检测结果
2.2.1 代谢物总离子图(TIC)分析 对质控样本(QC)的GC/MS总离子流图(TIC)进行重叠,初步考察分析方法的重现性。由图1可知,QC样本质谱峰的保留时间和相应强度重现性都很好,说明整个分析方法稳定可靠。2.2.2 多元统计分析 对A组和B组样本分别进行PCA、PLS-DA、OPLS-DA分析,得分图分别见图2—4。通过对PCA得分图分析,可知A组样本和B组样本分离较为明显,进一步采用PLS-DA和OPLS-DA对数据进行分析,从两个得分图可以得出A组和B组之间的代谢物存在显著差异;排列试验结果显示R2和Q2值均大于0.5,且比值接近于1;A组与B组的OPLS-DA得分图结合排列试验验证结果共同提示所建的模型成立,说明组间代谢出现了显著性差异。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1QC 样本的总离子流图(TIC)进行重叠
-->Fig. 1TICs of plasma samples from QC sample by GC/MS
-->
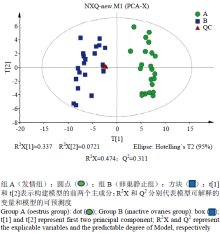 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2基于A、B两组奶牛血浆GC/MS谱的主成分分析(PCA)得分图
-->Fig. 2PCA scores plot based on plasma GC/MS spectra from groups A and B of dairy cows
-->
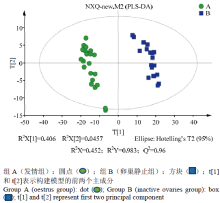 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3A、B两组奶牛血浆图谱偏最小二乘法-判别分析(PLS-DA)
-->Fig. 3PLS-DA for plasma profiles from groups A and B of dairy cows
-->
2.2.3 差异代谢物筛选和代谢通路分析 通过VIP值和P值共筛选出20种差异代谢物,通过KEGG通路分析进一步筛选与奶牛代谢相关的代谢物共17种,如表2所示。表中列出17种代谢物在KEGG中匹配的ID、气相色谱化合物的保留时间、筛选时VIP和P值、卵巢静止组相对于发情组的变化趋势和差异代谢物以及主要参与的代谢通路。
由表2可知,有16种代谢物在卵巢静止组含量低于发情组。它们涉及的通路包括氨基酸代谢,烟酸和烟碱的代谢,糖代谢和能量代谢等方面。仅胆酸的含量在卵巢静止组明显的高于发情组,与胆汁酸的生物合成有关。此外,通过CHEBI网站(http://www.ebi. ac.uk/ chebi/)查询3种代谢物(亚氨基二乙酸、N-甲基-L-谷氨酸、3-氨基异丁酸)的生物功能,根据文献资料显示与奶牛的代谢通路无关,可能与细胞能量代谢传导有关。
图5显示了通过P值的负log计算出17种代谢物的丰度,并进行通路富集分析。它们涉及较多的通路为苯丙氨酸、酪氨酸、色氨酸的生物合成,其次为丙酸乙酯、烟酸烟碱、苯丙氨酸和酪氨酸代谢。
Table 2
表2
表2奶牛卵巢静止和发情组血浆差异代谢物
Table 2Differential plasma metabolites of estrus cows and inactive ovaries cows
| No. 编号 | 代谢物 Metabolites | KEGG ID | 保留时间 RT (min) | VIP a | P value b | 变化趋势 Change trend c | 主要代谢通路及生物学功能 KEGG Pathway& Biofunction |
|---|---|---|---|---|---|---|---|
| 1 | 香草扁桃酸 Vanillylmandelic acid | C05584 | 30.94 | 1.96 | 6.93803E-10 | ↓ | 酪氨酸代谢 bta00350,Tyrosine metabolism |
| 2 | 2-哌啶酸 Pipecolinic acid | C00408 | 7.16 | 1.59 | 8.40658E-06 | ↓ | 赖氨酸降解 bta00310,Lysine degradation |
| 3 | 核糖醇 Ribitol | C00474 | 16.35 | 1.97 | 1.24245E-13 | ↓ | 戊糖葡萄糖酮酸转换 bta00040,Pentose and glucuronateinter conversions |
| 4 | 二乙酸 Oxalate | C00209 | 23.47 | 1.85 | 9.86836E-07 | ↓ | 乙醛酸和吡啶二甲酸二甲酯代谢 bta00630 Glyoxylate and dicarboxylate metabolism |
| 5 | 海藻糖 Trehalose | C01083 | 29.29 | 2.15 | 2.67844E-20 | ↓ | 淀粉和蔗糖代谢 bta00500,Starch and sucrose metabolism |
| 6 | 羟基丁酸 2-hydroxybutanoic acid | C05984 | 12.32 | 2.06 | 1.20739E-15 | ↓ | 丙酸乙酯代谢 bta 00640,Propanoate metabolism |
| 7 | 塔格糖 D-Tagatose | C00795 | 19.72 | 2.17 | 7.75014E-17 | ↓ | 半乳糖代谢 bta 00052,Galactose metabolism |
| 8 | 甲基化-D-半乳糖皮蒽 Methyl-beta-D-galactopyranoside | C03619 | 25.48 | 1.30 | 0.002138193 | ↓ | ABC转运体 bta 02010 ABC transporters |
| 9 | 苯丙酮酸 Phenylpyruvate | C00166 | 10.15 | 1.93 | 9.57887E-13 | ↓ | 苯丙氨酸代谢 bta 00360,Phenylalanine metabolism 苯丙氨酸,酪氨酸和色氨酸生物合成 bta00400,Phenylalanine, tyrosine and tryptophan biosynthesis |
| 10 | 6-羟基烟酸 6-Hydroxynicotinic acid | C01020 | 23.02 | 1.68 | 4.83618E-08 | ↓ | 烟酸和烟碱的代谢 bta00760,Nicotinate and nicotinamide metabolism |
| 11 | L-酪氨酸 L-Tyrosine | C00082 | 10.30 | 1.70 | 4.30652E-06 | ↓ | 酪氨酸代谢 bta00350,Tyrosine metabolism 苯丙氨酸代谢 bta 00360,Phenylalanine metabolism |
| 12 | β-丙氨酸 beta-Alanine | C00099 | 5.21 | 1.51 | 8.16721E-06 | ↓ | 丙酸乙酯代谢 bta 00640,Propanoate metabolism β-丙氨酸代谢 bta00410,beta-Alanine metabolism |
| 13 | 烟酸甘氨酸 Nicotinoylglycine | C05380 | 10.20 | 1.76 | 1.52213E-09 | ↓ | 烟酸和烟碱代谢 bta00760,Nicotinate and nicotinamide metabolism |
| 14 | 丁二胺 Putrescine | C00134 | 27.61 | 1.17 | 0.002150576 | ↓ | 精氨酸和脯氨酸代谢 bta00330 Arginine and proline metabolism |
| 15 | 羟胺 Hydroxylamine | C00192 | 32.53 | 1.29 | 4.18961E-05 | ↓ | 氮气代谢 bta00910,Nitrogen metabolism |
| 16 | 5-氨基咪唑-4-甲酰胺核苷酸 5-Aminoimidazole-4-carboxamide ribotide | C04677 | 29.81 | 1.01 | 0.000888248 | ↓ | 嘌呤代谢 bta00230,Purine metabolism 组氨酸和嘌呤的生物合成 bta01065,Biosynthesis of alkaloids derived from histidine and purine |
| 17 | 胆酸 Cholic acid | C00695 | 33.98 | 1.09 | 0.012798173 | ↑ | 胆汁酸生物合成 bta00120, Bile acid biosynthesis |
| 18 | 亚氨基二乙酸 Iminodiacetic acid | C09911 | 11.31 | 1.88 | 1.10404E-07 | ↓ | 甘氨酸衍生物 Glycine derivative |
| 19 | N-甲基-L-谷氨酸 N-Methyl-L-glutamic acid | C01046 | 12.87 | 2.00 | 4.51979E-15 | ↓ | 谷氨酸中间代谢产物 The intermediate product of glutamic acid metabolism |
| 20 | 3-氨基异丁酸 3-Aminoisobutyric acid | C05145 | 7.10 | 1.37 | 0.000382725 | ↓ | 胸腺嘧啶的代谢产物 The product of thymine metabolism |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4A、B两组奶牛血浆图谱正交校正偏最小二乘法-判别分析(左)和排列验证图(右)
-->Fig. 4Plots of OPLS-DA (left) and permutation tests (right) for plasma profiles from groups A and B of dairy cows
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5代谢物通路分析富集图
-->Fig. 5Enrichment map of metabolite pathway analysis
-->
3 讨论
3.1 卵巢静止与血液生殖激素的关系
卵巢静止组和发情组FSH,LH和P4的含量无显著差异。本试验中发情奶牛样品采集的时间为优势卵泡生长至排卵阶段,而FSH的含量在卵泡从开始生长至优势卵泡阶段上升,在卵泡生长至优势卵泡阶段开始下降,因而与没有卵泡生长的卵巢静止奶牛的FSH水平相近。在优势卵泡的生长阶段,LH呈脉冲式分泌,其每天的变化不定[13]。KAWASHIMA等报道不排卵奶牛的LH脉冲的频率相比排卵奶牛较低[14]。由于试验现场条件的局限性,仅能在60—90 d依据是否发情以及直肠检查和B超检查卵巢卵泡状况随机确立发情和卵巢静止奶牛对应的相近天数采集血液,再者,因未做到连续每2 h或在每天的同一时间点跟踪采样,因此,结果呈现为两组奶牛的LH含量无显著差异。P4在排卵后,黄体形成阶段分泌增加,因而未排卵阶段发情奶牛和卵巢静止奶牛P4含量无显著差异。相对于卵巢静止组,发情组奶牛的E2水平显著升高,在卵泡从初始卵泡生长至优势卵泡时,卵泡分泌的E2会增加,而卵巢静止奶牛的卵泡不生长或停止生长,因而发情组奶牛的E2含量显著高于卵巢静止组。BEAM等[15]报道排卵奶牛在产后8—14 d产生第一次卵泡波时,E2水平比不排卵奶牛高。P4浓度在奶牛排卵没有差异,在排卵后排卵奶牛的P4浓度高于不排卵奶牛。3.2 卵巢静止与差异代谢物的关系
目前,代谢组学技术已经成为有机体疾病模型和疾病生物标记物筛选,疾病诊断和生物途径表达的一个强有力的分析工具。本试验共筛选出20种差异代谢物,其中17种代谢物与奶牛体内代谢密切相关。而且,卵巢静止组相对于发情组,除胆酸含量升高外,其余16种代谢物含量均降低。通过差异代谢物的KEGG分析,总结了其参与的代谢通路,并对其可能的影响机制进行讨论。3.2.1 氨基酸代谢异常 差异代谢物富集到的通路中,关于氨基酸代谢的较多,包括酪氨酸、苯丙氨酸、色氨酸的生物合成,苯丙氨酸、丙酸乙酯和酪氨酸代谢。卵巢静止组中,筛选到的差异代谢物L-酪氨酸、β-丙氨酸和苯丙酮酸表达降低。L-酪氨酸和苯丙酮酸参与苯丙酮酸/色氨酸/酪氨酸的生物合成,L-酪氨酸和香草扁桃酸参与酪氨酸的代谢,这三种物质在卵巢静止组含量均下降,说明这两个通路的氨基酸合成减少或降解增加。在赖氨酸分解通路中,赖氨酸的下游产物,差异代谢物2-哌啶酸含量下降,由此推测赖氨酸在卵巢静止奶牛体内含量可能减少。另外两个通路,在丙酸乙酯代谢中β-丙氨酸含量下降,且其下游产物羟基丁酸含量也下降,说明此代谢通路合成减少或降解增强。在精氨酸脯氨酸代谢通路中,精氨酸和脯氨酸的上游代谢物,丁二胺含量在卵巢静止组下降,由此推测精氨酸和脯氨酸含量应下降,实际变化还应用后续试验验证。
氨基酸在卵泡生长中有着至关重要的作用,许多研究通过卵母细胞的体外培养,验证了卵泡液中不同代谢物对卵泡生长的作用。SINCLAIR等的研究表明,甘氨酸和丙氨酸是卵泡液中含量最丰富的两种氨基酸[16]。这两种氨基酸有许多功能与细胞生长相关,除了合成蛋白,还可参与核苷酸的生物合成,渗透调节[17]和解铵类物质的毒性[18]。MATOBA等人用代谢组学方法比较体外培养的卵母细胞,分析其正常生长和中途停止生长条件下,卵泡液中代谢物的差异,
结果发现甘氨酸、L-丙氨酸和L-谷氨酸与卵泡生长成正相关[19]。一些特定的氨基酸(甘氨酸,丙氨酸,脯氨酸等)通过颗粒细胞摄取,进而转到卵母细胞中,只有丝氨酸和谷氨酸在整个发情周期都维持着相同模式[20]。这说明氨基酸会进入卵泡腔中支持颗粒细胞层的发育。本试验中L-酪氨酸、赖氨酸、精氨酸、β-丙氨酸、脯氨酸在卵巢静止奶牛体内含量下降,提示产后奶牛体内氨基酸含量下降会影响或阻碍卵泡生长,进而会促发卵巢静止。因此,奶牛体内氨基酸的充足和平衡对卵泡生长发育以及发情有很大的影响。
3.2.2 烟酸代谢异常 相对于卵巢静止组,烟酸甘氨酸和6-羟基烟酸两种代谢物在发情组的含量高,均参与烟酸和烟碱代谢,均为烟酸的下游代谢产物。烟酸作为辅酶烟酰胺腺嘌呤二核苷酸和烟酰胺腺嘌呤二核苷酸磷酸(NAD+ 和NADP+)的前体,在能量代谢中是重要的参与者,能维持细胞的氧化还原状态,维持机体免疫功能,调控细胞的存活时间和细胞凋亡[21]。烟酸有强大的抗脂作用,可以在能量负平衡状态下减少非酯化脂肪酸(NEFA)水平。其在体内可以抑制脂肪细胞中腺苷环化酶的活性或增加环磷腺苷(CAMP)磷酸二酯酶的活性[22],进而抑制脂肪分解,减少血中NEFA浓度。卵巢静止奶牛烟酸含量下降,从而造成脂质分解成脂肪酸的能力增强,奶牛体内脂肪酸含量增多。这不仅会造成脂肪肝综合症,还会增加细胞毒性,甚至造成细胞死亡[23]。此外,血中NEFA的增加可以引起卵泡液中脂肪酸的增加,会影响卵母细胞复合体的形态和胚胎的质量[24]。卵母细胞周围包围卵丘细胞,一起构成卵母细胞复合体(COC),直接与卵泡液接触。卵丘细胞通过细胞间的间隙相连,且细胞间隙允许小分子代谢物在卵丘细胞和卵母细胞之间相互联系,促进卵母细胞的生长和成熟[25]。在卵泡液中,卵丘细胞是第一个受NEFA影响的代谢区域。之后卵母细胞从卵丘细胞摄取NEFA,在细胞内转化成中性脂肪,最后转化成脂质供后期胚胎的营养[26]。在卵母细胞内NEFA比例的增多可以通过促进神经酰胺形成、线粒体释放细胞色素C和激活半胱天冬酶来增加脂肪毒性[27],进而影响卵泡初期的生长。
3.2.3 糖类代谢异常 差异代谢物核糖醇、海藻糖、塔格糖,分别参与戊糖葡萄糖酮酸转换、淀粉和蔗糖代谢、半乳糖代谢等与糖代谢相关的三个通路。在卵巢静止组,三种物质的含量均降低,且其下游代谢产物丙酮酸、葡萄糖参与三羧酸循环。戊糖葡萄糖酮酸转换通过D-核酮糖-5-磷酸进入磷酸戊糖途径(PPP)。通过5-磷酸核糖基二磷酸(PRPP)进入嘌呤代谢途径参与嘌呤生成和代谢。在嘌呤代谢中氨基咪唑-4-甲酰胺核苷酸(AICAR)含量下降,它参与嘌呤代谢生成尿酸,其下游产物二乙酸和羟胺都呈下降趋势,分别参与乙醛酸和吡啶二甲酸二甲酯代谢、NH3代谢。葡萄糖是卵巢的重要能量来源。它可能会在卵巢中经厌氧途径代谢成乳酸。NANDI等研究了葡萄糖、乳酸、丙酮酸对体外培养的卵泡细胞和颗粒细胞的作用,发现卵泡直径随着卵泡液中葡萄糖浓度的增加而增加。在小卵泡中乳酸的浓度增加,这可能会改变卵泡细胞的能量来源[28]。卵母细胞和卵泡细胞可以通过三个主要的通路利用葡萄糖:葡萄糖氧化(糖酵解,柠檬酸循环(TCA)和氧化磷酸化),戊糖磷酸途径(PPP),或转换成细胞外代谢,用于细胞外基质扩张[29]。本试验结果涉及到三个与糖代谢相关的代谢通路,且在卵巢静止组代谢物呈下降趋势,说明卵巢静止奶牛的糖代谢通路受阻,进而影响糖酵解和磷酸戊糖途径,使卵泡中ATP和嘌呤生成减少,从而影响细胞的发育、细胞核的生长和细胞稳态的维持。
3.2.4 胆酸代谢异常 相对于发情组,卵巢静止组胆酸含量高。由于胆酸参与胆汁酸的合成,胆酸含量的升高,提示奶牛胆汁酸合成增加或分泌减少,这与SEJERSEN的结果一致,当奶牛泌乳开始时肝脏合成胆汁酸的能力增强[30]。在泌乳期血清胆汁酸增加,同时胆固醇和甘油三酯也会增加[31]。胆汁酸通过膜受体的内分泌信号,使G蛋白偶联胆汁酸受体1(GPBAR1),对细胞和器官发挥调节作用[32]。由于GPBAR1的广泛表达,胆汁酸可以在不同的组织调节细胞功能。卵巢静止奶牛体内胆汁酸合成增加,从而影响GPBAR1的表达,进而影响卵巢颗粒细胞的生长。胆汁酸可以通过核受体亚家族NR1H4介导的NR0B2阻止靶基因的转录,进而抑制其他核受体,NR5A2[33]。NR0B2会通过其对核受体NR5A2的抑制作用抑制类固醇类急性调节蛋白的表达,因此,NR5A2对卵巢的功能有重要的作用[34],并推测与胆汁酸代谢相关基因的表达可能会对颗粒细胞的生长有作用,这有待于进一步验证。
3.2.5 其他差异代谢物异常 亚氨基二乙酸是甘氨酸的一种氨基羧酸,是甘氨酸的一种衍生物[35],其在卵巢静止组含量下降。甘氨酸在卵泡生长过程中起到重要作用,但该衍生物的生物学作用尚不清楚。N-甲基-L-谷氨酸是谷氨酸的一种化学衍生物,是甲烷代谢的中间代谢产物。其由谷氨酸N-甲基甲胺酶催化甲胺和谷氨酸发生反应生成。其也可以被甲基谷氨酸脱氢酶催化生成谷氨酸[36]。在卵巢静止组,N-甲基-L-谷氨酸含量下降,但有关谷氨酸对奶牛卵巢静止的影响尚不知晓。3-氨基异丁酸是胸腺嘧啶的分解产物,由运动的肌肉中释放到血中,到达脂肪组织激活产热基因,从而使得白色脂肪褐变。最近有人推断,3-氨基异丁酸在细胞代谢中起作用,其燃烧脂肪调节胰岛素,总胆固醇和甘油三酯的代谢[37]。在卵巢静止奶牛体内检测到其含量下降,说明卵巢静止奶牛的细胞能量代谢可能处于减弱状态,造成产能减少,从而影响卵泡生长。
4 结论
本研究应用气相色谱/质谱联用技术筛选出了产后卵巢静止奶牛血浆差异代谢物,揭示了奶牛卵巢静止代谢轮廓以及可能的发病机理。相对于正常发情奶牛,卵巢静止奶牛血浆中有20种代谢物表现异常,其中17种与卵巢静止密切相关。通过对卵巢静止奶牛和发情奶牛不同代谢特征的分析,阐明了差异代谢物与奶牛卵巢的内在联系以及潜在的生物作用,并且新发现一些奶牛卵巢静止的差异代谢物,为今后深入探讨奶牛产后卵巢静止的发生机制和防治措施提供了新的方向。The authors have declared that no competing interests exist.
