0 引言
【研究意义】干旱、盐碱、高温、低温等非生物胁迫因子严重影响作物的产量和品质[1],其中低温是一个非常重要的环境因子。近年来气候变化异常,极端低温天气出现频繁,低温寒害已经成为农业生产中面临的严重自然灾害之一。低温通过影响植物细胞膜成分,气孔开度等生理、生化过程对植物造成伤害,限制作物的种植区域,影响作物的产量[2]。植物遭受冷胁迫时,从接收低温信号到引起生理生化反应,再到调节基因表达,最后产生耐冷能力,存在一个复杂的信号传导系统[3-4],其中低温胁迫相关转录因子的作用尤为关键,它可以诱导下游多个耐冷基因的表达从而提高植物的耐冷性[5]。小麦是世界重要的粮食作物之一,低温冻害和倒春寒对小麦生产造成了严重的威胁。因此,发掘小麦耐冷相关转录因子基因,研究其调控机制,对于完善低温胁迫应答的分子机制和利用分子手段改良作物耐冷性具有重要意义。【前人研究进展】植物对逆境胁迫应答反应是一个涉及多基因、多信号传导途径及多基因表达产物的复杂过程[6]。其中转录因子是植物体内一类重要的调节因子。转录因子(transcription factor,TF)也称反式作用因子,能够与基因启动子区域中顺式作用元件特异性结合,调节众多下游基因的表达,对植物的生长发育、形态建成、以及抵抗非生物胁迫起重要作用[7-9]。自植物中最早的转录因子在玉米中被报道以来[10],已从植物中分离鉴定出大量转录因子,根据DNA结构域的特点将转录因子分成若干个家族,包括WRKY、AP2/EREBP、MYB、bZIP和ZFPs等[11-12]。在植物对低温胁迫的响应过程中,转录因子通过调控下游抗逆相关基因的表达起着重要的作用[13]。低温能够诱导多种植物基因的表达,如COR、KIN、LTI或者RD等[14-16]。CBFs/DREBs转录因子能够与COR/KIN/LTI/RD基因启动子区的DRE/CRT顺式作用元件结合并调控其表达[17-18]。拟南芥中过表达CBF1和CBF3能调控下游冷诱导基因的表达,产生高水平的脯氨酸和可溶性糖,从而提高植物的耐冷性[19-21];冷处理下CBF2能够负向调控CBF1和CBF3的表达,从而调控下游基因表达及拟南芥的耐冷性[22]。ICE1编码一个MYC类bHLH 转录因子,位于CBFs上游,正向调控CBFs,过表达ICE1的同源基因ICE2同样能够提高拟南芥的耐冷性[23-24]。这些研究都表明CBF-依赖途径在植物低温胁迫中起着重要的作用。除了CBF-依赖途径,在植物的低温胁迫响应中还存在着多重的信号途径[25-27]。C2H2类锌指蛋白是真核生物中最大的转录因子家族之一,在植物非生物胁迫响应中起着重要作用[8, 28-29],其中一些C2H2类锌指蛋白对低温胁迫响应。例如大豆的锌指蛋白基因SCOF-1,能够提高bZIP类转录因子SGBF-1与ABRE的结合效率,调控转基因植物对低温的耐受性[30];另一个大豆的锌指蛋白基因GsZFP1能够被ABA、盐、干旱和低温诱导,增强转基因拟南芥对干旱和低温的耐受性[13]。据报道,水稻锌指蛋白基因ZFP245/ ZFP252/OSISAP1/OsCOIN和沙冬青的锌指蛋白基因AmZFPG受多种非生物胁迫诱导,均提高了转基因植株对冷、干旱和盐胁迫的耐受性[11, 31-34]。虽然近几年生物技术发展迅速,但是植物C2H2类锌指蛋白的生理生化功能研究还很少。到目前为止,大部分被鉴定的植物胁迫相关的C2H2类锌指蛋白都在干旱和盐胁迫中起着重要作用,然而其中很少涉及到冷胁迫响应,尤其是在作物中[30-31]。【本研究切入点】小麦是世界重要的粮食作物之一,而低温冻害和倒春寒却限制了小麦的种植区域。本研究通过对低温处理的小麦转录组测序结果进行分析,获得一个Di19家族转录因子TaDi19A。Di19家族属于锌指蛋白中的一个小家族,包含zf-di19和di19_C结构域,涉及到植物非生物胁迫响应[35-37]。在拟南芥、水稻和大豆中分别鉴定出了7个成员[35, 38-39],而在小麦中的研究却很少。小麦中,LI等[40]发现TaDi19A对植物非生物胁迫响应起着重要作用,过表达TaDi19A能提高拟南芥在萌发期对盐胁迫、ABA和甘露醇的敏感性,根长试验表明过表达TaDi19A能够降低植株对盐胁迫的耐受性和对乙烯的敏感性,然而关于Di19在小麦冷胁迫响应中的研究尚未见报道。【拟解决的关键问题】本研究通过实时荧光定量PCR鉴定了TaDi19A在低温胁迫下的表达模式,以及转基因拟南芥对低温胁迫的响应;为了进一步研究TaDi19A的耐冷作用机制,利用酵母双杂交技术以pGBKT7-TaDi19A为诱饵筛选小麦cDNA文库,筛选可能与其互作的候选蛋白,为研究小麦Di19转录因子抗逆调控机制提供依据。1 材料与方法
1.1 植物材料及胁迫处理
普通小麦(Triticum aestivum L.)农家品种小白麦是由中国农业科学院作物科学研究所景蕊莲研究员提供。将其播种在土中于22℃生长1周,然后对其进行低温胁迫处理:将小麦幼苗放入4℃继续生长,并于1、2、4、8、12和24 h分别取样。取2周大的野生型拟南芥(Columbia-0)和过表达TaDi19A的拟南芥进行下游胁迫相关基因的分析。将所取样品迅速放入液氮中,然后保存到-80℃冰箱中。1.2 基因的生物信息学分析
小麦TaDi19A数据来源于EnsemblPlants(http:// plants.ensembl.org/index.html)数据库。小麦TaDi19A蛋白的分子量和等电点用在线工具 Compute pI/Mw tool(http://web.expasy.org/protparam/)计算。其余的生物信息学分析方法如下:利用SMART(http://smart. embl-heidelberg.de/)在线工具分析小麦TaDi19A蛋白的结构域;利用GSDS(http://gsds.cbi.pku.edu.cn/)制作小麦TaDi19A外显子-内含子结构示意图;利用PHYRE2(http://www.sbg. bio.ic.ac.uk/ phyre2.html)在线工具对TaDi19A蛋白三级结构进行分析[41]。利用NetPhos 3.1 Server数据库(http://www.cbs.dtu.dk/ services/NetPhos/)预测TaDi19A蛋白磷酸化位点。1.3 RNA提取和实时荧光定量PCR(qRT-PCR)
用植物总RNA提取试剂盒(天根,北京)提取不同时间段低温处理的小麦RNA和拟南芥RNA,按照反转录试剂盒(TaKaRa,大连)说明书将提取的RNA反转录成单链cDNA。然后将反转录的cDNA模板均稀释到200 ng·μL-1,以SYBR Green染料法,在ABI 7500(Applied Biosystems,Foster City,CA)仪器上进行实时荧光定量PCR反应。反应体系及程序参见FENG等[38]。每个反应3次重复。按照基因相对表达分析2-ΔΔCT方法分析TaDi19A和拟南芥胁迫相关基因的相对表达量及其标准差。1.4 转基因拟南芥的产生及低温鉴定
将TaDi19A的编码序列构建到带有CaMV35S启动子的pBI121表达载体上,转入GV3101农杆菌中,通过花序侵染法侵染开花期的野生型拟南芥。转基因拟南芥的筛选参照HE等[42],T3纯合转基因种子和野生型种子用于低温表型鉴定。将野生型WT与T3转基因拟南芥种子用70%的酒精洗3 min,无菌水洗3次,0.7%的NaClO溶液泡15 min,无菌水再冲洗3次,晾干后点种于MS0培养基上。先在4℃春化3 d打破休眠,然后转移到16 h光照/8 h黑暗、60%相对湿度、22℃的培养箱中继续生长。将生长5 d的拟南芥幼苗移到新的MS0培养基上,将其分别放入22℃和4℃直立生长,观察转基因和野生型植株根部的生长状况,统计根长和鲜重。将生长10 d大的拟南芥幼苗转移到营养土中(蛭石:泥炭土=1:1),在适宜条件下(16 h光照/8 h黑暗、温度22℃、相对湿度60%)生长3周,随后进行低温处理:4℃放置3 h进行冷适应,转移到-10℃放置5 h,然后转移到4℃放置3 h,最后转移到正常生长条件(22℃)恢复生长5 d,观察表型,统计存活率并照相。采用t检验方法,对所有数据进行显著性分析。P≤0.05即为差异显著,用一颗黑色五星标注,P≤0.01即为差异极显著,用两颗黑色五星标注。
1.5 小麦cDNA文库构建和诱饵载体构建
利用RNA提取试剂盒(天根,北京)提取小麦叶片的总RNA,将提取的RNA反转录合成cDNA第一链(TaKaRa,大连),以反转录合成的第一链cDNA为模板进行LD-PCR扩增,反应程序和后续反应按照于太飞等[43]的方法进行,最终得到小麦cDNA文库。根据TaDi19A的序列以及诱饵载体pGBKT7(Clontech,美国)的限制性酶切位点设计特异引物,通过PCR技术扩增TaDi19A的编码序列。pGBKT7采用NdeⅠ单酶切,将PCR产物及酶切产物切胶回收,然后通过In-Fusion技术(TaKaRa,大连)连接后转化入大肠杆菌TOP10感受态细胞中(天根,北京)。测序比对正确后提取质粒得到pGBKT7-TaDi19A重组质粒。
1.6 TaDi19A互作蛋白的筛选
酵母AH109的感受态细胞按照试剂盒说明书(Yeastmaker™ Yeast TransformationSystem 2 User Manual,Clontech)制备。自激活验证的方法参照于太飞等[43]的方法。首先将1 µg的pGBKT7-TaDi19A重组质粒加入50 µL新制备的酵母感受态细胞中,再加入500 µL PEG/LiAc,混匀后30℃水浴30 min,每5 min颠倒混匀一次;再加入20 µL DMSO,42℃水浴15 min,每5 min颠倒混匀一次;8 000 r/min离心15 s,弃上清,将菌体重悬于1 mL YPD液体培养基中,30℃振荡培养90 min;高速离心弃上清,将菌体重悬于0.9%的NaCl中,然后涂到SD/-Trp、SD/-Trp/-His/-Ade固体培养基上,验证pGBKT7-TaDi19A是否存在自激活。将5 µg的诱饵载体pGBKT7-TaDi19A质粒及5 µg的小麦cDNA文库质粒加入600 µL制备好的酵母感受态细胞中,再加入2.5 mL PEG/LiAc,混匀后30℃水浴45 min,期间每10 min颠倒混匀一次;再加入160 µL DMSO,混匀后42℃水浴20 min,每10 min颠倒混匀一次;200 r/min离心5 min弃上清,将菌体重悬于1 mL YPD液体培养基中,30℃震荡培养90 min;200 r/min离心5 min弃上清,将菌体重悬于0.9%的NaCl中,然后涂到SD/-Trp/-Leu/-His/-Ade固体培养基上,30℃倒置培养4 d左右;挑取直径大于2 mm的单克隆,重悬于0.9%的NaCl中,然后点涂到SD/-Trp/-Leu/-His/-Ade/X-gal显蓝板上避光培养,筛选蓝色阳性单克隆。
挑取筛选到的阳性菌落于1 mL YPDA液体培养基中,30℃,230 r/min振荡培养,待菌液摇混后进行PCR检测。PCR反应条件参照于太飞等[43]的方法。将插入片段大小在1 000 bp左右的酵母单克隆提取质粒并转化到大肠杆菌TOP10(天根,北京)中,测序,然后将测序结果在 NCBI 网站进行同源性BLAST分析。
2 结果
2.1 TaDi19A生物信息学分析
通过对低温处理的小麦转录组测序结果进行分析,获得一个锌指类转录因子TaDi19A。小麦TaDi19A全长747 bp,编码248个氨基酸,分子量为28.03 kD,等电点为4.74,基因含有4个外显子和3个内含子(图1-A);TaDi19A蛋白靠近N-端包含锌指结合结构域,C端为Di19结构域(图1-B),预测的TaDi19A蛋白三级结构包含2个α螺旋结构(图1-C),有助于折叠成正确的蛋白结构,从而行使其生物学功能;磷酸化位点分析结果显示TaDi19A含有12个丝氨酸、9个苏氨酸和3个酪氨酸磷酸化位点,推测磷酸化作用可能与TaDi19A蛋白的活性调控有关。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1TaDi19A的基因结构和蛋白结构
A:TaDi19A结构;B:TaDi19A蛋白保守结构;C:TaDi19A蛋白三级结构
-->Fig. 1Gene structure, protein structure of TaDi19A
A: Gene structure of TaDi19A; B: Conserved domains of TaDi19A protein; C: Tertiary structure of TaDi19A protein
-->
2.2 TaDi19A低温胁迫响应分析
为进一步研究TaDi19A对低温胁迫的响应,通过实时荧光定量PCR分析TaDi19A在低温处理不同时间段的表达模式。结果显示,在低温胁迫下,TaDi19A上调表达,在胁迫处理2 h时达到最大值,为对照的25倍,之后表达量迅速下降,处理后12 h后恢复到初始水平(图2)。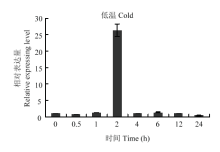 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2TaDi19A在低温胁迫下的表达模式
-->Fig. 2The expression pattern of TaDi19A under low temperature treatment
-->
2.3 转TaDi19A拟南芥植株的耐冷性鉴定
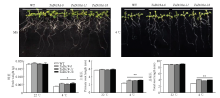
为进一步研究TaDi19A对低温胁迫的响应,通过获得的TaDi19A转基因拟南芥(图3)分析其在低温胁迫下的根长和耐冷性。在正常生长条件下,野生型拟南芥与3个转基因株系的主根长、总根长和鲜重均没有显著差异。而在4℃处理后,野生型和转基因拟南芥的生长都受到抑制,野生型拟南芥受抑制的程度要比转基因植株严重,转基因拟南芥的主根长、总根长和鲜重都显著高于野生型拟南芥(图4)。例如,在低温处理20 d后,野生型拟南芥的主根长平均为2.4 cm左右,而转基因拟南芥达到2.9 cm左右。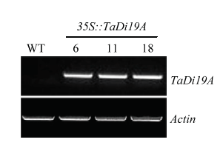 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3TaDi19A在野生型和转基因拟南芥中的表达
-->Fig. 3Gel electrophoresis detection of TaDi19A in the WT and 35S::TaDi19A lines.
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4低温处理下TaDi19A转基因拟南芥根长统计
*:P<0.05;**:P<0.01
-->Fig. 4The effect of low temperature on root length of TaDi19A transgenic seedlings
-->
为进一步检测野生型和转基因拟南芥的耐冷性,将植株种在土盆里于22℃生长4周,随后经4℃/3 h、-10℃/5 h和4℃/3 h低温处理,22℃/5 d恢复正常生长,发现大约60%野生型拟南芥存活,而大约90%的转基因植株存活,转基因植株的存活率明显高于野生型(图5)。无论是低温根长试验还是存活率都表明转基因植株的耐冷性强于野生型拟南芥,表明TaDi19A提高了转基因植株的耐冷性。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5TaDi19A转基因拟南芥耐冷性鉴定
*: P<0.05; **: P<0.01
-->Fig. 5Identification of cold tolerance in TaDi19A transgenic Arabidopsis
-->
2.4 冷胁迫相关基因在转TaDi19A植株中的表达
为研究TaDi19A耐低温胁迫应的机制,检测正常生长情况下转基因和野生型拟南芥植株中冷胁迫响应有关基因的表达。结果显示,正常生长条件下,除了CBL1在转基因拟南芥中的表达量比野生型高之外,CBL2、CBL3和KIN1的表达量在野生型和转基因拟南芥中没有显著差异;4℃处理后,CBL1、CBL2、CBL3和KIN1在野生型和转基因拟南芥中表达量都有显著提高,但在转基因植株的表达量明显高于野生型,如CBL1在转基因拟南芥中的表达量是野生型的2倍多(图6)。结果表明,TaDi19A能正向调控CBL1、CBL2、CBL3和KIN1的表达,并通过调控冷胁迫相关基因的表达提高转基因植株的耐冷性。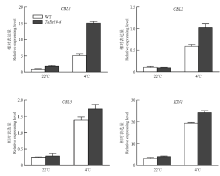 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6冷胁迫响应相关基因的表达分析
-->Fig.6Expression analyses of cold response genes in WT and TaDi19A transgenic plants under normal and 4℃ condition
-->
2.5 诱饵载体的构建及自激活检测
将TaDi19A编码区全长构建到pGBKT7诱饵载体上,用PCR技术进行菌液检测,琼脂糖电泳得到与目的片段大小相符的单一条带约750 bp,经测序和序列比对,提取正确的重组质粒pGBKT7-TaDi19A。为检测TaDi19A是否存在自激活活性,将pGBKT7-TaDi19A重组质粒转入酵母感受态细胞中,转化产物分别涂布于SD/-Trp、SD/-Trp/-His/-Ade的固体培养基上,30℃倒置培养3 d,结果只有在SD/-Trp培养基长出酵母菌落,而SD/-Trp/-His/-Ade平板上没有菌落长出(图7)。表明pGBKT7-TaDi19A成功转入酵母感受态细胞,且TaDi19A无自激活活性,可以用酵母双杂交系统筛选小麦cDNA文库。
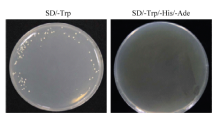 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7TaDi19A自激活验证
-->Fig. 7Auto-activity assays of TaDi19A
-->
2.6 小麦cDNA文库的筛选以及候选互作蛋白序列分析
为解析TaDi19A的抗性机理,利用酵母双杂交系统筛选其可能的互作候选蛋白。将诱饵载体pGBKT7- TaDi19A质粒与小麦cDNA文库质粒共转化酵母感受态细胞,转化后产物涂布于SD/-Trp/-Leu/-His/-Ade固体培养基上,30℃倒置培养4 d左右,挑取直径大于2 mm的单克隆,点涂于SD/-Trp/-Leu/-His/-Ade/X-gal显蓝板上培养,筛选蓝色阳性单克隆(图8)。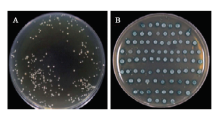 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8TaDi19A互作蛋白的筛选
A:筛库得到的克隆;B:SD/-Trp/-Leu/-His/-Ade/X-α-gal平板上鉴定的阳性克隆
-->Fig. 8Screening of TaDi19A-interacting proteins
A: Clones screened from cDNA library; B: The positive clones tested on SD/-Trp/-Leu/-His/-Ade/X-α-gal plates
-->
将显蓝的单克隆进行菌液PCR检测,结果表明不同克隆插入的片段大小不同,大部分集中在1 000 bp 左右(图9),大部分克隆扩增结果为1条带,但还有一些克隆扩增结果为2条带。将插入片段大小在1 000 bp左右的单克隆提质粒并转化到大肠杆菌TOP10(天根,北京)中,送达公司测序,然后将测序结果在NCBI网站进行同源性比对分析。通过序列比对分析结果(表1),发现筛选出的互作候选蛋白包括金属硫蛋白、PSBR蛋白、温度诱导的脂质运载蛋白、热激蛋白、低温诱导蛋白、核转运因子等,其中大多能够参与植物对逆境胁迫响应,还有的能介导细胞内代谢物质交换,还有一些编码功能未知蛋白。例如金属硫蛋白能够解除金属离子的毒害、维持细胞内环境的稳定、消除活性氧的危害,对植物抵御非生物胁迫有着重要作用[44];核转运因子能够协助运载物运进或运出细胞;温度诱导的脂质运载蛋白能够传递信号并调节植物抵御逆境[45];低温诱导蛋白和热激蛋白都能参与植物对逆境胁迫的响应等[46-48]。这些蛋白能参与植物的能量代谢以及对非生物胁迫的响应,对植物抵御逆境胁迫有着重要的作用。
Table 1
表1
表1候选基因的BLAST分析结果及其功能推测
Table 1BLAST analysis and predicted functions of candidate genes
| TaDi19A互作基因 The genes interacting with TaDi19A | GenBank登录号 GenBank accession No. | 功能 Function |
|---|---|---|
| 金属硫蛋白 Metallothionein-like protein | EMS61268.1 | 解除金属离子的毒害、维持内环境的稳定、消除活性氧 Remove metal ions poison, maintain the stability of internal environment and eliminate reactive oxygen species |
| 1,5-二磷酸核酮糖羧化酶/加氧酶小亚基 Rubisco small subunit | BAB19812.1 | 调控羧化反应催化效率和影响Rubisco对CO2/O2的底物特异性 Control carboxylation catalytic rate, impact the Rubisco substrate specificity for carbon/ oxygen |
| NADH脱氢酶 NADH dehydrogenase | EMS47720.1 | 催化电子从NADH传递给辅酶Q Catalyze electrons from NADH to coenzyme Q |
| PSBR蛋白 Photosystem II polypeptide | EMS68597.1 | 在光合系统Ⅱ的组装过程中发挥着重要作用 Small molecule protein in photosyntheticⅡsystem,important in the process of assembly |
| 温度诱导的脂质运载蛋白 Temperature stress-induced lipocalin | AAL75812.1 | 在植物抵御逆境时具有重要的调节作用和信号传递作用 Regulate plant response to stress, important in signal transduction |
| 核转运因子 Nuclear transport factor | XP_010235339.1 | 协助运载物运进或运出细胞 Impact in carrying objects into or out of the cell |
| 低温诱导蛋白 Low temperature induced protein | AAC96100.2 | 增强细胞抗冰冻脱水能力、保护酶行使正常功能、稳定细胞膜 Enhance the cellular anti-freeze dehydration, protect the action of normal function of enzymes, stability membrane |
| 热激蛋白 Heat shock protein | XP_003558274.1 | 分子伴侣功能、与逆境胁迫相关 Molecular chaperone, regulate plant response to stress |
新窗口打开
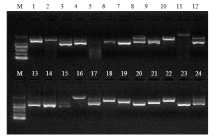 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9候选克隆的PCR检测
M:DL2000 Marker;1—24:酵母克隆
-->Fig.9PCR identification of candidate clones
M: DL2000 Marker; 1-24: Yeast clones
-->
3 讨论
干旱、盐碱、高温、低温等非生物胁迫因子严重影响植物的生长和发育。目前已经报道的参与逆境胁迫调控过程的蛋白主要分两类:一类是功能蛋白,主要参与逆境胁迫的直接调控,包括分子伴侣、离子通道蛋白等;另一类是调节蛋白,包括转录因子、蛋白激酶等信号分子[49]。其中转录因子能够与基因启动子区域中顺式作用元件特异性结合,是一大类转录调控因子。本研究从低温处理的小麦转录组测序结果中获得了一个转录因子基因TaDi19A。Di19蛋白编码一个小基因家族,包含保守的C2H2锌指结构域,属于锌指类转录因子,在植物的生长、发育和非生物胁迫响应中起着重要的作用[35-37]。拟南芥中Di19基因广泛的在不同组织中表达,包括幼苗、根、茎、花和果实中;AtDi19-1和AtDi19-3能够快速被干旱胁迫诱导,AtDi19-2和AtDi19-4在高盐的诱导下表达量增加,而AtDi19-7与光信号的调控有关,对非生物胁迫无响应[50-51]。拟南芥AtDi19-1能结合PR1、PR2、PR5启动子的TACA(A/G)T元件,增强其表达,过表达AtDi19-1能提高转基因拟南芥的抗旱性[35]。另外拟南芥Di19家族成员能够以Ca2+依赖的方式被CPK11和CPK3磷酸化[50]。qRT-PCR和芯片数据分析表明,水稻7个Di19家族成员能够大量在营养器官中表达,但在生殖器官中表达量很少,一些OsDi19能显著被非生物胁迫和外源激素诱导[37]。过表达OsDi19-4通过增强ROS的清除活性提高转基因水稻的抗旱性,并且转基因水稻对ABA高度敏感,OsDi19-4敲除表现出对ABA敏感性降低[37,39]。OsCDPK14与OsDi19-4互作并磷酸化,ABA处理后OsDi19-4的磷酸化作用增强,提高了OsDi19-4调控下游ABA相关基因的能力[39]。大豆中共鉴定出了7个Di19基因,每个Di19基因对盐、干旱、氧化、ABA胁迫有着特定的响应。GmDi19-5在非生物胁迫中起着负调的作用,过表达GmDi19-5提高了转基因拟南芥对盐、干旱、氧化和ABA胁迫的敏感性;GmDi19-5与GmLEA3.1互作,通过调控胁迫相关基因的表达参与ABA和SOS信号通路[38]。小麦TaDi19A在植物对非生物胁迫的响应中起着重要作用,过表达TaDi19A提高了拟南芥在萌发期对盐、ABA和甘露醇的敏感性,过表达TaDi19A降低了拟南芥在苗期对盐胁迫的耐受性和对乙烯的敏感性[40]。FAN等[52]发现TaDi19能被多种胁迫诱导,过表达TaDi19提高了转基因拟南芥的耐盐性。这些研究都表明Di19在植物非生物胁迫响应中起着重要的作用。
本研究从低温处理的小麦转录组测序结果中获得了TaDi19A。实时荧光定量PCR结果表明TaDi19A受低温诱导;低温处理的根长试验,转基因和野生型拟南芥的耐冷性鉴定(图4和图5)都表明过表达TaDi19A能提高转基因植株的耐冷性。为研究TaDi19A耐冷胁迫响应机制,通过检测正常和低温处理情况下转基因和野生型拟南芥中冷胁迫响应相关基因的表达,表明TaDi19A能正向调控CBL1、CBL2、CBL3和KIN1的表达,说明TaDi19A可能通过调控冷胁迫相关基因的表达提高转基因植株的耐冷性。为进一步研究TaDi19A调控植物冷胁迫响应的作用机制,本研究通过酵母双杂交技术筛选到一些可能与TaDi19A互作的候选蛋白,其中括金属硫蛋白、PSBR蛋白、温度诱导的脂质运载蛋白、热激蛋白、低温诱导蛋白、核转运因子等,其中大多能够参与植物对逆境胁迫响应,比如热激蛋白。热激蛋白广泛分布于真菌、动物和植物细胞中,研究发现,热激蛋白在高温、低温、干旱、过氧化等逆境下均能大量表达,通过作为分子伴侣促进其他蛋白合成、折叠、稳定、运输和降解等来维持植物内环境的稳定,在植物抵御逆境及适应环境中发挥重要作用[53-54]。据报道,HSP90、HSP70家族和一些小的HSPs能在低温响应中积累,通过保护细胞膜、蛋白质的重新折叠等抵御低温胁迫[53]。当植物遭遇低温胁迫时,TaDi9A表达量上升,热激蛋白积累量增多,植物抵御低温能力增强,TaDi9A可能通过与热激蛋白相互作用提高转基因拟南芥的耐冷性。
另外,有研究表明温度诱导的脂质运载蛋白涉及非生物胁迫响应[55-57]。温度诱导的脂质运载蛋白是一种膜蛋白,在低温胁迫下大量积累[57]。拟南芥中TIL1缺失突变体对光和冷敏感,与野生型相比,过氧化氢和活性氧的积累增多;而过表达TIL1植株对冷和强光胁迫的耐受性增强[58]。小麦和苜蓿TIL1都响应低温胁迫,转MfTIL1烟草通过促进活性氧的清除和调控下游耐冷相关基因的表达提高转基因植株的耐冷性[56-57]。本研究通过酵母双杂交技术筛选出的脂质运载蛋白、热激蛋白、低温诱导蛋白等都是和温度胁迫相关的蛋白,它们可能通过与TaDi9A相互作用共同调控植物对低温胁迫的响应,这可能部分解释了TaDi19A转基因拟南芥的耐冷性提高。
4 结论
小麦TaDi19A受低温胁迫诱导表达,TaDi19A过表达提高了转基因拟南芥的耐冷性;TaDi19A可能通过与其他蛋白相互作用参与植物对低温的响应过程。The authors have declared that no competing interests exist.
