0 引言
【研究意义】苏云金芽孢杆菌(Bacillus thuringiensis,Bt)可在其生命周期中产生一种专一性极强的晶体毒素(crystal toxin,Cry toxin),导致昆虫肠道细胞溶解或引发细胞凋亡程序,从而杀死昆虫[1-3]。Cry1Ac毒素作为应用最为广泛的一类微生物杀虫蛋白,在防治大量田间害虫中已取得巨大成效[4-5]。然而,Cry毒素的抗药性问题已成为世界级难题,尤其是小菜蛾(Plutella xyllostella)被认为是田间抗药性最严重和最难防治的世界性害虫之一[6-8]。目前认为受体的变异或缺失导致毒素结合能力的改变是抗性产生的最主要原因[9-11]。因此研究毒素-受体结合模式对改善抗性问题显得尤为重要,分子模拟正是针对这一问题而提出的理性解决方法[12-13]。【前人研究进展】碱性磷酸酯酶(alkaline phosphatase,ALP)作为Cry毒素在害虫体内的靶标受体之一[1-3],已有很多研究显示ALP受体与害虫抗性密切相关。JURAT-FUENTES等[14]比较分析了敏感性和抗性烟芽夜蛾(Heliothis virescens)幼虫中ALP与Cry1Ac的结合特征,推测ALP为使其产生抗性的重要因素;JURAT-FUENTES等[15]利用逆转录定量PCR(qRT-PCR)发现多种鳞翅目靶标昆虫中肠膜结合碱性磷酸酯酶(membrane- bound alkaline phosphatase,mALP)的表达量下调是导致其产生抗性的重要因素;CHEN等[16]报道了敏感性和抗性棉铃虫ALP受体上影响与Cry毒素结合区域(toxin-binding region,TBR),首次发现棉铃虫ALP受体TBR区域对Cry毒素活性发挥的作用。小菜蛾是田间最早报道对Cry1Ac毒素产生抗性的昆虫,因而其抗性问题也一直是本领域的研究热点[17-19]。YANG等[20]分别对敏感性和抗性小菜蛾的碱性磷酸酯酶以及其他潜在受体分别进行表达和生物学研究,为小菜蛾抗性治理提供了指导;刘洁等[21]克隆小菜蛾抗性、敏感种群中的部分碱性磷酸酶基因,通过与敏感种群相比发现抗性种群中该基因片段发生基因突变,该结果对于进一步研究小菜蛾全基因结构、功能有重要意义;近期GUO等[22]报道并证实了小菜蛾mALP可被MAPK(丝裂原活化蛋白激酶)信号途径反式调控从而导致小菜蛾对Cry毒素的高抗性。在众多研究毒素-受体结合模式的方法中,利用分子模拟(同源建模和分子对接)研究,在已知毒素和受体可以发生结合的情况下,正确预测复合物的结合模式是一种极为有效的途径[23-24],SHAN等[25]利用同源建模构建了棉铃虫的ALP三维模型并通过生物信息学在线网站对ALP受体功能进行了理论研究。 【本研究切入点】利用分子模拟研究Cry1Ac和小菜蛾mALP的结合模式还未见报道。【拟解决的关键问题】原核表达具有Cry1Ac毒素结合活性的mALP受体,用于体外进行与毒素模拟物的结合分析,并利用分子模拟研究毒素和受体互作模式以及参与互作的关键氨基酸位点,进一步了解Cry毒素与mALP的互作机制,为利用分子改造提升Cry毒素与受体结合能力以增强Cry毒素活性的研究提供新的研究思路和技术途径。1 材料与方法
试验于2015年12月至2016年7月在江苏省农业科学院食品质量安全与检测研究所完成。1.1 材料
1.1.1 供试昆虫、表达载体及菌株 小菜蛾( 4龄幼虫)由笔者实验室于室内饲养多年,期间未施任何杀虫剂;表达载体pET-26b(+)购于Novagen公司;E. coli Trans1-T1、E. coli BL21(DE3)感受态细胞购自北京全式金生物技术有限公司。1.1.2 试验试剂 Trizol和Super script III反转录试剂盒购自Invitrogen公司;Fast Pfu DNA聚合酶购自近岸蛋白质科技有限公司;卡那霉素和IPTG购自Sigma公司;PCR纯化试剂盒购自Promega公司;胶回收试剂和质粒提取试剂盒购自Axygen公司;Nco I、Not I内切酶、T4 DNA连接酶购自美国NEB公司;HRP标记Anti His-Tag鼠单抗、HRP-羊抗兔IgG购自GE Healthcare公司;蛋白Marker购自Thermo公司;增强型HRP-DAB底物显色试剂盒购自天根生化科技(北京)有限公司;PVDF膜购自BIOSHRP;其他试剂均为分析纯级试剂。
1.2 方法
1.2.1 小菜蛾mALP基因扩增 将小菜蛾4龄幼虫置冰上冷冻,从其尾部拉取中肠,用0.5%的生理盐水清洗干净,放入匀浆器中,利用Trizol法提取总RNA,用反转录试剂盒将RNA反转录为cDNA第一链(按说明书方法)。根据GenBank公布的小菜蛾mALP基因序列(登录号:GenBank KC841472.2)设计全长引物。上游引物mALP-F:5′-CATGCCATGGCCTCTC GCGTGGCGCGCCAGGTATC-3′(下划线为Nco I酶切位点,CATG:保护碱基,CC:防止移码所加碱基);下游引物mALP-R: 5′-AATGCGGCCGCTAATAAGC GTCTCAGATACG-3′(下划线为Not I酶切位点,AAT:保护碱基)。PCR扩增条件:95℃预变性2 min;94℃变性30 s,57℃退火30 s,72℃延伸1 min,共30个循环;最后72℃终延伸10 min,4℃保存。扩增产物经1.0%琼脂糖凝胶电泳后,PCR产物纯化试剂盒纯化目的片段。1.2.2 重组质粒pET-26b-mALP的构建及鉴定 纯化后的mALP基因片段和提取的pET-26b表达载体,同时进行NcoⅠ和 NotⅠ限制性内切酶酶切,纯化回收酶切产物,经T4连接酶连接过夜,次日转化至Trans1- T1感受态细胞并涂布于含50 µg·mL-1卡那霉素的LB平板上进行阳性转化子筛选,挑取阳性克隆过夜培养后提取质粒进行PCR鉴定、双酶切鉴定及序列测定(由上海生工生物工程公司完成),并将测序结果提交至GenBank进行序列同源性比对。
1.2.3 pET-26b-mALP在E. coli BL21(DE3)中的诱导表达和Ligand blot试验鉴定 将pET-26b-mALP重组质粒转化至E. coli BL21(DE3)。挑取阳性克隆,经测序及双酶切验证后接种于含50 µg·mL-1卡那霉素的LB培养基中过夜培养,以pET-26b空载作为对照。次日按1%比例转接于含0.5%葡萄糖和50 µg·mL-1卡那霉素的LB培养基中,37℃,250 r/min振荡培养至OD600约为0.6—0.8,加入终浓度为0.5 mmol·L-1 IPTG,25℃诱导表达16 h,过夜诱导表达产物与变性上样缓冲液混匀煮沸后经SDS-PAGE电泳分离后,用湿转法将蛋白转移至PVDF膜上,5% MPBS(含5%脱脂奶粉的PBS)室温封闭过夜,用PBST(含0.5%吐温-20的PBS)洗膜3次每次10 min,加入HRP标记的Anti His-Tag鼠单抗(1﹕3 000)作为二抗,室温孵育2 h后洗膜,用增强型HRP-DAB底物显色试剂盒显色,检测目的蛋白的表达。Ligand blot前期步骤均与Western blot一致,并增加pET26b空载诱导产物对照和mALP转膜后不与Cry毒素孵育对照,排除非特异性和假阳性。过夜封闭洗膜后,加入Cry1Ac毒素孵育2 h后洗膜,加入亲和纯化后的兔抗Cry1Ac多抗(笔者实验室自己制备)孵育2 h后洗膜,加入HRP-羊抗兔IgG(1﹕3 000)孵育2 h后洗膜,增强型HRP-DAB底物显色试剂盒显色,检测目的蛋白是否具有与Cry1Ac毒素结合能力。
1.2.4 小菜蛾mALP同源建模及模型评价 将本研究获得的mALP基因翻译后的氨基酸序列作为目标蛋白,用BLAST中的blastp suite对PDB蛋白结构数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)分别进行多序列同源性搜索,取同源性最高的晶体结构(PDB ID:1K7H)作为同源建模模板,同步将蛋白序列提交至I-TASSER进行建模。Cry1Ac在PDB数据库中已有晶体结构(PDB ID:4ARY),可直接下载其pdb文件。利用Swiss-Model(http://swissmodel. expasy.org/)和I-TASSER(http://zhanglab.ccmb.med.umich.edu/I- TASSER/),分别预测mALP的三维结构。将模型能量最小化后,采用OpenMM Zephyr程序对其进行分子动力学模拟。最终将获得的模型结构采用生物信息学在线网站http://services.mbi.ucla.edu/SAVES/中的PROCHECK、ERRAT以及Verify3D模块进行评估,检测其合理性,比较分析后选取最佳mALP三维模型进行后续研究。
1.2.5 小菜蛾mALP与Cry1Ac分子对接 将Cry1Ac和mALP的pdb文件利用PatchDOCK对接程序分析(http://bioinfo3d.cs.tau.ac.il/PatchDock/),得到200个对接复合物,进一步利用其FireDock的refine模块,获得综合打分排序的复合物,同样进行能量最小化和分子动力学模拟验证。验证后的对接复合物进行ASA计算,分析毒素和受体参与结合的区域;并进一步通过Ligplot分析毒素和受体结合区域中参与互作的氨基酸位点。
1.2.6 关键氨基酸位点预测 利用DrugscorePPI在线服务(http://cpclab.uni-duesseldorf.de/dsppi/main.php),提交毒素-受体对接复合物pdb文件,基于丙氨酸扫描突变,计算出突变前后结合自由能的变化值,当结合自由能的变化值>2 kJ·mol-1时被认为是关键氨基酸位点,通过计算分别预测出毒素和受体参与结合的关键氨基酸位点。
2 结果
2.1 小菜蛾mALP基因扩增
提取小菜蛾4龄幼虫中肠总RNA,利用反转录试剂盒成功制备cDNA。通过针对mALP全长设计的引物,PCR扩增获得了大小约为1 655 bp的条带,与预期大小一致(图1)。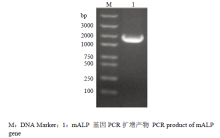 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1小菜蛾mALP基因的扩增
-->Fig. 1mALP gene amplification of P. xyllostella
-->
2.2 重组质粒pET-26b-mALP的构建及鉴定
将纯化后的PCR产物连接至pET-26b载体中,经PCR验证条带大小与预期大小一致(约1 700 bp)(图2-A),经NcoⅠ和NotⅠ酶切得到mALP片段(图2-B),并对其序列进行测定。序列分析结果表明该小菜蛾mALP基因编码区序列为1 632 bp,编码567个氨基酸,理论预测分子量约为62 kD。 经NCBI网站Blastp搜索比对后发现与已公布的小菜蛾mALP序列一致性为99%(仅有6个氨基酸存在差异)(图2-C)。说明pET-26b-mALP载体构建成功。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2pET-26b-mALP重组质粒PCR(A)、双酶切验证(B)、mALP序列比对(C)
-->Fig. 2PCR amplification by pET-26b-mALP recombinant plasmid (A) , restricted double-enzyme digestion (B), and amino acid sequence alignment of mALP (C)
-->
2.3 pET-26b-mALP在BL21中的诱导表达和Ligand blot鉴定
将鉴定无误的阳性克隆在25℃,转速220 r/min,终浓度为0.5 mmol·L-1 IPTG条件下,诱导培养16 h进行表达。经SDS-PAGE电泳发现,全菌液在预期大小处出现明显的特异性蛋白条带(62 kD)并经Western blot证实了成功表达出小菜蛾mALP蛋白(图3-A、3-B),Ligand blot试验则进一步证实了通过原核表达的mALP具有与Cry1Ac体外结合的能力(图3-C)。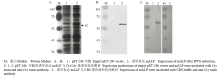 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3mALP蛋白表达的SDS-PAGE分析(A)、Western blot(B)和Ligand blot(C)验证
-->Fig. 3SDS-PAGE (A), Western blot (B) analysis of the mALP expression and Ligand blot (C) analysis of the binding capacity between mALP and Cry1Ac toxin
-->
2.4 小菜蛾mALP同源建模及模型评价
通过SWISS-MODEL和I-TASSER,分别构建了mALP的三维结构模型、能量最小化和分子动力学模拟后,利用在线模型评价方法对其三维结构进行评价比较分析,结果发现I-TASSER方法构建的mALP三维结构最佳(图4-A)。mALP的三维结构以及与模板的RMSD值为0.24(图4-B);经分子动力学模拟,模型构像趋于稳定后(图4-C)进行模型评价,结果表明构建的模型各项参数指标(表1)均显示模型是合理可信的,可用于后续分子对接试验。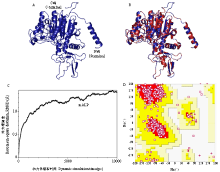 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4mALP三维结构(A)、与模板(红色)结构比对(B)、分子动力学模拟-RMSD值(C)及拉氏图分析(D)
-->Fig. 4Three-dimensional structures of mALP (A), structure alignment between mALP and its template (red) (B), molecular dynamic-RMSD value of mALP (C) and Ranmachandan plot of mALP (D)
-->
Table 1
表1
表1模型评价
Table 1Evaluation of model structures
| 模型 Model | 拉氏图 Ranmachandan plot (%) | Verified 3D score | |||
|---|---|---|---|---|---|
| 允许区 Allowed | 大致允许区 General | 不允许区Disallowed | 残基得分>0.2 (residues>0.2, %) | Errat score | |
| mALP | 96.7 | 1.9 | 1.4 | 89.38 | 83.45 |
新窗口打开
2.5 小菜蛾mALP与Cry1Ac分子对接
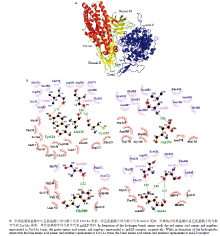
利用PatchDOCK对接程序分析,得到200个对接复合物,进一步利用其FireDock的refine模块,获得综合打分排序的复合物,同样经过能量最小化和分子动力学模拟,最终确定最佳的对接复合物(图5-A)。通过溶剂可及表面积变化值(solvent accessible surface areas,ASA)计算分析发现Cry1Ac毒素Domain II和Domain III的ASA值分别为823 Å2和622 Å2,对结合受体的贡献相对最重要,其中Loop环2的ASA值为586 Å2,受体中参与结合的氨基酸总的ASA变化值为1186 Å2(表2)。进一步利用Ligplot分析发现毒素和受体分别都有6个氨基酸残基参与互作,并且都有大量的氨基酸残基以疏水形式参与结合(图5-B)。Table 2
表2
表2溶剂可及表面积变化值计算
Table 2Calculation of the change solvent accessible surface areas (ASA, Å2)
| Cry毒素 Cry1Ac toxin | mALP 受体 mALP receptor | |
|---|---|---|
| 总ASA Total ASA (Å2) | 1669Å2 | 1186 Å2 |
| 结构域2 Domain II | 823 Å2 (49.3%) | |
| 径环2 Loop 2 | 586 Å2 (35.1%) | |
| 径环3 Loop 3 | 237 Å2 (14.2%) | |
| 结构域3 Domain III | 622 Å2 (37.3%) | |
| 其他区域 Other region | 224 Å2 (13.4%) |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5mALP与Cry1Ac分子对接复合物(A)和氢键及疏水性分析(B)
-->Fig. 5Determination of the docking complex of Cry1Ac toxin-mALP receptor (A) and analysis of hydrogen bonds and hydrophobic interactions (B)
-->
2.6 关键氨基酸位点预测
经过DrugscorePPI计算预测对接复合物结合区域中主要参与结合的各残基结合自由能变化值,结果如图6-A所示,毒素和受体结合位点中分别有3个氨基酸残基(376ASN、443SER和486SER)和4个氨基酸残基(452ARG、499THR、502TYR和513TYR)为参与互作的关键氨基酸位点(结合自由能的变化值>2 kJ·mol-1);这些关键氨基酸位点的分布情况如图6-B所示。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6mALP与Cry1Ac分子对接复合物中关键氨基酸位点预测
-->Fig. 6Prediction of the key amino acids involved in the molecular docking complex of Cry toxin and mALP receptor
-->
3 讨论
目前,利用真核表达体系(杆状病毒-昆虫细胞)已成功表达了大量具Bt Cry毒素结合活性的各类受体[26-28],其中ALP主要依靠真核表达的糖基化位点并利用糖基锚定(GPI-anchored)位点导致细胞穿孔[29]。而原核表达(大肠杆菌)作为应用最为广泛和成功的系统,也被研究者们应用于Cry毒素受体的表达和功能活性鉴定[30-31],CHEN等利用pET系统成功表达并鉴定了烟芽夜蛾和棉铃虫的ALP具有和Cry毒素结合的能力[16,32]。本研究将小菜蛾mALP基因克隆至pET-26b载体进行原核表达和配体印迹试验,证实了经原核表达的mALP同样具有与Cry1Ac毒素体外结合的能力。在原核表达试验中,分别优化了IPTG浓度、诱导温度、转速和诱导时间,但在所有优化的条件下,发现mALP均会形成一定量的包涵体,且经尿素溶解蛋白变性后的mALP在配体印迹试验中同样具有Cry毒素结合活性(结果未显示),说明mALP参与毒素结合的关键氨基酸表位极有可能是线性表位而非空间构象,这与FERNANDEZ等[33]通过分段表达埃及伊蚊(Aedes aegypti)ALP受体蛋白区域与Cry11Aa毒素在变形条件下进行配体印记试验发现ALP具有两个结合表位区域相一致。通过比较Cry毒素和靶标昆虫潜在受体(敏感性和抗性)在结合模式下参与互作氨基酸的变化,对了解毒素-受体作用的分子机理和利用蛋白质工程方法提高Cry毒素杀虫效果具有重要意义[34-35]。但由于Cry毒素种类繁多以及其在不同昆虫中的潜在受体不断被发现且分子量普遍偏大,而目前在蛋白质数据库(protein data bank,PDB)中仅有十几种Cry毒素晶体结构和双翅目昆虫疟蚊的氨基肽酶受体APN晶体结构被解析[36-37]。所以利用同源建模和分子对接可为研究毒素-受体结合模式提供强有力的支撑[38-39]。虽然配体印迹试验是在受体蛋白变形条件下进行的,但结果证实了ALP结合Cry毒素是不依赖其空间构象的,在非变性条件下同样具备和Cry毒素结合的能力[29],所以可以利用预测的小菜蛾ALP三维结构与Cry毒素进行分子模拟研究。利用Swiss-Model和I-TASSER分别进行了mALP的三维建模,经过能量最小化和分子动力学分析,以及模型评价分析,最终确定了I-TASSER构建的mALP三维模型最佳,可一步通过分子对接分析其结合表位特征。
通过PatchDOCK和FireDock程序以及分子动力学模拟方法,对Cry1Ac-mALP进行分子对接和对接复合物评价,获得参数最优的对接复合物,经溶剂可及表面积变化和Ligplot氢键及疏水性分析,发现Cry1Ac毒素的结构域II和结构域III均参与受体结合,结构域II中的Loop2和Loop3区域对受体结合的贡献相对更大;Loop3区域中有2个氨基酸残基与受体形成氢键,而Loop2区域中有多达7个氨基酸与受体可形成疏水结合作用,这对形成稳定和牢靠的复合物至关重要,且与目前报道的Cry毒素Loop2区域主要参与结合ALP的研究相一致[40-41]。mALP有6个氨基酸与毒素形成氢键结合,更多的氨基酸则是通过疏水作用与受体结合。经过计算机辅助丙氨酸突变扫描,预测了毒素和受体中参与互作的关键氨基酸残基-“热点”(Hot-Spots),它们对蛋白质间的结合自由能(∆GBind)有着显著的贡献,是毒素与受体相互作用主要依赖的少数几个氨基酸残基[42]。本研究中预测出的这些热点残基可以在接下来的试验中进一步通过生物分子互作试验(例如Biacore)验证,并且mALP的热点残基对于今后认知和定位受体的毒素结合区域以及在比较敏感型和抗性昆虫受体氨基酸变异上有很大帮助,同时Cry毒素中的热点残基也是今后利用现代分子生物学手段改造毒素用于提高毒素活力和改善抗性的首要选择。
4 结论
利用原核表达系统,成功制备了能够结合Cry1Ac毒素的小菜蛾mALP;预测出小菜蛾mALP的三维结构及与毒素的结合模式,并在此基础上通过计算机辅助丙氨酸突变扫描获得毒素-受体结合的关键氨基酸位点,为进一步阐明Cry毒素与mALP的互作机制及分子改造增强Cry毒素活性的研究打下基础。(责任编辑 岳梅)
