0 引言
【研究意义】鞘脂质是生物膜的重要成分,它可维持细胞膜的流动性并稳定细胞结构[1]。鞘氨醇-1-磷酸(sphingosine 1 phosphate,S1P)是一类具有生物功能的鞘脂质,其在细胞死亡途径(凋亡、坏死、自噬)、癌细胞增生、迁移、炎症和抗药性中都发挥重要作用[2]。S1P的合成需要一个关键的鞘脂质代谢酶——鞘氨醇激酶(sphingosine kinase,SK)参与。虽有研究表明SK可参与细胞抗药性、病毒传播与复制[3-4],但SK的相关研究均在人体细胞或哺乳动物中进行,昆虫中还未见报道。以重要水稻害虫灰飞虱(Laodelphax striatellus Fallén)为研究对象,探究SK在携带水稻条纹病毒(Rice stripe virus,RSV)种群和健康种群灰飞虱不同发育时期和不同组织的表达特征,及杀虫剂胁迫后LsSK表达水平的变化,对后续深入研究SK与灰飞虱RSV病毒传播的关系以及开发灰飞虱的新型防治技术具有重要意义。【前人研究进展】SK/S1P信号途径可保护癌症细胞免除药物引发的细胞死亡,表明SK和S1P可调控细胞抗药性。在PC3癌症细胞中,上调SK含量可增加细胞对喜树碱的抗性,而抑制SK表达导致细胞对该药物敏感[5]。大量研究表明,在慢性白细胞病CML细胞中过表达SK后,神经酰胺/S1P的动态平衡改变,使得S1P含量增加,从而诱导细胞对药物产生抗性[6]。SCHNITZER等[4]也阐述了SK在A549肺癌细胞中的抗药作用。A549细胞在低氧条件下可诱导SK表达,从而导致S1P分泌,激活MAPK代谢途径,诱导细胞抗凋亡。在HCT116癌细胞中,SK也表现出对丁酸钠诱导的凋亡产生抗性[7]。此外,SK和S1P也参与病毒的传播和复制。在人体感染巨细胞病毒(cytomegalovirus)和上呼吸道合胞体病毒(respiratory syncytial virus)后,SK酶活显著提升,且过表达SK可增强人流感病毒(influenza virus)的传播[3]。相反,在感染牛病毒性腹泻病毒(bovine viral diarrhea virus)和登革热病毒(dengue virus)后,该酶的活性反而下降[8]。MONICK等[9]研究表明,细胞感染上呼吸道合胞体病毒后,SK含量上升,胞外信号调节激酶(extracellular signal-related kinase,ERK)和蛋白激酶(Akt)两条途径被激活,使得细胞存活时间和存活率都显著增加。SK与病毒传播间的关系在人体及哺乳动物细胞中已有大量研究,但在昆虫及其病毒传播体系中关于SK的研究还很缺乏。灰飞虱是东亚重要水稻害虫之一,也是RSV及小麦、玉米多种禾谷类作物病毒病的重要传播媒介[10-12],且其传毒对水稻的危害远大于直接刺吸造成的危害[12]。目前防治灰飞虱的主要方法是喷施化学杀虫剂[13-14],但化学杀虫剂的不合理使用,造成灰飞虱对常用的杀虫剂均产生了不同程度的抗性。尽管已有大量研究报道了灰飞虱的化学杀虫剂抗药性机制[15],但鞘脂类代谢与杀虫剂抗性之间的关系却未有涉及。参考SK与人体细胞抗药性的相关研究,SK不仅可以通过控制S1P含量而影响细胞程序性死亡,还能影响与S1P受体相关的钠离子通道等信号途径[16-17],因此SK可能影响昆虫对杀虫剂的敏感性。而且,根据ZHOU等[18]研究,杀虫剂处理灰飞虱若虫后,SK的上游代谢酶中性神经酰胺酶的活性显著升高。【本研究切入点】目前,有关SK生物特性及其与病毒传播、抗药性关系的研究均在人体或哺乳动物细胞中进行,而昆虫SK的相关研究却尚未有报道。【拟解决的关键问题】对灰飞虱鞘氨醇激酶LsSK进行克隆和序列分析,利用qRT-PCR技术确定该基因在带毒和健康种群灰飞虱的时空表达特征,以及不同杀虫剂处理后LsSK表达水平的变化,通过RNA干扰技术沉默带毒种群和健康种群灰飞虱的该基因后,观察两个灰飞虱种群在杀虫剂处理后死亡率变化,进一步探索LsSK功能。1 材料与方法
试验于2015年6月至2016年3月在浙江大学昆虫科学研究所完成。1.1 供试材料
带毒种群和健康种群灰飞虱由江苏省农业科学院植物保护研究所周益军教授实验室提供,带毒种群置于烧杯中小范围饲养。带毒种群与健康种群的培养条件均为温度26℃,相对湿度70%,光周期L﹕D=16 h﹕8 h,所用水稻为秀水品系。带毒灰飞虱种群扩张后,设计针对RSV特有基因——coat protein(CP)的引物,用反转录PCR法检测,确定健康种群灰飞虱不带毒。定期检测带毒群带毒率,通过纯化带毒种群[19],维持带毒率在90%左右。1.2 RNA提取与第一链cDNA合成
取5头灰飞虱成虫,参照trizol(Invitrogen,USA)说明书提取总RNA,使用NanoDrop 2000微量分光光度计测定RNA质量与浓度。以1 μg总RNA为模板,根据反转录试剂盒说明书(PrimeScript RT reagent Kit with gDNA Eraser,TaKaRa)合成第一链cDNA。1.3 基因克隆
以模式昆虫SK基因为模板,搜索此前公开的灰飞虱转录组数据[20],获得一条LsSK基因序列,并设计引物克隆验证。所用引物均用Primer Premier 5.0设计(表1)。以1.2中的第一链cDNA为模板参照ExTaq 酶(TaKaRa)说明书进行PCR扩增,扩增产物经琼脂糖凝胶电泳后,回收纯化并测序验证。Table 1
表1
表1本试验所用引物
Table 1Primers used in this study
| 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) |
|---|---|
| LsSK-F | TTCAGACTTCATCTCACGTCTTT |
| LsSK-R | ACGTTCTCAAGCCAATGAGG |
| RSV-CP-F | CTAGTCATCTGCACCTTCTG |
| RSV-CP-F | ATGGGTACCAACAAGCCAGC |
| dsRNA-LsSK-F | TAATACGACTCACTATAGGGAGAACGTTACACGTCACGCTCAA |
| dsRNA-LsSK-R | TAATACGACTCACTATAGGGAGACGGAATTCTCACAAACGACA |
| dsRNA-GFP-F | TAATACGACTCACTATAGGGGGCGAAGTTCAGCGTGTCCG |
| dsRNA-GFP-R | TAATACGACTCACTATAGGGGGCGCACCTTGATGCCGTTC |
| qRT-PCR Actin-F | CCGCCTCCTCCAGTTCAC |
| qRT-PCR Actin-R | TGTCCAC GTCGCACTTCAT |
| qRT-PCR LsSK-F | CTTGTGGGTCAGGAAATGGT |
| qRT-PCR LsSK-R | GGTTTGAACACGGACCAAAT |
新窗口打开
1.4 杀虫剂处理
将吡虫啉(imidacloprid)、噻嗪酮(buprofezin)和溴氰菊酯(deltamethrin)3种杀虫剂(浙江新农化工有限公司,纯度均≥95%)用丙酮配制成储存液,逐级稀释成5个浓度后点滴灰飞虱4龄若虫。参见半致死浓度(LC50)计算方法[21],计算得出吡虫啉LC50为6.5 ng·μL-1,噻嗪酮为500 ng·μL-1,溴氰菊酯为37.5 ng·μL-1。用手动微量点滴仪(Hamilton)将0.1 μL的3种杀虫剂点滴于灰飞虱4龄若虫中胸背板,每种杀虫剂点滴50头,试验设3个生物学重复。24 h后观察死亡情况并统计死亡率。收集带毒种群与健康种群灰飞虱4龄若虫各300头,CO2麻醉(约30 s)后,用半致死剂量(LD50)的3种杀虫剂处理,每头试虫剂量为0.1 μL。分别于处理后1、4、8、12、24和48 h随机选择带毒试虫与健康试虫各10头,提取总RNA,用于检测LsSK表达水平的变化。试验设3个生物学重复。1.5 荧光定量PCR
使用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术检测LsSK的相对表达水平。供试样本包括带毒和健康灰飞虱的1—5龄若虫和雌雄成虫,以及雌雄成虫的不同组织(头部、唾液腺、中肠、马氏管、精巢和卵巢)。参照qRT-PCR试剂盒(TransStart Top Green qPCR SuperMix,北京全式金生物技术有限公司)说明书设置反应体系:10 ng模板cDNA,10 μL 2×TransStart Tip Green qPCR SuperMix,上下游引物各0.4 μL,用无核酸酶的水将反应体系补足至20 μL。反应条件:94℃,30 s,1个循环;94℃,5 s,60℃,30 s,40个循环。试验设3个生物学重复,内参基因为actin。所用引物见表1。1.6 RNA干扰
设计一对基因特异性引物(引物5′端添加T7 RNA聚合酶的启动子序列,表1),以1.2中的第一链cDNA为模板,进行PCR扩增,产物回收后,作为合成双链RNA(dsRNA)的模板。参考XU等[22]的步骤,使用MEGAscript T7 High Yield Transcription Kit试剂盒(Ambion,USA)合成dsRNA。将合成的dsRNA稀释至2 mg·mL-1后,置于-80℃存储待用。RNA干扰试验所用仪器为TransferMan NK2显微操作系统,试虫为蜕皮48 h的3龄若虫,注射部位为前胸与中胸之间,注射量为每试虫200 ng[23]。采用注射绿色荧光蛋白(GFP)dsRNA的试虫作为对照。将注射后的试虫置于人工气候培养箱中培养,为了确定dsRNA注射后的基因干扰水平,选取SK dsRNA(简写为dsSK)和对照组GFP dsRNA(简写为dsGFP)注射48 h后的试虫各5头用于检测干扰效率。试验设3个生物学重复。为避免注射引起机械损伤而导致的死亡,将试虫在注射试验后恢复48 h,再以半致死浓度的3种杀虫剂处理存活的试虫,点滴量为0.1 μL。杀虫剂处理24 h后,记录带毒种群与健康种群灰飞虱的死亡率。每种杀虫剂处理均设3次生物学重复,每重复试虫为90头。1.7 数据分析
LsSK氨基酸序列采用Clustal Omega在线序列比对;使用MEGA6软件以邻近法(neighbor-joining,NJ)构建进化树。荧光定量结果用2-ΔΔCt法分析[24],再使用DPS数据处理系统(Data Processing System,V9.5版)的一般线性模型(general linear model),用双因素或多因素方差分析(ANOVA)和最小显著差异法(LSD)比较不同处理组平均值间的差异[21];因灰飞虱死亡率的原始数据变化幅度在38%—90%,故先进行反正弦平方根(arcsine square root)转换。2 结果
2.1 LsSK序列分析
通过搜索灰飞虱转录组数据库,获得一条编码SK的cDNA片段,长度为1 282 bp,该序列经PCR扩增和测序得以验证,登录号为KT989975。Blast结果表明灰飞虱与点蜂缘蝽(Riptortus pedestris)、内华达古白蚁(Zootermopsis nevadensis)的SK氨基酸序列一致性分别为63%和62%。以模式昆虫黑腹果蝇(Drosophila melanogaster)的SK氨基酸序列为模板在灰飞虱转录组中搜索,确定灰飞虱在mRNA水平上不存在其他SK同源基因,说明SK在灰飞虱体内只有一种转录形式。为分析LsSK的蛋白质特征,将LsSK氨基酸序列与其他昆虫SK进行比对,结果表明LsSK的开放阅读框虽不完整,但该序列包括SK酶的4个保守区域,其中SK酶的Diacylglycerol(DAG)活性位点位于C1—C3区域(图1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1灰飞虱与其他昆虫的LsSK氨基酸多序列比对
方框内表示Diacylglycerol(DAG)区域,其为激酶活性位点,阴影部分为SK的5个保守区域C1—C5 Diacylglycerol (DAG) region was boxed, which was the active site of protein kinase. The shadowed regions indicated the five conserved domains of the SK superfamily。灰飞虱Laodelphax striatellus (Lstr)、褐翅椿象Halyomorpha halys(Hhal)、赤拟谷盗Tribolium castaneum(Tcas)、内华达古白蚁Zootermopsis nevadensis(Znev)、黑腹果蝇Drosophila melanogaster(Dmel)
-->Fig. 1Multiple alignment of amino-acid sequences of LsSK from L. striatellus and other insect species
-->
2.2 LsSK氨基酸序列系统进化分析
SK进化树分化成7个分支,其中来自于鞘翅目、膜翅目、鳞翅目、双翅目、半翅目,哺乳动物和植物的SK各聚为独立的分支,且置信度均高于50(图2)。灰飞虱与褐飞虱SK氨基酸序列有较高的一致性,并分布在同一分支且置信度为100,表明它们亲缘关系较近。LsSK与其他半翅目昆虫如豌豆长管蚜(Acyrthosiphon pisum)、点蜂缘蝽聚集在半翅目分支,置信度为70。由图2可知,SK基因相对保守,植物、哺乳动物以及昆虫体内SK间的遗传距离明显较远。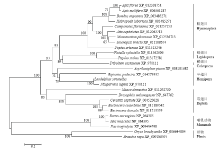 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2LsSK系统进化树(邻接法)
各分支置信度(boostrap)均进行1 000次重复检验,且置信度低于50不显示
-->Fig. 2Phylogentic tree of LsSK (neighbor-joining)
The phylogeny was analyzed by boostrapping over 1 000 replications, values lower than 50 were not shown on the node
-->
2.3 LsSK在灰飞虱体内的时空表达
qRT-PCR结果表明,LsSK的时空表达模式在两个灰飞虱种群之间存在差异。在若虫期,LsSK在带毒种群的4龄若虫中表达量最高,3龄次之;在健康种群中,LsSK在5龄若虫最高,1、4龄次之。并且带毒种群LsSK在3、4龄的表达量显著高于健康种群同时期若虫(P<0.05);在成虫期,带毒种群的LsSK表达量显著高于健康种群,且带毒雄虫整头的表达量高于带毒雌虫整头的表达量(图3-A)。LsSK在带毒种群的雄虫的各个组织的表达量显著高于带毒种群的雌虫与健康种群雌、雄虫各个组织,且在唾液腺和马氏管的表达量最高,头部次之。而该基因在带毒雌虫、健康雌、雄虫的各个组织的表达量没有显著差异(P>0.05)(图3-B)。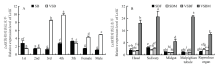 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3LsSK在灰飞虱不同发育时期(A)和成虫不同组织(B)表达分析
1st:1龄若虫First instar nymph;2nd:2龄若虫Second instar nymph;3rd:3龄若虫Third instar nymph;4th:4龄若虫Fourth instar nymph;5th:5龄若虫Fifth instar nymph;Female:雌虫;Male:雄虫;SB:健康灰飞虱RSV-free SBPH;VSB:带毒灰飞虱Virus-infected SBPH;Head:头;Salivary:唾液腺;Midgut:中肠;Malpighian tubules:马氏管;Reproduce organ:精巢和卵巢Ovary and spermary;SBF:灰飞虱雌虫RSV-free SBPH female;SBM:灰飞虱雄虫RSV-free SBPH male;VSBF:带毒灰飞虱雌虫Virus-infected SBPH female;VSBM:带毒灰飞虱雄虫Virus-infected SBPH male。数据分析均用一般线性分析,不同小写字母表示差异显著(P<0.05) All the data were analyzed by GLM, different lowercases on the bar meant significant differences (P<0.05)
-->Fig. 3Relative expression analysis of LsSK at different stages (A) and in various tissues (B) of two L. striatellus colonies
-->
2.4 杀虫剂处理后LsSK的表达动态
带毒种群与健康种群灰飞虱在3种杀虫剂处理后的LsSK的相对表达分析结果显示,健康若虫在噻嗪酮处理1 h后,LsSK mRNA水平开始升高,8 h后达到最高;溴氰菊酯处理后,LsSK表达量无显著变化(P>0.05);吡虫啉处理1 h后SK表达量下降后上升,且在16 h上升至0 h的1.4倍(图4-A)。带毒种群在吡虫啉和噻嗪酮处理4 h和8 h后该基因的表达量显著提高(P<0.05),且在噻嗪酮处理8 h后表达量最高,这与健康种群处理组的结果基本一致;而溴氰菊酯处理后,带毒灰飞虱LsSK的表达量无显著变化(P>0.05)(图4-B)。带毒种群和健康种群灰飞虱在噻嗪酮处理8 h后LsSK表达量均显著上升(P<0.05),而两种群LsSK对吡虫啉和溴氰菊酯的响应则不同。根据带毒与否、杀虫剂种类、杀虫剂处理时间三因素方差分析(ANOVA)结果表明,带毒种群与健康种群灰飞虱在杀虫剂处理后SK含量的变化趋势一致,带毒与否因素对SK mRNA含量变化趋势影响不显著(F(1, 107) =1.877;P =0.175),故将带毒种群与健康种群的数据合并分析(图4-C):LsSK对噻嗪酮的响应最为迅速,处理后8 h mRNA水平即达到最高(2.27倍),而对吡虫啉的响应较缓慢,在处理16 h后表达量达到最高(升高2.21倍)。LsSK对溴氰菊酯无响应,表达水平无显著变化(P>0.05)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4带毒与健康灰飞虱在杀虫剂处理后LsSK表达水平分析
A:健康灰飞虱种群RSV-free L. striatellus;B:带毒灰飞虱种群RSV-infected L. striatellus;C:健康和带毒灰飞虱种群RSV-free and RSV-infected L. striatellus。数据均采用多因素ANOVA分析 All the data were analyzed by ANOVA
-->Fig. 4The relative mRNA level of LsSK from L. striatellus exposed to three insecticides
-->
2.5 RNA干扰效果
通过qRT-PCR检测健康灰飞虱在干扰48 h后的LsSK表达水平,确定dsSK干扰效率。由图5可知,注射dsSK后,试虫体内LsSK表达量明显低于注射dsGFP的试虫,平均下降75%。表明注射dsSK后,LsSK被成功沉默。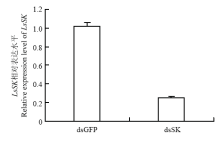 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5注射dsSK后灰飞虱体内LsSK的mRNA水平
-->Fig. 5The mRNA level of SK in RSV-free L. striatellus after injection with dsSK
-->
2.6 沉默SK基因后健康与带毒灰飞虱种群在杀虫剂处理后的死亡率
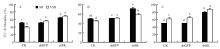
注射dsRNA 48 h后,用LC50浓度的3种杀虫剂处理灰飞虱,24 h后记录试虫死亡情况。以注射dsGFP和未注射的灰飞虱作为对照。由两因素ANOVA(RNAi:F(2, 17)=117.46;P = 1E-07;带毒因子:F(1, 17)= 1.02;P = 0.33)和图6-A可知,带毒种群与健康种群灰飞虱在注射dsGFP后,用吡虫啉处理24 h后的死亡率相似,差异不显著,且接近50%,与未注射组的结果相似。当沉默LsSK后,带毒种群与健康种群间的死亡率差异不显著,但SK沉默组在吡虫啉处理后的死亡率都显著高于dsGFP注射组和未注射组(P<0.05)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6SK沉默后3种杀虫剂处理灰飞虱后的死亡率
A:吡虫啉Imidacloprid;B:噻嗪酮Buprofezin;C:溴氰菊酯Deltamethrin。SB:健康灰飞虱RSV-free SBPH;VSB:带毒灰飞虱RSV-infected SBPH;CK:未注射灰飞虱组Uninjected SBPH;dsGFP:注射双链GFP灰飞虱组dsGFP-injected L. striatellus;dsSK:注射双链SK灰飞虱组dsSK- injected L. striatellus。不同小写字母表示差异显著(P<0.05)Different lowercases on the bar meant significant differences (P<0.05)
-->Fig. 6The mortality of three insecticides to SK silenced L. striatellus
-->
由两因素ANOVA(RNAi:F(2, 17)=117.46;P = 0.00;带毒因子:F(1, 17)= 15.00;P = 0.0022)和图6-B中可知,带毒种群与健康种群注射dsGFP后噻嗪酮处理24 h后的死亡率差异不显著,也接近50%,与未注射组结果相似。但沉默LsSK后,带毒种群与健康种群对噻嗪酮的敏感性明显上升,死亡率均显著高于dsGFP注射组和未注射组,且健康种群的死亡率显著高于带毒种群(P<0.05)。
两因素ANOVA(RNAi:F(2, 17)= 84.87;P = 1E-07;带毒因子:F(1,17)= 45.25;P = 2.11E-05)和图6-C显示,dsGFP注射组和未注射组中健康种群在溴氰菊酯处理后的死亡率显著低于带毒种群。在干扰SK后,带毒种群与健康种群的死亡率都显著高于dsGFP注射组和未注射组(P<0.05)。
综合图6结果可知,带毒种群与健康种群在沉默SK后,3种杀虫剂处理后死亡率均显著高于两个对照组(图6-A、6-B);而对于注射dsGFP和不注射的试虫而言,带毒种群与健康种群对每种杀虫剂的敏感性也存在一定差异,其中带毒种群灰飞虱对溴氰菊酯的敏感性高于健康种群(图6-C)。
3 讨论
SK/S1P途径调控多种重要的细胞过程,如细胞存活、细胞生长、细胞死亡和细胞免疫[25-26],而且不少报道表明SK与病毒传毒相关[27-28]。SK是一种脂类激酶,其在进化过程中比较保守。该酶属于甘油二脂(diacylglycerol,DAG)激酶家族,包含5个保守区域C1—C5[29]。本研究克隆得到了长度为1 282 bp的SK基因序列,且LsSK与其他昆虫的SK基因有较高的一致性。LsSK氨基酸序列包含SK酶的4个保守区域C1—C4,其中SK激酶的活性位点——DAG活性区域位于C1—C3区域[29](图1)。SK氨基酸系统进化树(图2)结果表明,LsSK与半翅目昆虫聚在同一支,说明其亲缘关系较近,SK比较保守[30]。RSV可在植物及昆虫寄主如灰飞虱体内复制[31],通常情况下灰飞虱在3、4龄若虫期带毒量最高;且该龄期若虫传毒能力很强,到成虫传毒能力略有下降[32-33]。在本研究中,带毒种群3、4龄LsSK表达量显著高于健康种群3、4龄若虫,笔者推测SK可能参与了RSV在灰飞虱体内复制和传播。另外,带毒雄成虫各个组织中LsSK的表达量都显著高于同种群雌成虫和健康雌雄虫的相应组织,且带毒雄成虫唾液腺中的表达量极高;带毒雄成虫(整虫)中LsSK表达量也要高于带毒雌成虫。大量研究表明,增加SK含量有助于病毒的复制和传播[8],因此推测LsSK可能与雄虫体内RSV复制有关。PHAN等[34]在缺少S1P裂解酶的果蝇突变体中发现,S1P裂解酶的缺少使得S1P等鞘脂质的积累,导致果蝇精巢发育畸形,表明S1P对精巢的发育十分重要,由此推测SK可能影响带毒雄虫的生长发育,这还需进一步试验证实。
在真核生物中,神经酰胺和S1P含量的平衡可以调控细胞程序性死亡[35]。有研究表明,在SK抑制剂作用下,S1P含量降低,神经酰胺含量上升,显著抑制促存活AKT代谢途径[36],从而诱导细胞凋亡[37];但在MCF7细胞中过表达SK基因,细胞则对三苯氧胺诱导的细胞死亡产生抗性[38]。由于SK基因被报道参与调控细胞抗药性[39],而且周瀛[40]发现灰飞虱受到杀虫剂胁迫后,中性神经酰胺酶的活性显著上升,说明杀虫剂处理可诱导灰飞虱表达中性神经酰胺酶。本研究中,带毒种群与健康种群LsSK在吡虫啉和噻嗪酮处理后的表达水平均有提升,说明这两种杀虫剂可诱导LsSK上调表达,这与周瀛[40]的结果一致。三因素方差分析表明,带毒与否对LsSK mRNA水平变化影响不显著。带毒种群与健康种群灰飞虱在沉默SK后,3种杀虫剂胁迫处理后死亡率均显著升高,说明LsSK可影响灰飞虱对杀虫剂的敏感性。在SK干扰组中,带毒种群对吡虫啉和溴氰菊酯的敏感性显著高于健康种群,而带毒种群对噻嗪酮敏感性却低于健康种群,这可能与杀虫剂的作用机制不同有关。
根据人体细胞SK对药物抗药性有关的报道[16],结合本试验沉默SK基因后,灰飞虱对杀虫剂敏感性显著上升的结果,可以进一步推断LsSK在灰飞虱抵抗杀虫剂胁迫中可能发挥着重要作用。由于SK直接调控神经酰胺/S1P的平衡,当神经酰胺含量升高时,可诱导细胞凋亡;而S1P含量更高时,则诱导细胞生长[16]。免疫细胞中的研究发现,SK可通过S1P激活胞内钙离子信号通道,调控细胞的增生、分化和死亡[41]。钙离子与钠离子交换是钙离子信号传导途径的重要组成部分[42]。抑制淋巴细胞SK的活性将减少JAK-STAT信号传导,降低细胞活力[43]。在头颈鳞状细胞癌研究中也有相似发现,抑制SK可增加细胞对辐射的敏感性,导致细胞毒性增加[44]。综上所述,LsSK被沉默后,推测S1P的合成被抑制,破坏了神经酰胺/S1P的平衡,一方面促使神经酰胺含量更高而诱导细胞凋亡,另一方面抑制了S1P诱导的促细胞生长代谢途径;造成细胞存活力下降;还可能抑制了S1P受体1而破坏钠离子和钙离子通道,最终导致灰飞虱对杀虫剂更为敏感。
本试验探索了LsSK在带毒种群和健康种群灰飞虱的表达模式,为研究SK与RSV传播关系提供了部分鞘脂类代谢学基础;SK的干扰与3种类型的杀虫剂对灰飞虱有协同“增效”作用,这为从水稻-媒介昆虫-病毒生态系统中发掘内禀控制因子,调控灰飞虱及其传播的病毒病[10]提供了一种潜在的新方法。
4 结论
从灰飞虱中克隆得到LsSK基因片段,生物信息分析表明该基因在不同物种间比较保守。qRT-PCR结果表明LsSK在带毒灰飞虱4龄若虫表达量最高,3龄次之;在健康种群中,LsSK在1、4和5龄若虫最高。且LsSK在带毒种群3、4龄若虫的表达量显著高于健康种群的3、4龄若虫;在成虫期,带毒种群灰飞虱LsSK表达量明显高于健康种群。3种杀虫剂处理灰飞虱后,LsSK对噻嗪酮的反应最为迅速。干扰LsSK后带毒种群与健康种群对3种杀虫剂的敏感性均显著升高,表明SK基因有利于灰飞虱抵抗杀虫剂胁迫。The authors have declared that no competing interests exist.
