0 引言
【研究意义】蝗虫是威胁农牧业生产的重要害虫,目前对蝗虫控制主要依赖化学防治方法,给环境造成了严重污染。积极探索有效的生物治蝗技术,是当前国内外蝗灾综合治理的发展趋势。20世纪80年代,微孢子虫被作为控制蝗虫的生物制剂[1],现在已有121种直翅目昆虫能够感染蝗虫微孢子虫(Paranosema locustae)[2]。蝗虫感染微孢子虫的早期阶段很难从蝗虫的临床症状观察出来。因此,喷洒微孢子虫制剂后,定期对蝗虫进行微孢子虫感染率检测,分析其扩散传播情况,掌握其流行动态等十分必要。【前人研究进展】蝗虫微孢子虫作为主要感染蝗虫脂肪体的脂肪细胞,因其具有垂直和水平传播能力、致病力温和、在宿主体内能够大量产生孢子和孢子在0℃以下长期保存等优点,已成为一种非常有效的蝗虫生物杀虫剂[3-4]。中国部分蝗区实施了微孢子虫生物治蝗措施,并取得了良好的效果[5-7]。目前微孢子虫的检测方法主要有显微镜检测技术、免疫学检测技术以及PCR检测技术[8]。传统的显微镜检测技术,操作繁琐,灵敏度差,容易带来主观误差;由于微孢子虫表面具有多抗原决定簇,假阳性比例较高,导致免疫学检测技术难以推广应用[9]。应用PCR方法检测微孢子虫的报道较多[10-12],与传统的显微镜法比较,PCR法更加灵敏和快捷[13]。如对家蚕微孢子虫(Paranosema bombycis)的检测灵敏度可达到102—104 P.b/mL [14]。套式PCR(nested-PCR)是一种建立在普通聚合酶链反应PCR基础上的核酸检测技术,使用内、外两对PCR引物对有限的目的基因进行扩增,经过两轮PCR扩增,能够很大程度地增加灵敏性和特异性,已应用于多种病原体和基因的检测[15],但在蝗虫微孢子虫的检测应用上未见报道。【本研究切入点】传统的显微镜检测方法对蝗虫微孢子虫检测中,不仅费时耗力,而且灵敏度低,人为因素影响检测结果,假阴性现象普遍存在。因此,建立一种更为方便快捷的检测技术,是科学研究与生产实践中的迫切需求。【拟解决的关键问题】根据微孢子小亚单位核糖体RNA基因(SSrRNA)中保守的区域序列设计了两对特异性的套式PCR引物,并进行应用评价,以期建立一种用于检测蝗虫微孢子的敏感性高,快捷可靠的检测方法,为蝗虫微孢子虫感染监测提供技术支持。1 材料与方法
试验于2015年3月至2016年4月在中亚区域跨境有害生物联合控制国际研究中心实验室完成。1.1 材料与试剂
1.1.1 材料 供试用飞蝗(Locusta migratoria)虫卵和蝗虫微孢子虫浓缩液均由中国农业大学农业部生物防治重点开放实验室提供。将蝗卵置于人工气候箱中孵化、饲养,条件为温度(26±2)℃,相对湿度50%,光周期14L﹕10D。孵出后饲养供试验所用。1.1.2 试剂 TaqDNA聚合酶、dNTPs、DL2000 marker购自大连宝生物工程有限公司;Goldviewer购自上海赛百盛基因技术有限公司;琼脂糖为Biowest公司原装;其他常规试剂均为分析纯产品。
1.2 仪器与设备
Mastercyclerpros梯度PCR仪和5430R台式高速冷冻离心机(德国Eppendorf公司产品);BIO-RAD Gel Doc XR+凝胶成像分体系统(美国BIO-RAD公司产品);NanoDrop2000(美国Thermo公司产品)。1.3 方法
1.3.1 微孢子虫发芽液的制备 微孢子虫粗提液的制备参考丁晓宇等[16]的方法,将感染微孢子虫的蝗虫制成微孢子虫粗提液。蝗虫微孢子虫发芽处理参照何永强等[17]的方法,取0.5 mL蝗虫微孢子虫粗提悬浮液,5 000 r/min离心5 min,离心后弃上清,保留孢子,同时加入0.2 mol·L-1 KOH 0.25 mL,充分混合,27℃诱导1 h后5 000 r/min离心5 min,去除诱导液,加入pH 7.4的PBS缓冲液0.5 mL重悬,25℃放置30 min,使孢子充分发芽。将上述发芽后的悬液5 000 r/min离心5 min,去除PBS,加入TE缓冲液0.5 mL悬浮,作为蝗虫微孢子虫的发芽液,直接供PCR作为模板使用。1.3.2 引物设计 在GenBank数据库中下载小孢子虫属的SSUrRNA序列,通过序列比对后,利用PrimerSelect软件,在序列保守区域设计两对套式PCR引物(表1),由上海生工生物技术有限公司合成。
Table 1
表1
表1PCR扩增引物
Table 1The primer pairs used for PCR
| 基因Gene | 引物Primer | 序列Sequence (5′-3′) | 长度Length (bp) | |
|---|---|---|---|---|
| 小亚单位核糖体RNA基因 SSUrRNA | 第1轮 First round | P.L.-F1 | CCAGGTTGATTCTGCCTGAC | 298 |
| P.L.-R1 | GTCAAGTTTCGCCCCTGCTG | |||
| 第2轮 Second round | P.L.-F2 | GCCTGACGTAGACGCTATACTC | 242 | |
| P.L.-R2 | CTCTCAGGCTCCTTCTCCG | |||
新窗口打开
1.3.3 套式PCR条件的优化 两次PCR反应体系均为20 μL:Buffer(10×)2.0 μL,dNTPs(10 mmol·L-1)0.3 μL,Taq DNA酶(250 U)0.3 μL,上、下游引物(10 μmol·L-1)各0.3 μL,微孢子虫发芽液(或者第1轮产物稀释液)1 μL,加水补充到20 μL。第2轮PCR以第1轮PCR产物10倍倍比稀释为模版。PCR反应程序:94℃预变性3 min;94℃变性30 s,第1轮50—62℃优化退火温度(第2轮50—62℃优化退火温度)30 s,72℃延伸20 s,共30个循环;72℃延伸10 min,4℃保存。用胶回收试剂盒对PCR产物进行纯化,并与p-MD18T载体连接,转化入DH5α感受态细胞,PCR检测后选取阳性克隆送上海生物工程有限公司测序。
1.3.4 灵敏度试验 将1×109 个孢子/mL微孢子虫原液进行10倍梯度稀释作为母液(1×108 个孢子/mL)使用,然后依次进行2倍梯度稀释,共21个稀释度。按照上述方法提取DNA后,从每个稀释度各取1 µL作为模板进行第1次PCR扩增(20 µL反应体系),然后进行第2次套式PCR扩增,最后通过1%的琼脂糖凝胶电泳检测该套式PCR反应体系的敏感性。
1.3.5 田间样品检测 从新疆哈密地区巴里坤北山采集的240份蝗虫样本,单头置于研钵中,加入1 mL蒸馏水研磨后过滤,制得微孢子虫粗提液。按照1.3.1方法发芽后,作为PCR模版,采用优化过的套式PCR检测方法进行扩增,结果经凝胶电泳分析。同时对样品进行常规的显微镜镜检,统计并比较这两种方法的检测结果。
2 结果
2.1 套式PCR退火温度优化及最终反应体系建立
两轮PCR退火温度分别在50、52、54、56、58、60和62℃下电泳结果如图1。结果表明,第1轮PCR最佳退火温度为60℃,第2轮PCR最佳退火温度为62℃。套式PCR最终反应体系为Buffer(10×)2.0 μL,dNTPs(10 mmol·L-1)0.3 μL,Taq DNA酶(250 U)0.3 μL,上、下游引物(10 μmol·L-1)各0.3 μL,微孢子虫发芽液(或者第1轮产物稀释液)1 μL,加水补充到20 μL。第2轮PCR以第1轮PCR产物10倍倍比稀释为模版。PCR反应程序为94℃ 3 min;94℃ 30 s、60℃(第2轮62℃)30 s、72℃ 20 s,30个循环。PCR第1轮产物扩增片段为298 bp,经克隆测序后Blast分析表明,序列与GenBank中公布的山松甲虫(Dendroctonus ponderosae)微孢子虫(登录号:GQ337704)、玉米螟(Ostrinia furnacalis)微孢子虫(登录号:NFU26532)等小亚单位核糖体RNA序列同源性分别为99%和99.7%;PCR第2轮产物片段为242 bp(图2)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1套式PCR退火温度优化A:第1轮PCR The first round PCR;B:第2轮PCR The second round PCR;1—7:分别为50、52、54、56、58、60和62℃退火温度扩增的条带
-->Fig. 1Optimization of annealing temperature by nested-PCR amplificationAmplified bands of the PCR annealing temperature of 50, 52, 54, 56, 58, 60 and 62℃, respectively;M:DL-2000 Marker
-->
2.2 灵敏度检测
将1×109 孢子/mL微孢子虫原液进行10倍梯度稀释作为母液(DNA量为8.8 ng·µL-1)使用,然后依次进行2倍梯度稀释,共21个稀释度。从每个稀释液各取1 µL作为模板进行套式PCR扩增。结果表明,套式PCR的第1次扩增可检测到微孢子虫为781.25个孢子/µL(DNA量为27.5 pg·µL-1)(图2),将第1次PCR产物作为模板进行套式PCR的第2次扩增后,在对原液进行81 920倍稀释后仍可扩增出清晰的目的片段(图2),此模板微孢子虫含量为12.2个孢子/µL(DNA量为1.07 pg·µL-1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2套式PCR灵敏度M:DL-2000 Marker;1—21:分别为1﹕21—1﹕221倍稀释1﹕21-1﹕221 dilution, respectively;“-”:阴性对照Negative control
-->Fig. 2The sensitivity of nested-PCR
-->
2.3 田间蝗虫微孢子虫检测
利用建立的套式PCR方法对哈密地区巴里坤北山的240头蝗虫进行检测,同时建立阴、阳性对照,检测结果56头扩增出了242 bp的条带,为阳性,184头为阴性(图3),阳性率为23.3%。与显微镜检测结果进行比较,显微镜检测结果阳性为9头,阳性率为3.8%。套式PCR方法与显微镜观察方法中,检测每头平均耗时分别为5和24 min(表2)。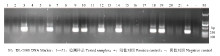 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3套式PCR临床样品检测
-->Fig. 3Detection of clinical samples by nested-PCR
-->
Table 2
表2
表2哈密地区巴里坤北山蝗虫微孢子虫检测结果
Table 2The testing results of P. locustae in Barkol Bei Mountain of Hami region
| 样品编号Sample number | 经度 Longitude (°) | 纬度 Latitude (°) | 海拔 Elevation (m) | 样品数量(头) Quantity (individual) | PCR结果(头) Results of nested PCR (individual) | 镜检结果(头) Results of microscope (individual) |
|---|---|---|---|---|---|---|
| 1 | 93.494926 | 43.680612 | 2120 | 20 | 0 | 0 |
| 2 | 93.491056 | 43.698938 | 2183 | 20 | 0 | 0 |
| 3 | 93.450767 | 43.721974 | 2194 | 20 | 8 | 2 |
| 4 | 93.445117 | 43.685950 | 2052 | 20 | 11 | 3 |
| 5 | 93.342290 | 43.706675 | 1913 | 20 | 14 | 1 |
| 6 | 93.318230 | 43.718452 | 1921 | 20 | 7 | 1 |
| 7 | 93.252386 | 43.794503 | 2022 | 20 | 3 | 0 |
| 8 | 93.182294 | 43.800781 | 1907 | 20 | 3 | 0 |
| 9 | 93.163369 | 43.790189 | 1845 | 20 | 4 | 0 |
| 10 | 93.438020 | 43.690080 | 2030 | 20 | 6 | 2 |
| 11 | 93.205910 | 43.784590 | 1924 | 20 | 0 | 0 |
| 12 | 93.223507 | 43.640872 | 1853 | 20 | 0 | 0 |
| 合计Total | 240 | 56 | 9 |
新窗口打开
3 讨论
21世纪以来,化学防控蝗虫的方法已逐步被生物防治方法替代[18]。早在20世纪80年代,新疆就有用微孢子虫防治草原蝗虫的报道[19]。蝗虫感染微孢子虫后常呈亚致病性状态,是一种慢性的隐性感染,因此对于草原蝗虫是否感染微孢子虫进行长期监测具有重要意义。PCR作为近年发展起来的一种特异性扩增方法,因其具有快速、特异、灵敏和简便的优点被广泛地运用于检测家蚕微孢子虫病[20]。而套式PCR方法相对于普通PCR具有准确和高敏感性等优点,已被广泛运用到动植物病毒的检测等很多领域[21-24]。
在本研究中,第1轮PCR扩增可检测到781.25个孢子/µL,如果采用传统的显微镜检测法,在血球计数板中央的25方格计数区中,样品体积为0.1 µL,相当于有78.125个微孢子,敏感性并没有优于显微镜检法。但经过第2轮PCR扩增后,可检测微孢子虫含量为12.207个孢子/µL,相当于显微镜检法中的视野中仅有1.22个微孢子虫,灵敏度明显高于传统的检测方法。在对哈密地区巴里坤北山蝗虫微孢子虫的检测中,套式PCR方法的检出率高于显微镜观察检出率;其次,建立的套式PCR方法可以避免人员技术熟练因素造成的误差,适合快速、大规模的流行病学调查。利用建立的蝗虫微孢子虫套式PCR方法对不同微孢子虫浓度感染的蝗虫进行检测,均扩增出了目的条带,具有良好的应用前景。
本研究参考何永强等[17]的方法,直接取蝗虫微孢子虫的发芽液作为PCR的模板,简便快捷,重复性好。引物设计则选择了在同属(柞蚕微孢子属Paranosema antheraeae等)具有高度保守性的微孢子虫SSrRNA基因序列核糖体RNA为模板[25-28],选取该区域设计两对特异性引物进行微孢子虫的检测和鉴定,测序结果表明PCR产物为特异性扩增。这充分验证了PCR方法的可靠性及小亚单位核糖体RNA序列的高度保守性。
4 结论
建立的套式PCR方法具有快速、灵敏、特异性强的应用价值。该方法可用于蝗虫微孢子虫的快速检测,为蝗虫微孢子虫流行动态监测提供了新的有效方法,建议推广使用。The authors have declared that no competing interests exist.
