 ,, 郭庆港, 董丽红, 王培培, 苏振贺, 张晓云, 鹿秀云, 李社增, 马平
,, 郭庆港, 董丽红, 王培培, 苏振贺, 张晓云, 鹿秀云, 李社增, 马平 ,*河北省农林科学院植物保护研究所/河北省农业有害生物综合防治工程技术研究中心/农业农村部华北北部作物有害生物综合治理重点实验室,河北保定 071000
,*河北省农林科学院植物保护研究所/河北省农业有害生物综合防治工程技术研究中心/农业农村部华北北部作物有害生物综合治理重点实验室,河北保定 071000Transcriptome and Proteome Analysis of Bacillus subtilis NCD-2 Response to L-proline from Cotton Root Exudates
ZHAO WeiSong ,, GUO QingGang, DONG LiHong, WANG PeiPei, SU ZhenHe, ZHANG XiaoYun, LU XiuYun, LI SheZeng, MA Ping
,, GUO QingGang, DONG LiHong, WANG PeiPei, SU ZhenHe, ZHANG XiaoYun, LU XiuYun, LI SheZeng, MA Ping ,*Plant Protection Institute of Hebei Academy of Agricultural and Forestry Sciences/IPM Centre of Hebei Province/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture and Rural Affairs, Baoding 071000, Hebei
,*Plant Protection Institute of Hebei Academy of Agricultural and Forestry Sciences/IPM Centre of Hebei Province/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture and Rural Affairs, Baoding 071000, Hebei通讯作者:
责任编辑: 岳梅
收稿日期:2021-03-21接受日期:2021-05-31
| 基金资助: |
Received:2021-03-21Accepted:2021-05-31
作者简介 About authors
联系方式:赵卫松,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1788KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
赵卫松, 郭庆港, 董丽红, 王培培, 苏振贺, 张晓云, 鹿秀云, 李社增, 马平. 枯草芽孢杆菌NCD-2对棉花根系分泌物L-脯氨酸响应的转录-蛋白质组学联合分析. 中国农业科学, 2021, 54(21): 4585-4600 doi:10.3864/j.issn.0578-1752.2021.21.009
ZHAO WeiSong, GUO QingGang, DONG LiHong, WANG PeiPei, SU ZhenHe, ZHANG XiaoYun, LU XiuYun, LI SheZeng, MA Ping.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】芽孢杆菌(Bacillus spp.)是开发微生物源农药的重要资源之一,已经在生物防治中得到广泛研究和应用[1,2,3,4]。对于作物土传病害的防治而言,生防芽孢杆菌在作物根际的有效定殖并保持较高的群体数量是其发挥抑菌、竞争等防病作用的重要前提,且生物膜状态下的细菌更有利于其生防能力的发挥[5,6,7]。YARYURA等[8]研究表明,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)BNM339在大豆品种间的根际定殖能力存在差异,且定殖能力与不同品种根系分泌物的组成相关。笔者实验室前期研究发现,棉花根系分泌物L-脯氨酸是影响生防菌株定殖的关键因素之一,枯草芽孢杆菌(Bacillus subtilis)NCD-2菌株在不同抗、感黄萎病棉花品种间定殖能力存在差异,在感病品种冀棉11上的定殖能力最强[9]。通过研究枯草芽孢杆菌NCD-2对根系分泌物L-脯氨酸响应的分子特征,有助于揭示两者之间的互作关系,对如何提高该菌株定殖能力及其在农业生产上的应用具有重要的实践意义。【前人研究进展】芽孢杆菌防治作物土传病害的机制主要体现在诱导抗性、竞争作用、抑菌作用方面[10]。芽孢杆菌在植物根际或根表定殖能力强弱是发挥生防效果的先决条件[6,11-12]。然而生防细菌的根际定殖能力与生物膜形成能力、趋化作用和外界环境因素有关[9,13-14]。根系分泌物可以直接或间接影响生防细菌在植物根部的定殖能力,其主要通过促进生防微生物生物膜的形成和趋化作用来实现[13]。因此,研究生防微生物与根系分泌物之间的相互关系,对于提高生防微生物对植物病害的防治效果和调控植物根系的微生物群落结构和功能具有重要意义。近年来,转录组和蛋白质组学的发展使生防微生物对外界环境的响应特征获得了更加丰富与完整的基因表达信息。【本研究切入点】有益微生物的生防机理是一个非常复杂的过程,仅通过对部分生防相关基因的克隆与功能开展研究不能够全面诠释生防机理。枯草芽孢杆菌NCD-2是笔者实验室筛选出的一株可有效防治作物土传病害的生防细菌,以该菌株为有效成分研制的微生物杀菌剂对棉花黄萎病具有很好的防治效果[15]。同时研究表明,NCD-2菌株在棉花根际的定殖能力与其根系分泌物组成中的L-脯氨酸相关,L-脯氨酸能够促进NCD-2菌株生物膜形成[9]。然而L-脯氨酸如何影响枯草芽孢杆菌的生物膜形成和生防潜力尚不明确。【拟解决的关键问题】采用转录组(RNA-seq)和蛋白质组(iTRAQ)技术,对生防枯草芽孢杆菌NCD-2在根系分泌物L-脯氨酸作用下的差异表达基因(differentially expressed gene,DEG)或蛋白(differentially expressed protein,DEP)进行分析,筛选与生防潜力和生物膜形成相关的功能基因,为探讨根系分泌物和有益枯草芽孢杆菌的互作关系提供理论依据。1 材料与方法
试验于2019年在河北省农林科学院植物保护研究所植物病害生物防治实验室完成。1.1 供试菌株及培养基
枯草芽孢杆菌NCD-2菌株保藏于中国农业微生物菌种保藏管理中心(CGMCC No.1019),由河北省农林科学院植物保护研究所植物病害生物防治实验室提供。生物膜诱导培养基(MSgg培养基)[16]:100 mmol·L-1 MOPS,0.5%甘油,0.5%谷氨酸,5 mmol·L-1磷酸钾缓冲液(pH 7.0),50 μg·mL-1色氨酸,50 μg·mL-1苯丙氨酸,2 μmol·L-1 VB1,2 mmol·L-1 MgCl2,700 μmol·L-1 CaCl2,50 μmol·L-1 FeCl3,50 μmol·L-1 MnCl2,1 μmol·L-1 ZnCl2。蛋白裂解缓冲液:100 mmol·L-1碳酸氢铵,6 mol·L-1尿素,0.2% SDS,pH 8.0。上述培养基和缓冲液各组分121℃,20 min单独灭菌。1.2 生物膜的制备
参考文献[16]的方法制备枯草芽孢杆菌生物膜,具体步骤如下:将在LB平板上活化的NCD-2菌株接种至5 mL LB液体培养基的试管中,37℃、180 r/min过夜培养至OD600=0.5—0.6。在24孔培养板的每个孔中加入2 mL含有L-脯氨酸浓度为10 mg·mL-1的MSgg培养液,种子液接种浓度为1.0%(v/v),以不加入L-脯氨酸只接种菌株的处理作为空白对照,在37℃培养箱中恒温培养48 h后,吸取并弃掉培养孔下的MSgg培养液,保留培养孔中的生物膜,无菌水清洗两次后,液氮速冻,-80℃保存备用。1.3 L-脯氨酸诱导下NCD-2菌株生物膜形成的转录差异基因分析
cDNA文库的构建及测序:按照1.2将收集的不同样品送至北京诺禾致源科技股份有限公司,进行不同样本总RNA提取及质量检测,利用NEBNext® UltraTM Directional RNA Library Prep Kit(NEB,USA)试剂盒进行cDNA文库构建,利用Agilent 2100 bioanalyzer对文库插入的片段长度进行检测,并用实时荧光定量PCR(RT-qPCR)对文库有效浓度进行定量,每组样品3个重复。构建成功的cDNA文库使用Illumina Hiseq 2500高通量测序平台进行测序,测序得到的原始数据提交至中国国家生物信息中心(CNCB),获得接收编号为CRA004208。基因注释和表达定量分析:通过上述测序平台得到不同样品cDNA文库的原始数据,分布去除数据中带有接头、N的比例大于10%和低质量的reads,得到的clean reads用于后续基因组比对分析。根据比对结果,采用HTSeq软件对各样品进行基因表达水平分析。利用FPKM值表示对应unigene的表达丰度。同时,计算Q20、Q30和GC含量对测序数据进行质量评估。
差异表达基因的筛选:通过比较分析不同样本之间的数据比值筛选出差异表达基因。将P<0.05且差异倍数(fold change,FC,两样品间表达量的比值)≥2作为筛选标准。通过GOseq软件实现差异表达基因的GO富集分析,使用KOBAS软件进行KEGG Pathway的富集分析。
1.4 L-脯氨酸诱导下NCD-2菌株生物膜形成的差异蛋白分析
样品制备:将1.2制备的样品转移至液氮预冷的研钵中研磨成粉,迅速转移至离心管,加入适量蛋白裂解缓冲液,涡旋仪上振荡混匀,冰水浴超声5 min使其充分裂解,4℃、12 000×g离心15 min,取上清加入终浓度10 mmol·L-1 DTTred于56℃金属浴反应1 h,之后加入足量IAM,25℃黑暗条件反应1 h,之后加入4倍体积的预冷丙酮在-20℃沉淀至少2 h,4℃、12 000×g离心15 min,收集沉淀。之后加入1 mL -20℃预冷丙酮重悬并清洗沉淀,在相同条件下收集沉淀,风干后送至北京诺禾致源科技股份有限公司进行后续处理,包括蛋白质量检测、酶切与除盐、iTRAQ标记、色谱分离和质谱检测。每组样品3次重复。测序得到的原始数据提交至蛋白数据库(ProteomeXchange),获得接收编号为PXD026233。数据处理:利用NCBI Bacillus subtilis customer. fasta蛋白质数据库对质谱数据进行匹配,利用Proteome Discoverer2.2软件对检索结果进行过滤,选择可信度在99%以上的谱肽,去除FDR>0.01的肽段和蛋白。
差异表达蛋白的筛选:当FC≥1.2且P<0.05,蛋白表达量上调;当FC≤0.83且P<0.05,蛋白表达量下调,作为差异表达蛋白筛选标准。
1.5 RT-qPCR验证
为进一步检测转录组和蛋白质组数据的准确性,从L-脯氨酸诱导下选择不同代谢途径中的26个差异基因通过RT-qPCR进行定量分析,用软件设计qPCR引物(表1),以gyrB为内参基因。利用细菌总RNA提取试剂盒(TIANGEN)提取RNA,利用NanoDrop 2000C分光光度计测定RNA浓度及纯度,以cDNA为模板,用荧光定量试剂盒(TB GreenTM Premix EX TaqTM)、QuantStudioTM real-time PCR软件(Applied Biosystems公司)进行荧光定量检测。选取扩增反应体系为20 μL,其中2×TransStartTM Green qPCR SuperMix 10 μL、上下游引物各(10 μmol·L-1)0.4 μL、cDNA 模板2 μL、Passive Reference Dye I 0.4 μL、ddH2O补足至20 μL。反应程序条件95℃ 10 min;95℃ 5 s、60℃ 15 s、72℃ 15 s、40个循环,相对变化倍数利用公式2-ΔΔCT进行计算。Table 1
表1
表1引物及其碱基序列
Table 1
| 基因 Gene | 序列Sequence (5′ to 3′) | 基因 Gene | 序列Sequence (5′ to 3′) | ||
|---|---|---|---|---|---|
| fliF | F | ACCGAAAGCGGGAACTAC | opuCC | F | GCAAGGAAGCGGAGAAAG |
| R | CATCAGGCGGCTCTACCA | R | AGCCGTAGGAATCAAACCA | ||
| gInQ | F | TATCGGGATGGTGTTTCA | gcvPB | F | TTATTTCCCGCTTAATGTTG |
| R | GTCAGCCTTGTCTGGGAT | R | TCTTCCGCCTCGTATCTG | ||
| cheY | F | GGAGCACAAGCGGTAGAG | putC | F | AATCGTTTCAATCAACCCAG |
| R | CTGAATGGCATCAATAAC | R | TATCGGCATCCGCCTCGT | ||
| fliY | F | CAGACCGTATTCCTGATG | rocA | F | TAGTTGAGCATCCGAAGAC |
| R | CACCGTTTCTTCTTCCTC | R | CAATTACCCGTTTGAGCC | ||
| opuCA | F | CCAGCAGAACATCTCACTC | yodQ | F | GGCAATACAGCCCTTCTT |
| R | GCGGATAACGGTCTAAATAC | R | GCCGCACTCTTCATCTAC | ||
| znuA | F | GGGCTTTCACCTGACCAA | ald | F | CCTCTTCTGACGCCAATG |
| R | CGAGCGTATCTGCGACCT | R | CAACGCCTCCTCCGATAA | ||
| gapB | F | AAGAGGTTGTGGCTGGTG | yerA | F | GAGAAGGCTGGAACTGGG |
| R | TTGCTTCGACGACTATGT | R | ATTGTAGGCGTCGATTGC | ||
| mmgD | F | AATGGAAACGCTGGAACG | asnO | F | TGTCGGATGTGCCTGTTT |
| R | TGTTTGCGGAAGGAGACC | R | CATTTGTGGTGCGTTGTG | ||
| acoC | F | TGGACCAGGCGGACGAAT | yisZ | F | AGGATCGGGACATGGTTA |
| R | TCGGGCAGCGATGACCTT | R | ATGAAATCGGGTGAAAGC | ||
| thrD | F | ACTGATCGCCGCTTACTT | ggt | F | ACACTGTCCAGGATTTCG |
| R | ACCGCTCCGTGAGAATGT | R | GGAGGAGGAGTAGTAGCG | ||
| yjmD | F | CAGCGGAGGTGAAGAAGC | yoaD | F | CCCGAACTTTCATTTGTC |
| R | GAGGGTAGCGAGCGGATT | R | CTCCATCCTTCAGCCACT | ||
| epsA | F | TCGAATCTCAGTGACATCCA | epsC | F | AATCCAGAAGAGGCGGTCAA |
| R | AGATAGGTGCAATTCCGC | R | GCCGAAGCGAACAGCAAC | ||
| ssuB | F | ATTATCAATCGCACCAGG | scoB | F | TTGTCGCAAATGAGATACCC |
| R | CAACAGTCAGCCAAGGAA | R | CGTCTTCCGTTCCTTCCA | ||
| gyrB | F | GAAGCACGGACAATCACC | |||
| R | TCCAAAGCACTCTTACGG |
新窗口打开|下载CSV
1.6 数据统计与分析
采用Origin 8.6软件进行数据分析,利用SPSS 17.0软件进行单因素方差分析、独立样本T检验统计分析。2 结果
2.1 转录组测序数据质量分析
两个处理(T:添加L-脯氨酸;CK:未添加L-脯氨酸的作为空白对照)经高通量测序,CK和T处理原始测序序列数目分别为1 110万条和897万条左右,经过滤得到的数据分别为1 087万条和878万条左右,总信息量分别为1.63 G和1.32 G。将获得的不同处理的过滤序列与NCD-2菌株全基因组序列比对,得到的有效序列分别为963万条和804万条,分别约占总序列的88.59%和91.57%。测得数据经过滤后GC含量介于41.81%—43.30%,CycleQ20 值均在97%以上,Cycle Q30值大于90%(表2)。综合分析表明,测得的数据准确度高,数据质量好,能够满足后期数据的分析。Table 2
表2
表2测序数据质量统计
Table 2
| 处理 Treatment | 原始序列 Raw reads | 过滤序列 Clean reads | 过滤序列大小 Clean reads bases (G) | Q20 比例Q20 percentage (%) | Q30比例Q30 percentage (%) | G和C占总碱基数量百分比 GC content (%) |
|---|---|---|---|---|---|---|
| CK | 11104298±1620312 | 10870077±1617999 | 1.63±0.24 | 97.46±0.11 | 92.90±0.32 | 41.81±0.40 |
| T | 8978376±1390913 | 8783987±1431917 | 1.32±0.22 | 97.99±0.11 | 93.79±0.27 | 43.30±0.05 |
新窗口打开|下载CSV
2.2 基因表达数量及比例分析
分别统计了NCD-2菌株在添加和未添加L-脯氨酸条件下不同FPKM值基因的数量以及基因的表达比例(表3)。在单个基因的表达方面,FPKM 值大于1基因表达比例为85.58%,表达水平较高。转录组测序结果与参考基因组(Bacillus subtilis subsp. subtilis 168)进行比对,共得到4 530个转录本,有功能注释的转录本有4 017个,处理组与对照组之间的差异表达的基因有1 071个,其中602个基因上调,469个基因下调(图1)。Table 3
表3
表3不同表达水平区间的基因数量及比例统计
Table 3
| 项目 Item | 处理 Treatment | FPKM值 FPKM value | ||||
|---|---|---|---|---|---|---|
| 0-1 | 1-3 | 3-15 | 15-60 | >60 | ||
| 基因数量 Number of genes | CK | 616.33±7.64 | 130.33±10.41 | 493.67±31.13 | 984.67±33.01 | 2305.00±54.44 |
| T | 690.00±22.27 | 165.67±4.73 | 569.33±18.58 | 1073.67±36.23 | 2031.33±74.22 | |
| 基因表达比例 Gene expression ratio (%) | CK | 13.60±0.17 | 2.87±0.23 | 10.90±0.69 | 21.74±0.73 | 50.88±1.20 |
| T | 15.23±0.49 | 3.66±0.10 | 12.57±0.41 | 23.70±0.80 | 44.84±1.64 | |
新窗口打开|下载CSV
图1
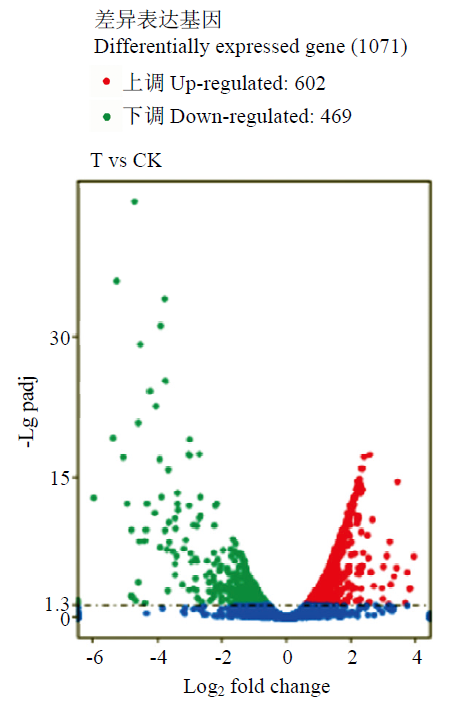 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1差异表达基因的整体分布
Fig. 1Overall distribution of DEGs
2.3 差异表达基因的GO功能注释
GO富集分析主要分为生物过程、细胞组分和分子功能3个基本分类,它们又分别包含1 183、224和649个亚分类。将转录组测序的结果在GO数据库进行基因功能注释,以P<0.05为筛选阙值,评价不同功能条目的富集情况(图2)。图2
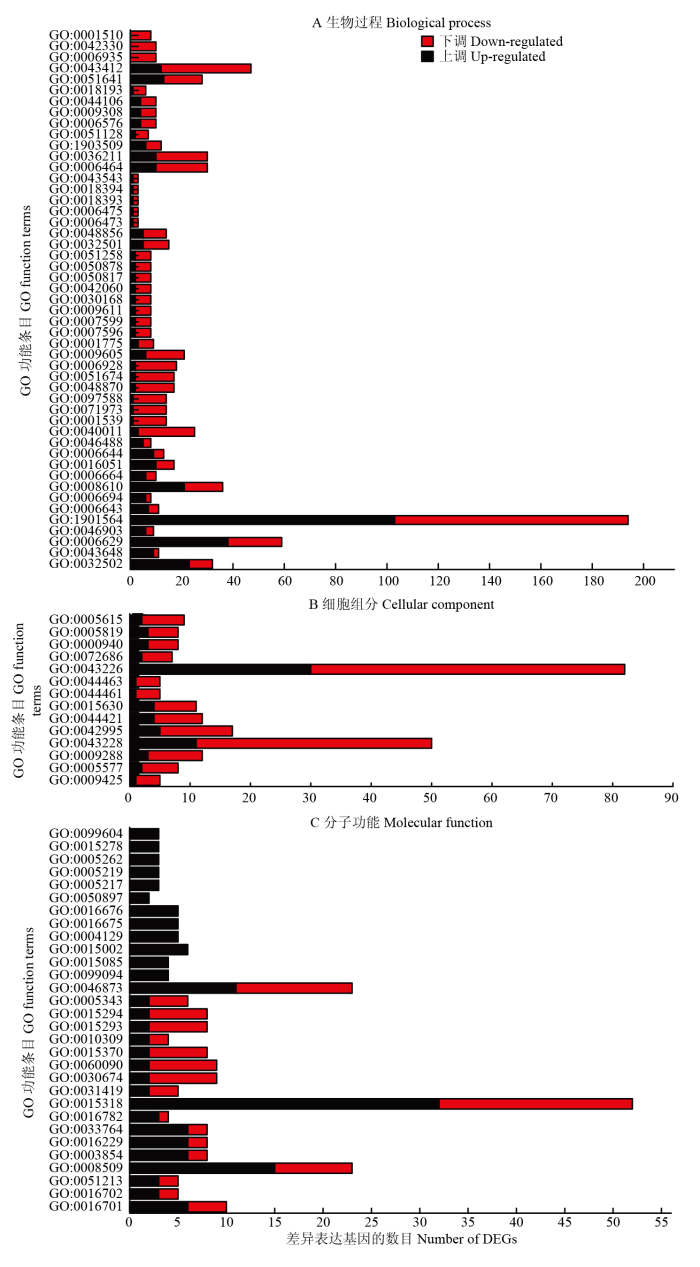 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2差异表达基因的GO分析
Fig. 2GO analysis of DEGs
在生物过程方面,共有49个功能条目显著富集,对不同功能条目差异表达基因分析发现,可分为3类,上调基因数均显著高于下调基因数(12个功能条目),分别为发育过程(GO:0032502)、脂质代谢过程(GO:0006629)、二羧酸代谢过程(GO:0043648)、分泌过程(GO:0046903)、有机氮化合物代谢过程(GO:1901564)、类固醇生物合成过程(GO:0006694)、膜脂代谢过程(GO:0006643)、脂质生物合成过程(GO:0008610)、糖脂代谢过程(GO:0006664)、碳水化合物生物合成过程(GO:0016051)、磷脂代谢过程(GO:0006644)和磷脂酰肌醇代谢过程(GO:0046488);下调基因数显著高于上调基因数(34个功能条目),位于前10位的功能条目分别为运动(GO:0040011)、纤毛或鞭毛依赖的细胞运动(GO:0001539)、细菌型鞭毛依赖的细胞运动(GO:0071973)、古细菌或细菌型鞭毛依赖的细胞运动(GO:0097588)、细胞运动(GO:0048870)、细胞定位(GO:0051674)、细胞或亚细胞成分的运动(GO:0006928)、外界刺激响应(GO:0009605)、细胞激活(GO:0001775)和凝血(GO:0007596);完全下调基因功能条目有3个,分别为趋化性(GO: 0006935)、趋性(GO:0042330)和RNA甲基化(GO:0001510)。
在细胞组分方面,共有14个功能条目显著富集,分别是细菌型鞭毛基体(GO:0009425)、纤维蛋白复合体(GO:0005577)、细菌型鞭毛(GO:0009288)、无膜细胞器(GO:0043228)、细胞突起(GO:0042995)、胞外区域(GO:0044421)、微管细胞骨架(GO: 0015630)、细菌型鞭毛部分(GO:0044461)、细胞突起部分(GO:0044463)、细胞器(GO:0043226)、有丝分裂纺锤体(GO:0072686)、浓缩染色体外着丝粒(GO:0000940)、纺锤体(GO:0005819)和细胞外间隙(GO:0005615)。进一步对其差异表达基因分析发现,下调基因数均显著高于上调基因数,说明枯草芽孢杆菌NCD-2在L-脯氨酸诱导后降低了其自身组成能力。
在分子功能方面,共有30个功能条目显著富集,对不同功能条目差异表达基因分析分为3类,包括上调基因数均显著高于下调基因数(有9个功能条目),分别为不同类型与分子氧结合作用于单个供体的氧化还原酶活性(GO:0016701和GO:0016702)、双加氧酶活性(GO:0051213)、阴离子跨膜转运蛋白活性(GO:0008509)、不同类型的类固醇脱氢酶活性(GO:0003854、GO:0016229和GO:0033764)、转移酶活性(GO:0016782)、无机分子跨膜转运蛋白活性(GO:0015318);下调基因数显著高于上调基因数(有 9个功能条目),分别为钴胺素结合(GO:0031419)、蛋白结合(GO:0030674)、分子适配器活性(GO:0060090)、钠协同载体(GO:0015370)、亚铁离子介导的双加氧酶活性(GO:0010309)、转运体活性(GO:0015293)、阳离子转运体活性(GO:0015294)、钠转运体活性(GO:0005343)和金属离子跨膜转运蛋白活性(GO:0046873);完全上调基因功能条目为12个,分别为配体阳离子通道活性(GO:0099094)、钙离子跨膜转运蛋白活性(GO:0015085)、血红素铜末端氧化酶活性(GO:0015002)、细胞色素c氧化酶活性(GO:0004129)、作用于供体血红素基团及氧作为受体的氧化还原酶活性(GO:0016675和GO: 0016676)、钴离子结合(GO:0050897)、细胞内配体离子通道活性(GO:0005217)、兰尼碱敏感的钙释放通道活性(GO:0005219)、钙通道活性(GO:0005262)、钙释放通道活性(GO:0015278)和配体主导的钙通道活性(GO:0099604)。
2.4 差异表达基因的KEGG代谢途径分析
将差异表达基因与KEGG数据库进行比对,确定差异表达基因中显著性富集的代谢途径(筛选阈值以P<0.05为显著富集的条目),探讨枯草芽孢杆菌NCD-2在L-脯氨酸作用下差异表达基因参与的代谢途径差异。结果表明,L-脯氨酸处理NCD-2菌株后富集显著的代谢途径有10条(表4),分别为不同环境的微生物代谢、链霉素生物合成、碳代谢、硫代谢、乙醛酸和二羧酸代谢、细菌趋化性、鞭毛组装、核糖体、萜类化合物生物合成和错配修复。Table 4
表4
表4KEGG代谢途径分析
Table 4
| KEGG代谢途径 KEGG pathway | 差异基因数目 Number of DEGs | 所有基因数目 Number of all genes | 差异表达基因比例 DEGs ratio (%) | P值 P-value | 表达调控 Regulated |
|---|---|---|---|---|---|
| 不同环境的微生物代谢 Microbial metabolism in diverse environments | 40 | 169 | 23.67 | 0.0076 | Up |
| 链霉素生物合成 Streptomycin biosynthesis | 6 | 9 | 66.67 | 0.0088 | Up |
| 碳代谢Carbon metabolism | 25 | 94 | 26.60 | 0.0103 | Up |
| 硫代谢Sulfur metabolism | 8 | 17 | 47.06 | 0.0118 | Up |
| 乙醛酸和二羧酸代谢 Glyoxylate and dicarboxylate metabolism | 9 | 25 | 36.00 | 0.0276 | Up |
| 鞭毛组装 Flagellar assembly | 26 | 33 | 78.79 | 0 | Down |
| 细菌趋化性 Bacterial chemotaxis | 13 | 24 | 54.17 | 0 | Down |
| 核糖体 Ribosome | 18 | 88 | 20.45 | 0.0248 | Down |
| 萜类化合物生物合成 Terpenoid backbone biosynthesis | 5 | 14 | 35.71 | 0.0413 | Down |
| 错配修复Mismatch repair | 6 | 20 | 30.00 | 0.0475 | Down |
新窗口打开|下载CSV
NCD-2菌株在L-脯氨酸作用下差异基因表达情况具体表现为不同环境的微生物代谢(KEGG ID: bsu01120)相关的2-脱氢-3-脱氧葡萄糖激酶基因(kdgK)、2-磷酸磺酰乳酸磷酸酶基因(yitC)、4-羟基苯乙酸-3-单加氧酶基因(yoaI)、氧化还原酶基因(yrbE)等40个基因表达上调;碳代谢(KEGG ID: bsu01200)相关的甲基丙二酸半醛脱氢酶基因(mmsA)、氨基甲基转移酶基因(gcvT)、2-甲基柠檬酸合成酶基因(mmgD)等25个基因表达上调;硫代谢(KEGG ID: bsu00920)相关的硫酸腺苷酰转移酶基因(sat)、脂肪族磺酸盐结合蛋白基因(ssuA)、胱硫醚-γ-裂解酶基因(yrhB)等8个基因表达上调;乙醛酸和二羧酸代谢(KEGG ID: bsu00630)相关的二磷酸果糖酶基因(kdgA)、草酸脱羧酶基因(oxdC)、乙酰辅酶A乙酰转移酶基因(mmgA)等9个基因表达上调。
鞭毛组装(KEGG ID: bsu02040)相关的鞭毛生物合成蛋白基因(fliP)、鞭毛M环蛋白基因(fliF)等26个基因表达下调,差异基因占该代谢途径基因的78.79%;细菌趋化性(KEGG ID: bsu02030)相关的鞭毛运动开关蛋白基因(fliM、fliY)、趋化蛋白基因(cheW、cheY)等13个基因表达下调,差异基因占该代谢途径基因的54.17%;核糖体(KEGG ID: bsu03010)相关的50S核糖体蛋白L23(rplW)、30S核糖体蛋白S6(rpsF)等18个基因表达下调,差异基因占该代谢途径基因的20.45%;萜类化合物生物合成(KEGG ID: bsu00900)相关的丙烯基二磷酸合酶基因(hepS、hepT)、焦磷酸合酶基因(ispA)等5个基因表达下调,差异基因占该代谢途径基因的35.71%;错配修复(KEGG ID: bsu03430)相关的单链DNA结合蛋白基因(ssbA)、单链DNA特异性核酸外切酶基因(recJ)等6个基因表达下调,差异基因占该代谢途径基因的30.00%。
2.5 差异表达蛋白分析及功能注释
分别对空白对照处理、L-脯氨酸处理后的枯草芽孢杆菌NCD-2进行总蛋白提取及iTRAQ定量分析,结果显示,在对照和处理样品中共鉴定并定量了2 329个蛋白质,对所有蛋白质强度进行归一化并进行t-test统计差异分析(P<0.05),筛选到211个表达量具有显著差异的蛋白质。对211个差异蛋白质进行聚类分析(图3),每一行代表一个蛋白质(群),其中红色部分表示显著上调,蓝色部分表示显著下调。对照组和处理组分别聚类,聚类良好,主要聚类为两大类群。图3
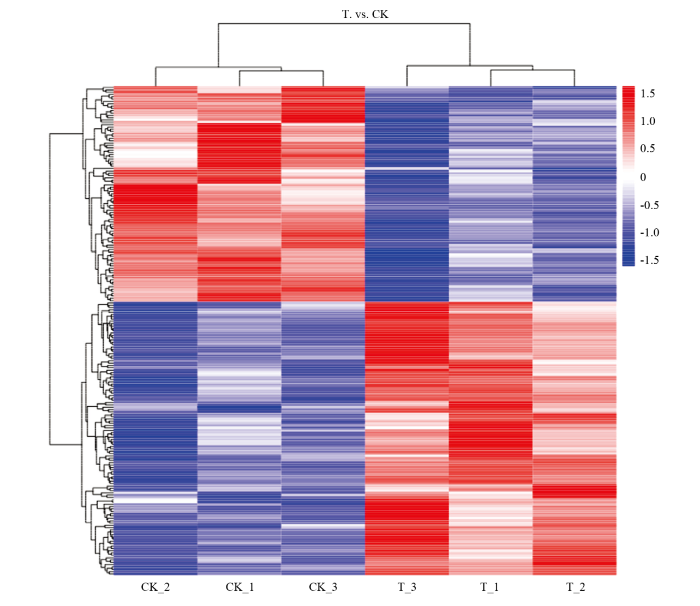 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3差异表达蛋白的聚类分析
Fig. 3Cluster analysis of DEPs
与空白对照相比,L-脯氨酸处理后NCD-2菌株菌体内118个蛋白上调,93个蛋白下调。以P<0.05为阈值,通过GO显著性分析确定差异蛋白行使的主要生物学功能(图4)。结果表明,在分子功能方面,存在8个显著富集的条目,其分别为作用于CH-NH基团供体的氧化还原酶活性(GO:0016645)、天冬酰胺合酶活性(GO:0004066)、核糖体腺嘌呤二甲基转移酶活性(GO:0000179)、辅酶A转移酶活性(GO:0008410)、γ-谷氨酰转移酶活性(GO:0003840)、运动活性(GO:0003774)、NAD或NADP作为受体、CH-NH基团为供体的氧化还原酶活性(GO:0016646)和吡咯啉-5-羧酸还原酶活性(GO:0004735)。在生物过程方面,存在13个显著富集的条目,其分别为羧酸分解代谢过程(GO:0046395)、α-氨基酸代谢过程(GO:1901605)、α-氨基酸分解代谢过程(GO:1901606)、天冬酰胺生物合成过程(GO:0006529)、核糖体修饰(GO:0000154)、谷胱甘肽代谢过程(GO:0006749)、细胞氨基酸分解代谢过程(GO:0009063)、脯氨酸代谢过程(GO:0006560)、细菌型鞭毛依赖性细胞运动(GO:0071973)、谷氨酰胺家族氨基酸代谢过程(GO:0009064)、有机氮化合物分解代谢过程(GO:1901565)、核糖体加工(GO:0006364)、细胞氨基酸生物合成过程(GO:0008652)。然而在细胞组分方面,L-脯氨酸处理与空白对照处理之间不存在显著富集的条目。
图4
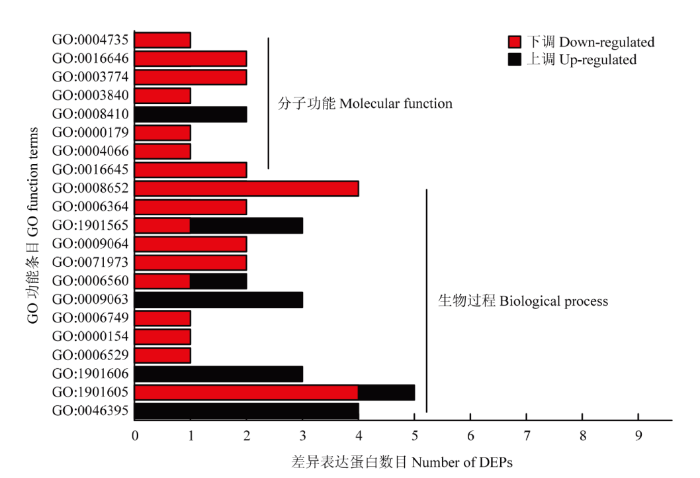 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4差异表达蛋白的GO功能富集
Fig. 4GO function enrichment of DEPs
2.6 差异表达蛋白KEGG代谢途径分析
获得的211个差异蛋白经DAVID工具分析后,与KEGG数据库进行比对,确定差异表达蛋白中显著性富集的代谢通路(筛选阈值以P<0.05为显著富集的条目),探讨枯草芽孢杆菌NCD-2在L-脯氨酸作用下差异表达蛋白参与的代谢通路差异。结果表明,L-脯氨酸处理NCD-2菌株后富集显著的代谢通路有10条(表5),具体包括酮体的合成与降解、乙醛酸和二羧酸代谢、牛磺酸和亚牛磺酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、鞭毛组装、戊糖和葡萄糖醛酸的相互转化、精氨酸和脯氨酸代谢、丁酸代谢、不同环境的微生物代谢和ABC转运蛋白。Table 5
表5
表5差异表达蛋白的KEGG代谢途径分析
Table 5
| KEGG代谢途径 KEGG pathway | 注释代谢途径的差异表达蛋白数量 Number of DEPs with pathway annotation | 注释代谢途径的蛋白数量 Number of proteins with pathway annotation | 差异蛋白比例 DEPs ratio (%) | P值 P-value | 上调数量Up-regulated number | 下调数量Down-regulated number |
|---|---|---|---|---|---|---|
| 酮体的合成与降解 Synthesis and degradation of ketone bodies | 4 | 5 | 80.00 | 0.0004 | 4 | 0 |
| 乙醛酸和二羧酸代谢 Glyoxylate and dicarboxylate metabolism | 9 | 29 | 31.03 | 0.0009 | 7 | 2 |
| 牛磺酸和亚牛磺酸代谢 Taurine and hypotaurine metabolism | 3 | 7 | 42.86 | 0.0224 | 2 | 1 |
| 丙氨酸、天冬氨酸和谷氨酸代谢 Alanine, aspartate and glutamate metabolism | 7 | 31 | 22.58 | 0.0226 | 4 | 3 |
| 鞭毛组装Flagellar assembly | 2 | 3 | 66.67 | 0.0255 | 0 | 2 |
| 戊糖和葡萄糖醛酸的相互转化 Pentose and glucuronate interconversions | 5 | 19 | 26.32 | 0.0284 | 4 | 1 |
| 精氨酸和脯氨酸代谢 Arginine and proline metabolism | 5 | 19 | 26.32 | 0.0284 | 3 | 2 |
| 丁酸代谢Butanoate metabolism | 5 | 19 | 26.32 | 0.0284 | 5 | 0 |
| 不同环境的微生物代谢 Microbial metabolism in diverse environments | 22 | 151 | 14.57 | 0.0335 | 13 | 9 |
| ABC转运蛋白ABC transporter | 13 | 79 | 16.46 | 0.0486 | 7 | 6 |
新窗口打开|下载CSV
2.7 转录-蛋白质组联合分析
枯草芽孢杆菌NCD-2菌株经L-脯氨酸诱导后,经转录-蛋白质组联合分析表明,存在共有差异的蛋白(或基因)数目为112个(图5)。图5
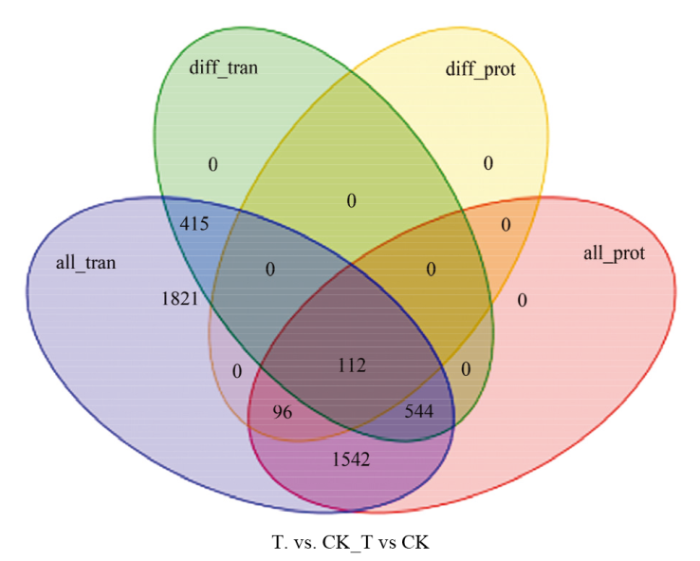 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5转录组和蛋白质组表达调控韦恩图
all_tran代表转录组测序得到的所有基因,diff_tran代表转录组测序得到的差异表达基因,all_prot代表蛋白质组测序得到的所有蛋白,diff_prot代表蛋白质组测序得到的差异表达蛋白
Fig. 5Venn diagram of expression regulation of transcriptome and proteome
all_tran represents all the genes identified by transcriptome, diff_tran represents the differentially expressed genes identified by transcriptome, all_prot represents all the proteins identified by proteome, diff_prot represents the differential expressed proteins identified by proteome
进一步在GO数据库进行基因功能注释,以P<0.05为筛选阙值,结果表明,功能分类主要分布在催化活性、细胞脂质代谢过程、定位、营养库活性、细胞膜、氧化还原过程、sigma因子活性、转运活性、孢子形成9个方面。
L-脯氨酸处理(T)和空白对照(CK)的转录-蛋白质联合组学KEGG代谢途径分析表明,富集显著的代谢通路有11条,分别为ABC转运蛋白、细菌趋化性、抗生素生物合成、丁酸代谢、鞭毛组装、赖氨酸降解、代谢途径、不同环境中的微生物代谢、丙酮酸代谢、淀粉和蔗糖代谢、双组分系统。其中,62.5%的ABC转运蛋白通路下调表达;细菌趋化性和双组分系统通路下调表达;丁酸代谢、丙酮酸代谢、赖氨酸降解、淀粉和蔗糖代谢上调表达;71.43%的抗生素合成、72.73%不同环境中的微生物代谢、81.82%代谢途径通路上调表达。
2.8 RT-qPCR 验证
为验证转录-蛋白质组联合分析的数据准确性,选取26个差异表达显著的基因(包含能量代谢、ABC转运蛋白、抗生素合成、鞭毛组装、生物膜形成和趋化作用相关的基因),设计引物并利用RT-qPCR 进行对照组和L-脯氨酸诱导下基因的表达量变化分析。结果表明,RT-qPCR 结果与组学联合测序的结果在基因表达幅度上有一定的差异,但基因的表达趋势一致(图6),说明组学测序的结果是可信的。图6
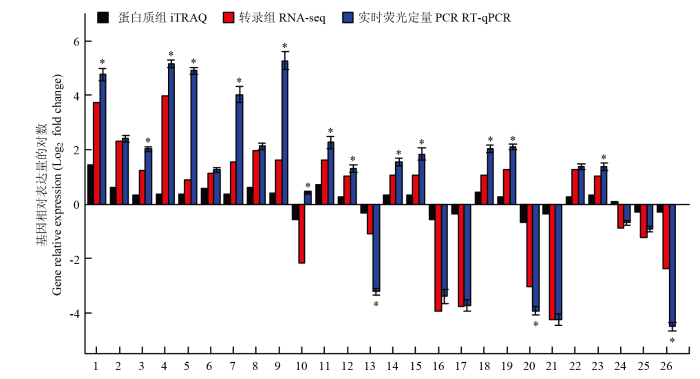 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6差异表达基因的RT-qPCR验证
1—13代表能量代谢(氨基酸、糖类等)相关的基因,分别为putC、rocA、ald、gapB、yerA、mmgD、asnO、acoC、yisZ、thrD、ggt、yjmD和yoaD;14—19代表ABC转运蛋白相关的基因,分别为scoB、glnQ、opuCC、opuCA、znuA和ssuB;20、21代表鞭毛组装相关的基因,分别为fliF和fliY;22、23代表抗生素合成相关的基因,分别为gcvPB和yodQ;24、25代表生物膜形成相关的基因,分别为epsA和epsC;26代表趋化作用相关的基因cheY
Fig. 6RT-qPCR validation of DEGs
1-13 are genes related to energy metabolism (amino acids, sugars, etc.), representing putC, rocA, ald, gapB, yerA, mmgD, asnO, acoC, yisZ, thrD, ggt, yjmD and yoaD, respectively. 14-19 are genes related to ABC transporters, representing scoB, glnQ, opuCC, opuCA, znuA and ssuB, respectively. 20-21 are genes related to flagellar assembly, representing fliF and fliY, respectively. 22-23 are genes related to biosynthesis of antibiotics, representing gcvPB and yodQ, respectively. 24-25 are genes related to biofilm formation, representing epsA and epsC, respectively. 26 represents chemotaxis related gene cheY
3 讨论
微生物不同组学技术从生理代谢和形态结构水平发展到细胞的内在适应机制、转录水平和翻译水平调控的分子层面[17]。抗生素是枯草芽孢杆菌产生的主要抑菌物质,该菌株在植物根部与其他微生物通过营养竞争和空间竞争表征定殖能力的强弱。芽孢杆菌的定殖作用受自身遗传因素(主要包括生物膜形成、群集运动和趋化性等)的影响,还受外界环境条件(植物根系分泌物、温度、湿度、土壤pH等)的影响。为深入了解棉花根系分泌物L-脯氨酸介导的与枯草芽孢杆菌的分子互作机制,本研究采用转录组、蛋白质组及联合组学技术分析了枯草芽孢杆菌在L-脯氨酸作用下的响应特征,从生物膜形成、运动和趋化作用、抗生素生物合成、双组分系统、能量代谢和ABC转运蛋白通路方面推测了枯草芽孢杆菌对根系分泌物响应情况。3.1 对生物膜形成的影响
芽孢杆菌的生物膜由胞外多糖(EPS)、TasA蛋白、γ-多聚谷氨酸(γ-PGA)以及一些脱氧核糖核酸(DNA)等物质组成,其中胞外多糖和胞外蛋白TasA是构成生物膜的骨架和基本组分,其分别由epsA-O操纵子和tapA-sipW-tasA操纵子负责合成并分泌到胞外组成生物膜的胞外基质,维持芽孢杆菌生物膜的结构稳定[18,19]。本研究通过转录-蛋白质组学联合分析未发现NCD-2菌株经L-脯氨酸处理后对生物膜形成GO功能显著富集的相关基因。然而,转录组分析发现L-脯氨酸处理后GO功能富集的生物膜形成相关的MarR家族转录调控因子基因(ybfA)和假设蛋白基因(ykjA)上调表达;蛋白质组学分析发现在L-脯氨酸作用下NCD-2菌株的参与生物膜基质形成的多聚糖生物合成蛋白基因(epsC)下调表达,而生物膜蛋白基因(bslB)上调表达。此外,本课题组前期发现,L-脯氨酸处理后显著提高NCD-2菌株中tasA表达,且随外源L-脯氨酸浓度的增加,表达倍数递增;而低浓度L-脯氨酸(0.625 mg·mL-1)显著提高了epsA的表达,高浓度L-脯氨酸使epsA表达量与空白对照差异不显著,推测L-脯氨酸处理后主要是诱导tasA的表达,促使产生更多的胞外蛋白TasA,而胞外多糖较少参与或不参与[16]。因此,为了更深入系统地了解NCD-2菌株对棉花根系分泌物L-脯氨酸的响应机制,对ybfA和ykjA的功能进行验证是今后的重要工作之一。3.2 对运动或趋化作用的影响
鞭毛是细菌的运动器官,细菌会通过鞭毛介导的运动朝着有利的方向运动,具有一定的趋化作用[20]。趋化作用是生防菌在植物根部形成生物膜定殖到植物根部进而发挥防病作用的前提条件[21]。此外,已有研究表明部分细菌鞭毛、纤毛、菌丝及膜小泡等对生物膜形成存在影响[22,23,24]。本研究中,在L-脯氨酸作用下,NCD-2菌株的鞭毛组装和细菌趋化性相关的GO term显著富集,包含鞭毛运动开关基因(fliY)、鞭毛基体M环蛋白基因(fliF)、趋化和运动的调控基因(cheY)均表现为下调表达。转录组分析表明,趋化作用相关基因(cheA、cheB、cheC、cheD、cheW)、与鞭毛相关的基因(flgBCDGLK、fliEFGHIJK、fliM、fliZ、fliP、fliR、fliS、flhB、flhA、flhF、flhP、flhO)均下调表达。由此推测,NCD-2菌株在L-脯氨酸作用下,虽然在一定程度上降低了其运动和趋化作用,但能够在寄主周围定殖占据生态位。3.3 对抗生素合成的影响
已有研究表明,抗生素是枯草芽孢杆菌产生的主要抑菌物质,同时抗生素类物质是微生物竞争的有效武器,且其能够作为信号分子调节微生物群落的动态平衡[25,26,27,28]。HOFFMAN等[26]研究报道抗生素妥布霉素(tobramycin)在低浓度下能够增强细菌生物膜的形成;LÓPEZ等[27]研究报道表面活性素(surfactin)能够感受细胞膜激酶KinC并传导至SinI-Spo0A途径,增强枯草芽孢杆菌6051生物膜的形成;XU等[28]研究表明,杆菌霉素D(bacillomycin D)的合成基因bamD缺失突变菌株显著影响解淀粉芽孢杆菌的生物膜形成和根际定殖能力;徐志辉等[29]研究报道杆菌霉素D参与铁离子调控解淀粉芽孢杆菌SQR9生物膜形成的通路;董丽红[30]研究发现,表面活性素通过增强生物膜形成能力提高NCD-2菌株的定殖能力。本研究通过转录-蛋白质联合组学分析发现,在L-脯氨酸作用下,NCD-2菌株抗生素合成相关的GO term显著富集,细胞脂质代谢过程基因(fni)、吡咯啉-5-羧酸还原酶基因(proH)和dTDP-4-脱氧核糖核酸-3,5-差向异构酶基因(spsL)下调表达,占抗生素合成代谢途径的28.57%,而负责催化活性的氨基甲基转移酶基因(gcvT)、甘氨酸脱羧酶基因(gcvPB)、脯氨酸脱氢酶基因(ycgM)和脱乙酰酶基因(yodQ)上调表达,占该代谢途径的71.43%。蛋白质组学分析发现,与空白对照相比,NCD-2菌株经L-脯氨酸处理后脂肽类抗生素泛革素(fengycin)家族合成酶相关基因(ppsABCDE)、聚酮类抗生素(如四环素、红霉素等)聚酮体合成酶基因(pksJMR)表达不存在显著差异;表面活性素家族合成酶相关基因srfAA、srfAB和srfAD表达不存在显著差异,而srfAC显著下调表达。综上所述,上述基因的表达可能是枯草芽孢杆菌NCD-2菌株在L-脯氨酸作用下产生的应激反应。
3.4 对双组分信号转导系统的影响
STOCK等[31]认为双组分信号转导系统是细菌中常见的信号系统,细菌可以通过双组分系统感知、适应各种细胞外环境条件的变化并作出反应。已有研究表明,典型的双组分系统由位于细胞膜上的组氨酸蛋白激酶和位于细胞质内的调控因子组成,细菌中双组分系统的数量取决于基因组大小和细菌所处环境的多样性[32,33]。枯草芽孢杆菌含有36种组氨酸激酶和34种响应因子[34]。同时,许多****研究发现,双组分系统作为信号分子影响抗生素生物合成、氨基酸合成、生物膜形成和芽孢形成相关基因[35,36,37]。SULLIVAN[35]研究发现芽孢杆菌中双组分调控系统ComPA,主要调控感受态的形成(吸收外源DNA)和表面活性素、γ-多聚谷氨酸的产生;MURRAY等[36]研究发现,双组分调控系统DegSU中的调控因子DegU能够调控芽孢杆菌从浮游状态向生物膜状态的改变;GUO等[37]研究认为,PhoR/PhoP双组分系统通过影响氨基酸和碳水化合物的代谢来调控脂肽类物质的合成。本研究中蛋白质组学分析发现,NCD-2菌株中存在42个双组分调控系统,在L-脯氨酸作用下,其中DegSU、PhoRP、ResDE、VicRK等40个双组分调控系统中基因表达不存在显著差异,而DNA结合反应调控因子(NarL/FixJ家族,包含REC和HTH结构域)基因表达显著上调,趋化反应调控因子CheB(趋化性家族,包含REC和蛋白质谷氨酸甲基酯酶结构域)基因表达显著下调。
3.5 对能量代谢的影响
PISITHKUL等[38]研究发现,枯草芽孢杆菌在早期生物膜生长期间三羧酸(TCA)循环的相关酶活性增加,从脂肪酸生物合成转变为脂肪酸降解,通过代谢组学、转录组学和蛋白质组学的结果表明,生物膜发育过程中的代谢重塑受转录水平的调控,证明乙酰胆碱的产生对生物膜的生长至关重要,并且具有维持氧化还原平衡和细胞外pH的双重作用。KIMURA等[39]研究发现,谷氨酸合成酶缺失突变体抑制了生物膜的形成,进一步分析发现该突变体在三羧酸循环中积累的柠檬酸根离子会由于螯合而导致铁缺乏,从而降低生物膜形成,外源添加过量的铁到培养基时,突变体的生物膜形成能力恢复。本研究蛋白质组学分析发现,参与三羧酸循环的编码柠檬酸合成酶基因(citA)上调表达、参与糖酵解的3-磷酸甘油醛脱氢酶基因(gapA和gapB)分别表现下调和上调表达。联合组学分析表明,在L-脯氨酸作用下,NCD-2菌株丁酸代谢相关的GO term显著富集,乙酰辅酶A转移酶基因(scoB)、3-羟基丁酰辅酶A脱氢酶基因(mmgB)和降解乙酰辅酶A硫酶基因(mmgA)上调表达;NCD-2菌株中催化活性和营养库活性相关的GO term显著富集,依赖AdoMet甲基转移酶基因(yrrT)、草酸脱羧酶基因(oxdC)、氧化还原酶基因(yjmD)、羧酸脱氢酶基因(putC、rocA)、依赖NAD的丙氨酸脱氢酶基因(ald)、腺嘌呤脱氨酶基因(yerA)、芽孢形成相关的天冬酰胺合成酶基因(asnO)、膜结合γ-谷氨酰转肽酶基因(ggt)上调表达;NCD-2菌株中淀粉和蔗糖代谢活性相关的GO term显著富集,葡萄糖苷酶基因(malA)、磷酸转移酶系统(PTS)地衣聚糖特异酶基因(licA)和麦芽糖特异酶基因(malP)均上调表达。此外,苏氨酸合成酶基因(thrC)、2-羟基酸脱氢酶基因(yoaD)和天冬氨酸激酶Ⅲ基因(thrD)下调表达,而柠檬酸合成酶基因(mmgD)、2-磷酸-3-环丁磺酸合酶基因(slpS)、二氢硫辛酸乙酰转移酶基因(acoC)、磷酸腺苷酸还原酶基因(yitB)、磷酸烯醇式丙酮酸羧激酶基因(pckA)、甘油醛-3-磷酸脱氢酶基因(gapB)、腺苷酸硫酸激酶基因(yisZ)等8个基因上调表达。上述代谢途径基因表达的变化说明L-脯氨酸干扰了NCD-2菌株的能量代谢,其中由于芽孢形成相关的天冬酰胺合成酶基因(asnO)上调表达,推测L-脯氨酸可能促进NCD-2菌株芽孢产生,从而提高菌株在环境中的存活能力,该推论有待于进一步验证。3.6 对ABC转运蛋白的影响
已有研究表明,无机离子转运和代谢(如铁离子)对微生物生物膜的形成至关重要。RIZZI等[40]研究认为,枯草芽孢杆菌生物膜的形成与铁的获取之间有着密切联系,尤其是生物膜基质在促进铁载体的有效利用方面起着重要作用;OLLINGER等[41]证实枯草芽孢杆菌共有5个铁离子运输的转运系统,即YwbMNL、YfmCDEF、YfiYZ、FhuBGC和FeuABC;LIN等[42]发现铁离子ABC转运蛋白正向调控生物膜形成,在低铁的条件下,金黄色葡萄球菌(Staphylococcus aureus)铁ABC转运蛋白基因缺失后生物膜形成能力下降了75%;BANIN等[43]和PATRIQUIN等[44]发现,敲除铜绿假单胞菌(Pseudomonas aeruginosa)中铁载体pyoverdine的基因后,突变菌株仅能形成微弱的生物膜,外源加入铁不能够形成完整的生物膜;XU等[28]研究发现,解淀粉芽孢杆菌突变体SQR9M1的生物膜形成延迟现象与其铁离子转运能力受损有关,其铁离子ABC转运蛋白FhuBGC、FeuABC和YfmCDEF相关基因显著下调表达。本研究发现,L-脯氨酸处理后NCD-2菌株与ABC转运蛋白活性相关的GO term显著富集,62.5%的ABC转运蛋白通路下调表达,包括不同氨基酸ATP结合蛋白的基因(opuAA、opuCA)、细胞通透蛋白的基因(opuAB)、氨基酸结合脂蛋白基因(opuAC)、保护细胞通透脂蛋白的基因(opuCC);37.5%的ABC转运蛋白通路上调表达,包括谷氨酰胺转运蛋白基因(glnQ)、锌结合脂蛋白基因(znuA)和脂肪族磺酸盐转运蛋白基因(ssuB)。同时,经蛋白质组学分析发现铁离子结合脂蛋白基因(fecC)上调表达,而转录组学分析发现铁ABC转运蛋白相关基因(yfmD)下调表达。因此,在L-脯氨酸作用下NCD-2菌株的ABC转运蛋白代谢途径相关基因的表达产生改变,但其具体分子机制还需深入研究。4 结论
棉花根系分泌物L-脯氨酸与生防菌株枯草芽孢杆菌NCD-2之间存在复杂的分子互作关系,通过转录-蛋白质联合组学分析发现,显著富集的代谢通路主要集中在生物膜形成、趋化作用、抗生素生物合成、双组分系统、能量代谢和ABC转运蛋白方面,从而影响生防菌株的定殖能力和抑菌作用。同时,不同代谢途径之间存在密切的关系,共同影响枯草芽孢杆菌NCD-2生物膜形成的调控网络。(责任编辑 岳梅)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.micres.2015.05.005URL [本文引用: 1]
DOI:10.1128/AEM.02605-14URL [本文引用: 1]
DOI:10.5423/PPJ.SI.08.2012.0125URL [本文引用: 1]
DOI:10.1007/s00374-011-0605-xURL [本文引用: 1]
DOI:10.1104/pp.103.028712URL [本文引用: 2]
DOI:10.1023/B:RESB.0000040458.35960.25URL [本文引用: 1]
DOI:10.1007/s00284-008-9137-5URL [本文引用: 1]
[本文引用: 3]
[本文引用: 3]
DOI:10.1146/arplant.2013.64.issue-1URL [本文引用: 1]
DOI:10.1111/fml.2014.353.issue-1URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11104-016-3159-8URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 3]
DOI:10.1186/s12864-018-4960-yURL [本文引用: 1]
DOI:10.1111/mmi.2006.59.issue-4URL [本文引用: 1]
DOI:10.1371/journal.pgen.1001243URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s11103-016-0432-4URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1186/1471-2180-9-197URL [本文引用: 1]
DOI:10.1371/journal.ppat.1002204URL [本文引用: 1]
[本文引用: 1]
DOI:10.1038/nature03912URL [本文引用: 2]
[本文引用: 2]
DOI:10.1128/AEM.02645-12URL [本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.1146/biochem.2000.69.issue-1URL [本文引用: 1]
DOI:10.1016/S1369-5274(00)00070-9URL [本文引用: 1]
DOI:10.1146/micro.2012.66.issue-1URL [本文引用: 1]
DOI:10.1128/JB.181.7.1975-1983.1999URL [本文引用: 1]
DOI:10.1016/S0958-1669(98)80057-8URL [本文引用: 2]
DOI:10.1099/mic.0.023903-0URL [本文引用: 2]
DOI:10.1016/j.micres.2020.126557URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1128/JB.188.10.3664-3673.2006URL [本文引用: 1]
DOI:10.1371/journal.pone.0034388URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
