 ,广东省农业科学院蚕业与农产品加工研究所/农业农村部功能食品重点实验室/广东省农产品加工重点实验室,广州 510610
,广东省农业科学院蚕业与农产品加工研究所/农业农村部功能食品重点实验室/广东省农产品加工重点实验室,广州 510610Effects of Hot Air-Vacuum Freeze Combined with Drying on Physical Properties and Prebiotic Activities of Brittle Dried Longan
DENG YuanYuan, YANG Jing, WEI ZhenCheng, ZHANG Yan, LIU Guang, ZHANG RuiFen, TANG XiaoJun, WANG JiaJia, LIAO Na, ZHANG MingWei ,Sericultural & Agri-Food Research Institute, Guangdong Academy of Agricultural Sciences/Key Laboratory of Functional Foods, Ministry of Agriculture and Rural Affairs/Guangdong Key Laboratory of Agricultural Products Processing, Guangzhou 510610
,Sericultural & Agri-Food Research Institute, Guangdong Academy of Agricultural Sciences/Key Laboratory of Functional Foods, Ministry of Agriculture and Rural Affairs/Guangdong Key Laboratory of Agricultural Products Processing, Guangzhou 510610通讯作者:
责任编辑: 赵伶俐
收稿日期:2019-09-20接受日期:2019-12-26网络出版日期:2020-05-16
| 基金资助: |
Received:2019-09-20Accepted:2019-12-26Online:2020-05-16
作者简介 About authors
邓媛元,Tel:020-87032667;E-mail:yuanyuan_deng@yeah.net。

摘要
关键词:
Abstract
Keywords:
PDF (527KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
邓媛元, 杨婧, 魏振承, 张雁, 刘光, 张瑞芬, 唐小俊, 王佳佳, 廖娜, 张名位. 热风-真空冷冻联合干燥对脆性龙眼果干品质及益生活性的影响[J]. 中国农业科学, 2020, 53(10): 2078-2090 doi:10.3864/j.issn.0578-1752.2020.10.014
DENG YuanYuan, YANG Jing, WEI ZhenCheng, ZHANG Yan, LIU Guang, ZHANG RuiFen, TANG XiaoJun, WANG JiaJia, LIAO Na, ZHANG MingWei.
0 引言
【研究意义】龙眼(Dimocarpus longan Lour.)又称桂圆,为无患子科龙眼属的亚热带常绿果树,我国的龙眼种植面积和产量位居世界第一[1,2]。龙眼风味独特,含有丰富的糖类、氨基酸、多肽类、多酚类、脂类和微量元素等成分,可以抗氧化、抗衰老、抗肿瘤、免疫调节、改善学习记忆及调节肠道菌群等,具有较高的营养价值和保健功效[3,4]。然而,龙眼成熟于高温高湿季节,鲜果易腐烂,贮藏保鲜难度大。干制是龙眼最主要的加工方式[5,6],且干制龙眼(桂圆肉)被卫计委认定为“药食同源”原料[7,8]。已有研究表明不同的干燥方式对果蔬的品质及其生物活性影响较大[9]。因此,建立理想的干燥方式,并明确其对产品品质和生物活性的影响,对龙眼产品的开发具有重要意义。【前人研究进展】热风干燥是龙眼传统的干燥方式,该方式设备投资小、能耗较低,并且有利于提高龙眼果肉多糖的免疫调节活性[10,11]。但该方式较易破坏龙眼质构,果干褐变严重,感官品质不高[12]。CHUNTHAWORN等[13]研究指出,龙眼属于高糖水果,在热风干燥过程中易受温度和时间的影响发生褐变。龙眼果肉在60—100℃热风干燥过程中,前180 min内亮度缓慢增加,之后随着干燥时间的增加,亮度急剧下降。若干燥温度上升到110—130℃,亮度降低时间则提前至干燥开始后的60 min。NATHAKARANAKULE等[14]采用远红外辐射辅助热风或热泵干燥龙眼。该技术有利于缩短干燥时间,提高干燥效率。并且在远红外辐射过程中容易形成多孔结构,可以降低果干的皱缩率和硬度,增强复水性和韧性。但该技术仍然需要10 h以上的热处理过程,对果干色泽及风味影响较大。真空冷冻干燥技术能够较好地保持龙眼原有的外观形状、色泽、风味及生物活性,并且果干质地较脆。但该方式设备投资高,干燥时间长且能耗大[15]。田玉庭等[16]采用热风干燥、真空干燥、微波干燥、微波真空干燥和真空冷冻干燥来干燥龙眼,发现真空冷冻干燥龙眼果肉品质最佳,其次为微波真空干燥。RAJKUMAR等[17]研究了热风干燥和真空冷冻干燥工艺对甘蓝片品质、挥发性风味物质及感官评分的影响。结果表明,与热风干燥产品相比,真空冷冻干燥能更好的保留甘蓝片的风味物质,且具有较高的感官评分和整体可接受性。SZYCHOWSKI等[18]研究结果表明,真空冷冻干燥的木瓜抗氧化活性最高,其次是微波真空干燥,对流干燥和对流-微波真空干燥两者相当且都较低。WOJDYLO等[19]干燥红枣也得出相似的结论。【本研究切入点】不同干燥方式因干燥温度、氧浓度等条件的不同,对果蔬的营养品质、外观、风味及生物活性的影响不同。联合干燥是结合不同干燥方式进行分阶段干燥的一种复合技术,可以综合多种干燥方式的优点,弥补单一方式的不足。【拟解决的关键问题】通过以热风干燥、真空冷冻干燥为对照,明确热风-真空冷冻联合干燥对脆性龙眼果干品质、风味及益生活性的影响,旨在为龙眼干燥工艺的优选提供理论依据。1 材料与方法
试验于2018年9月至2019年3月在广东省农业科学院蚕业与农产品加工研究所/农业农村部功能食品重点实验室/广东省农产品加工重点实验室进行。1.1 试验材料
‘储良’龙眼购于广东省高州晟丰水果专业合作社。环己酮为色谱纯试剂,购于天津市大茂化学试剂厂。乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸标准品,购于美国Sigma公司。MRS琼脂培养基、MRS肉汤培养基,购自广东环凯微生物技术有限公司。植物乳杆菌(Lactobacillus plantarum,编号:GIM 1.191)和嗜酸乳杆菌(Lactobacillus acidophilus,编号:GIM 1.321),均购于广东省微生物菌种保藏中心。1.2 仪器与设备
FDU-2100真空冷冻干燥机,东京理化器械株式会社;LabSwift-Novasina便携式水分活度仪,瑞士Novasina公司;电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;SPX-250B-Z高压蒸汽灭菌锅,上海博讯实业有限公司;PB-10 pH计,德国Sartorius公司;LRH-250生化培养箱,上海一恒科技有限公司;GC-2010 Plus气相色谱仪,日本岛津公司;超净工作台,江苏安泰空气技术有限公司;6890N/5975B GC-MS气质联用仪,美国Agilent公司。1.3 试验方法
1.3.1 龙眼果干的制备 热风-真空冷冻联合干燥(hot air-vacuum freeze combined drying,HA-VFCD):挑选2.4 kg新鲜龙眼果肉双层平铺于托盘内,在100℃温度下进行热风预干燥。干燥3 h(期间每0.5 h翻动一次),之后停止干燥并分装,-20℃预冻12 h。预干燥的龙眼果干放入容量为2.4 kg的真空冷冻干燥进行满负荷干燥,腔内压强3—4 Pa,低温-80℃,连续干燥50 h,水分含量达7%左右,得到热风-真空冷冻联合干燥龙眼干。热风干燥(hot air drying,HAD):2.4 kg新鲜龙眼果肉双层平铺于托盘内,采用电热鼓风干燥箱干燥。温度为65℃,干燥时间20 h,期间每3 h翻动一次。热风干燥龙眼果干水分含量为14.53%,与市售龙眼干干燥温度和品质相当。
真空冷冻干燥(vacuum freeze drying,VFD):2.4 kg新鲜龙眼果肉放入-20℃冰箱预冷冻12 h,之后采用真空冷冻干燥机满载干燥,腔内压强 3—4 Pa,低温-80℃,连续干燥62 h,龙眼干水分含量7.46%。
1.3.2 水分含量 采用直接干燥法,参照GB 5009.3 —2016完成。
1.3.3 水分活度 使用便携式水分活度仪测定。将2 g龙眼果干剪碎后置于水分活度仪测量皿中测定。
1.3.4 收缩率 采用正庚烷体积置换法测定龙眼干收缩率[20]。以正庚烷为替代品,以加入龙眼干正庚烷的体积与未加入龙眼干正庚烷体积差为龙眼干体积。10个样品进行检测并求平均值。收缩率计算公式如下:
$收缩率(\%)=\frac{干燥前的体积-干燥后的体积}{干燥前的体积}\times 100$
1.3.5 复水比 龙眼干置于初始温度为90℃的热水中复水。以1 min为时间间隔测定龙眼再水化质量的变化,测定时间10 min[6]。干燥后龙眼复水比计算公式如下:
$复水比(\%)=\frac{复水后的重量-原始重量}{原始重量}\times 100$
1.3.6 总糖及多糖含量 称取50 g的龙眼果干或250 g的新鲜龙眼果肉,加入1 L 80%的乙醇浸泡过夜,打浆获得龙眼果浆。在4 000 r/min的转速下离心10 min,获得沉淀,重复2—3次,除去多酚、单糖等。将所得沉淀按料液比1﹕20(g?mL-1)加入蒸馏水,在90℃下浸提4 h,用纱布趁热过滤,将滤液在65℃的真空浓缩至原体积的1/5,获得龙眼多糖溶液。取多糖溶液,加入1/4体积的Sevag溶液(氯仿﹕正丁醇=4﹕1)脱蛋白,中低速磁力搅拌15 min,在4 000 r/min的转速下离心10 min脱除蛋白,收集上清液,重复3次,将上清液中的有机试剂在55℃下旋蒸去除。取多糖溶液,加入乙醇并搅拌,使体系中乙醇最终浓度达到80%,4℃静置过夜,抽滤获得沉淀,用无水乙醇溶液清洗沉淀。将乙醇沉淀的多糖用蒸馏水溶解后真空冷冻干燥,获得龙眼多糖冻干粉[21]。
总糖采用苯酚-硫酸法测定,称取龙眼多糖冻干粉溶于去离子水中,制备为龙眼多糖溶液。龙眼多糖溶液按照一定倍数稀释后取1 mL稀释液置于25 mL试管中。随后加入0.5 mL质量分数为6%的苯酚溶液和2.5 mL浓硫酸,采用漩涡震荡器混合均匀,并室温静置30 min。紫外分光光度计在490 nm波长处测吸光度。以去离子水代替多糖溶液作为空白对照。
还原糖采用3,5-二硝基水杨酸(DNS)法测定[22]。1 mL龙眼多糖稀释液置于25 mL试管中,加入0.75 mL DNS溶液,采用漩涡震荡器混合均匀后沸水浴5 min,之后采用流水冲洗试管外壁迅速冷却,再加入10.75 mL去离子水,混合均匀,540 nm处测吸光度。以去离子水代替多糖溶液作为空白对照。
多糖含量=总糖含量-还原糖含量
1.3.7 单位能耗 电热恒温鼓风干燥箱和真空冷冻干燥机分别安装专用电表,测定其耗电量。干燥能源效率用单位能耗(SEC)表示[20],计算公式如下:
$单位能耗=\frac{干燥过程中使用的总能源(\text{kj})}{龙眼水分损失的总质量(\text{kg})}$
1.3.8 风味物质 采用顶空-固相微萃取法[23]。将一定量的龙眼干粉碎,称取1 g左右的粉碎样品装入15 mL的顶空瓶中,再加入5 μL 0.2 mg?mL-1的环己酮(内标物),拧紧瓶盖,顶空瓶放入50℃的热水中平衡30 min后,使用DVB/CAR/PDMS 50/30 μm的萃取头插入顶空瓶,30 min后抽回萃取头,插入进样器,解析8 min。
气相色谱条件:Agilent 6890 N气相色谱仪,弹性石英毛细管柱HP-5 MSUI,30 m×0.25 mm×0.25 μm,He流量1 mL?min-1,不分流进样,进样口温度250℃。起始柱温35℃保持2 min,然后以5℃/min的升温速率升温到250℃,保持5 min。
质谱条件:Agilent 5975 MSD质谱,电离方式EI,电子能量70 eV,电子倍增器电压1 000 V,灯丝发热电流0.25 mA,接口温度250℃,离子源温度200℃,扫描速度全程(40—550)AMU/sec。
1.3.9 龙眼果干益生活性的测定
1.3.9.1 龙眼干果浆的制备 热风干燥、真空冷冻干燥、热风-真空冷冻联合干燥龙眼果干(干重均为100 g)置于1 L的烧杯中,加蒸馏水至500 mL,浸泡2 h后家用打浆机打浆;新鲜龙眼500 g(干重100 g)用打浆机打浆后补充蒸馏水至500 mL,再继续打浆混匀。4种果浆按照每瓶100 mL标准分装到250 mL锥形瓶中,纱布和封口膜封口后121℃高压蒸汽灭菌锅灭菌15 min,取出备用[24]。
1.3.9.2 龙眼果浆乳酸菌发酵 龙眼果浆按照6 lg cfu/mL接种量接种培养至稳定期的乳酸菌,37℃摇床培养箱中分别培养0、6、12、24和48 h后进行检测[24]。
1.3.9.3 菌落数的测定 参考GB 4789.35—2016执行。
1.3.9.4 pH的测定 取5 mL发酵液用pH计测定,每个样品重复测定3次。
1.3.9.5 总糖及还原糖的测定 发酵液中总糖含量采用苯酚-硫酸法测定[21]。取1 mL发酵液以4 000 r/min离心10 min,上清液用蒸馏水稀释至合适的浓度,按照前述总糖测定方法进行。发酵液中还原糖含量按照前述DNS法进行。
1.3.9.6 短链脂肪酸的测定 短链脂肪酸的测定按照如下方法进行。10 mL发酵果浆10 000 r/min离心15 min后,注射器吸取1 mL发酵上清液过0.22 μm滤膜后装入气相瓶,采用气相色谱分析。色谱条件如下:DB-FEAP色谱柱,载气为N2,流速30.0 mL?min-1,分流比1﹕9,空气流速400 mL?min-1,H2流速30 mL?min-1。检测器FID,检测温度240℃,进样口温度240℃,升温程序70℃—240℃。样品进样量1 μL,测定时间42.47 min。同时以乙酸、丙酸、正丁酸、异丁酸、正戊酸和异戊酸为标准品,按上述操作绘制标准曲线[24]。
1.4 数据分析
用Excel 2010和SPSS 20.0进行结果分析。风味物质经GC-MS分析鉴定后,其结果用计算机谱库(NIST 05/WILEY)检索和人工图谱解析,并结合相关文献共同分析。2 结果
2.1 热风-真空冷冻联合干燥对脆性龙眼果干品质的影响
2.1.1 水分含量、水分活度、皱缩率 热风-真空冷冻联合干燥的龙眼果干水分含量、水分活度和皱缩率均低于热风干燥而高于真空冷冻干燥(表1)。在水分含量和水分活度上,热风-真空冷冻联合干燥的龙眼果干与真空冷冻干燥的龙眼果干无显著性差异。在皱缩率上,热风-真空冷冻联合干燥介于两者之间,说明热风-真空冷冻联合干燥相对于热风干燥在一定程度上降低了皱缩率。Table 1
表1
表1热风-真空冷冻联合干燥对龙眼果干水分含量、水分活度和皱缩率的影响
Table 1
| 干燥方式 Drying method | 水分含量 Water content (%) | 水分活度 Water activity | 皱缩率 Shrinkage rate (%) |
|---|---|---|---|
| 热风干燥Got air drying | 14.53±0.59b | 0.63±0.01b | 76.43±2.13c |
| 真空冷冻干燥Vacuum freeze drying | 7.46±0.31a | 0.41±0.01a | 39.21±1.68a |
| 热风-真空冷冻联合干燥 Hot air-vacuum freeze combined drying | 8.02±0.01a | 0.42±0.00a | 47.25±1.28b |
新窗口打开|下载CSV
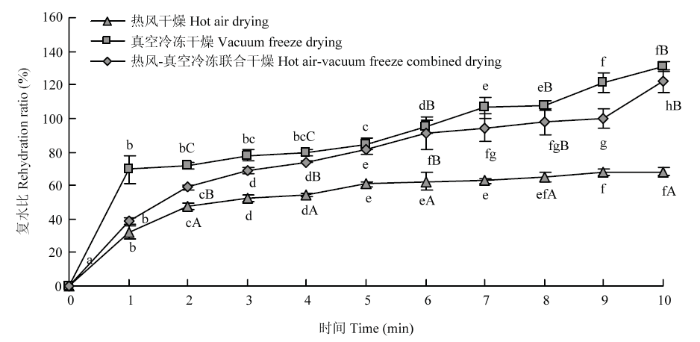
2.1.2 复水比 复水比是评价干制品品质的重要指标,它可以反映物料由干燥引起的结构变化和细胞破坏程度。热风-真空冷冻联合干燥的龙眼果干在不同时间复水比均高于热风干燥而低于真空冷冻干燥。热风干燥的龙眼果干复水比在浸泡5 min后变化较小,其复水性较差。热风-真空冷冻联合干燥龙眼果干复水比介于两者之间,更接近于真空冷冻干燥的龙眼果干。在2—4 min内,3种干燥方式的龙眼果干复水比存在显著性差异。其中,热风-真空冷冻联合干燥的龙眼果干复水比高于热风干燥而低于真空冷冻干燥。然而,当6 min后,热风-真空冷冻联合干燥与真空冷冻干燥的龙眼果干复水比无显著性差异,且均高于热风干燥的龙眼果干(图1)。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1热风-真空冷冻联合干燥对龙眼果干复水比的影响
不同小写字母表示同一干燥方式不同复水时间的数值差异显著(P<0.05);不同大写字母表示相同时间不同干燥方式复水比的数值差异显著(P<0.05)
Fig. 1Effect of hot air-vacuum freeze combined with drying on rehydration ratio of longan fruit
Different lowercase letters indicate significant difference in rehydration time of the same drying method (P<0.05); Different capital letters indicate significant difference of rehydration ratio with different drying methods at the same time (P<0.05)
2.1.3 风味物质 热风-真空冷冻联合干燥对龙眼果干挥发性风味物质的影响见表2。结果表明,热风干燥、真空冷冻干燥、热风-真空冷冻联合干燥分别检测出17、34和23种物质,物质种类共44种,包括烷烃类12种,烯烃类11种,醇类5种,酯类2种,醛类13种,酸类1种。其中10种挥发性风味物质为3种干燥方式所共有。这些挥发性物质按照一定的比例构成了龙眼的特有风味。
Table 2
表2
表2热风-真空冷冻联合干燥对龙眼果干挥发性风味物质的影响
Table 2
| 挥发性物质 Volatile flavor substances | 热风干燥 Hot air drying | 真空冷冻干燥 Vacuum freeze drying | 热风-真空冷冻联合干燥 Hot air-vacuum freeze combined with drying |
|---|---|---|---|
| 烷烃类Alkane | |||
| 三氯甲烷Trichloromethane | — | 0.75±0.09 | 0.25±0.04 |
| 十一烷Undecane | 0.16±0.01 | — | 0.08±0.01 |
| 十二烷Dodecane | 0.08±0.01 | 0.52±0.02 | 0.19±0.13 |
| 十三烷Tridecane | — | 0.41±0.11 | 0.20±0.02 |
| 十四烷Tetradecane | 0.06±0.01 | 0.45±0.00 | 0.21±0.02 |
| 八甲基环四硅氧烷Octamethyl cyclotetrasiloxane | — | 0.18±0.11 | — |
| 十甲基环五硅氧烷Decamethyl cyclopentasiloxane | 0.44±0.23 | 1.30±0.30 | 0.99±0.04 |
| 十二甲基环六硅氧烷Dodecymethyl cyclohexasiloxane | 1.05±0.11 | 1.65±0.11 | 1.03±0.08 |
| 十四甲基环七硅氧烷Tetradecyclic heptasiloxane | 0.69±0.11 | 0.86±0.06 | 0.54±0.01 |
| 十六烷基环八硅氧烷Hexadecyl cycloocsiloxane | 0.09±0.11 | 0.09±0.01 | 0.13±0.01 |
| 正十九烷Nonadecane | 0.08±0.01 | — | — |
| 十八甲基环九硅氧烷Octadecymethyl cyclodoxy siloxane | — | 0.21±0.02 | — |
| 烷烃类总量Total alkane | 2.65±0.12 | 6.42±0.37 | 3.61±0.25 |
| 烯烃类Olefin | |||
| 罗勒烯异构体混合物Mixture of basil isomers | 0.10±0.26 | 15.89±0.86 | 20.07±4.62 |
| (E)-B-罗勒烯(E)-B-ocimene | — | 0.36±0.04 | 0.60±0.11 |
| 别罗勒烯Alloocimene | — | — | 0.71±0.19 |
| 反式石竹烯Trans carnation | — | 0.13±0.00 | 0.10±0.03 |
| 古巴烯Cuba ene | 0.14±0.02 | — | |
| 2,6-二甲基-1,3,5,7-辛四烯2,6-dimethyl-1,3,5,7-octatetracene | — | — | 0.13±001 |
| α–法呢烯α–farnesene | 0.16±0.02 | 0.19±0.02 | |
| (6E)-7,11-二甲基-3-亚甲基-1,6,10-十二碳三烯 (6E)-7,11-dimethyl-3-methylene-1,6,10-dodecatriene | — | 0.28±0.02 | 0.55±0.07 |
| 2,6二乙基吡嗪 2,6-diethylpyrazine | — | 0.55±0.05 | — |
| 2,6-二甲基-6-(4-甲基-3-戊基)双环[3.1.1]七碳-2-烯 2,6-dimethyl-6- (4-methyl-3-pentenyl)-bicyclo [3.1.1]hept-2-ene | — | — | 0.11±0.03 |
| 3,7,11-三甲基-1,3,6,10-十二碳-四烯(E,E)-α-farnesene | — | — | 0.16±0.11 |
| 烯烃类总量Total olefin | 0.10±0.26 | 17.50±0.87 | 22.62±4.96 |
| 醇类Alcohol | |||
| (2R,3R)-(-)-2,3-丁二醇(R,R)-2,3-butanediol | 0.39±0.07 | — | 0.14±0.02 |
| 2,3-丁二醇2,3-butanediol | 0.72±0.24 | 0.92±0.05 | 0.14±0.01 |
| 环己醇Cyclohexanol | 0.07±0.01 | — | — |
| 芳樟醇Linalool | — | 2.03±0.34 | — |
| 苯乙醇Phenethyl alcohol | — | 0.37±0.04 | — |
| 醇类总量Total alcohol | 1.19±0.32 | 3.32±0.03 | 0.13±0.18 |
| 酯类Ester | |||
| 水杨酸甲酯Methyl salicylate | 0.12±0.01 | 1.53±0.09 | — |
| 软脂酸乙酯Ethyl palmitate | 0.07±0.00 | 1.05±0.03 | 0.07±0.02 |
| 月桂酸乙酯Ethyl laurate | — | 2.45±0.07 | 0.04±0.01 |
| 烟酸甲酯Methyl nicotinate | — | 1.13±0.06 | — |
| 苯甲酸乙酯Ethyl benzoate | — | 0.53±0.12 | — |
| 烟酸乙酯Nicotinic acid ethyl ester | — | 0.28±0.13 | — |
| 乙酸乙酯Ethyl acetate | — | 0.12±0.01 | — |
| (Z)-3,7-二甲基-2,6-辛二烯酸甲酯 2,6-octadienoic acid,3,7-dimethyl-, methyl ester | — | 0.20±0.17 | — |
| 癸酸乙酯Ethyl caprate | — | 0.66±0.06 | — |
| 月桂酸甲酯Methyl laurate | — | 0.32±0.05 | — |
| 十四酸乙酯Ethyl myristate | — | 0.76±0.11 | — |
| 14-甲基十五烷酸甲酯Methyl 14-methylpentadecanoate | — | 0.18±0.03 | — |
| 油酸乙酯Ethyl oleate | — | 0.10±0.01 | — |
| 酯类总量Total ester | 0.19±0.01 | 9.30±0.24 | 0.11±0.01 |
| 醛类Aldehyde | |||
| 壬醛Nonanal | 0.12±0.03 | 0.52±0.13 | 0.09±0.02 |
| 癸醛Capraldehyde | 0.07±0.01 | — | — |
| 醛类总量Total aldehyde | 0.20±0.14 | 0.52±0.13 | 0.09±0.02 |
| 酸类Acid | |||
| 壬酸N-nonanoic acid | 0.07±0.00 | — | — |
| 酸类总量Total acids | 0.07±0.00 | — | — |
新窗口打开|下载CSV
就挥发性物质种类及含量而言,热风干燥检出的挥发性物质种类最少,其中最多的是烷烃类8种,最少的是烯烃类和酸类,均为1种;相对含量最高的烷烃类为2.65 μg?g-1,最低的酸类为0.07 μg?g-1。真空冷冻干燥中最多的是醛类,共13种;最少的是酯类,为1种;相对含量最高的为烯烃类(17.50 μg?g-1),最低的为醛类(0.52 μg?g-1)。热风-真空冷冻联合干燥中最多的是烷烃类和烯烃类,均为9种,最少的是酯类,为1种;相对含量最高的是烯烃类(22.62 μg?g-1),最低的是醛类。热风-真空冷冻联合干燥的龙眼果干中烃类物质含量最多,其中别罗勒烯的异构体化合物含量最高,占挥发性物质总量的85.17%。就挥发性物质的总量而言,热风-真空冷冻联合干燥(26.56 μg?g-1)高于热风干燥(4.4 μg?g-1),低于真空冷冻干燥(37.06 μg?g-1)。表明热风-真空冷冻联合干燥的龙眼果干在风味上优于热风干燥,更接近于真空冷冻干燥。
2.1.4 总糖及多糖含量 热风-真空冷冻联合干燥龙眼中总糖及多糖含量见表3。其中,热风-真空冷冻联合干燥的龙眼果干中总糖及多糖含量分别为2.23 mg?g-1 DW和1.96 mg·g-1·DW,低于真空冷冻干燥,而高于新鲜龙眼和热风干燥的含量。
Table 3
表3
表3热风-真空冷冻联合干燥龙眼中总糖及多糖含量
Table 3
| 干燥方式Drying method | 总糖Total sugar (mg?g-1 DW) | 多糖Polysaccharide (mg?g-1 DW) |
|---|---|---|
| 新鲜龙眼Fresh logan | 1.72±0.15a | 1.55±0.15a |
| 热风干燥Hot air drying | 1.86±0.09a | 1.52±0.09a |
| 真空冷冻干燥Vacuum freeze drying | 3.15±0.17c | 2.76±0.18c |
| 热风-真空冷冻联合干燥Hot air-vacuum freeze combined drying | 2.23±0.12b | 1.96±0.13b |
新窗口打开|下载CSV
2.2 热风-真空冷冻联合干燥对能源消耗与干燥时间的影响
干燥相同重量的新鲜龙眼,热风-真空冷冻联合干燥比真空冷冻干燥节约干燥时间12.16%,节约单位能耗25.40%。热风干燥效率高,但其产品品质较差。真空冷冻干燥时间长,能耗大,但品质较好。热风-真空冷冻联合干燥结合两种干燥方式的特点,实现了干燥时间的缩短和能耗的节约,提高了干燥效率(表4)。Table 4
表4
表4热风-真空冷冻联合干燥对龙眼果干单位能耗和干燥时间的影响
Table 4
| 干燥方式 Drying method | 干燥2.4 kg龙眼时间Drying time of 2.4 kg longan (h) | 单位能耗Unit energy consumption (mj?kg-1) | ||||
|---|---|---|---|---|---|---|
| 热风干燥阶段Hot air drying period | 真空冷冻阶段Vacuum freeze drying period | 总耗时 Total time | 热风干燥阶段Hot air drying period | 真空冷冻阶段Vacuum freeze drying period | 总单位能耗、Total unit energy consumption | |
| 热风干燥Hot air drying | 20.00 | — | 20.00 | 7.90 | — | 7.90 |
| 真空冷冻干燥Vacuum freeze drying | — | 74.00 | 74.00 | — | 108.09 | 108.09 |
| 热风-真空冷冻联合干燥 Hot air-vacuum freeze combined with drying | 3.00 | 62.00 | 65.00 | 4.68 | 75.96 | 80.64 |
新窗口打开|下载CSV
2.3 热风-真空冷冻联合干燥对脆性龙眼果干益生活性的影响
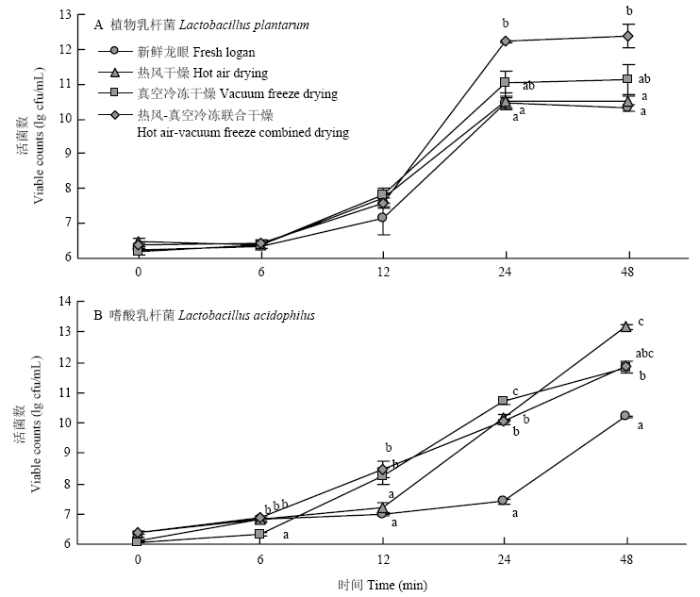
2.3.1 活菌数 新鲜龙眼和不同干燥方式的龙眼果干均可以促进植物乳杆菌生长。当植物乳杆菌开始发酵6 h时活菌数无显著变化,处于迟滞期,12 h时活菌数提高,24 h时活菌数显著提高,达到对数生长期,48 h以后活菌数变化稳定。热风-真空冷冻干燥龙眼果干发酵48 h后活菌数生长最多可达12.40 lg cfu/mL,其次是真空冷冻干燥(11.14 lg cfu/mL)和热风干燥(10.51 lg cfu/mL),新鲜龙眼最低(图2-A)。嗜酸乳杆菌发酵新鲜龙眼和不同干燥方式的龙眼果干,48 h仍未达到稳定期。热风干燥的龙眼在发酵48 h后活菌数达到最大值(13.17 lg cfu/mL),显著高于其余3种。热风-真空冷冻干燥(11.84 lg cfu/mL)和真空冷冻干燥(11.83 lg cfu/mL)活菌数无显著差异,新鲜龙眼活菌数最低(图2-B)。结果表明,新鲜和干制龙眼果干都能增殖植物乳杆菌和嗜酸乳杆菌,但不同菌种和不同干燥方式对活菌数的影响不同。干制可以提高龙眼对益生菌的增殖能力。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2热风-真空冷冻联合干燥的龙眼果干发酵过程中活菌数的变化
不同小写字母表示不同干燥方式在同一发酵时间差异显著(P<0.05)。下同
Fig. 2The change of the number of viable bacteria during the fermentation of dried longan fruit by hot air-vacuum freeze combined with drying
Different lowercase letters indicate significant difference among different drying methods at the same fermentation time (P<0.05). The same as below
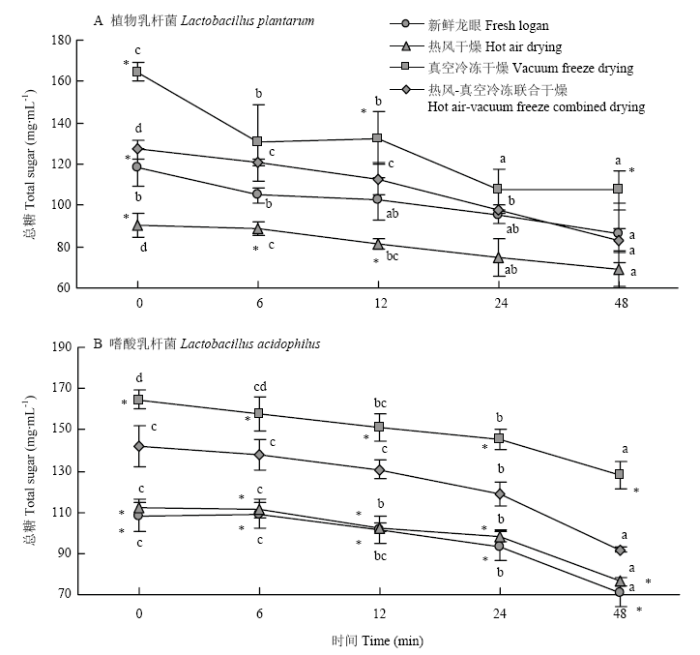
2.3.2 总糖 植物乳杆菌发酵过程中随着发酵时间的延长,总糖含量持续下降,24 h后开始趋于稳定,发酵48 h后,总糖含量与发酵前相比显著降低;发酵48 h后热风干燥龙眼干总糖含量最低,真空冷冻干燥龙眼干的总糖含量显著高于其他干燥方式(图3-A)。嗜酸乳杆菌发酵过程中前12 h总糖变化无显著性差异,12 h以后总糖持续下降且未出现稳定期,与嗜酸乳杆菌活菌数的变化呈负相关关系;发酵48 h后,新鲜龙眼和热风干燥龙眼总糖含量显著低于热风-真空冷冻联合干燥,真空冷冻干燥龙眼总糖含量则显著高于热风-真空冷冻联合干燥(图3-B)。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3热风-真空冷冻联合干燥的龙眼果干发酵过程中总糖的变化
不同小写字母表示同一干燥方式不同发酵时间差异显著(P<0.05);*表示同一发酵时间其他干燥方式与热风-真空冷冻干燥相比差异显著(P<0.05)。下同
Fig. 3The change of the total sugar during the fermentation of dried longan fruit by hot air-vacuum freeze combined with drying
Different lowercase letters indicate significant difference of different fermentation time of the same drying method (P<0.05); * indicate significant difference between other drying methods and hot air-vacuum freeze combined drying at the same fermentation time (P<0.05). The same as below
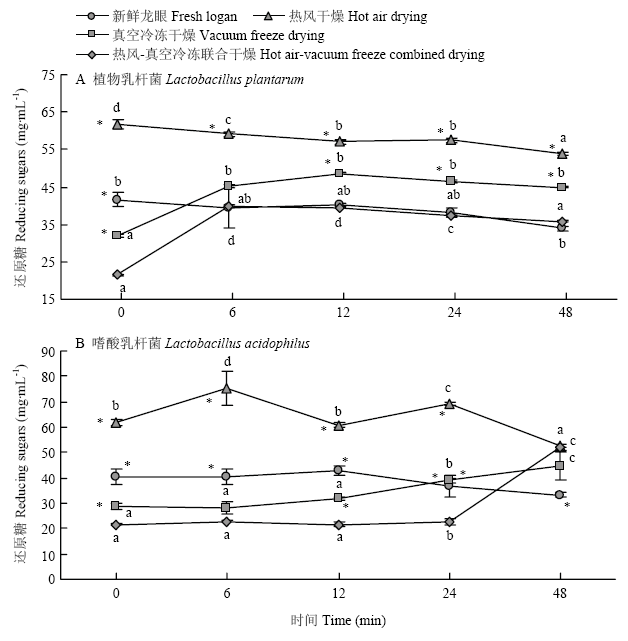
2.3.3 还原糖 植物乳杆菌和嗜酸乳杆菌发酵后呈现较为相似的变化(图4)。随着发酵时间的延长,真空冷冻干燥和热风-真空冷冻联合干燥的龙眼干还原糖均呈上升趋势,而新鲜龙眼和热风干燥龙眼干发酵后还原糖含量降低。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4热风-真空冷冻联合干燥的龙眼果干发酵过程中还原糖的变化
Fig. 4The change of the reducing sugars during the fermentation of dried longan fruit by hot air-vacuum freeze combined with drying
2.3.4 短链脂肪酸 不同干燥方式的龙眼果干经植物乳杆菌发酵48 h后的短链脂肪酸相对于新鲜龙眼显著提高,且不同干燥方式龙眼果干经植物乳杆菌发酵产生的短链脂肪酸的含量差异较大。4种龙眼果干经发酵后均能产生较高含量的乙酸,其次是异戊酸、丙酸、正丁酸,而异丁酸和正戊酸含量较低。其中,热风-真空冷冻联合干燥产生的乙酸(148.92 μmol?mL-1)显著低于热风干燥,与真空冷冻干燥相当。热风-真空冷冻联合干燥的龙眼果干经发酵产生的异丁酸(0.84 μmol?mL-1)含量最高。不同干燥方式的龙眼果干经发酵产生的丙酸、异戊酸、正戊酸含量无显著性差异(表5)。
Table 5
表5
表5热风-真空冷冻干燥的龙眼果干经植物乳杆菌发酵48 h后短链脂肪酸含量变化
Table 5
| 干燥方式 Drying method | 乙酸 Acetic acid | 丙酸 Propionic acid | 异丁酸 Isobutyric acid | 正丁酸 N-butyric acid | 异戊酸 Isovaleric acid | 正戊酸 Pentanoic acid |
|---|---|---|---|---|---|---|
| 新鲜龙眼Fresh logan | 125.92±4.38a | 2.68±0.19a | 0.68±0.03ab | 2.65±0.09a | 4.80±2.51a | 0.28±0.03a |
| 热风干燥Hot air drying | 163.34±7.82c | 5.61±1.02b | 0.78±0.16b | 6.26±0.41c | 6.98±0.57ab | 0.42±0.02b |
| 真空冷冻干燥Vacuum freeze drying | 157.89±2.32bc | 4.65±0.52b | 0.53±0.03a | 4.38±0.66b | 12.14±0.98b | 0.41±0.01ab |
| 热风-真空冷冻联合干燥 Hot air-vacuum freeze combined drying | 148.92±4.63b | 5.90±0.75b | 0.84±0.07b | 3.26±0.24a | 8.65±4.66ab | 0.42±0.12b |
新窗口打开|下载CSV
4种龙眼果干经嗜酸乳杆菌发酵后均能产生较高含量的乙酸,其次是异戊酸、丙酸、正丁酸,而异丁酸和正戊酸含量较低。其中,新鲜和不同干燥方式的龙眼果干经发酵产生的乙酸、正戊酸含量无显著性差异。热风-真空冷冻联合干燥的脆性龙眼果干经发酵产生的丙酸(11.35 μmol?mL-1)、异丁酸(1.80 μmol?mL-1)、异戊酸(9.27 μmol?mL-1)含量显著高于新鲜、热风干燥、真空冷冻干燥(表6)。表明不同干燥方式龙眼果干经嗜酸乳杆菌发酵产生的短链脂肪酸含量差异较大,且益生效果受菌株种类的影响较大。
Table 6
表6
表6热风-真空冷冻干燥的龙眼果干经嗜酸乳杆菌发酵48 h后短链脂肪酸含量变化
Table 6
| 干燥方式 Drying method | 乙酸 Acetic acid | 丙酸 Propionic acid | 异丁酸 Isobutyric acid | 正丁酸 N-butyric acid | 异戊酸 Isovaleric acid | 正戊酸 Pentanoic acid |
|---|---|---|---|---|---|---|
| 新鲜龙眼Fresh logan | 138.18±31.16a | 4.41±0.75a | 0.74±0.33a | 3.38±1.48ab | 8.02±0.06ab | 0.42±0.04a |
| 热风干燥Hot air drying | 179.08±14.05a | 5.47±0.33a | 0.85±0.03a | 4.64±0.43b | 7.60±0.26a | 0.60±0.03a |
| 真空冷冻干燥Vacuum freeze drying | 145.61±24.34a | 5.47±0.68a | 1.41±0.07a | 3.37±0.26ab | 7.19±0.24a | 0.49±0.09a |
| 热风-真空冷冻联合干燥 Hot air-vacuum freeze combined drying | 177.03±27.10a | 11.35±2.12b | 1.80±0.34b | 2.95±0.39a | 9.27±1.31b | 0.68±0.38a |
新窗口打开|下载CSV
3 讨论
热风-真空冷冻联合干燥结合了真空冷冻干燥和热风干燥的特点,且由于其热风干燥时间较短,因此其品质更接近于真空冷冻干燥产品品质。真空冷冻干燥的龙眼果干疏松多孔呈海绵状,亲水性好,复水率高。而热风干燥过程中龙眼果肉内部细胞组织结构塌陷[25],收缩并形成致密结构,这使得产品在再水化期间持水保留的能力较低。张群等[26]研究表明在热风干燥蓝莓的过程中,表面温度高于内部温度将造成表面水分迅速迁移并形成一层硬膜,内部呈现出内裂空隙现象,使热风干燥后的产品干瘪,口感坚硬,复水性差。采用本研究工艺制备的龙眼干色泽微黄,口感较脆硬,咀嚼过程中略带韧性,与市售传统热风干燥产品相比,品质有明显提升。此外,联合干燥脆性龙眼果干水分活度保持在0.6以下,可以认为其不受常见微生物损害,有利于长期保存。在挥发性风味物质上,CHANG等[27]从龙眼中分离出来的挥发性物质主要为醇、醛、酮、酯、烷烃、酸、多酚、呋喃和混杂化合物9类,与本研究结果一致。这些挥发性物质按照一定比例形成了龙眼的特殊风味。其中龙眼烯烃类物质含量最高,依次是烷烃类、酯类,而罗勒烯的异构体化合物含量最高,这与胡文舜等[28]用DVB/CAR/PDMS萃取头检测‘晚香’龙眼含量最高的香气成分是罗勒烯异构体混合物为74.1%的结果一致。真空低温的条件下营养物质的破坏较小,风味保留较好,因此真空冷冻干燥相对于热风干燥挥发性物质的种类更高[29,30]。本研究发现热风-真空冷冻联合干燥相对于热风干燥同样保留了更多的挥发性风味物质种类和含量,略低于真空冷冻干燥。因此,联合干燥在风味上优于热风干燥的产品,更接近于真空冷冻干燥龙眼果干。
本研究比较不同干燥方式龙眼果干对植物乳杆菌和嗜酸乳杆菌的增殖效果,发现发酵过程中两种益生菌的活菌数和部分短链脂肪酸在48 h后显著升高,pH和总糖含量降低,说明龙眼干具有较好的益生活性。笔者课题组前期研究表明,将龙眼干打浆后灌胃小鼠,可以显著提高小鼠肠道内的乳杆菌数量,且对小鼠肠道黏膜免疫系统具有正向调节作用[24]。有研究表明,植物多糖对肠道菌群的组成和代谢产物有显著的影响,特定的多糖可被益生菌分泌的细菌糖苷酶水解成单糖,然后单糖被细菌代谢降解成短链脂肪酸以及气体,导致发酵液的pH显著降低[31]。ALAVIJEH等[32]研究表明开心果果壳多糖可以促进植物乳杆菌和鼠李糖乳杆菌的增殖且能提高发酵液中乙酸、丙酸和丁酸的含量。HU等[33]研究发现车前子种子多糖可部分被人体粪便微生物利用,体外发酵过程中总SCFA、乙酸、丙酸和正丁酸的产量均显著增加,其单糖组成决定了其短链脂肪酸的产生。AHMADI等[34]研究指出,热风干制会引起多糖高分子聚合链的构象改变,结晶度和功能团变化,进而影响其益生活性变化。因此,推测不同干燥方式下龙眼果干的益生活性差异可能是由于不同加工方式引起多糖的理化性质和结构差异所致。此外,多糖选择性地利用肠道中的益生菌,并通过增加肠道中益生菌的数量和调节其代谢物来发挥其健康益处[35]。同一种多糖对不同乳酸菌增殖效果也存在差异,WANG等[36]研究表明,油菜籽不同级分的多糖CRP1和CRP2都能促进双歧杆菌和乳杆菌的增殖,且不同级分的多糖增殖效果不同,表明微生物对多糖的利用程度具有差异性。综上,干燥方式造成的多糖结构变化和微生物对多糖的差异化利用造成了龙眼果浆发酵植物乳杆菌和嗜酸乳杆菌过程中活菌数、pH、总糖、还原糖、短链脂肪酸变化的差异较大。
4 结论
热风-真空冷冻联合干燥龙眼果干的水分含量、水分活度和皱缩率显著低于热风干燥,复水比显著高于热风干燥。联合干燥龙眼果干的总糖含量、多糖含量以及挥发性风味物质种类和总量均低于真空冷冻干燥,而高于热风干燥。热风-真空冷冻联合干燥比真空冷冻干燥节约干燥时间12.16%,节约单位能耗25.40%。此外,植物乳杆菌和嗜酸乳杆菌均能通过发酵龙眼干增加活菌数量,产生短链脂肪酸,降低发酵液pH。龙眼干的益生效果受干燥方式和菌株种类的影响较大。综合考虑,热风-真空冷冻联合干燥结合了热风干燥和真空冷冻干燥两种干燥方式的优点,可以显著缩短干燥时间、节约能耗、提高干燥效率和龙眼果干品质。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.biosystemseng.2018.01.007URL [本文引用: 2]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1016/j.carbpol.2010.03.021URL [本文引用: 1]
DOI:10.1007/s00217-009-1076-2URL [本文引用: 1]

Headspace solid-phase microextraction has been applied to the analysis of volatile components in longan (Dimocarpus longan Lour.). Silica fiber coated with divinylbenzene–carboxen–polydimethylsiloxane (DVB–CAR–PDMS) was found to be more efficient for extracting volatile compounds than other fibers such as those coated with polydimethylsiloxane, polyacrylate, and carboxen–polydimethylsiloxane. The SPME headspace volatiles were collected using a DVB–CAR–PDMS fiber. The extraction conditions were optimized using a response surface experimental design to analyze the effect of three factors: extraction temperature, equilibrium time and extraction time. The best response was obtained when the extraction temperature was around 50°C, equilibrium time near 15min and extraction time close to 25min. The volatile extracts were analyzed using gas chromatograph/mass spectrometry system. Sixty-two different volatile compounds from the headspace of longan were identified. The linearity was good in the considered concentration ranges (R 2≥0.965). Average recoveries ranged from 78.6 to 108.3% and showed good accuracy. The precision of the present method was found to be good (RSD<13.59%). Therefore, this method can be applied to determine the quality of the longan or other volatile components as an alternative to full-scale headspace analysis.
[D].
[本文引用: 4]
[D].
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.lwt.2018.10.027URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.carbpol.2015.02.040URL [本文引用: 1]
