 ,1, 王凤涛1, 庞云星1, 李雪1, 赵爱平1, 张艳霞2, 张金玲1,3, 李文兴4, 何苏琴5, 冯晶1, 李赟1,6, 文才艺6, 徐世昌1
,1, 王凤涛1, 庞云星1, 李雪1, 赵爱平1, 张艳霞2, 张金玲1,3, 李文兴4, 何苏琴5, 冯晶1, 李赟1,6, 文才艺6, 徐世昌1Genetic Diversity of Dactylobotrys graminicola and Its Pathogenicity to Hordeum vulgare var. nudum Seedlings
CHEN Lin1, LIN RuiMing ,1, WANG FengTao1, PANG YunXing1, LI Xue1, ZHAO AiPing1, ZHANG YanXia2, ZHANG JinLing1,3, LI WenXing4, HE SuQin5, FENG Jing1, LI Yun1,6, WEN CaiYi6, XU ShiChang1
,1, WANG FengTao1, PANG YunXing1, LI Xue1, ZHAO AiPing1, ZHANG YanXia2, ZHANG JinLing1,3, LI WenXing4, HE SuQin5, FENG Jing1, LI Yun1,6, WEN CaiYi6, XU ShiChang1通讯作者:
责任编辑: 岳梅
收稿日期:2019-06-18接受日期:2019-08-16网络出版日期:2020-01-01
| 基金资助: |
Received:2019-06-18Accepted:2019-08-16Online:2020-01-01
作者简介 About authors
陈琳,E-mail:lin170521@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (2267KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
陈琳, 蔺瑞明, 王凤涛, 庞云星, 李雪, 赵爱平, 张艳霞, 张金玲, 李文兴, 何苏琴, 冯晶, 李赟, 文才艺, 徐世昌. 禾生指葡孢霉的遗传多样性及对苗期青稞的致病性[J]. 中国农业科学, 2020, 53(1): 213-224 doi:10.3864/j.issn.0578-1752.2020.01.020
CHEN Lin, LIN RuiMing, WANG FengTao, PANG YunXing, LI Xue, ZHAO AiPing, ZHANG YanXia, ZHANG JinLing, LI WenXing, HE SuQin, FENG Jing, LI Yun, WEN CaiYi, XU ShiChang.
0 引言
【研究意义】大麦(Hordeum vulgare)种植分布区域非常广泛,是世界上第四大禾谷类作物(http:// faostat.fao.org)。根据播种面积和产量,大麦也是我国第四大禾谷类作物。大麦是有稃大麦(又称皮大麦)和裸大麦的总称,在我国青藏高原地区裸大麦被称作青稞(H. vulgare var. nudum)。青稞是青藏高原及周边高海拔地区的唯一的小禾谷类粮食作物,也是主要饲草来源。青稞在我国各生态区域均有不同规模种植,但集中分布于青海全省、西藏自治区、四川西北部、甘肃甘南州和云南西北部如迪庆等青藏高原及其周边高海拔冷凉地带。穗腐病是近年来在青藏高原及其周边麦区发现的一种严重危害青稞穗部的真菌新病害,给该地区青稞安全生产带来严重的挑战。研究穗腐病病原菌群体的遗传多样性、系统进化以及对寄主种子萌发及幼苗生长的影响,可以揭示病原菌的流行传播、与寄主植物互作关系以及初侵染菌源,为病害防治提供依据。【前人研究进展】2009年在甘肃省甘南藏族自治州局部青稞地块发现了穗腐病[1],也称鞘腐病,其病原菌无性世代鉴定为禾生指葡孢霉(Dactylobotrys graminicola)[2]。2012年笔者在青海省主要青稞种植区域也发现了这种病害。根据笔者2011—2018年系统跟踪调查结果,目前已在西藏日喀则、青海全省、甘肃甘南州、四川甘孜州青稞种植区域发现了穗腐病,危害程度和流行区域总体呈不断加重和扩散蔓延态势。在病害流行区,一般青稞田块病穗率为1%—5%,局部病穗率高达10%—15%。同时发现,青藏高原青稞田主要禾本科杂草之一野燕麦(Avena fatua)是该病原菌另一个重要自然寄主植物。此外,已发现禾谷类作物如普通小麦(Triticum aestivum)、栽培燕麦(A. sativa)、黑麦(Secale cereale)以及其他禾本科杂草如冰草(Agropyron cristatum)也是其自然寄主。复杂的寄主范围给研究病害传播途径和制定防治技术带来挑战。【本研究切入点】禾生指葡孢霉引起的穗腐病对青稞等小禾谷类作物造成严重经济损失,但对该病原菌的遗传变异以及对寄主植物种子萌发、幼苗生长的影响等情况了解甚少。【拟解决的关键问题】对禾生指葡孢霉菌株进行分离纯化培养,采用SRAP技术分析其遗传多样性,揭示禾生指葡孢霉遗传变异和不同病害流行区域病原菌群体间的关系,进一步分析病原菌群体遗传特征和不同地区间病害传播及流行规律;利用共培养接种试验分析禾生指葡孢霉对青稞种子萌发及幼苗生长的影响,为明确穗腐病初侵染菌源及制定防治策略提供依据。1 材料与方法
试验于2017—2019年在中国农业科学院植物保护研究所完成。1.1 病原菌材料
采集新鲜典型标本共27份,包括3份黑麦、8份野燕麦、14份青稞、1份小麦病穗和1份青稞麦粒(表1),将病穗标本快速脱水干燥后室温保存,用于病原菌分离;以遗传距离较近的小麦赤霉病菌——禾谷镰孢(Fusarium graminearum)作为遗传多样性分析的对照菌株。Table 1
表1
表1禾生指葡孢霉菌株来源、寄主种类及分离的病变组织
Table 1
| 菌株Strain | 来源Origin | 寄主种类/组织Host species/tissue | 采集日期Collection date |
|---|---|---|---|
| Z 13001 | 甘肃合作市 Hezuo, Gansu | 黑麦/穗 Rye/spike | 2013-08 |
| Z 13002 | 甘肃合作市 Hezuo, Gansu | 野燕麦/穗 Wild oat/spike | 2013-08 |
| Z 13003 | 甘肃合作市 Hezuo, Gansu | 青稞/穗 Naked barley/spike | 2013-08 |
| Z 13004 | 甘肃卓尼县 Zhuoni, Gansu | 青稞/穗 Naked barley/spike | 2013-08 |
| Z 13005 | 甘肃临潭县 Lintan, Gansu | 青稞/穗 Naked barley/spike | 2013-08 |
| Z 13006 | 甘肃临潭县 Lintan, Gansu | 青稞/穗 Naked barley/spike | 2013-08 |
| Z 13007 | 甘肃临潭县 Lintan, Gansu | 黑麦/穗 Rye/spike | 2013-08 |
| Z 13008 | 甘肃临潭县 Lintan, Gansu | 小麦/穗 Common wheat/spike | 2013-08 |
| Z 13009 | 甘肃临潭县 Lintan, Gansu | 青稞/穗 Naked barley/spike | 2013-08 |
| Z 13010 | 青海湟中县 Huangzhong, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13011 | 青海湟中县 Huangzhong, Qinghai | 野燕麦/穗 Wild oat/spike | 2013-07 |
| Z 13012 | 青海互助县 Huzhu, Qinghai | 野燕麦/穗 Wild oat/spike | 2013-07 |
| Z 13013 | 青海互助县 Huzhu, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13014 | 青海海晏县 Haiyan, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13015 | 青海海晏县 Haiyan, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13016 | 青海海晏县 Haiyan, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13017 | 青海门源县 Menyuan, Qinghai | 野燕麦/穗 Wild oat/spike | 2013-07 |
| Z 13018 | 青海门源县 Menyuan, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13019 | 青海门源县 Menyuan, Qinghai | 野燕麦/穗 Wild oat/spike | 2013-07 |
| Z 13020 | 青海门源县 Menyuan, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13021 | 青海门源县 Menyuan, Qinghai | 野燕麦/穗 Wild oat/spike | 2013-07 |
| Z 13022 | 青海门源县 Menyuan, Qinghai | 野燕麦/穗 Wild oat/spike | 2013-07 |
| Z 13023 | 青海门源县 Menyuan, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13024 | 青海湟源县 Huangyuan, Qinghai | 黑麦/穗 Rye/spike | 2013-07 |
| Z 13025 | 青海湟源县 Huangyuan, Qinghai | 野燕麦/穗 Wild oat/spike | 2013-07 |
| Z 13026 | 青海湟源县 Huangyuan, Qinghai | 青稞/穗 Naked barley/spike | 2013-07 |
| Z 13027 | 青海海晏县 Haiyan, Qinghai | 青稞/籽粒 Naked barley/seed | 2013-07 |
新窗口打开|下载CSV
1.2 病原菌分离纯化与鉴定
采用常规组织分离法对所采集的典型病穗标本进行病原菌分离与纯化[3]。剥开未抽穗病株叶鞘,选取病变穗部麦芒、小穗穗梗或穗轴,切取小块病样组织(0.5—1.0 cm),经75%乙醇(v/v)消毒3—5 s,在稀释4倍次氯酸钠溶液(活性氯含量7.5%)消毒0.5—1 min后,用无菌水漂洗3遍,每次漂洗10 min,然后移至PDA(马铃薯200 g,葡萄糖20 g,琼脂粉15 g,蒸馏水定容至1 L)培养基平板上,置于23—25℃恒温箱中培养3—5 d,在菌落边缘挑取小块培养基,转移至另一个PDA培养基平板中进行纯化培养,培养基内放置8—10个无菌滤纸片(1.0 cm×1.0 cm),培养7 d后收菌滤纸片,真空干燥后于-20℃长期保存。为抑制细菌污染,可以在PDA培养基中添加乳酸(3—5滴/100 mL)。收集纯化后的病原菌菌株的分生孢子,采用稀释法获得单孢培养物。1.3 病原菌形态鉴定
将分离所得单孢菌株置于23—25℃下培养6—7 d,待产孢后于光学显微镜下观察鉴定病原菌分生孢子和分生孢子梗的形态特征,同时观察记录菌落形态特征,确定分离获得菌株为禾生指葡孢霉。1.4 禾生指葡孢霉对种子萌发和幼苗根系的影响
分离自青海门源县青稞禾生指葡孢霉Z 15403-3-1单孢菌株培养6—7 d后收集分生孢子,用无菌水配制1×103、1×105孢子/mL的孢子悬浮液。将青稞品种‘柴青1号’种子先用70%乙醇消毒5 min,然后在稀释1倍次氯酸钠溶液(活性氯含量7.5%)消毒30 min,无菌水漂洗3次,每次10 min。将消毒后的种子在23—25℃条件下无菌水中浸泡24 h,去除剩余的水继续培养约1 d,待种子萌发后(即胚根突破种皮)用不同浓度的孢子悬浮液浸泡24 h,然后转移至水琼脂(0.5%,w/v)平板上,置于培养箱中继续培养;或将消毒后的种子用灭菌的滤纸吸干多余水分,浸泡在不同浓度的孢子悬浮液24 h,然后转移至水琼脂(0.5%,w/v)平板上在同样条件下继续培养。接种共培养温度为25℃昼/23℃夜,光照时间为16 h·d-1,光照强度为5 000—6 000 lx。每个处理培养3皿,3.0 mL孢子悬浮液浸泡90粒种子,每皿培养30粒种子。发芽率=(发芽种子数/供检测种子总数)×100%,出苗率=(长出幼苗种子数/供检测种子总数)×100%。以灭菌水浸泡已消毒的种子作为空白对照处理(Mock)。培养5 d后调查,采用SPSS Statistics v20(IBM,美国)进行方差齐性检验和单因素方差分析,采用Duncan’s multiple range test(P<0.05)分析处理间差异显著性。试验独立重复2次。1.5 SRAP遗传多样性分析
每个菌株在PDA培养基上培养3皿(直径9 cm),收集培养7 d的菌丝,CTAB(cetyltrimethylammoniumbromide)法提取基因组DNA。检测DNA浓度及纯度,并稀释至标准工作液50 ng·μL-1备用。选取16条已公布的SRAP标准引物(表2)[4],由北京三博远志生物技术有限责任公司合成。以禾生指葡孢霉菌株和禾谷镰孢对照菌株DNA为模板,进行特异PCR引物筛选及遗传多样性分析。PCR反应体系包括Taq酶(5 U·μL-1)0.2 μL,10×PCR缓冲液2.0 μL,dNTPs 0.8 μL,上游引物和下游引物各1.0 μL,DNA模板2.0 μL,加ddH2O至20.0 μL。SRAP-PCR反应体系采用复性变温法,反应程序设定为两个阶段:第一阶段为94℃预变性5 min,94℃变性1 min,35℃退火1 min,72℃延伸2 min,5次循环;第二阶段为94℃变性1 min,50℃退火1 min,72℃延伸2 min,35次循环,72℃延伸5 min,扩增产物置于4℃下保存。制备6%聚丙烯酰胺凝胶,电泳分离检测扩增产物[5]。Table 2
表2
表2SRAP分析的引物序列
Table 2
| 正向引物序列 Forward primer sequence | 反向引物序列 Reverse primer sequence | ||
|---|---|---|---|
| Me1 | TGAGTCCAAACCGGATA | Em1 | GACTGCGTACGAATTAAT |
| Me2 | TGAGTCCAAACCGGAGC | Em2 | GACTGCGTACGAATTTGC |
| Me3 | TGAGTCCAAACCGGAAT | Em4 | GACTGCGTACGAATTTGA |
| Me4 | TGAGTCCAAACCGGACC | Em5 | GACTGCGTACGAATTAAC |
| Me5 | TGAGTCCAAACCGGAAG | Em6 | GACTGCGTACGAATTGCA |
| Me6 | TGAGTCCAAACCGGTAA | Em9 | GACTGCGTACGAATTCGA |
| Me7 | TGAGTCCAAACCGGTCC | Em10 | GACTGCGTACGAATTCAG |
| Me8 | TGAGTCCAAACCGGTGC | Em11 | GACTGCGTACGAATTCCA |
新窗口打开|下载CSV
1.6 进化树分析和DNA指纹检索表构建
以禾生指葡孢霉Z 13005菌株DNA为模板,选用LSU(LRORf:GTACCCGCTGAACTTAAGC,LR5r:ATCCTGAGGGAAACTTC)[6]和Rpb2(RPB2-f5F:GAYGAYMGWGATCAYTTYGG,Rpb2-7cR:CCCAT RGCTTGYTTRCCCAT)[7]保守基因位点引物进行PCR扩增,分别获得DNA片段克隆到T载体(TaKaRa,大连)中测序。分别以LSU、Rpb2部分序列在NCBI数据库中BLAST分析,获得与禾生指葡孢霉的保守基因具有较高相似性的真菌DNA序列,构建进化树。采用MEGA5.05软件进行序列比对处理,NJ(neighbor-joining)法构建系统发育树,进行1 000次Bootstrap检验。基于SRAP分析方法获得的多态性DNA条带结果构建禾生指葡孢霉菌株的二叉式分子检索表,具体方法参考SHAN等[8]。1.7 SRAP数据处理
以Marker øX174 Hae Ⅲ酶切产物和DL500 DNA marker条带为标准,确定PCR产物片段大小(bp),同时采用二进位制记录电泳后DNA条带数据,在扩增产物相同位点处依据条带有和无分别记录为‘1’和‘0’,用于SRAP遗传多样性分析,并利用NTSYS软件的非加权组平均法(UPGMA,Unweighted Pair Group Method with Arithmetic Mean)进行聚类分析。2 结果
2.1 禾生指葡孢霉分离纯化
对27份穗腐病标本(表1)进行病原菌常规组织分离,经培养菌落形态和分生孢子及孢子梗形态特征鉴定,均为目的病原菌的纯培养物,同时获得27个菌株的单孢培养物65份,选用其中21个菌株的单孢培养物进行遗传多样性分析。2.2 禾生指葡孢霉对青稞种子萌发及幼苗生长的影响
将初萌发的青稞种子与禾生指葡孢霉分生孢子悬浮液共培养24 h,然后在水琼脂平板上继续培养5 d,共培养处理能明显抑制幼苗根系生长(图1-A、1-C)。处理后幼苗根系长度与对照(Mock)相比差异显著(P=0.009<0.05),能造成幼苗根系变为浅褐色(图1-A),而不同浓度孢子悬浮液处理间差异均不显著;孢子悬浮液处理后出苗率(P=0.822>0.05)和幼苗平均株高(P=0.206>0.05)与对照相比差异不显著(图1-C)。另外,将表面消毒的未萌发种子与禾生指葡孢霉分生孢子悬浮液共培养24 h,在水琼脂培养基上继续培养5 d后与对照相比较,共培养处理后种子发芽率(P=0.675>0.05)和出苗率(P=0.992>0.05)均差异不显著,青稞幼苗株高(P=0.369>0.05)和幼苗根系长度(P=0.203>0.05)与对照相比也无显著差异(图1-D),幼苗生长没有受到明显的抑制,无明显的褪绿或萎蔫症状(图1-B)。图1
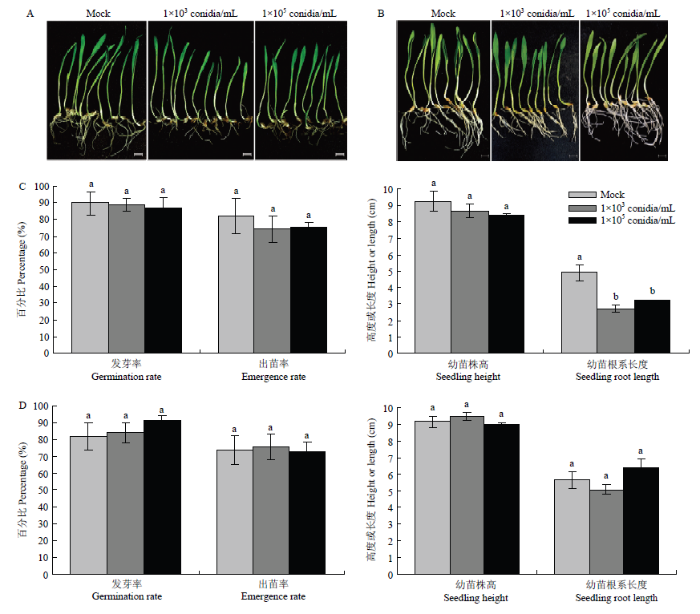 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1禾生指葡孢霉侵染对青稞种子萌发及幼苗生长的影响
标尺Scale bar =1.0 cm
Fig. 1Effects of D. graminicola infection on seed germination and seedling growth of H. vulgare var. nudum
2.3 SRAP引物PCR扩增
利用优化PCR体系扩增反应程序进行引物筛选,选用14对较高多态性的特异性引物组合(表3),共获得具有多态性DNA条带1 255条,平均一对SRAP引物能对21个禾生指葡孢霉菌株和1个禾谷镰孢对照菌株PCR扩增产生90个条带,其中Me6-Em5引物组合扩增产生的多态性条带最多,其次是为Me6-Em10 引物组合。PCR扩增DNA片段大小分布于100—700 bp。统计发现,其中11个禾生指葡孢霉菌株具有1—7个菌株特异性分子标记,分离自小麦菌株Z 13008的特异性标记最多(7个),其次是分离自黑麦(Z 13024)和野燕麦(Z 13002)菌株具有5个特异性标记,而分离自青稞的菌株特异性标记较少(1—4个);未发现其余10个菌株的特异性标记。平均每个禾生指葡孢霉菌株仅有1.4个特异性标记,而对照禾谷镰孢菌株特异性标记多达20个(表4)。Table 3
表3
表3利用14对SRAP引物组合扩增禾生指葡孢霉菌株获得的多态性DNA条带
Table 3
| 引物组合 Primer combination | 多态性条带 Polymorphic band | 引物组合 Primer combination | 多态性条带 Polymorphic band | |
|---|---|---|---|---|
| Me1-Em2 | 59 | Me6-Em5 | 210 | |
| Me3-Em5 | 102 | Me6-Em10 | 177 | |
| Me3-Em11 | 22 | Me7-Em1 | 67 | |
| Me4-Em2 | 108 | Me7-Em4 | 97 | |
| Me4-Em10 | 97 | Me7-Em6 | 52 | |
| Me4-Em11 | 22 | Me7-Em9 | 47 | |
| Me5-Em2 | 88 | Me8-Em5 | 107 |
新窗口打开|下载CSV
Table 4
表4
表4禾生指葡孢霉菌株特异性SRAP分子标记
Table 4
| 菌株 Strain | 标记数目 Number of markers | 菌株特异性标记 Specific marker details a |
|---|---|---|
| F. graminearumb | 20 | Me6-Em5, 230; Me7-Em1, 70; Me7-Em1, 500; Me7-Em4, 120; Me7-Em4, 550; Me7-Em6, 200; Me7-Em6, 310; Me7-Em6, 400; Me8-Em5, 580; Me8-Em5, 120; Me8-Em5, 250; Me4-Em10, 370; Me4-Em10, 330; Me4-Em2, 330; Me4-Em2, 360; Me3-Em5, 500; Me3-Em5, 260; Me3-Em5, 180; Me3-Em5, 160; Me1-Em2, 430 |
| Z 13003-1 | 4 | Me1-Em2, 430; Me4-Em2, 180; Me4-Em11, 270; Me3-Em2, 250 |
| Z 13003 | 3 | Me3-Em2, 250; Me3-Em5, 600; Me3-Em5, 400 |
| Z 13002 | 5 | Me4-Em2, 330; Me3-Em5, 210; Me3-Em2, 370; Me6-Em5, 570; Me6-Em10, 380 |
| Z 13008 | 7 | Me4-Em2, 180; Me4-Em11, 270; Me4-Em11, 210; Me5-Em2, 530; Me3-Em5, 600; Me6-Em10, 100; Me7-Em4, 280 |
| Z 13006 | 2 | Me6-Em5, 320; Me6-Em10, 230 |
| Z 13009 | 1 | Me7-Em4, 230 |
| Z 13012 | 1 | Me3-Em2, 270 |
| Z 13020 | 1 | Me4-Em11, 270 |
| Z 13021 | 1 | Me6-Em10, 100 |
| Z 13024 | 5 | Me7-Em1, 310; Me7-Em1, 120; Me7-Em1, 380; Me7-Em1, 350; Me7-Em1, 600 |
新窗口打开|下载CSV
2.4 禾生指葡孢霉的遗传聚类分析
根据对不同SRAP引物组合产生的PCR条带的统计结果,利用软件NTSYS pc 2.10对试验数据进行非加权组平均法(UPGMA)聚类分析,根据遗传相似系数(GS)法对禾生指葡孢霉21个菌株及对照禾谷镰孢菌株遗传多样性进行聚类(图2)。对照禾谷镰孢菌株与禾生指葡孢霉菌株间菌遗传距离较大,说明SRAP方法可以用于分析禾生指葡孢霉群体中不同菌株间的遗传多样性。分析21份禾生指葡孢霉菌株的遗传距离系数范围0.70—0.99,具有一定的多态性,而与禾谷镰孢遗传距离系数<0.70。在遗传距离0.82水平上,可将21个禾生指葡孢霉菌株划分为4个类群,类群Ⅰ包含17个菌株,来源于甘肃甘南州以及青海省多个地区,分离自寄主植物青稞和野燕麦,类群Ⅱ包括Z 13008和Z 13013,分别从甘肃甘南州临潭县小麦和青海互助县青稞病穗,类群Ⅲ仅包括分离自甘肃甘南州临潭县寄主青稞的菌株Z 13006,而类群Ⅳ仅包括菌株Z 13024,来自青海湟源县寄主黑麦病穗。类群Ⅰ中17个成员与类群Ⅱ、Ⅲ和Ⅳ中的4个菌株遗传背景差异较大。类群Ⅰ中菌株来源地较多样化,病原菌地域分布与其遗传多样性缺乏明显相关性,青海与甘肃流行区间穗腐病原菌交流频繁。根据类群Ⅰ菌株的寄主种类,可以确定青稞和野燕麦对病原菌遗传多样性的选择作用较小;但类群Ⅱ、Ⅲ和Ⅳ中的4个菌株分别分离自小麦(Z 13008)、黑麦(Z 13024)和青稞(Z 13013,Z 13006),其遗传多样性与其他菌株差异较大,说明病原菌群体中存在一定程度的遗传变异,寄主小麦和黑麦可能比青稞和野燕麦对禾生指葡孢霉遗传变异具有更大的选择作用。图2
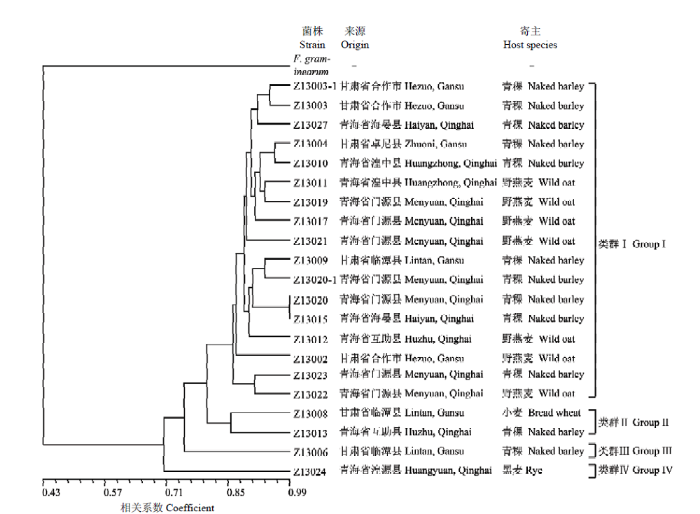 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2基于SRAP遗传多样性鉴定及UPGMA方法分析21个禾生指葡孢霉菌株及对照禾谷镰孢菌株的遗传变异
Fig. 2The dendrogram of 21 D. graminicola strains and one F. graminearum control, constructed by UPGMA based on the total genetic differences identified with SRAP method
2.5 DNA指纹检索表的制定
从14对多态性SRAP引物组合中选择9对引物组合(Me1-Em2、Me3-Em2、Me3-Em5、Me4-Em2、Me6-Em5、Me6-Em10、Me7-Em4、Me7-Em6和Me7-Em9)扩增所得的20个分子标记,编制21个禾生指葡孢霉菌株的DNA指纹二叉式分类检索表,根据检索表可鉴定21个禾生指葡孢霉菌株(表5)。Table 5
表5
表5利用SRAP分子标记构建禾生指葡孢霉及对照禾谷镰孢菌株二叉式分类检索表
Table 5
| SRAP标记 SRAP markera | P/Ab | 菌株数Strain numberc |
|---|---|---|
| 1. Me6-Em5, 290 | P | 4, 6, 8, 12, 15, 16, 19, 20, 21 |
| 1.1 Me6-Em10, 450 | P | 4, 12, 15, 16, 19, 21 |
| 1.1.1 Me7-Em4, 270 | P | 19 |
| 1.1.2 Me7-Em4, 270 | A | 4, 12, 15, 16, 21 |
| 1.1.2.1 Me7-Em4, 190 | P | 4, 12, 16 |
| 1.1.2.1.1 Me3-Em2, 450 | P | 4 |
| 1.1.2.1.2 Me3-Em2, 450 | A | 12, 16 |
| 1.1.2.1.2.1 Me4-Em2, 190 | P | 12 |
| 1.1.2.1.2.2 Me4-Em2, 190 | A | 16 |
| 1.2 Me6-Em10, 450 | A | 6, 8, 20 |
| 1.2.1 Me6-Em5, 260 | P | 6, 20 |
| 1.2.1.1 Me6-Em10, 230 | P | 6 |
| 1.2.1.2 Me6-Em10, 230 | A | 20 |
| 1.2.2 Me6-Em5, 260 | A | 8 |
| 2. Me6-Em5, 290 | A | 1, 2, 3, 5,7 ,9, 10, 11, 13, 14, 17, 18, 22 |
| 2.1 Me7-Em4, 130 | P | 2, 3, 7, 9, 17, 18, 22 |
| 2.1.1 Me6-Em10, 330 | P | 2, 9, 17 |
| 2.1.1.1 Me3-Em2, 650 | P | 2 |
| 2.1.1.2 Me3-Em2, 650 | A | 9, 17 |
| 2.1.1.2.1 Me6-Em10, 170 | P | 9 |
| 2.1.1.2.2 Me6-Em10, 170 | A | 17 |
| 2.1.2 Me6-Em10, 330 | A | 3, 7, 18, 22 |
| 2.1.2.1 Me6-Em10, 120 | P | 7, 21 |
| 2.1.2.1.1 Me7-Em4, 130 | P | 7 |
| 2.1.2.1.2 Me7-Em4, 130 | A | 21 |
| 2.1.2.2 Me6-Em10, 120 | A | 3, 18 |
| 2.1.2.2.1 Me3-Em5, 500 | P | 3 |
| 2.1.2.2.2 Me3-Em5, 500 | A | 18 |
| 2.2 Me7-Em4, 130 | A | 1, 5, 10, 11, 13, 14 |
| 2.2.1 Me1-Em2, 480 | P | 1, 5 |
| 2.2.1.1 Me3-Em2, 500 | P | 1 |
| 2.2.1.2 Me3-Em2, 500 | A | 5 |
| 2.2.2 Me1-Em2, 480 | A | 10, 11, 13, 14 |
| 2.2.2.1 Me3-Em2, 450 | P | 10, 11 |
| 2.2.2.1.1 Me7-Em6, 450 | P | 10 |
| 2.2.2.1.2 Me7-Em6, 450 | A | 11 |
| 2.2.2.2 Me3-Em2, 450 | A | 13, 14 |
| 2.2.2.2.1 Me7-Em9, 450 | P | 13 |
| 2.2.2.2.2 Me7-Em9, 450 | A | 14 |
新窗口打开|下载CSV
2.6 禾生指葡孢霉的进化关系
以核糖体大亚基(LSU)和RNA聚合酶Ⅱ第2大亚基(Rpb2)基因的两个保守位点序列(LSU+ Rpb2)构建进化树,Cladosporium sphaerospermum作为外群对照菌株。禾生指葡孢霉与肉座菌目(Hypocreales)丛赤壳科(Nectriaceae)的丛赤壳属(Nectria sp.)真菌遗传距离最近,其次是镰孢菌属(Fusarium sp.)真菌,而与肉座菌科(Hypocreaceae)真菌(如Cladobotryum sp.、Hypomyces sp.和Trichoderma sp.)遗传距离较远(图3)。此外,利用其他保守位点序列组合(LSU+TUB和RPB2+TUB)构建进化树,也验证了禾生指葡孢霉与丛赤壳属真菌遗传距离较近。图3
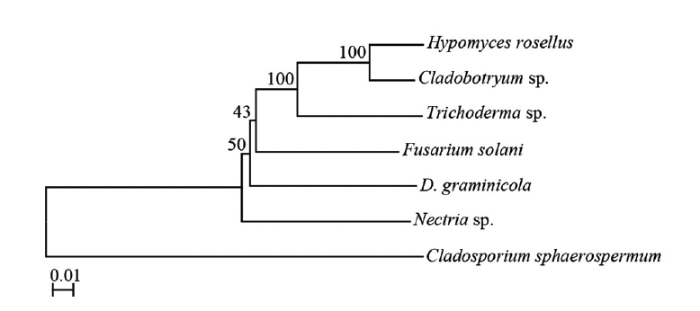 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3依据两个保守基因位点(LSU+Rpb2)序列构建的禾生指葡孢霉及其相关类群的精简系统发育树
菌株LSU和Rpb2序列GenBank序列号GenBank accession numbers of LSU and Rpb2 sequences of fungal species:Cladobotryum sp.(MH871991,FN868654);Hypomyces rosellus(FN859443,EU710774);Trichoderma sp.(MH333256,FJ860531);Fusarium solani(AY097317,AB986567);Nectria sp.(JN939838,HM534886);Cladosporium sphaerospermum(KY873376,KJ443161);D. graminicola(菌株Z 13005,本研究测序结果Strain Z 13005, sequences in this study)
Fig. 3Parsimonious phylogenetic tree of D. graminicola and related fungal species based on genomic sequences of two loci (LSU + Rpb2)
3 讨论
3.1 禾生指葡孢霉群体的遗传多样性及其系统发育
依据ITS1-5.8S-ITS2序列分析结果,禾生指葡孢霉与肉座菌目丛赤壳科一些属种(如Cosmospora sp.、Pseudocosmospora eutypellae和N. flavoviridis)的遗传距离比与其他属种真菌的遗传距离近[2]。在此基础上,利用两个保守基因位点(LSU+Rpb2)序列组合进一步构建精简进化树,发现禾生指葡孢霉与丛赤壳属真菌遗传距离最近,其次是镰孢菌属真菌(图3)。因此,可以初步确定穗腐病原菌属于丛赤壳科,该结果还需要从有性世代的形态特征以及多个保守基因位点的系统发育树构建分析加以验证。SRAP标记技术非常适合用于生物遗传多样性的分析和基因标记定位研究[9,10],如用于金针菇[11]、西葫芦[12]种质资源鉴定以及遗传图谱构建[4,13-14]。本研究中采用SRAP技术分析得出21个禾生指葡孢霉菌株的遗传距离相关系数范围为0.70—0.99,群体内具有一定水平的遗传变异,但与禾谷镰孢遗传背景差异较大(图2),进一步验证了利用保守基因位点构建的系统发育树的分析结果。仅获得11个禾生指葡孢霉菌株的特异性分子标记,平均每个菌株仅有1.4个特异性标记,而对照禾谷镰孢菌株特异性标记多达20个(表4),说明禾生指葡孢霉群体中遗传多样性水平明显低于作为多种禾谷类作物重要病原真菌的禾谷镰孢。3.2 禾生指葡孢霉的分子标记
类似于植物分类检索表,基于基因组DNA分子标记编制的二分式检索表首先用于区别萝卜品种[15],该方法已用于构建花椰菜品种、野生鹰嘴豆及窄叶羽扇扁豆的指纹图谱[8,16-17],利用MFLP分子标记编制了遗传多样性较低的栽培鹰嘴豆品种分子检索表[18]。在本研究中利用20个SRAP分子标记编制了21个禾生指葡孢霉菌株的分子检索表(表5),便于禾生指葡孢霉菌株的分子鉴定。3.3 寄主植物对病原菌遗传变异的选择
在青藏高原及周边麦区发生的禾谷类作物穗腐病的地域分布具有一定的局限性,目前仅在青海各州、甘肃甘南高海拔地区以及西藏日喀则青稞、燕麦以及野燕麦、冰草等禾本科杂草上发现了该病害(表1)。在自然条件下禾生指葡孢霉仅侵染寄主幼穗引起穗腐病,同时侵染包裹幼穗的旗叶叶鞘或倒二叶叶鞘形成梭形褐色病斑,而不能侵染叶片组织或从叶鞘外表面直接侵入幼穗。因此该病原菌的致病性较弱,仅适合在气候冷凉的青藏高原独特生态环境中进化成为青稞和燕麦等麦类作物及多种禾本科杂草的病原菌。病原菌在寄主-病原菌互作识别、相互适应过程中建立寄生关系,二者协同进化能导致寄主抗病等位基因及病原菌毒性等位基因和遗传结构的高度多样化[19,20,21]。因此,寄主对病原菌基因型具有关键的选择作用,也是维持病原菌遗传多样性及致病性变异的一种机制,如小眼夜蛾核多角体病毒(Panolis flammea nucleopolyhedrovirus,PaflNPV)能侵染多种昆虫寄主,从而改变了田间病毒遗传多样性[22];胶孢炭疽菌(Colletotrichum gloeosporioides)遗传多样性及其致病性变异才能适应寄主毛薯(Dioscorea alata)数量抗病性[23]。在本研究中,禾生指葡孢霉的最初主要寄主可能是青藏高原普遍分布的野燕麦及本地唯一的麦类粮食作物青稞,二者对病原菌的遗传变异具有相似的选择作用,而在自然界中野燕麦可能是穗腐病流行与病原菌传播途径中的重要‘桥梁’寄主。与青稞不同,小麦和黑麦仅在低海拔或温度较高的局部区域内种植,要克服小麦和黑麦寄主作物抗病性及逆境胁迫,禾生指葡孢霉发生了更明显的遗传变异(图2)。另外,依据穗腐病自然发生危害情况调查结果,常见的主要危害对象是青稞、栽培燕麦和野燕麦,而采集到的小麦、黑麦及冰草病害标本较少。因此,青稞和野燕麦是禾生指葡孢霉更适宜的寄主植物,然后寄主范围逐渐扩大。因标本来源不均匀,还需要更多菌株验证不同寄主对禾生指葡孢霉遗传变异的选择效应的差异。同时,在分离自青稞和野燕麦的菌株中,个别菌株与其他菌株的遗传相似性存在较大的变异,如Z 13013和Z 13006。甘肃甘南州和青海省是相对独立的穗腐病流行区域,但在遗传多样性聚类分析中菌株地域分布与其遗传多样性缺乏明显相关性(图2)。因此,青藏高原地区禾生指葡孢霉受到相似的环境选择压力,病原菌可能随带菌种子等病原载体在不同区域传播扩散,导致来自地理距离较近的甘肃和青海禾生指葡孢霉菌株的遗传变异不具有明显的地域分布特征。3.4 禾生指葡孢霉与近缘属种病原真菌的致病性比较
丛赤壳科包括150个属(http://www.mycobank. org/),多数是腐生菌,其中一些属种是重要的农作物病原真菌。丛赤壳属真菌能侵染多种作物或树木,如N. ipomoeae(异名Neocosmospora ipomoeae)的无性世代是爪哇镰孢(F. javanicum),侵染番茄引起茎腐病[24];N. galligena(异名Neonectria galligena,N. ditissima)的无性世代为Cylindrocarpon mali,能侵染苹果等多种果树引起溃疡病[25];赤霉属(Gibberella sp.)的无性世代大多属于镰孢属,如G. zeae(无性世代F. graminearum)能侵染多种禾本科植物,引起麦类作物赤霉病[26]及玉米苗枯、根腐、茎基腐和穗腐等病害[27];麦类雪腐菌(Monographella nivalis,异名Calonectria graminicola,C. nivalis)的无性世代为雪腐镰孢(F. nivale),能造成麦类作物雪腐病和赤霉病[28]。禾生指葡孢霉作为丛赤壳科中新成员,目前发现该病原菌仅危害麦类作物及禾本科杂草,引起穗腐病,寄生能力较弱,与丛赤壳科其他植物病原菌的营养方式和侵染特点高度相似。3.5 禾生指葡孢霉对青稞种子萌发和幼苗生长的影响
被病原菌侵染的种子是重要的初侵染菌源,降低了种子发芽率和种子活力,引起苗期病害。例如麦根腐平脐蠕孢(Bipolaris sorokiniana)或Alternaria spp.侵染大麦或小麦灌浆期种子引起黑胚病[29],能严重降低种子发芽率[30]。麦根腐平脐蠕孢、黄色镰孢(F. culmorum)和禾谷镰孢侵染大麦根系和幼苗引起普通根腐病和立枯病[29]。大麦条纹病菌(Pyrenophora graminea)引起的大麦条纹病是典型的种传病害,种子带菌几乎不影响种子萌发及出苗[29]。然而禾生指葡孢霉仅侵染麦类作物及野燕麦等禾本科杂草植物穗部,因此携带病原菌的种子是重要的初侵染源之一,也是该病害跨区域传播的主要途径。利用禾生指葡孢霉分生孢子悬浮液与已发芽或未发芽的青稞种子进行共培养试验(图1),结果表明其对青稞种子萌发及对幼苗植株生长无明显影响,仅高浓度的孢子悬浮液与已发芽的青稞种子共培养24 h能明显抑制幼苗根系生长,根系颜色变为浅褐色,对幼嫩根系能产生致病作用。因此禾生指葡孢霉对青稞种子萌发以及幼苗生长期间的致病作用微弱,它是一种弱致病性植物病原真菌,种子携带的病原菌不能对青稞种子萌发和幼苗正常生长产生明显的致病作用。而该病原菌可能在青稞或其他禾本科杂草寄主根部或表层土壤中植物枯残组织上生长扩繁,为在青稞生育后期侵染穗部提供初始菌源。另外,在青稞收获时节,青稞或其他禾本科杂草的病穗组织极易破碎而遗落在田间地表或表层土壤中,这些病残体也能在青稞生育中后期产生和积累大量的分生孢子,是穗腐病的主要初侵染菌源。4 结论
由禾生指葡孢霉侵染麦类作物以及多种禾本科杂草的幼穗引起穗腐病,它是仅在我国青藏高原及其周边的部分青稞种植区域发生的一种真菌新病害。禾生指葡孢霉是弱致病性病原菌,对青稞种子萌发及幼苗生长无明显的抑制作用,其与丛赤壳属真菌遗传距离较近,是丛赤壳科新成员。禾生指葡孢霉基因组多态性较低,其遗传变异与寄主种类及其所处的环境条件密切相关。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
2版. 蔺瑞明,冯晶, 陈万权, 徐世昌, 译. ,
[本文引用: 3]
2nd ed. LIN R M, FENG J, CHEN W Q, XU S C, trans.
[本文引用: 3]
[本文引用: 1]
