 ,2, 柴红梅2, 张焱珍1,21
,2, 柴红梅2, 张焱珍1,21 2
The Extracellular Enzymes Activity of F1 Generations and Single-spore Isolations in Agrocybe salicacola Strain YAAS711
ZHOU HuiMing1,2, ZHAO YongChang ,2, CHAI HongMei2, ZHANG YanZhen1,21
,2, CHAI HongMei2, ZHANG YanZhen1,21 2
通讯作者:
责任编辑: 赵伶俐
收稿日期:2019-04-8接受日期:2019-08-3网络出版日期:2019-10-16
| 基金资助: |
Received:2019-04-8Accepted:2019-08-3Online:2019-10-16
作者简介 About authors
周会明,E-mail:632243530@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (478KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
周会明, 赵永昌, 柴红梅, 张焱珍. 杨柳田头菇YAAS711菌株F1子代胞外酶活性分析[J]. 中国农业科学, 2019, 52(20): 3672-3684 doi:10.3864/j.issn.0578-1752.2019.20.017
ZHOU HuiMing, ZHAO YongChang, CHAI HongMei, ZHANG YanZhen.
0 引言
【研究意义】杨柳田头菇(Agrocybe salicacola)隶属于真菌界、担子菌亚门、伞菌纲、伞菌亚纲、伞菌目、球盖菇科、田头菇属[1,2],其生长于亚热带地区柳树上,具有外观美、肉质嫩、味道鲜、口感佳等优点,为中国云南省特有的珍稀食用菌。虽然该菌人工栽培出菇,但农艺性状较差,由于资源的稀缺性及遗传育种相关的基础研究不多,开展杨柳田头菇YAAS711菌株F1子代胞外酶活性分析研究对杂交亲本选择具有指导意义。【前人研究进展】目前,对杨柳田头菇的一些研究主要集中在形态观察[3,4]、分子生物学鉴定[5]、菌株驯化[6]、生物活性物质分离[7,8,9]、转录组比较[10]、交配基因分析[11]、交配型测定[12]、品种选育[13]等方面,但缺少必要的生理生化基础研究。杨柳田头菇市场需求较大,人工种植比较容易,但从野生子实体中分离出来的菌株,因其农艺性状不稳定,无法应用于商业化生产用种,选育杂交品种成为其推广的当务之急。亲本的生理特性对杂交后代的影响极为重要,该研究为品种的驯化和优良菌株的选择提供足够的理论支持。胞外酶是一类产生于细胞内而在细胞外发挥作用的酶,其活性大小与食用菌种类和培养基质密切相关[14]。食用菌在整个生长发育阶段可向培养基质中分泌多种胞外酶,这些酶可将培养基中的大分子物质(纤维素、半纤维素、木质素、淀粉、果胶、蛋白质等)水解成小分子物质供菌丝吸收和利用[15]。通过对食用菌胞外酶活性的研究,可以了解各种食用菌在不同发育阶段的胞外酶分泌特点、活性大小及动态变化趋势[16],推测不同食用菌对培养基质中木质纤维素、淀粉等大分子营养成分的降解动态,对提高其栽培技术具有重要意义。目前在榆黄蘑(Pleurotus citrinopileatus)[17]、黄孢原毛平革菌(Phanerochaete chrysosporium)[18]、雅致栓孔菌(Lenzites elegans)[19]、平菇(Pleurotus spp.)[20]、巴尔喀什蘑菇(Agaricus balchaschensis)[21]、蜜环菌(Armillaria spp.)[22]、玉木耳(Auricularia fuscosuccinea)[23]、红托竹荪(Dictyophora rubrovalvata)[24]、茶树菇(Agrocybe aegerita)[25]、白灵侧耳(Pleurotus tuoliensis)[26]等大型真菌的胞外酶活性已开展了研究,上述食用菌胞外酶与其生长发育密切相关。【本研究切入点】杂交育种的难点是亲本选择,多数的杂交育种研究都是随机选择,不仅工作量大,也具有较大的盲目性。在前期的研究中发现单孢菌株群体在生长速度上有较大的差异,组合配对的双核体生长与单核体存在某种关系,一般而言,菌丝的生长速度与基质利用(即分泌胞外酶降解基质)相关。有关双核体胞外酶与两单核体亲本之间的关系研究未见报道,探索单核体交配极性、交配因子和胞外酶活性对形成的双核体胞外酶活性的影响,将为杂交育种的亲本定向选择奠定基础。杨柳田头菇不同极性单核菌株的胞外酶活性至今尚未报道,笔者对该菇的前期研究工作表明,菌株YAAS711分离的单核体在直径为90 mm的培养皿YPD培养基上培养,根据其生长速度分为生长快型(F:2.2—3.5 mm?d-1)和生长慢型(S:1.2—1.4 mm?d-1)两类,单孢菌株群体中每种极性都有生长速度快慢之分,生长速度极慢的单核菌株几乎集中在一种交配型AyBy中[12]。按生长速度将每种极性中的单孢菌株分为两类,数量多的为I型菌株(包括生长速度快(F)的AxBx、AxBy、AyBx和生长速度慢(S)的AyBy),数量少的为II型菌株(包括生长速度慢(S)的AxBx、AxBy、AyBx和生长速度快(F)的AyBy)。【拟解决的关键问题】以I型菌株中F×F和F×S组合为对照,对II型中F或S单孢菌株进行组合,共形成6种双核体组合,对18个单核体与22个双核体的9种胞外酶活性进行测定与分析,找出杨柳田头菇单核体与双核体胞外酶活性变化规律。1 材料与方法
1.1 单核体与双核体
杨柳田头菇菌株YAAS711由采集于云南省香格里拉市的野生子实体分离得到,试验用的成熟子实体在云南省农业科学院生物技术与种质资源研究所实验室通过袋栽法获得。无菌条件下,将新鲜子实体置于灭过菌的带有硫酸纸的培养皿内收集担孢子,稀释涂布法制备单孢菌株,单核体配对获得双核菌丝体(表1)[12,27]。不同菌株的9种胞外酶活性研究于2018年9月在滇西科技师范学院生物技术与工程学院实验室开展。Table 1
表1
表1试验菌株
Table 1
| 菌株Strain | AxBx (F) | AyBy (S) | AxBy (F) | AyBx (F) | |
|---|---|---|---|---|---|
| 单核体 Monokaryotic strain | 001、130、173、 185 | 020、029、032、 071、187 | 026、034、036、048、 076、163、182 | 096、186 | |
| 双核体 Dikaryotic strain | F×F: 001*020、001*032 F×S: 001*029、001*071、001*187 S×S: 071*130、071*173、071*185 F×S: 020*130、020*173、020*185、 032*130、032*173、032*185 | F×F: 036*096、036*186、096*034 F×S: 096*026、096*048、096*076、 096*163、096*182 | |||
新窗口打开|下载CSV
1.2 菌株培养与粗酶液制备
将已活化的单核体与双核体菌株接种于YPD(0.2%蛋白胨、0.2%酵母膏、2%葡萄糖、1.5%琼脂)固体培养基,在25℃条件下培养,平皿生长速率法测定生长速度[12]。将单核体与双核体菌株接种于YPD固体培养基,在(24±1)℃下黑暗培养15 d,用直径7 mm打孔器处理培养菌株边缘打孔,挑取1块接种于含120 mL YPD液体培养液(除不含琼脂外,成分同固体)的250 mL三角瓶中,3次重复,置于旋转式摇床,100 r/min、(25±1)℃下黑暗培养10 d。过滤(200目三层尼龙纱布),取滤液,离心(4℃、4 000 r/min、20 min),上清液即为粗酶液,置于-20℃下保存,用于胞外酶测定[28]。1.3 酶活测定
40个子代个体是单独一个处理下的酶活测试,羧甲基纤维素酶、滤纸纤维素酶、β-葡糖糖苷酶、半纤维素酶以及淀粉酶的测定采用二硝基水杨酸(DNS)法[29],所有酶活单位用U表示。1.3.1 羧甲基纤维素酶 以羧甲基纤维素钠为底物,用pH 4.6、0.1 mol?L-1柠檬酸缓冲液配制0.5%羧甲基纤维素(CMC)溶液。向试管(3支样品、3支对照)中加入0.5%的CMC-Na溶液0.75 mL,样品管加粗酶液0.125 mL,50℃恒温水浴保温30 min,取出后立即加入DNS试剂0.75 mL(对照管加入DNS后再加入0.125 mL酶液),沸水浴10 min,取出立即冷却,加蒸馏水25 mL,混匀,于520 nm测OD值,依据葡萄糖标准曲线(图1-A)求得还原糖量[30]。1 U=1 mg葡萄糖?(30 min)-1?mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l mg葡萄糖为一个活力单位)。
图1
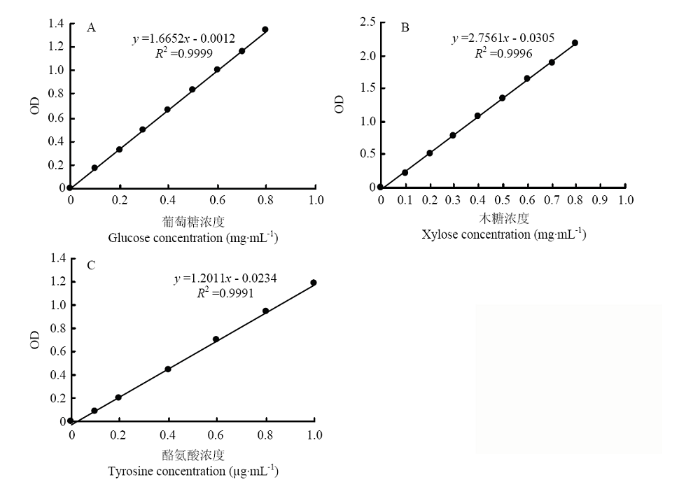 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1标准曲线
A:葡萄糖标准曲线;B:木糖标准曲线;C:酪氨酸标准曲线
Fig. 1Standard curve
A: Glucose standard curve; B: Xylose standard curve; C: Tyrosine standard curve
1.3.2 滤纸纤维素酶 以一层滤纸(规格:1 cm×6 cm,新华1号)为底物,向试管(3支样品、3支对照)中加入一条新华1号滤纸,而后加入0.1 mol? L-1柠檬酸缓冲液(pH 4.6)0.5 mL,再往样品管中加入粗酶液0.125 mL,置于50℃保温60 min,取出后,立即加入DNS试剂1.5 mL(对照管加入DNS后再加入0.125 mL酶液),沸水浴10 min,取出冷却后加蒸馏水至25 mL,混匀,然后于520 nm处测OD值,依据葡萄糖标准曲线求得还原糖量[31]。1 U=1 mg葡萄糖?(60 min)-1?mL-1发酵液(即1 mL发酵液中的酶量与底物作用60 min释放出l mg葡萄糖为一个活力单位)。
1.3.3 β-葡糖糖苷酶 以纤维二糖为底物,向试管(3支样品、3支对照)中加入0.2%的纤维二糖0.5 mL,样品管加入粗酶液0.075 mL,50℃恒温水浴保温30 min,取出后立即加入DNS试剂0.75 mL(对照管加入DNS后再加入0.075 mL酶液),沸水浴10 min,取出立即冷却,加蒸馏水15 mL,摇匀,于520 nm测OD值,依据葡萄糖标准曲线求得还原糖量[32]。1 U=1 mg葡萄糖?(30 min)-1?mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l mg葡萄糖为一个活力单位)。
1.3.4 半纤维素酶 以木聚糖为底物,用pH 4.6、0.2 mol?L-1的乙酸缓冲液配制0.5%木聚糖溶液。向试管中(3支样品、3支对照)加入0.5%的木聚糖0.75 mL,样品管加粗酶液0.05 mL,50℃恒温水浴保温30 min,取出立即加入DNS试剂0.75 mL(对照管加入DNS后再加0.05 mL酶液),沸水浴10 min,取出立即冷却,加蒸馏水10 mL,摇匀,于520 nm测OD值。依据木糖标准曲线(图1-B)求还原糖量[33]。1 U=1 mg木糖?(30 min)-1?mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l mg木糖为一个活力单位)。
1.3.5 淀粉酶 以可溶性淀粉为底物,向试管(3支样品、3支对照)中加入0.5%的可溶性淀粉溶液0.5 mL,样品管加入粗酶液0.05 mL,混匀,38℃恒温水浴保温30 min,取出立即加入DNS试剂0.75 mL(对照管加入DNS后再加入0.05 mL酶液),沸水浴10 min,取出立即冷却,加蒸馏水10 mL,摇匀,于520 nm测OD值,依据葡萄糖标准曲线求得还原糖量[34]。1 U=1 mg葡萄糖?(30 min)-1?mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l mg葡萄糖为一个活力单位)。
1.3.6 蛋白酶 以酪蛋白为底物,向试管中(3支样品、3支对照)加入2%酪蛋白(预热至30℃)1 mL,样品管加入稀释10倍的粗酶液0.5 mL摇匀,30℃保温10 min,加入10%三氯乙酸l mL中止反应,再吸取粗酶液0.5 mL加入对照管中,摇匀,25℃静置30 min,离心(4℃、3 000 r/min)2 min。另取试管(3支样品,3支对照),然后分别加入0.5 mL上清测定液、对照液,分别加入2.5 mL的0.4 mol?L-1碳酸钠溶液,最后加入0.5 mL福林-酚试剂,摇匀,30℃水浴保温30 min,取出后置于分光光度计650 nm处测OD值,依酪氨酸标准曲线(图1-C)求值[35]。1 U=1 μg酪氨酸?(30 min)-1?mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l μg酪氨酸为一个活力单位)。
1.3.7 木质素酶 木质素酶主要包括漆酶、多酚氧化酶及过氧化物酶,参考EGGER[36]、POINTING[37]、SIK[38]等的方法测定。酶活性定义:1 U=ΔOD?(30 min)-1?mL-1发酵液,即1 mL发酵液中的酶量每分钟使OD值改变0.01为一个活力单位。
1.3.7.1 漆酶 向试管中(3支样品、3支对照)加入3.36 mmol?L-1邻联甲苯胺0.5 mL作为底物,加入0.2 mol?L-1乙酸缓冲液(pH 4.6)3 mL,样品管再加入0.4 mL酶液,对照管中加入煮沸10 min的粗酶液0.4 mL,置28℃恒温水浴下反应30 min,取出后立即于600 nm处测OD值。
1.3.7.2 多酚氧化酶 向试管中(3支样品、3支对照)加入0.1 mmol?L-1的邻苯二酚2.0 mL和0.05 mol?L-1磷酸缓冲液(pH=6.0)2.0 mL,样品管再加入粗酶液0.4 mL,对照管中加入煮沸10 min的粗酶液0.4 mL,28℃恒温水浴保温30 min,取出后立即于400 nm处测0D值。
1.3.7.3 过氧化物酶 向3支样品管加入粗酶液0.4 mL,3支对照管中加入煮沸10 min的粗酶液0.4 mL,再分别加入过氧化物反应混合物(取愈创木酚0.019 mL,过氧化氢0.028 mL,pH 6.0的0.2 mol?L-1磷酸缓冲液100 mL混合)3.0 mL,倒入比色皿立即计时30 min,测定470 nm的OD值。
1.4 统计分析
活性值的测定均为3次重复,采用SPSS 19.0 统计软件对所有数据进行分析[39]。2 结果
2.1 杨柳田头菇不同单核体的菌丝生长速度及其9种胞外酶活性分析
通过上述方法测定杨柳田头菇不同单核体的菌丝生长速度和胞外酶活性。多重比较(Duncan法)结果表明,不同的单核体其菌丝生长速度与9种胞外酶活性均存在较大的差异,在显著水平为0.05上各自均表现出不同程度的显著差异(表2)。大部分菌丝生长速度较快的单核体的胞外酶活性也较高,反之,胞外酶活性较低;但少数类型Ⅱ单核体如026、182及173等却出现菌丝生长速度与大部分胞外酶活性成反比的现象。同时,除类型Ⅱ的单核体048和020的羧甲基纤维素酶外,所有单核体的淀粉酶、滤纸纤维素酶、半纤维素酶、β-葡糖糖苷酶、羧甲基纤维素酶及蛋白酶比过氧化物酶、多酚氧化酶、漆酶的活性高。因此,单核体生长发育阶段,淀粉、纤维素、半纤维素及蛋白质是其菌丝通过胞外酶降解并吸收利用的主要大分子物质,对木质素的要求较少。Table 2
表2
表2杨柳田头菇不同单核体的菌丝生长速度与胞外酶平均活力的差异
Table 2
| 单核体 Monokaryon | 菌丝生长速度 Mycelial growth rate (cm?d-1) | 胞外酶平均活力 Average activity of extracellular enzymes (U) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| CMC | FP | βG | HC | AM | PR | LA | PPO | POD | ||
| 001 | 0.30±0.01c | 3.20±0.68a | 3.89±0.60bcdef | 1.55±0.35cde | 2.77±0.88bcdef | 7.59±0.86a | 1.48±0.33abcd | 0.77±0.04b | 0.27±0.06fg | 0.39±0.06a |
| 020 | 0.39±0.01a | 0.10±0.03f | 3.43±0.41cdefgh | 1.42±0.21cde | 3.41±0.37ab | 6.28±0.13b | 1.21±0.03abcde | 0.70±0.02c | 0.58±0.03b | 0.19±0.03d |
| 026 | 0.15±0.00e | 2.68±0.58ab | 3.20±0.46defgh | 2.11±0.58bcd | 2.57±0.53cdefg | 7.80±0.08a | 1.50±0.55abc | 0.13±0.01fgh | 0.34±0.08ef | 0.31±0.05ab |
| 029 | 0.14±0.02e | 1.28±0.19de | 5.23±1.28ab | 1.73±0.23cde | 3.04±0.28abcde | 2.02±0.26e | 0.89±0.11cde | 0.07±0.01h | 0.10±0.01jk | 0.35±0.07a |
| 032 | 0.34±0.03b | 1.92±0.90bcd | 4.67±0.12bcd | 3.17±1.77ab | 3.00±0.38abcde | 5.47±0.19c | 1.22±0.11abcde | 0.69±0.02c | 0.61±0.07ab | 0.21±0.05cd |
| 034 | 0.23±0.01d | 2.34±0.57abc | 2.74±0.67fgh | 1.75±0.15cd | 2.59±0.47cdefg | 4.21±0.43d | 1.22±0.18abcde | 0.18±0.07ef | 0.18±0.05hi | 0.36±0.04a |
| 036 | 0.33±0.01b | 2.30±0.56abc | 4.42±0.85bcde | 3.09±0.73ab | 2.40±0.05defg | 4.27±0.30d | 1.27±0.18abcde | 0.06±0.01h | 0.42±0.08d | 0.31±0.02ab |
| 048 | 0.15±0.01e | 0.15±0.04f | 3.54±1.41cdefg | 1.48±0.22cde | 3.13±0.14abcd | 0.95±0.40f | 0.81±0.01e | 0.15±0.02efg | 0.21±0.04ghi | 0.35±0.03a |
| 071 | 0.14±0.01e | 2.29±0.12abc | 4.75±0.82bc | 0.42±0.19e | 1.89±0.20g | 3.66±0.73d | 1.34±0.32abcde | 0.11±0.01fgh | 0.15±0.02ij | 0.35±0.08a |
| 076 | 0.11±0.01f | 0.66±0.56ef | 6.18±0.85a | 1.35±0.84cde | 2.24±0.16efg | 1.22±0.50f | 0.81±0.04e | 0.08±0.01gh | 0.23±0.02gh | 0.32±0.03ab |
| 096 | 0.33±0.01b | 2.56±0.41ab | 1.99±0.83h | 3.46±0.86a | 2.59±0.69cdefg | 5.36±0.12c | 1.73±0.85ab | 0.87±0.02a | 0.31±0.04f | 0.36±0.02a |
| 130 | 0.15±0.01e | 1.15±0.56de | 3.85±0.44bcdef | 1.28±0.52de | 3.04±0.20abcde | 2.11±0.40e | 0.84±0.05de | 0.39±0.08d | 0.04±0.01k | 0.31±0.06ab |
| 163 | 0.15±0.00e | 2.27±0.33abc | 2.36±0.97gh | 1.65±0.77cde | 3.21±0.74abc | 0.83±0.35f | 0.90±0.07cde | 0.11±0.09fgh | 0.14±0.03ij | 0.34±0.06a |
| 173 | 0.15±0.00e | 2.42±0.20abc | 3.16±0.50efgh | 1.57±0.95cde | 3.62±0.32a | 7.66±0.54a | 1.16±0.43abcde | 0.15±0.01efg | 0.50±0.03c | 0.30±0.08abc |
| 182 | 0.13±0.01e | 2.64±0.25abc | 4.78±0.74bc | 2.61±0.37abc | 3.66±0.16a | 5.12±0.58c | 1.13±0.24bcde | 0.15±0.01efg | 0.40±0.02de | 0.34±0.01a |
| 185 | 0.15±0.00e | 0.64±0.07ef | 3.46±0.17cdefg | 0.91±0.55de | 2.02±0.35fg | 0.90±0.43f | 0.94±0.01cde | 0.22±0.07e | 0.27±0.03fg | 0.31±0.06ab |
| 186 | 0.35±0.03b | 1.53±0.58cde | 4.59±0.16bcde | 1.52±0.21cde | 2.41±0.13cdefg | 4.37±0.11d | 1.79±0.61a | 0.65±0.02c | 0.66±0.03a | 0.34±0.08a |
| 187 | 0.15±0.00e | 1.23±0.61de | 3.54±0.94cdefg | 1.45±0.36cde | 3.04±0.07abcde | 1.96±0.51e | 0.88±0.11cde | 0.10±0.02gh | 0.23±0.01gh | 0.32±0.03bcd |
新窗口打开|下载CSV
2.2 杨柳田头菇不同双核体的菌丝生长速度及其9种胞外酶活性分析
双核体的菌丝生长速度和胞外酶活性多重比较(Duncan法)结果表明,不同类型的双核体其菌丝生长速度与9种胞外酶活性均存在较大的差异(P<0.05)(表3)。对于类型Ⅰ单核体组合所形成的双核体来说,单核体菌丝生长速度“快-慢”组合与“快-快”组合相比,前者除半纤维素酶、蛋白酶和多酚氧化酶外,其他胞外酶活性都较高,具有类型Ⅱ单核体参与形成的双核体的胞外酶活性却各不相同且无规律,一部分双核体(如:020*173、096*163)胞外酶活性表现较高,另一部分双核体(如:096*026、032*185)胞外酶活性却较低。总之,在22个双核体中,组合编号为001*029、096*163、020*173等的胞外酶活性较高,而组合编号为036*096、071*185、071*130等胞外酶活性较低。同时,除部分双核体蛋白酶(001*029、001*071、001*187、032*173和096*026)、半纤维素酶(020*185和032*173)和β-葡萄糖苷酶(071*185和096*026)外,所有双核体的淀粉酶、滤纸纤维素酶、半纤维素酶、β-葡糖糖苷酶、羧甲基纤维素酶及蛋白酶比过氧化物酶、多酚氧化酶、漆酶的活性高。因此,双核体生长发育阶段,对大分子物质的需求与单核体相似。Table 3
表3
表3杨柳田头菇不同双核体的菌丝生长速度与胞外酶平均活力的差异
Table 3
| 双核体 Dikaryon | 菌丝生长速度 Mycelial growth rate (cm?d-1) | 胞外酶平均活力 Average activity of extracellular enzymes (U) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| CMC | FP | βG | HC | AM | PR | LA | PPO | POD | ||
| 001*020 | 0.29±0.01g | 2.96±0.22bcde | 5.13±0.68bcde | 3.07±0.22ab | 1.61±0.51de | 6.00±0.72cdef | 1.33±0.26abcd | 0.87±0.02b | 0.47±0.03cd | 0.28±0.02def |
| 001*029 | 0.32±0.02def | 3.53±0.10abcd | 4.30±1.21cdefg | 3.22±0.93ab | 3.31±0.72a | 10.09±0.97a | 1.18±0.21abcd | 1.26±0.09a | 0.26±0.02gh | 0.48±0.04a |
| 001*032 | 0.30±0.01fg | 0.88±0.64h | 4.87±0.20cdef | 3.13±0.25ab | 3.09±0.40a | 6.83±0.31bcd | 1.50±0.05abcd | 0.74±0.22b | 0.42±0.07cde | 0.27±0.10def |
| 001*071 | 0.30±0.03fg | 3.85±0.26abc | 5.02±0.20bcdef | 3.18±0.88ab | 3.29±0.55a | 6.77±0.40bcd | 1.03±0.67bcd | 1.36±0.43a | 0.23±0.05hi | 0.45±0.10ab |
| 001*187 | 0.35±0.00abc | 3.52±0.44abcd | 4.25±0.52cdefg | 3.23±0.72ab | 3.28±0.50a | 6.90±0.84bc | 1.29±0.30abcd | 1.30±0.03a | 0.20±0.04hi | 0.34±0.03cde |
| 020*130 | 0.34±0.00bcd | 4.54±0.79a | 3.44±0.75efgh | 1.58±0.42def | 1.35±0.36ef | 7.85±0.27b | 1.62±0.28abcd | 1.13±0.03a | 0.35±0.11efg | 0.27±0.10def |
| 020*173 | 0.36±0.02ab | 2.96±0.51bcde | 4.52±0.59cdefg | 2.70±0.51bcd | 2.95±0.34abc | 9.38±0.20a | 1.48±0.40abcd | 1.22±0.18a | 0.27±0.04gh | 0.25±0.02defg |
| 020*185 | 0.33±0.01bcde | 4.56±0.66a | 6.60±1.24b | 3.19±0.60ab | 0.45±0.09f | 4.98±0.49fgh | 1.28±0.31abcd | 1.13±0.01a | 0.49±0.11c | 0.18±0.03fgh |
| 032*130 | 0.37±0.02a | 3.50±0.70abcd | 5.98±0.51bc | 3.02±0.61abc | 1.87±0.59bcde | 7.00±0.16bc | 1.64±0.93abc | 1.23±0.04a | 0.28±0.05fgh | 0.23±0.04efgh |
| 032*173 | 0.35±0.01abc | 3.00±0.92bcde | 4.75±0.44cdefg | 3.40±0.87ab | 0.88±0.24ef | 7.00±0.92bc | 1.18±0.36abcd | 1.27±0.19a | 0.35±0.02efg | 0.14±0.01h |
| 032*185 | 0.35±0.01abc | 4.06±0.12ab | 2.44±0.93h | 1.78±0.16cdef | 1.87±0.50cde | 5.56±0.55defg | 1.52±0.10abcd | 1.23±0.02a | 0.19±0.02hi | 0.24±0.03defgh |
| 071*130 | 0.22±0.00h | 2.63±0.52cde | 4.43±0.33cdefg | 0.78±0.77f | 1.56±0.28de | 3.42±0.10i | 0.95±0.03cd | 0.10±0.01c | 0.67±0.04ab | 0.32±0.06cde |
| 071*173 | 0.21±0.01hi | 1.49±0.46gh | 3.42±0.65efgh | 1.43±0.42ef | 2.68±0.91abcd | 1.23±0.34j | 0.86±0.05d | 0.06±0.02c | 0.59±0.03b | 0.35±0.03bcd |
| 071*185 | 0.21±0.01hi | 2.09±0.81ef | 4.64±0.84cdefg | 0.74±0.09f | 1.94±0.25bcde | 7.35±0.48bc | 0.99±0.17cd | 0.09±0.02c | 0.74±0.07a | 0.35±0.07bcd |
| 036*096 | 0.23±0.01h | 2.61±0.73de | 3.96±0.73defgh | 2.90±0.39abc | 1.99±0.91bcde | 4.18±0.53hi | 1.89±0.73a | 0.70±0.01b | 0.38±0.05def | 0.16±0.03gh |
| 036*186 | 0.19±0.01i | 2.71±0.30cde | 3.33±0.61fgh | 2.89±0.87abc | 1.52±0.47e | 4.63±0.63ghi | 1.79±0.10ab | 0.71±0.04b | 0.38±0.11def | 0.28±0.01def |
| 096*026 | 0.31±0.01efg | 3.21±0.71bcde | 4.31±0.51cdefg | 1.13±0.72ef | 1.91±0.96bcde | 6.19±0.65cdef | 1.16±0.37abcd | 1.20±0.06a | 0.35±0.04efg | 0.14±0.10h |
| 096*034 | 0.29±0.02g | 3.14±1.05bcde | 3.04±0.66gh | 2.82±0.90abc | 3.57±0.08a | 4.68±0.56gh | 1.70±0.09abc | 1.34±0.27a | 0.38±0.02def | 0.25±0.01defg |
| 096*048 | 0.30±0.01fg | 2.91±0.68bcde | 4.64±1.01cdefg | 2.30±0.96bcde | 2.98±0.67ab | 7.15±1.34bc | 1.29±0.30abcd | 1.21±0.19a | 0.22±0.03hi | 0.41±0.01abc |
| 096*076 | 0.31±0.01fg | 3.48±0.85abcd | 4.19±2.25defg | 4.05±0.52a | 1.93±0.22bcde | 7.26±1.53bc | 1.47±0.11abcd | 1.22±0.01a | 0.14±0.02i | 0.31±0.10cde |
| 096*163 | 0.33±0.03cde | 2.84±0.22bcde | 8.30±1.48a | 3.17±0.44ab | 1.99±0.82bcde | 6.42±0.79cde | 1.35±0.37abcd | 1.22±0.08a | 0.25±0.09gh | 0.41±0.05abc |
| 096*182 | 0.29±0.00g | 3.44±0.70abcd | 5.36±0.70bcd | 2.86±0.88abc | 3.14±0.94a | 5.37±0.62efgh | 1.39±0.57abcd | 1.21±0.06a | 0.29±0.02fgh | 0.24±0.01defgh |
新窗口打开|下载CSV
2.3 单核体菌丝生长速度与9种胞外酶活性之间的相关性分析及通径分析
为分析不同胞外酶活力大小与杨柳田头菇菌丝生长速度的关系,对18个单核体的菌丝生长速度及其9种胞外酶平均活力进行相关性分析及通径分析[40]。相关性分析结果表明(表4),所测定的胞外酶平均活力除滤纸纤维素酶、半纤维素酶、过氧化物酶外,其余与单核体菌丝生长速度呈正相关;其中单核体的菌丝生长速度与漆酶、多酚氧化酶、蛋白酶的平均酶活力呈极显著正相关(P<0.01),与淀粉酶、β-葡萄糖苷酶的平均酶活力呈显著正相关(P<0.05)。因此,单核体的菌丝生长速度与9种胞外酶平均活力存在着一定程度的相关性。Table 4
Table 4Correlation coefficients among mycelial growth rate and average activity of extracellular enzymes
| 项目 Item | CMC | FP | βG | HC | AM | PR | LA | PPO | POD |
|---|---|---|---|---|---|---|---|---|---|
| CMC | 1.000 | ||||||||
| FP | -0.226 | 1.000 | |||||||
| βG | 0.408 | -0.149 | 1.000 | ||||||
| HC | -0.007 | -0.205 | 0.224 | 1.000 | |||||
| AM | 0.590** | -0.183 | 0.358 | 0.220 | 1.000 | ||||
| PR | 0.558* | -0.214 | 0.360 | -0.268 | 0.700** | 1.000 | |||
| LA | 0.090 | -0.225 | 0.316 | 0.043 | 0.453 | 0.609** | 1.000 | ||
| PPO | 0.038 | 0.072 | 0.383 | 0.179 | 0.575* | 0.531* | 0.467 | 1.000 | |
| POD | 0.408 | -0.080 | -0.144 | -0.272 | -0.197 | 0.112 | -0.225 | -0.570* | 1.000 |
| 菌丝生长速度 Mycelial growth rate (cm?d-1) | 0.089 | -0.161 | 0.469* | -0.033 | 0.473* | 0.644** | 0.785** | 0.664** | -0.370 |
新窗口打开|下载CSV
上述相关性分析只能表明胞外酶活力与单核体菌丝生长速度之间的直接关系,但不同胞外酶之间相互作用对其影响没有直观表现。因此,需在相关性分析的基础上进行通径分析,通过逐步回归分析法,把胞外酶活力与单核体菌丝生长速度之间的相关性分解为直接作用和间接作用,筛选出与单核体菌丝生长速度较为密切的胞外酶种类。
以单核体菌丝生长速度为因变量Y,羧甲基纤维素酶、滤纸纤维素酶、β-葡萄糖苷酶、HC、半纤维素酶、淀粉酶、蛋白酶、漆酶、多酚氧化酶和过氧化物酶分别为自变量X1、X2、X3、X4、X5、X6、X7、X8和X9。采取多元线性回归分析法,剔除偏回归系数不显著的自变量,建立Y的最优多元回归方程为:Y=0.086+0.205X7+0.202X8(F=20.136,P=0.000<0.01),多元线形回归方程的F检验达到极显著,进一步做通径分析。
通径分析结果表明(表5),在2个自变量与Y的多元线形回归方程中,直接通径作用的关联程度为X7>X8,间接通径的关联程度为X8>X7,决策系数的大小为X7>X8。因此,X8通过X7对Y的间接作用大于X7通过X8对Y的间接作用(0.284>0.178),说明多酚氧化酶对单核体的菌丝生长速度的间接影响大于漆酶,但漆酶对单核体的菌丝生长速度的综合作用(包括直接作用以及与其他胞外酶的协同作用)最大(R2=0.585)。同时,多酚氧化酶与漆酶共同作用参与木质素的降解,因此,在杨柳田头菇单核体的生长发育过程中,木质素对其影响较大。
Table 5
表5
表5以菌丝生长速度为因变量的通径分析
Table 5
| 自变量 Independent variable | 相关系数 Related coefficient | 直接通径系数 Direct path coefficient | 间接通径系数 Indirect path coefficient | 决策系数(R2) Decision coefficient | ||
|---|---|---|---|---|---|---|
| →LA(X7) | →PO(X8) | 间接通径系数总和 Total of Indirect path coefficient | ||||
| LA(X7) | 0.785 | 0.607 | 0.178 | 0.178 | 0.585 | |
| PPO(X8) | 0.664 | 0.380 | 0.284 | 0.284 | 0.360 | |
新窗口打开|下载CSV
2.4 双核体菌丝生长速度与9种胞外酶活性之间的相关性分析及通径分析
双核体的菌丝生长速度与胞外酶的相关性分析表明(表6),所测定的胞外酶平均活力除多酚氧化酶与过氧化物酶外,其余与其菌丝生长速度呈正相关。其中双核体的菌丝生长速度与漆酶、淀粉酶、羧甲基纤维素酶的平均酶活力呈极显著正相关(P<0.01),但与多酚氧化酶平均酶活力呈极显著负相关(P<0.01)。因此,杨柳田头菇单核体菌丝的生长速度与9种胞外酶平均活力也存在着一定程度的相关性。Table 6
表6
表6菌丝生长速度及其胞外酶平均活力的相关系数
Table 6
| 项目 Item | CMC | FP | βG | HC | AM | PR | LA | PPO | POD |
|---|---|---|---|---|---|---|---|---|---|
| CMC | 1.000 | ||||||||
| FP | 0.038 | 1.000 | |||||||
| βG | 0.189 | 0.327 | 1.000 | ||||||
| HC | -0.256 | -0.188 | 0.135 | 1.000 | |||||
| AM | 0.296 | 0.172 | 0.307 | 0.186 | 1.000 | ||||
| PR | 0.173 | -0.176 | 0.399 | -0.041 | 0.090 | 1.000 | |||
| LA | 0.649** | 0.169 | 0.612** | 0.192 | 0.549** | 0.358 | 1.000 | ||
| PPO | -0.470* | -0.027 | -0.617** | -0.316 | -0.475* | -0.406 | -0.864** | 1.000 | |
| POD | -0.092 | 0.129 | 0.030 | 0.508* | 0.241 | -0.407 | -0.069 | -0.106 | 1.000 |
| 菌丝生长速度 Mycelial growth rate (cm?d-1) | 0.554** | 0.276 | 0.416 | 0.023 | 0.612** | 0.158 | 0.814** | -0.666** | -0.134 |
新窗口打开|下载CSV
以相关性分析为基础,对胞外酶活力与双核体菌丝生长速度进行通径分析,剔除偏回归系数不显著的自变量,建立Y的最优线性方程为:Y=0.195+ 0.104X7(F=39.276,P=0.000<0.01),线形回归方程的F检验达到极显著。总之,漆酶对双核体的菌丝生长速度的作用最大,不同胞外酶之间的协同作用对双核体菌丝的生长速度影响较小。
2.5 极性对9种胞外酶平均活力的影响分析
在单核体的基础上,根据极性不同将单核体分为AxBx、AyBy、AxBy和AyBx 4类,分别计算每一类极性中单核体的9种胞外酶平均活力,通过多重比较(Duncan法)分析不同极性对9种胞外酶平均活力的影响。结果表明(表7),β-葡萄糖苷酶、淀粉酶、漆酶、多酚氧化因极性不同而表现出一定的显著差异,其余胞外酶酶活的表现无差异。Table 7
表7
表7不同极性对胞外酶平均活力的影响
Table 7
| 极性 Polarities | 胞外酶平均活力 The average activity of extracellular enzymes (U) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| CMC | FP | βG | HC | AM | PR | LA | PPO | POD | |
| AxBx | 1.85±0.38a | 3.59±0.68a | 1.32±0.59b | 2.86±0.44a | 4.56±0.56ab | 1.10±0.21a | 0.38±0.15b | 0.27±0.03b | 0.33±0.07a |
| AyBy | 1.36±0.39a | 4.32±0.71a | 1.64±0.55ab | 2.87±0.26a | 3.88±0.36bc | 1.11±0.14a | 0.33±0.02b | 0.33±0.03b | 0.28±0.05a |
| AxBy | 1.86±0.50a | 3.89±0.85a | 2.00±0.52ab | 2.83±0.32a | 3.49±0.38c | 1.09±0.18a | 0.12±0.05c | 0.27±0.05b | 0.28±0.03a |
| AyBx | 2.04±0.50a | 3.29±0.50a | 2.49±0.54a | 2.50±0.41a | 4.87±0.12a | 1.76±0.73a | 0.76±0.02a | 0.49±0.04a | 0.35±0.05a |
新窗口打开|下载CSV
2.6 交配因子与9种胞外酶平均活力的影响分析
用上述同样的方法,在单核体的基础上,根据交配因子不同将单核体分为Ax、Ay、Bx和By 4类,分别计算每一类交配因子中单核体的9种胞外酶平均活力,通过多重比较(Duncan法)分析不同交配因子对9种胞外酶平均活力的影响。结果表明(表8),大部分胞外酶因交配因子不同而未表现出差异性,只有漆酶、多酚氧化酶、过氧化物酶存在一定的显著差异。Table 8
表8
表8不同交配因子对胞外酶平均活力的影响
Table 8
| 交配因子 Mating factor | 胞外酶平均活力 The average activity of extracellular enzyme (U) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| CM | FP | βG | HC | AM | PR | LA | PO | PE | |
| Ax | 1.86±0.45a | 3.78±0.79a | 1.76±0.55a | 2.84±0.36a | 3.88±0.44a | 1.09±0.19a | 0.22±0.08b | 0.27±0.04c | 0.67±0.15a |
| Ay | 1.56±0.42a | 4.03±0.65a | 1.88±0.55a | 2.77±0.30a | 4.16±0.29a | 1.30±0.31a | 0.45±0.02a | 0.38±0.03a | 0.30±0.05b |
| Bx | 1.92±0.42a | 3.49±0.62a | 1.71±0.57a | 2.74±0.43a | 4.66±0.41a | 1.32±0.38a | 0.51±0.11a | 0.34±0.03ab | 0.34±0.06b |
| By | 1.65±0.45a | 4.07±0.79a | 1.85±0.54a | 2.85±0.30a | 3.65±0.37a | 1.10±0.16a | 0.21±0.03b | 0.30±0.04bc | 0.31±0.04b |
新窗口打开|下载CSV
3 讨论
据有关文献报道,大型真菌菌丝体的生长速率是由多个基因控制的数量性状位点[41,42]。大型真菌菌丝生长速度与酶类、激素分泌和耐温特性等[43,44]相关,并已经证实其单核体菌丝生长速度相关控制基因或数量基因座与交配因子[45]和自我识别系统连锁[46]。然而,直接说真菌胞外酶活性与菌丝生长速度相关的研究目前尚未见报道。本研究发现杨柳田头菇单核体中生长速度较快的也具有较高的胞外酶活性,生长速度较慢的其胞外酶活性低,因此,单核体胞外酶活性与菌丝生长速度之间可能存在一定的相关性。本研究发现,在显著水平为0.05上,极性对胞外酶的影响大于交配因子,目前的研究已证明交配因子A和B本身并不连锁且存在于不同的染色体上[47,48]。因此,杨柳田头菇单核体的胞外酶活性是与极性有相关性的多基因控制的数量性状,而不是与单独的交配因子相关。
高等真菌在人工驯化栽培过程中,其有性繁殖阶段交配型因子位点内出现重组的现象极其普遍,常常引发交配因子的偏分离,偏分离现象在Coprinus cinereus[49]、Lentinula edodes[50]、Amylostereum areolatum[46]等中均有报道,可导致极性菌株不成比例,严重者还出现某一极性丢失的现象[51],与正常菌株相比,偏分离菌株会出现一些不同的特征,如菌丝生长速度和胞外酶活性异常。本研究发现,除一些单核体和双核体菌株外,类型Ⅰ菌株的胞外酶活性有一定的规律。因此,单核体的菌丝生长速度与本极性异常与其胞外酶活性相关。
4 结论
淀粉酶、滤纸纤维素酶、半纤维素酶、β-葡萄糖苷酶、羧甲基纤维素酶及蛋白酶活性在单核体和双核体的表达水平较高;单核体与双核体的胞外酶活性极有可能与菌丝生长速度、极性相关,其中漆酶对单核体和双核体菌丝生长速度的影响较大,极性对胞外酶平均活力的影响大于交配因子。单核体的菌丝生长速度与本极性异常是改变各菌株生长速度和胞外酶活性表达水平的根源。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 4]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

研究了桑木层孔菌Phellinus mori液体培养过程中发酵液中淀粉酶、果胶酶、羧甲基纤维素酶(CMC酶)和漆酶等4种胞外酶的活性变化,同时测定了蛋白质、还原糖和pH的变化。结果表明,桑木层孔菌拥有丰富的胞外酶系,淀粉酶酶活第7天时达到最大值,果胶酶在第9天和第12天的酶活都较高,羧甲基纤维素酶第10天时酶活最高,漆酶酶活第9天时达到最大值,说明桑木层孔菌对淀粉类物质利用最早。蛋白质浓度在第8天和第11天时出现两个峰值,还原糖浓度随培养时间逐渐降低,发酵液pH值在培养初期逐渐变小,后期逐渐变大。
Magsci [本文引用: 1]

研究了桑木层孔菌Phellinus mori液体培养过程中发酵液中淀粉酶、果胶酶、羧甲基纤维素酶(CMC酶)和漆酶等4种胞外酶的活性变化,同时测定了蛋白质、还原糖和pH的变化。结果表明,桑木层孔菌拥有丰富的胞外酶系,淀粉酶酶活第7天时达到最大值,果胶酶在第9天和第12天的酶活都较高,羧甲基纤维素酶第10天时酶活最高,漆酶酶活第9天时达到最大值,说明桑木层孔菌对淀粉类物质利用最早。蛋白质浓度在第8天和第11天时出现两个峰值,还原糖浓度随培养时间逐渐降低,发酵液pH值在培养初期逐渐变小,后期逐渐变大。
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
