 ,
,Evaluation of Genotype Differences of Cold Tolerance of Sweet Potato Seedlings by Subordinate Function Value Analysis
XU Shu1, LI Ling1, ZHANG SiMeng1, CAO RuXia1, CHEN LingLing1, CUI Peng1, Lü ZunFu1, WU LieHong2, LU GuoQuan ,
,通讯作者:
责任编辑: 李莉
收稿日期:2019-03-29接受日期:2019-05-24网络出版日期:2019-09-01
| 基金资助: |
Received:2019-03-29Accepted:2019-05-24Online:2019-09-01
作者简介 About authors
徐舒,E-mail:727359337@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (1248KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
徐舒, 李玲, 张思梦, 曹如霞, 陈玲玲, 崔鹏, 吕尊富, 吴列洪, 陆国权. 基于隶属函数分析的甘薯薯苗耐冷性基因型差异研究[J]. 中国农业科学, 2019, 52(17): 2929-2938 doi:10.3864/j.issn.0578-1752.2019.17.002
XU Shu, LI Ling, ZHANG SiMeng, CAO RuXia, CHEN LingLing, CUI Peng, Lü ZunFu, WU LieHong, LU GuoQuan.
0 引言
【研究意义】甘薯(Ipomoea batatas (L.) Lam)作为起源于热带的薯类作物,其生长发育在寒冷地区会受到抑制,0—8℃易发生冷害[1]。低温伤害是冷害胁迫的初级阶段[2]。低温胁迫会使植物体内发生一系列异常的生理生化反应,影响植物的生长,甚至引起植株死亡[3]。探索植物的耐低温机制,可为北方薯区、海拔较高地区或早栽甘薯栽培和品种筛选提供较好的理论参考依据。【前人研究进展】当植物遭遇冷害时,细胞产生大量活性氧,高浓度的活性氧具有很强的氧化能力,能与所有细胞成分发生反应,进而影响膜系统的稳定性,对植物造成极其严重的伤害[4,5]。杨舒贻等[6]通过对逆境胁迫植物进行研究,表明在逆境条件下植物的抗氧化酶会起保护机制,诱导植物对胁迫环境产生耐受性。黄湛等[7]通过对甘薯薯块抗寒性探究,表明耐寒性与品种有关。XIE等[8]通过高通量测序寻找出甘薯在贮藏期间产生的低温相应基因。JIA等[9]通过对木薯的低温研究发现天然胞质SOD和APX的表达通过环状ROS(活性氧)清除同时激活抗氧化防御机制,从而提高其对冷胁迫的耐受性。【本研究切入点】目前,针对低温胁迫对甘薯等薯类幼苗影响的研究较多,但以全国各薯区主栽品种薯苗为试验材料的耐冷性研究报道较少。【拟解决的关键问题】本研究以30个主栽甘薯品种为材料,利用相关测定方法来测定低温条件下甘薯薯苗生理指标的变化,运用隶属函数、因子分析和相关性分析来分析4℃低温胁迫下甘薯薯苗48 h的相关变化,筛选耐低温甘薯品种,为甘薯薯苗耐冷资源鉴定与筛选及耐低温胁迫机制的研究提供理论依据。1 材料与方法
1.1 供试品种
试验选取30个不同基因型的甘薯(电子附表1),根据试验内容,选择具有不同生物学特征且在中国薯区主栽的甘薯品种,薯块催芽,形成薯苗。Table 1
表1
表1不同基因型甘薯薯苗隶属值
Table 1
| 品种 Variety. | 电导率 Conductivity | 丙二醛 Malondialdehyde | 超氧化物歧化酶 Superoxide dismutase | 过氧化物酶 Peroxidase | 过氧化氢酶 Catalase | 抗坏血酸过氧化酶 Aseorbate peroxidase | 脯氨酸 Proline | 平均值 Average |
|---|---|---|---|---|---|---|---|---|
| 龙薯515 Longshu 515 | 0.89 | 0.88 | 0.54 | 0.72 | 0.65 | 0.29 | 0.87 | 0.69 |
| 赣10-20 Gan 10-20 | 1.00 | 0.73 | 0.20 | 1.00 | 0.56 | 0.14 | 0.63 | 0.61 |
| 南薯010 Nanshu 010 | 0.95 | 0.81 | 0.30 | 0.23 | 1.00 | 0.21 | 0.57 | 0.58 |
| 红香蕉 Hongxiangjiao | 0.87 | 0.38 | 0.11 | 0.80 | 0.14 | 0.86 | 0.91 | 0.58 |
| 广薯87 Guangshu 87 | 0.86 | 0.73 | 0.26 | 0.25 | 0.37 | 0.54 | 1.00 | 0.57 |
| 苏薯8号 Sushu 8 | 1.00 | 0.66 | 0.72 | 0.19 | 0.21 | 0.14 | 0.97 | 0.56 |
| 渝薯17 Yushu 17 | 0.88 | 0.80 | 0.61 | 0.18 | 0.07 | 0.50 | 0.79 | 0.55 |
| 龙紫薯6号 Longzishu 6 | 0.71 | 1.00 | 0.27 | 0.75 | 0.05 | 0.54 | 0.48 | 0.54 |
| 烟薯25 Yanshu 25 | 0.71 | 0.66 | 0.27 | 0.15 | 0.26 | 1.00 | 0.46 | 0.50 |
| 浙薯13 Zheshu 13 | 0.75 | 0.70 | 1.00 | 0.15 | 0.03 | 0.29 | 0.31 | 0.46 |
| 遗字138 Yizi 138 | 0.63 | 0.76 | 0.12 | 0.24 | 0.05 | 0.68 | 0.63 | 0.44 |
| 甘薯166-7 Ganshu 166-7 | 0.75 | 0.87 | 0.27 | 0.18 | 0.08 | 0.50 | 0.34 | 0.43 |
| 秦紫薯2号 Qinzishu 2 | 0.72 | 0.79 | 0.44 | 0.15 | 0.16 | 0.18 | 0.17 | 0.37 |
| 徐薯55-2 Xushu 55-2 | 0.60 | 0.65 | 0.49 | 0.31 | 0.02 | 0.07 | 0.32 | 0.35 |
| 辽薯19 Liaoshu 19 | 0.73 | 0.31 | 0.20 | 0.49 | 0.03 | 0.14 | 0.57 | 0.35 |
| 辽薯15 Liaoshu 15 | 0.57 | 0.47 | 0.26 | 0.38 | 0.39 | 0.07 | 0.25 | 0.34 |
| 龙薯14 Longshu 14 | 0.71 | 0.58 | 0.30 | 0.23 | 0.08 | 0.29 | 0.20 | 0.34 |
| 徐薯22 Xushu 22 | 0.47 | 0.42 | 0.12 | 0.14 | 0.07 | 0.39 | 0.69 | 0.33 |
| 商薯19 Shangshu 19 | 0.53 | 0.74 | 0.32 | 0.31 | 0.05 | 0.04 | 0.28 | 0.32 |
| 普薯32 Pushu 32 | 0.35 | 0.63 | 0.46 | 0.18 | 0.04 | 0.00 | 0.53 | 0.31 |
| 宁紫薯2号 Ningzishu 2 | 0.69 | 0.74 | 0.20 | 0.17 | 0.01 | 0.18 | 0.20 | 0.31 |
| 龙薯9号 Longshu 9 | 0.70 | 0.64 | 0.12 | 0.17 | 0.10 | 0.29 | 0.14 | 0.31 |
| 商薯8号 Shangshu 8 | 0.79 | 0.62 | 0.44 | 0.19 | 0.02 | 0.00 | 0.04 | 0.30 |
| 徐紫薯8号 Xuzishu 8 | 0.49 | 0.36 | 0.41 | 0.17 | 0.15 | 0.07 | 0.33 | 0.28 |
| 红东 Hongdong | 0.60 | 0.59 | 0.12 | 0.12 | 0.00 | 0.18 | 0.17 | 0.25 |
| 苏薯16 Sushu 16 | 0.00 | 0.43 | 0.30 | 0.19 | 0.10 | 0.43 | 0.32 | 0.25 |
| 台湾英沟 Taiwanyinggou | 0.59 | 0.31 | 0.12 | 0.47 | 0.08 | 0.18 | 0.00 | 0.25 |
| 商徐紫1号 Shangxuzi 1 | 0.41 | 0.18 | 0.30 | 0.19 | 0.17 | 0.18 | 0.12 | 0.22 |
| 苏渝303 Suyu 303 | 0.51 | 0.00 | 0.27 | 0.29 | 0.07 | 0.11 | 0.19 | 0.20 |
| 紫罗兰 Ziluolan | 0.45 | 0.03 | 0.05 | 0.00 | 0.45 | 0.04 | 0.18 | 0.17 |
新窗口打开|下载CSV
1.2 材料处理
试验于2018年7月在浙江农林大学薯类研究所进行。不同品种的甘薯薯苗茎段10株,经基质培育后,每品种处理种5盆,选择长势一致,并长有7—8片完全展开叶的甘薯薯苗(3次重复),置于医用冰柜(白天设定光照强度为7 500 lx,晚上为0 lx,昼夜各为12 h,湿度85%,温度控制在(4±0.5)℃,湿度控制误差±1%)中培养48 h。然后取甘薯薯苗的叶片,除去叶脉后剪碎混匀,进行生理指标的测定。低温胁迫后甘薯薯苗叶片的萎蔫程度不一,故将每株处理的叶片进行多次重复测定,便于指标的计算和试验的准确性。1.3 指标测定方法
利用电导率法检测质膜相对透性;采用HODGES等[10]方法测定丙二醛(malondialdehyde,MDA)含量;根据RAO等[11]方法测定超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)和抗坏血酸过氧化酶(aseorbate peroxidase,APX)含量;参照BATES等[12]方法测定脯氨酸含量。1.4 数据分析
利用SPSS.19和Excel进行数据分析,采用隶属函数法和相关性分析进行综合评价,运用的隶属函数公式为:R(Xi)=(Xi-Xmin)/(Xmax-Xmin),式中,Xi为指标测定值,Xmin、Xmax为所有试验材料某一指标的最小值和最大值,如果为负相关则用反隶属函数进行转换,计算公式为R(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)。最后将各项函数值进行累加,求出平均数值,平均数值越大,耐寒性越好。2 结果
2.1 甘薯薯苗低温胁迫条件下的表型变化
6个耐冷性表型差异较大、具有代表性的品种分别是赣10-20、苏薯8号、渝薯17、浙薯13、商徐紫1号和紫罗兰(图1)。4℃低温胁迫下,赣10-20和苏薯8号薯苗茎秆未有太大的弯曲,叶片几乎未卷曲;渝薯17和浙薯13茎秆也未有太大弯曲,但叶片卷曲萎蔫程度较大;商徐紫号和紫罗兰茎秆萎蔫倒伏,叶片卷曲坏死。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图16个代表性甘薯薯苗低温胁迫前后表型变化
A:低温胁迫前;B:低温胁迫后
Fig. 1Phenotypic changes of six representative sweet potato seedlings before and after low temperature stress
A: Before low temperature stress; B: After low temperature stress
2.2 低温胁迫下甘薯薯苗质相对电导率的变化
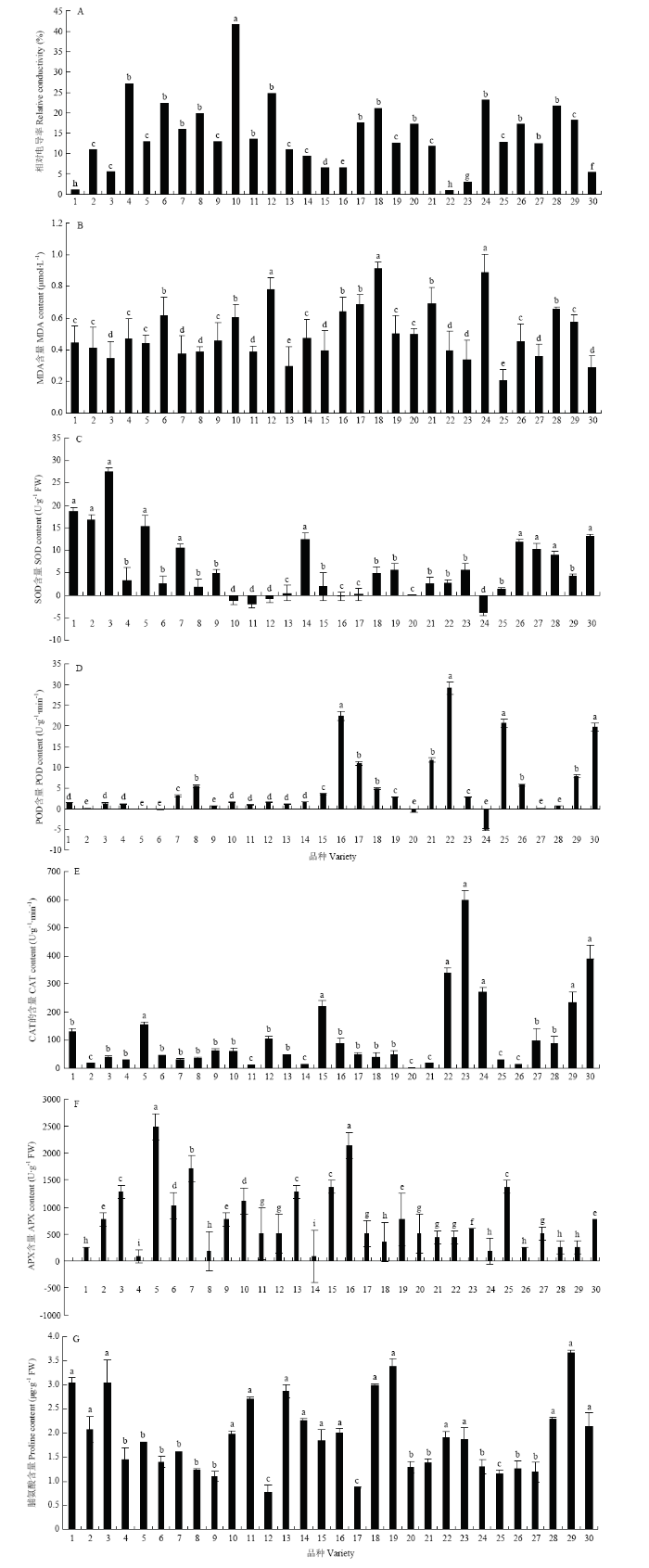
植物低温伤害的一个重要原因是植物细胞膜透性的变化。低温胁迫下,植物区域化细胞膜对物质的选择透性丧失,代谢平衡遭到破坏,细胞遭受伤害。通过对30个品种甘薯薯苗低温胁迫下电导率的测定(图2-A),同一处理条件下,甘薯薯苗的基因型不同,在低温胁迫48 h后的相对电导率差异较大,苏薯16的相对电导率变化最大,显著高于其他品种薯苗,相对电导率达到41.6%,说明苏薯16在低温胁迫下细胞膜受损严重。苏薯8号、赣10-20显著低于其他品种薯苗,相对电导率分别为1.04%和0.93%,这两个品种的甘薯薯苗在低温胁迫下细胞膜受损伤比较小,细胞遭受伤害较小,耐冷性相对较好。由于薯苗基因型差异,可以明确看出不同品种薯苗耐寒性差异较大。苏薯16的相对电导率是赣10-20的40倍(P<0.05)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2低温胁迫下不同品种甘薯薯苗的生理变化
A:电导率;B:丙二醛;C:超氧化物歧化酶;D:过氧化物酶;E:过氧化氢酶;F抗坏血酸过氧化酶;G:脯氨酸。不同小写字母表示P<0.05时差异显著。1—30分别为苏薯8号、浙薯13、渝薯17、普薯32、烟薯25、徐薯22、遗字138、商薯19、龙薯9号、苏薯16、宁紫薯2号、商徐紫1号、甘薯166-7、商薯8号、广薯87、红香蕉、台湾英沟、苏渝303、龙薯14、红东、辽薯19、赣10-20、南薯010、紫罗兰、龙紫薯6号、徐薯55-2、秦紫薯2号、徐紫薯8号、辽薯15、龙薯515
Fig. 2Physiological changes of different sweet potato seedlings under low temperature stress
A: Conductivity; B: Malondialdehyde; C: Superoxide dismutase; D: Peroxidase; E: Catalase; F: Aseorbate peroxidase; G: Pro. Different lower-case letters indicated significant difference at P<0.05. 1-30: Sushu 8, Zheshu 13, Yushu 17, Pushu 32, Yanshu 25, Xushu 22, Yizi 138, Shangshu 19, Longshu 9, Sushu 16, Ningzishu 2, Shangxuzi 1, Sweetpotato166-7, Shangshu 8, Guangshu 87, Hongxiangjiao, Taiwanyinggou, Suyu 303, Longshu 14, Hongdong, Liaoshu 19, Gan10-20,Nanshu010, Ziluolan, Longzishu 6, Xushu55-2, Qingzishu 2, Xuzishu 8, Liaoshu 15, Longshu 515
2.3 低温胁迫条件下甘薯薯苗抗氧化酶含量的变化
通过对低温胁迫条件下甘薯薯苗MDA含量的测定(图2-B)。30种薯苗在低温胁迫48 h时,叶片MDA含量均升高,差异极显著。商徐紫1号、苏渝303、紫罗兰的MDA含量变化最大,分别是78%、91%和89%,在低温胁迫下,这三个品种的甘薯耐冷性相对较差。166-7、龙薯515和龙紫薯6号的MDA含量变化最小,分别为30%、29%和20%,说明这三个品种的甘薯薯苗在低温胁迫下,MDA抗活性氧作用明显,耐冷性相对较好(P<0.05)。由图2-C可知,苏薯8号、渝薯17、浙薯13、烟薯25和龙薯515的SOD含量变化较大,与其他品种薯苗差异显著。龙薯16、宁紫薯2号、商徐紫薯1号、166-7和紫罗兰的变化较小,紫罗兰、苏薯16、宁紫薯1号和商徐紫1号呈现负值,尤其是紫罗兰负值最大,紫罗兰薯苗在低温胁迫下薯苗呈现萎蔫倒伏状态,SOD活性几乎没有变化,没有起到保护细胞作用,低温环境影响最大的品种是紫罗兰(P<0.05)。
由图2-D可知,红香蕉、赣10-20、龙紫薯6号和龙薯515的POD含量变化最大,说明在低温条件下,这四个品种的甘薯薯苗POD起保护细胞作用,且作用较大,POD活性变化值分别是29.21%、22.51%和20.69%。浙薯13号、烟薯25、徐薯22、红东和紫罗兰的POD含量变化不大,尤其是红东和紫罗兰,由于薯苗萎蔫,叶片卷曲枯死,POD活性呈现负值,再次说明紫罗兰薯苗耐冷性差(P<0.05)。
CAT是植物体内重要的保护酶,SOD与CAT偶联,能够使机体内的O2–和H2O2被彻底清除,起保护细胞膜的作用[13]。由图2-E可知,南薯010、赣10-20、龙薯515和紫罗兰的CAT的含量的变化最大,说明在低温条件下,这4个品种的CAT保护酶起较大的保护作用。浙薯13号、宁紫薯2号、商薯8号、红东和徐薯55-2的变化最小,说明在低温条件下,这5个品种薯苗细胞中CAT起较小的保护机制,耐冷性相对较差(P<0.05)。
APX是抗坏血酸在植物细胞氧化还原的重要酶类。由图2-F可知,遗字138、烟薯25、龙紫薯6号和红香蕉的APX含量变化较大,说明在低温条件下,这四个品种薯苗中的APX在细胞氧化过程中保护机制。普薯32、商薯8号和紫罗兰的APX活性变化较小,说明在低温条件下,这三个品种的薯苗耐冷性相对较差。烟薯25的APX活性变化的是苏薯16的60倍(P<0.05)
2.4 低温胁迫下甘薯薯苗脯氨酸含量的变化
由图2-G可知,在低温条件下,渝薯17、辽薯15、龙薯14和苏薯8号这4个品种的脯氨酸含量增加较大,脯氨酸变化达到3.04、3.66、3.38和3.03,在低温胁迫下,这4个品种的薯苗脯氨酸起重要保护作用。紫罗兰、台湾英沟、商徐紫1号的脯氨酸含量增加较小,分别为1.3、0.77和0.87,说明在低温胁迫下,这三个品种的薯苗脯氨酸没有起较大的保护机制,耐冷性相对较弱。脯氨酸含量增加最多的辽薯15是台湾英沟的3.3倍(P<0.05)。2.5 不同基因型甘薯薯苗隶属值
利用隶属函数分析甘薯薯苗耐冷性。在低温胁迫条件下,30种甘薯薯苗隶属函数值均不相同(表1)。在4℃低温胁迫下,甘薯薯苗耐冷性由强到弱为龙薯515>赣10-20>南薯010>红香蕉>广薯87 >苏薯8号>渝薯17 >龙紫薯6号>烟薯25 >浙薯13 >遗字138>甘薯166-7>秦紫薯2号>徐薯55-2>辽薯19 >辽薯15 >龙薯14 >徐薯22 >商薯19 >普薯32 >宁紫薯2号>龙薯9号>商薯8号>徐紫薯8号>红东>苏薯16 >台湾英沟>商徐紫1号>苏渝303>紫罗兰。2.6 甘薯薯苗生理指标相关性分析
由表2可得,在低温胁迫环境下,甘薯薯苗叶片的相对电导率、MDA、游离脯氨酸、POD、CAT、SOD、APX都呈现上升的趋势。低温胁迫下,甘薯薯苗叶片电导率与MDA含量呈显著正相关,与游离脯氨酸、CAT、POD呈显著负相关,与SOD呈极显著负相关。MDA与SOD、CAT、APX呈负相关,与POD、游离脯氨酸呈正相关。SOD与POD、CAT呈负相关,与APX、脯氨酸呈正相关。POD与CAT呈显著负相关,与APX呈显著正相关,与脯氨酸呈正相关。CAT与APX呈负相关,与脯氨酸呈正相关。APX与脯氨酸呈极显著正相关。Table 2
表2
表2甘薯薯苗生理指标相关性分析
Table 2
| 电导率 Conductivity | 丙二醛 Malondialdehyde | 超氧化物歧化酶 Superoxide dismutase | 过氧化物酶 Peroxidase | 过氧化氢酶 Catalase | 抗坏血酸过氧化酶 Aseorbate peroxidase | |
|---|---|---|---|---|---|---|
| 丙二醛Malondialdehyde 超氧化物歧化酶Superoxide dismutase 过氧化物酶Peroxidase 过氧化氢酶Catalase 抗坏血酸过氧化酶 Aseorbate peroxidase 脯氨酸Pro | 0.307* -0.338** -0.290* -0.315* -0.143 -0.283* | -0.121 0.092 -0.067 -0.036 0.096 | -0.049 -0.067 0.111 0.051 | -0.315* 0.263* 0.242 | -0.018 0.182 | 0.340** |
新窗口打开|下载CSV
3 讨论
3.1 低温胁迫对甘薯薯苗质膜相对透性的影响
温度过低会对植物细胞内的脂类产生影响,导致细胞膜透性发生变化。低温首先损伤了细胞的膜系统,进而导致了植物生理生化变化,植株损伤甚至死亡[14]。植物遭受低温胁迫时,植物脂肪酸不饱和度下降,膜结构受损,呼吸活性下降,膜透性增加[15]。相对电导率是鉴定植物抗逆性强弱的重要指标,能够反映细胞膜受损程度[16]。黄秋凤等[17]研究表明,随着胁迫温度的下降与胁迫时间的延长,木薯幼苗相对电导率有不同程度的增加。欧文军等[18]研究表明在低温环境下,随着胁迫时间的增长,叶片的相对电导率呈现不断上升的趋势。本研究表明低温胁迫下,甘薯薯苗的相对电导率都有不同程度的上升。在相同的胁迫环境下,甘薯薯苗受冷害程度小,相对电导率值就小,甘薯品种耐冷性较强。耐冷性弱的甘薯品种细胞受冷害程度深,相对电导率的值大。脯氨酸水溶性大,水合能力强,在胁迫条件下,细胞内的脯氨酸含量增加,增加细胞液浓度,从而保护细胞[19]。脯氨酸起到调节代谢物库和氧化还原平衡的代谢信号的作用,控制许多基因的表达并影响植物的生长和发育[20]。低温胁迫下,渗透调节物质作为细胞内的保护物质,其含量与植物抗逆性呈正相关[21]。作物在逆境环境下,脯氨酸含量会发生较大变化,把脯氨酸作为抗逆生理指标。陈京等[22]通过对甘薯薯苗苗期离体叶片研究表明,在水分胁迫条件下,各品种中脯氨酸均有不同程度的积累。积累量与品种适应水分胁迫能力的关系不密切。本研究通过对脯氨酸含量的变化测定表明:甘薯薯苗在低温胁迫下,脯氨酸含量增加,根据相关性分析,薯苗脯氨酸含量变化呈显著相关。脯氨酸增加的幅度取决于品种的耐冷性。甘薯品种耐冷性较强,脯氨酸值越大,低温胁迫的条件下,薯苗脯氨酸含量变化值较大。
3.2 低温胁迫对甘薯薯苗抗氧化酶活性的影响
所有的非生物胁迫都会干扰植物体内活性氧(ROS)代谢的平衡,即增加ROS的产生, 造成对细胞的伤害。轻中度胁迫下,ROS清除酶的活性增加,ROS造成的伤害得以缓解, 植物的抗氧化能力提高[23]。植物在低温胁迫环境下,细胞膜系统受到损害,活性氧大量产生和平衡受到破坏,自由基含量过多,影响细胞组分正常生命活动。保护酶系统积极响应,清除过多的自由基;但是随着胁迫加重,超过保护酶系统的清除能力,植物就会受伤害进而死亡。抗氧化酶能够清除植物体内的活性氧,其活性越高,植物的抗逆性越强[24]。保护酶的清除能力能缓解细胞氧化性伤害,增强耐寒性。陈禹兴等[25]研究表明抗寒性不同的冬小麦品种(系)丙二醛含量也呈增加趋势。郭慧等[26]研究不同基因型水稻苗期抗氧化酶的活性表明,抗氧化酶活性的升高有效降低了活性氧代谢的水平,缓解了低温冷害对细胞膜的伤害。本研究表明30品种个甘薯薯苗叶片随环境改变,低温胁迫条件下,丙二醛含量会相对增加,对薯苗本身起保护机制。丙二醛含量可代表膜损伤程度。耐冷性较强品种受害程度低,丙二醛值含量大。SOD是植物主要的细胞保护酶,可作为内源活性氧清除剂清除冷冻胁迫过程中细胞内产生的过量活性氧,维持细胞内代谢平衡,保持膜结构的稳定性从而减轻低温造成的伤害[27]。在植物的抗氧化防御系统中,SOD作为第一道防线,具有催化超氧化物的歧化反应的作用[28]。POD是催化底物氧化的酶,主要存在于细胞的过氧化物酶体中[29],APX主要促使H2O2和底物反应,使底物氧化,H2O2分解[30]。欧文军等[18]发现随着胁迫时间的延长,木薯叶片的超氧化物歧化酶活性、过氧化物酶活性呈先上升后下降的变化趋势;李春燕等[31]以扬麦16为试验材料,发现随着处理温度的降低、胁迫时间的延长,小麦叶片中SOD、POD和CAT活性均呈上升趋势,随胁迫程度加重,SOD最先表现出下降趋势,POD和CAT变化稍缓。崔强旺等[32]对低温胁迫下的菜用甘薯生理生化进行研究,表明不同品种的菜用甘薯POD、SOD活性变化的不同,是引起菜用甘薯抗寒性差异的原因之一。本研究结果同样表明,在低温胁迫下,甘薯薯苗叶片中保护酶起保护作用,抗氧化酶含量均有不同程度的上升,相关性分析表明,SOD、POD、APX含量变化呈极显著相关,CAT含量变化呈显著相关,MDA含量相关性不明显。
4 结论
低温胁迫会导致甘薯薯苗受到一定程度的损伤,由于甘薯基因型的差异,薯苗受到的损伤也大不相同,耐冷性也存在一定差异。薯苗中的抗氧化酶起保护机制、脯氨酸含量增加,薯苗叶片细胞质膜相对透性改变。低温胁迫促使薯苗产生应答反应机制。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
Magsci [本文引用: 1]

通过人工气候室模拟低温条件,对49个供试品种进行耐寒性鉴定。可分为三级:第一级属耐寒性强的品种有4个,第二级属耐寒性中等的品种有37个,第三级属耐寒性差的品种8个。综合生理测定的结果,耐寒品种均具有较高的可溶性糖含量,较高的组织汁液浓度,较高的组织束缚水含量,较低的电导率。同时,在叶片的形态结构上,组织排列比较紧密背面气孔数目较少;在内部的细胞亚显微构造上,随低温条件延长,叶内贮藏性淀粉粒逐渐分解,从而提高体内可溶性糖含量,提高组织汁液浓度,保护了各种细胞器的机能,维持细胞的正常生理活动。
Magsci [本文引用: 1]

通过人工气候室模拟低温条件,对49个供试品种进行耐寒性鉴定。可分为三级:第一级属耐寒性强的品种有4个,第二级属耐寒性中等的品种有37个,第三级属耐寒性差的品种8个。综合生理测定的结果,耐寒品种均具有较高的可溶性糖含量,较高的组织汁液浓度,较高的组织束缚水含量,较低的电导率。同时,在叶片的形态结构上,组织排列比较紧密背面气孔数目较少;在内部的细胞亚显微构造上,随低温条件延长,叶内贮藏性淀粉粒逐渐分解,从而提高体内可溶性糖含量,提高组织汁液浓度,保护了各种细胞器的机能,维持细胞的正常生理活动。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
Magsci [本文引用: 1]

<p>对南植199 和华南124 在低温胁迫下一些生理指标的变化进行研究。结果表明:随着胁迫温度的下降与胁迫时间的延长,木薯幼苗相对电导率和脯氨酸含量有不同程度的增加;丙二醛含量与可溶性蛋白含量则呈先升后降的趋势;叶绿素含量则不断下降。</p>
Magsci [本文引用: 1]

<p>对南植199 和华南124 在低温胁迫下一些生理指标的变化进行研究。结果表明:随着胁迫温度的下降与胁迫时间的延长,木薯幼苗相对电导率和脯氨酸含量有不同程度的增加;丙二醛含量与可溶性蛋白含量则呈先升后降的趋势;叶绿素含量则不断下降。</p>
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3724/SP.J.1006.2011.02293Magsci [本文引用: 1]

以扬麦16为试验材料, 利用人工气候箱模拟低温逆境, 研究-4℃、-6℃和-8℃低温胁迫对小麦苗期生长和叶片生理特性的影响。结果表明, 随着处理温度的降低、胁迫时间的延长, 小麦植株由叶尖萎蔫变黄的2、3级冻害加重至叶片全枯的4级冻害, 甚至大部分茎蘖冻死的5级冻害, –4℃和–6℃处理24 h没有发生4级及以上冻害。–8℃处理24 h和48 h后植株5级冻害比例显著增加, 植株死亡率分别为16.7%和39.6%。低温胁迫初期小麦叶片中SOD、POD和CAT活性均呈上升趋势, 随胁迫程度加重, SOD最先表现出下降趋势, POD和CAT变化稍缓, MDA含量增加。苗期低温胁迫使叶片中游离脯氨酸、可溶性蛋白和可溶性糖含量明显高于对照, 且随温度的降低和处理时间的延长呈上升趋势, 表现出对低温逆境的适应性。
DOI:10.3724/SP.J.1006.2011.02293Magsci [本文引用: 1]

以扬麦16为试验材料, 利用人工气候箱模拟低温逆境, 研究-4℃、-6℃和-8℃低温胁迫对小麦苗期生长和叶片生理特性的影响。结果表明, 随着处理温度的降低、胁迫时间的延长, 小麦植株由叶尖萎蔫变黄的2、3级冻害加重至叶片全枯的4级冻害, 甚至大部分茎蘖冻死的5级冻害, –4℃和–6℃处理24 h没有发生4级及以上冻害。–8℃处理24 h和48 h后植株5级冻害比例显著增加, 植株死亡率分别为16.7%和39.6%。低温胁迫初期小麦叶片中SOD、POD和CAT活性均呈上升趋势, 随胁迫程度加重, SOD最先表现出下降趋势, POD和CAT变化稍缓, MDA含量增加。苗期低温胁迫使叶片中游离脯氨酸、可溶性蛋白和可溶性糖含量明显高于对照, 且随温度的降低和处理时间的延长呈上升趋势, 表现出对低温逆境的适应性。
[本文引用: 1]
.
[本文引用: 1]
